INTRODUCCIÓN
La mayoría de los protocolos de quimioterapia para el cáncer de mama están disponibles solamente en administración intravenosa y, generalmente, contienen fármacos irritantes y/o vesicantes. La quimioterapia intravenosa administrada de forma periférica, daña el endotelio vascular de la red venosa periférica, lo que, en algunas ocasiones, provoca complicaciones como flebitis, infección y necrosis tisular debido a la extravasación de la quimioterapia (1. Estas complicaciones pueden provocar ansiedad, fobia a las agujas, rechazo del tratamiento y sufrimiento emocional del paciente (2,3.
En mujeres con cáncer de mama, la dificultad para obtener un acceso venoso para la infusión de quimioterapia es un problema frecuente. Estas mujeres, en general, son sometidas al menos a cuatro ciclos de quimioterapia neoadyuvante, seguidos de cirugía y ciclos de quimioterapia adyuvante adicionales, y el acceso a la red venosa se convierte en un problema a medida que el tratamiento avanza. Este problema se agrava cuando la paciente es sometida a una mastectomía unilateral con linfadenectomía axilar porque, en este caso, solo se puede utilizar el brazo contralateral para la venopunción y la infusión de quimioterapia 4. Cuando la paciente tiene una mastectomía bilateral, el problema es todavía peor, porque los dos brazos pueden tener su drenaje linfático comprometido, dificultando el acceso y mantenimiento de la permeabilidad de la red venosa.
Pacientes con cáncer de mama, con frecuencia necesitan recibir antibióticos, hidratación o, incluso, transfusiones de sangre durante los intervalos entre ciclos de protocolos de quimioterapia. Cuando no se puede utilizar una vena periférica, se perfora una nueva vena y, con el tiempo, a medida que el tratamiento avanza, habrá menos opciones de venas periféricas disponibles, lo que puede causar estrés al personal de enfermería que atiende al paciente. Si no hay venas periféricas viables, es posible que el paciente necesite retrasar el tratamiento, ser hospitalizado para que le instalen un acceso venoso central o someterse a un procedimiento de emergencia para acceder a una vena profunda.
Por lo tanto, debemos comprender la trayectoria de las condiciones de las venas periféricas en mujeres con cáncer de mama que reciben quimioterapia mediante administración periférica. Hasta donde sabemos, no existen estudios en la literatura sobre la historia natural del daño causado por la quimioterapia a la red venosa. El objetivo de este estudio fue evaluar las alteraciones con el tiempo de una vena periférica utilizada una sola vez para infusión de quimioterapia en pacientes con cáncer de mama.
MÉTODOS
Diseño
Este artículo fue un estudio observacional prospectivo realizado en el Centro de Oncología de Alta Complejidad de un hospital universitario en Brasil. Este estudio se adhiere a la Declaración sobre el Fortalecimiento de la Notificación de Estudios Observacionales en Epidemiología (in ing. Strengthening the Reporting of Observational Studies in Epidemiology - STROBE).
Población y Muestra
Mujeres que fueron diagnosticadas con cáncer de mama y estaban programadas para recibir doxorrubicina y docetaxel por vía intravenosa periférica fueron elegibles para este estudio. Otros criterios de inclusión eran: tener 18 años o más y estar recibiendo quimioterapia por primera vez en la vida. Los criterios de exclusión fueron: presencia de enfermedad vascular periférica, linfadenectomía axilar previa o radioterapia axilar, antibioticoterapia intravenosa previa y uso actual de terapia anticoagulante. Además, la primera venopunción de la paciente debía ser en el antebrazo, en la superficie dorsal de la mano o en la muñeca. Si la única vena accesible era la vena ante cubital, la paciente no era elegible para este estudio.
Durante seis meses, todas las mujeres que estaban programadas para recibir el protocolo de quimioterapia fueron invitadas a participar en el estudio por una de las investigadoras (S.L.N.S.). Los criterios de inclusión y exclusión fueron verificados y fueron explicados a las pacientes los objetivos y procedimientos del estudio.
Dado que el objetivo principal de este estudio era evaluar la magnitud de los problemas con una vena periférica utilizada para la infusión, no se incluyeron pruebas de hipótesis y no fueron encontrados estudios previos sobre el tema en la literatura, un cálculo formal del tamaño de la muestra no fue garantizado. Nuestro objetivo era incluir tantas participantes como fuera posible durante el período de tiempo del estudio, con el fin de tener una estimación sólida de la magnitud de los problemas con la accesibilidad de las venas.
Consideraciones Éticas
El estudio fue aprobado por el Comité de Ética en Investigación de la Facultad de Ciencias de la Salud de la Universidad de Brasilia (aprobación n. 063/2011). Las participantes recibieron una explicación detallada de los procedimientos del estudio y se obtuvo el consentimiento informado por escrito de cada participante.
Procedimientos
Las participantes fueron sometidas a cuatro ciclos de quimioterapia neoadyuvante con doxorrubicina y docetaxel y fueron evaluadas en cada ciclo de quimioterapia. El ciclo consistió en un día de infusión de quimioterapia (CHT), seguido de 20 días de descanso. En el día del primer ciclo, una enfermera elegiría una vena para venopunción según la accesibilidad en el siguiente orden: antebrazo (dirección distal a proximal), superficie dorsal de la mano y muñeca. La vena fue evaluada antes de la punción venosa (denominada “preCHT”) y después de la extracción del catéter periférico al final de la infusión de quimioterapia (“posCHT”). La vena que se pinchó en ese día, no fue pinchada nuevamente para la CHT, pero ella fue evaluada en los siguientes ciclos de CHT en los días 21, 42 y 63 después de la primera infusión venosa (que denotamos por D21, D42 y D63, respectivamente.)
Desenlaces
Recogemos datos sobre el calibre, la palpabilidad, la visibilidad y la rectilinealidad de las venas. Se eligieron estos resultados porque son clínicamente importantes cuando es necesaria una venopunción. Además, en cada evaluación, se le preguntó a la mujer si ella estaba hospitalizada entre los ciclos de quimioterapia y si esa vena especifica fue utilizada durante la hospitalización.
Se utilizó un transiluminador Veinlite LEDX® para visualizar la vena y se midió el calibre en milímetros utilizando una cinta métrica. El transiluminador es un anillo en forma de C de 31 mm de diámetro, basado en una fuente de luz fría (24 luces naranjas y 8 luces de LED rojas ultrabrillantes), que maximiza el contraste de la imagen durante la transiluminación.
Análisis Estadístico
Se realizó un análisis descriptivo para todas las variables. Para el calibre de la vena, a lo largo del tiempo, se calculó el número y la proporción de participantes en cada trayectoria. Se calcularon intervalos de confianza con 95% de confianza para las proporciones de ciertos resultados (como la proporción de mujeres que tenían 0 mm de calibre de vena en el día 63, por ejemplo). Los datos fueron analizados con IBM SPSS (versión 26.0).
RESULTADOS
Cincuenta y nueve mujeres que recibieron doxorrubicina y docetaxel por primera vez participaron del estudio. La edad osciló entre 23 y 65 años (mean = 46.0, SD = 10.1).
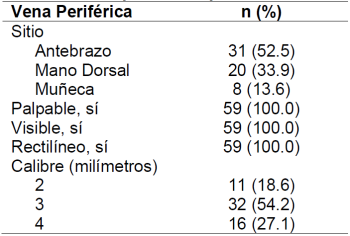
La Tabla 1, muestra la distribución de los sitios y características de la vena periférica a la que se accedió por venopunción para la primera infusión de quimioterapia. Las venas superficiales del antebrazo fueron elegidas para la venopunción en 52,5% de las pacientes, seguidas de las venas superficiales de la mano dorsal (33,9%) y de la muñeca (13,6%). Todas las venas eran palpables, visibles y rectilíneas. La medida de las venas fue en milímetros, redondeada al milímetro más cercano, y varió de 2 a 4 milímetros, siendo la mayoría de 3 mm (54,2%).
La Tabla 2 muestra la trayectoria del calibre de la vena periférica durante el período de seguimiento. Ninguna de las venas volvió a su calibre inicial durante el tiempo de seguimiento. En 24 mujeres (40,7%, intervalo de confianza [IC] de 95%: 28% - 53%), el calibre de la vena tuvo cierta recuperación, pero en 35 mujeres (59,3%, IC de 95%: 47% - 72%) el calibre de la vena fue de 0 mm incluso en el último seguimiento en el día 63. De las 24 mujeres cuyas venas tuvieron alguna recuperación, 15 de ellas (62,5%, IC de 95%: 43% - 82%) tenían venas esclerosadas con un cordón palpable que no funcionaba para el acceso venoso. El daño a la vena ocurrió independientemente del tamaño del calibre de la vena en la línea de base o en el lugar de la venopunción (Figura 1).
TABLA 2. Tamaño del calibre de la vena periférica durante el tiempo de seguimiento (n=59)
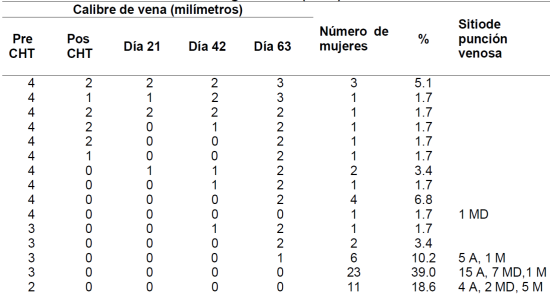
CHT = Quimioterapia, A = Antebrazo, MD = Mano Dorsal, M = Muñeca
La suma de los porcentajes no es de 100% debido a un error de redondeo.
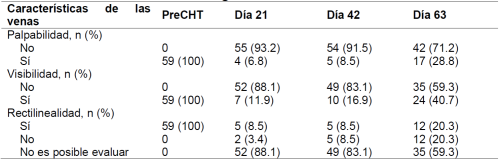
Las características de las venas con respeto a la palpabilidad, la visibilidad y la rectilinealidad se describen en la Tabla 3. La mayoría de las venas se volvieron impalpables e invisibles después del primer ciclo de quimioterapia. La mayoría de las venas no recuperaron su palpabilidad (71,2%, IC de 95%: 60% - 83%) o visibilidad (59,3%, IC de 95%: 47% - 72%) en D63.
Durante el período de seguimiento, 12 mujeres fueron hospitalizadas para manejo clínico, específicamente para recibir antibioterapia intravenosa (n = 6) o hidratación (n = 6) por neutropenia y emesis relacionados con el protocolo de quimioterapia. La mayoría de ellas fueron hospitalizadas entre el inicio y el D42. Las venas estudiadas no fueron utilizadas durante el período de hospitalización, por eso nuestro estudio no fue afectado.
DISCUSIÓN
Este estudio tuvo como objetivo evaluar las alteraciones con el tiempo de una vena periférica utilizada una única vez para la infusión de quimioterapia neoadyuvante en pacientes con cáncer de mama. Cincuenta y nueve mujeres recibieron doxorrubicina y docetaxel por primera vez. Observamos una gran proporción de mujeres cuya vena se redujo en calibre durante el periodo de estudio, incluidas muchas cuya vena permaneció en 0 mm hasta el final del estudio.
A pesar del aumento de la disponibilidad de agentes quimioterapéuticos orales, la vía intravenosa sigue siendo la más utilizada para la infusión de quimioterapia antineoplásica. La quimioterapia neoadyuvante es común en el tratamiento del cáncer de mama y se usa para reducir el tamaño del tumor antes de la cirugía, aumentando la probabilidad de mejores resultados 5. Sin embargo, las características intrínsecas de los agentes de quimioterapia causan daño al endotelio vascular. Los protocolos de quimioterapia suelen ser realizados en muchos ciclos, lo que provoca una sobrecarga de la red venosa periférica.
La doxorrubicina y el docetaxel son fármacos bien conocidos por su toxicidad cardiovascular y vascular 6. Estos fármacos suelen llevar a una disfunción endotelial inducida por estrés oxidativo e inducción de citocinas proinflamatorias que conduce al aumento de la vasoconstricción 7,8. Durante el período de seguimiento, la mayoría de las venas periféricas tenían un calibre de 0 mm, incluso en el último chequeo en el día 63. Un gran número de mujeres experimentaron un cordón palpable en sus venas, lo que podría explicarse por la apoptosis endotelial, conocida por ser causada por taxanos 9.
Muchos intentos sin suceso de punción venosa pueden limitar el acceso futuro a las venas periféricas 3)(10)(11)(12. Además, existe el riesgo de un aumento de la extravasación de quimioterapia periférica en las venas que han tenido múltiples intentos de canulación, con una incidencia reportada en la literatura de 0.08% a 6.5% 13,14. Aunque la incidencia es baja, los efectos devastadores a largo plazo de la extravasación de la quimioterapia en el paciente pueden provocar dolor significativo, necrosis tisular y pérdida de la función en el lugar de la lesión 13. Por tanto, las venas superficiales del antebrazo son preferibles para la venopunción, con menor riesgo de lesión dado que están alejadas de las articulaciones. Los protocolos de quimioterapia neoadyuvante comienzan con fármacos vesicantes y, generalmente, se elige el lugar del antebrazo para la punción venosa al comienzo del tratamiento. En este estudio, las mujeres que iniciaron el protocolo de quimioterapia en las venas del antebrazo, las tenían dañadas, y eso habría reducido las opciones para lugares de venopunción en los siguientes ciclos de quimioterapia.
Vías alternativas de infusión deben ser exploradas para conservar las venas periféricas en pacientes con cáncer de mama, ya que tendrán un tratamiento prolongado que requiere acceso intravenoso. Según la literatura, si el paciente requiere repetidamente más de tres intentos de punción venosa y el plan de tratamiento es someterse a quimioterapia durante un período prolongado, un catéter venoso central puede ser apropiado 15,16.
El acceso venoso central es obligatorio para una serie de soluciones específicas para infusión, como las que contienen fármacos vesicantes. La quimioterapia para el cáncer de mama suele incluir al menos un fármaco vesicante en su protocolo. Existen complicaciones relacionadas con el catéter venoso central y también con el catéter venoso periférico, pero la elección de un dispositivo venoso periférico en los hospitales públicos brasileños suele justificarse por el bajo costo. Entre las pacientes evaluadas en este estudio, 20 (27%) tenían un catéter venoso central que fue insertado en algún momento de la terapia adyuvante. Por lo tanto, si a un paciente se le implantará un catéter venoso central en algún momento de su tratamiento, a largo plazo, podría ser más barato y menos perjudicial para el paciente insertar el catéter central al comienzo de la quimioterapia. Es necesario analizar el costo-beneficio a largo plazo del uso de un catéter venoso central versus dispositivos venosos periféricos cuando se realiza quimioterapia en esos pacientes.
Limitaciones
En este estudio, se utilizó una cinta métrica como instrumento para medir el calibre de las venas periféricas. Los autores sugieren que el micrómetro sea utilizado como dispositivo para medir el calibre de las venas en estudios futuros. Dado que el micrómetro es un instrumento que puede medir milímetros con mayor precisión, su uso puede identificar la recuperación de calibre menor a 1 milímetro, lo que puede ser cínicamente importante.
CONCLUSIÓN
A medida que avanza el tratamiento, la toxicidad del endotelio vascular causada por los agentes de quimioterapia disminuye la accesibilidad de las venas periféricas para la quimioterapia en mujeres con cáncer de mama. La magnitud del problema es grande y puede ser perjudicial para la paciente y su tratamiento. Vías alternativas, como un catéter venoso central, deben ser exploradas para conservar las venas para uso futuro. Esto es importante especialmente en pacientes con cáncer de mama, cuyo tratamiento es muy prologando y requiere acceso intravenoso.











 texto en
texto en