Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Oral, Patología Oral y Cirugía Bucal (Ed. impresa)
versión impresa ISSN 1698-4447
Med. oral patol. oral cir. bucal (Ed.impr.) vol.9 no.3 may./jul. 2004
Condiciones optimas de manipulación para la cuantificación
de fibronectina en saliva
Mª Carmen Llena Puy(1), Consuelo Montañana Llorens(2), Leopoldo Forner Navarro(3)
(1) Estomatólogo. Unidad de Odontología Preventiva de Área. Servicio Valenciano de Salud. Profesora de Odontología.
Facultad de Ciencias Experimentales y de la Salud. Universidad Cardenal Herrera-CEU
(2) Becaria de Investigación
(3) Profesor Titular de Patología y Terapéutica Dental. Departamento de Estomatología. Facultad de Medicina y Odontología.
Universidad de Valencia. España
Correspondencia:
Mª Carmen Llena Puy
Guillem de Castro Nº 44, 3º
46001 Valencia
Tf. 963924018
E-Mail: llena@uch.ceu.es
Recibido: 5-01-2003 Aceptado: 18-05-2003
| Llena-Puy MC, Montañana-Llorens C, Forner-Navarro L. Condiciones optimas de manipulación para la cuantificación de fibronectina en saliva. Med Oral 2004;9:191-6. © Medicina Oral S. L. C.I.F. B 96689336 - ISSN 1137 - 2834 |
RESUMEN
Introducción: La fibronectina (Fn) es una glucoproteína presente en múltiples fluidos y tejidos orgánicos, tanto en condiciones fisiológicas como patológicas. También en la saliva puede detectarse aunque en muy pequeñas cantidades y frecuentemente en cadenas fragmentadas, induce agregación bacteriana y sus niveles se reducen cuando aumentan los niveles de bacterias cariogénicas o periodontopatógenas. La capacidad infectiva de la saliva de los pacientes infectados por el virus de la inmunodificiencia humana (VIH) se ha relacionado con los niveles de esta proteína. En algunas enfermedades crónicas de la mucosa oral como es el liquen plano, la concentración de Fn salivar se encuentra reducida. También su cuantificación varía en presencia de algunos tumores como el carcinoma oral de células escamosas, aunque no puede considerarse un factor específico.
Objetivo: Debido a la baja concentración de Fn en la saliva y a su labilidad en la forma soluble, las condiciones de recogida y conservación de las muestras son extremadamente importantes, por ello nos proponemos en el presente trabajo estandarizar dichas condiciones con el fin de poder cuantificarla de manera óptima.
Material y método: Se determinó la concentración de Fn en saliva humana de 20 personas sanas de edades comprendidas entre 28 y 54 años mediante técnica de ELISA, comparando la concentración de la proteína en muestras frescas, conservadas 24 h a 4ºC, o congeladas a - 40ºC durante diferentes periodos de tiempo.
Resultados y conclusiones: Tras comparar diferentes formas de conservación de las muestras de saliva, observamos que las condiciones óptimas son: recoger las muestras en tubos de vidrio, cuantificarlas inmediatamente tras su recogida o como máximo 24 horas después, conservándolas a 4ºC. La congelación y posterior descongelación para su cuantificación induce pérdidas de hasta el 60 % de la proteína.
Palabras clave: Fibronectina, saliva, cuantificación, almacenamiento
INTRODUCCIÓN
La fibronectina (Fn) es una glucoproteina multifactorial que se encuentra de forma soluble en la sangre, la saliva y en otros fluidos orgánicos (1,2) y de forma insolube interactuando con diferentes componentes de la matriz extracelular. Sus niveles están positivamente relacionados con patología infecciosa aguda, así como con procesos crónicos como es el caso de la cirrosis hepática o el hepatocarcinoma (3,4). Está compuesta por dos subunidades de 230 KDa unidas por dos puentes disulfuro con una compleja estructura subdividida en una serie de pequeños dominios, cada uno de los cuales es aparentemente responsable de alguna de sus funciones, dos de ellos son los encargados de la unión al colágeno y a la fibrina así como a las células eucarióticas, esta habilidad reside en el N-terminal y en el dominio central de la secuencia respectivamente (5,6).
La Fn es un factor inespecífco de defensa en la saliva como la lisozima, la lactoferrina, la beta 2 microglobulina, la histidina, la mucina, o el sistema de las peroxidasas (7), juega un papel fundamental en los mecanismos de unión celular, es capaz de unirse a las bacterias (8-12) y a la hidroxiapatita, contribuye a la formación de la película adquirida y de la placa bacteriana (13). Puede encontrarse también de forma soluble en la saliva total o en la saliva parotídea, submaxilar o sublingual, así como en el fluido crevicular (14).
Cuando la Fn u otros factores de unión celular disminuyen, se reduce la capacidad de agregación bacteriana de la saliva y cuando se administran a una saliva previamente depleccionada se restaura la interacción entre la saliva y las bacterias presentes en ella como los Streptococcus (15), por todo ello se le considera un factor responsable de la agregación bacteriana (16). En la saliva de pacientes con enfermedad periodontal, los niveles de Fn son inferiores que los encontrados en pacientes sanos. Conocemos que esta proteína es una de las responsables de la unión a las fimbrias de la Porfiromona Gingivalis (17). Así mismo, se ha demostrado una correlación inversa entre los niveles de Streptopcoccus mutans y la concentración de Fn soluble en la saliva. (18).Un estudio reciente ha demostrado que la secuencia de aminoácidos Qrg-Gly-Asp (RGD) es el lugar de unión de la proteína para el Streptococcus mitis (19).
La Fn interactúa también con las glicoproteinas de la cápsula del virus de la inmunodeficiencia humana (HIV), pudiendo intervenir de manera positiva en la reducción de la transmisión del mismo (20, 21). La muerte celular en los cultivos de fibroblastos inducida por el peróxido de hidrógeno se ve frenada por la incorporación de Fn a dichos cultivos (22). En pacientes con liquen plano oral, los niveles de Fn salivar están reducidos con respecto a pacientes sanos (23). Una isoforma de ésta proteína obtenida por glicosilación de la Fn normal y algunos segmentos extra de la proteína están fuertemente correlacionados con un elevado número de tumores, incluyendo el carcinoma oral de células escamosas, pero sus niveles en saliva no proporcionan ningún especificidad con respecto al tumor (24) .
Los niveles de Fn en saliva y otros fluidos humanos son muy bajos (25), y su manipulación extremadamente crítica, por ello el objetivo de este trabajo es revisar las condiciones de manipulación y almacenamiento de las muestras en condiciones óptimas que nos permitan determinar adecuadamente los niveles de dicha proteína.
MATERIAL Y MÉTODO
Se recogieron entre 7 y 10 ml de saliva estimulada con parafina a 20 personas de edades comprendidas entre los 28 y 54 años de edad. Las muestras se distribuyeron en 7 alíquotas, 4 de las cuales fueron congeladas en tubos de vidrio con nitrógeno líquido tras su recogida y almacenadas a -40º C, una fue recogida en un tubo de vidrio y procesada inmediatamente para la cuantificación de la proteína, otra fue almacenada a 4 ª C durante 24 horas en un tubo de vidrio hasta su utilización y una tercera fue conservada como la anterior pero en un tubo de plástico. Las muestras congeladas fueron analizadas transcurridas 1, 2, 4 y 8 semanas respectivamente, previa descongelación a 37 º C y conservación a 4ª C durante el procesado. Como proteína estándar se utilizó Fn humana plasmática (Boheringer Mannheim) diluida en agua destilada y congelada a - 40 º C.
Para cuantificar la Fn se utilizó una técnica ELISA modificada. Se utilizó el método de doble anticuerpo descrito por Lamberts y cols. (26), utilizando anticuerpos anti Fn humana plasmática policlonal, Anti IgG AP-conjugada de conejo (Promega Corp.), dietanolamina al 9,7 % a un pH de 9,8 (Sigma Aldrich), Mg SO4 (1mM) (Merck Igoda S.A) y p-nitrofenol (1 mM) para visualizar el reconocimiento de la Fn por los anticuerpos. El método fue modificado como se expresa a continuación: la Fn plasmática humana fue diluida en PBS para aplicar duplicados en un rango de 10 - 250 ng/ml con el fin de obtener concentraciones desde 1/2 (p/v) a 1/4, 1/10 y 1/24 (v/v). Las muestras fueron colocadas en placas (Nunc MaxiSorp) e incubadas durante 12 horas a 4ºC con los anticuerpos correspondientes, posteriormente fueron lavadas con BSA libre de Fn (25). La absorbancia fue medida a 405 nm después de 40 minutos en un lector de ELISA (Novapath BIORAD Laboratories S.A).
Se determinó el porcentaje de pérdida de proteína en las diferentes condiciones considerando la determinación inmediata como el 100%, se calcularon los valores medios y los intervalos de confianza al 95% para cada grupo de almacenamiento y se compararon entre si mediante el análisis de la varianza, utilizando el test de Duncan para la comparación de los grupos dos a dos.
RESULTADOS
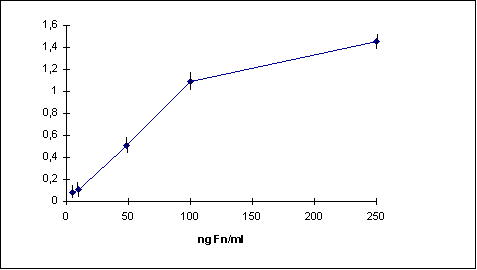
Se realizó una curva estándar para la Fn plasmática humana con tres experimentos individuales y con tres ensayos para cada concentración utilizando el protocolo ELISA descrito anteriormente. Como se puede ver en la figura 1, se observa una respuesta lineal para las concentraciones comprendidas entre 10 y 100 ng/ ml con un coeficiente de regresión de Spearmann de 0,88.
Fig. 1. Curva estándar para las diferentes concentraciones ensayadas
Curva estandar para las concentraciones comprendidas entre 10 y 250 ng/ml
de Fn plasmática humana. Cada punto representa el valor medio obtenido tras
la medición de tres ensayos diferentes. ( n=9) (r = 0,88).
Se cuantificaron los valores de proteína para cada una de las 20 muestras y para cada una de las formas de conservación (N= 120) y se observó que para las muestras conservadas durante 24 horas a 4ºC, se producía una pérdida del 10 %, mientras que si las muestras se almacenaban en tubos de plástico, las pérdidas eran superiores; así mismo cuando eran congeladas aun conservándolas en tubos de vidrio, se producían pérdidas de proteína en un rango entre el 40 y el 60 % como se observa en la figura 2.
Fig. 2. Porcentaje de pérdida de proteína según las condiciones de conservación.
Porcentaje de pérdida de Fn en cada una de las condiciones de almacenamiento
con respecto a la cuantificación inmediata considerada el 100%.
C: Muestras conservadas 24 h a 4ºC en tubos de vidrio
D, E, F, G: Muestras conservadas a - 40 ºC en tubos de vidrio durante 1, 2, 4
y 8 semanas respectivamente
La tabla 1 muestra los valores medios y los intervalos de confianza al 95 % para cada condición de almacenamiento, no encontrándose diferencias significativas entre los niveles de proteína medidos inmediatamente tras su recogida y los obtenidos tras 24 horas de almacenamiento en un tubo de vidrio a 4º. Ambos grupos muestran diferencias estadísticamente significativas con todos los demás.
Tabla 1. Valores medios e intervalos de confianza para cada una de las formas
de conservación.
+, * Representa los grupos entre los que se encontraron diferencias
estadísticamente significativas.
DISCUSIÓN
Los resultados obtenidos muestran importantes pérdidas de Fn inmunoreactiva en saliva almacenada con los sistemas habituales de conservación y almacenamiento, este hecho ha sido demostrado por otros autores en muestras de diferentes fluidos orgánicos (26), pero el alto porcentaje de pérdidas en la saliva es un hecho que se debe de considerar de cara a la manipulación cuidadosa de las muestras.
La conservación en plástico de las muestras o la simple manipulación de la saliva con instrumental plástico favorece la pérdida de proteína, ya que ésta se coapta en las paredes del tubo. La conservación durante 24 horas en tubo de vidrio a 4ºC produce pérdidas poco apreciables, mientras que cualquier otra forma de conservación de las evaluadas produce pérdidas muy importantes.
El almacenamiento a -40ºC, y su posterior descongelación proporciona pérdidas muy importantes, probablemente más relacionadas con el proceso de descongelación que con la propia congelación de las muestras. También es posible que la presencia de factores de degradación de la proteína presentes en la saliva total (27) y la conocida labilidad de la proteína en presencia de agua (28) den como resultado la incapacidad de los anticuerpos utilizados en el ensayo para reconocerla. La gran capacidad de la proteína para unirse a las células y a la matriz extracelular puede afectar a esta gran reducción durante el proceso de descongelación.
Un hecho importante es que el antisuero de conejo permite la unión a seis fracciones de la proteína (230, 200, 110, 85, 75 y 65 KDa), así como a la proteína completa, mientras que el antisuero monoclonal de ratón reconoce solo la molécula de 230 KDa que no está presente en la saliva total (29), este aspecto es sumamente importante en cuanto a la metodología de cuantificación de la proteína, ya que con antisuero monoclonal de ratón, no podríamos detectarla.
Como conclusión podemos decir que la recogida de muestras de saliva para cuantificar Fn debe de realizarse en tubos de vidrio y que las muestras deben procesarse como máximo transcurridas 24 horas de su recogida y durante éste tiempo deben conservarse a 4ºC. La congelación y posterior descongelación de las muestras produce pérdidas de hasta el 60 % de la proteína con respecto a los valores iniciales.
BIBLIOGRAFIA
1. Ruoslahti E. Fibronectin and its receptor. Ann Rev Biochem 1988;57:375-431. [ Links ]
2. Tynelius-Bratthall G, Ericson D, Araujo HM. Fibronectin in saliva and gingival crevices. J Periodontal Res 1986;21:563-8. [ Links ]
3. Llena MC, Cornudella R, Barrau F, Gutiérrez M, Martínez MR, Tres A. Fibronectina y hepatopatías: un nuevo parámetro en la valoración de la función hepatocelular. Rev Esp Enf Ap Digest 1986;70:169-71. [ Links ]
4. Atance JC, Tres A, Martínez MA, Ortells JL, Llena-Puy MC. Fibronectina: estudio en gastroenteritis agudas. Re Esp En Ap Digest 1987;72:512-4. [ Links ]
5. Mosher DF. Physiology of fibronectin. Ann Rev Med 1984;35:561-75. [ Links ]
6. Ruoslahti E, Vaheri A. Interaction of soluble fibroblast surface (fs) antigen with fibrinogen and fibrin. Identity with cold insoluble globulin of human plasma. J Exp Med 1982;141:497-501. [ Links ]
7. Vanden-Abbeele A, Courtois P, Pourtois M. The antiseptic role of saliva. Rev Belg Med Dent 1992;47:52-8. [ Links ]
8. Babu JP, Simpson WA, Courtney HS, Beachey E H. Interaction of human plasma fibronectin with cariogenic and non-cariogenic oral streptococci. Infect Immun 1983;41:162-8. [ Links ]
9. Ericson D, Tynelius-Bratthall G. Absorption of fibronectin from human saliva by strains of oral streptococci. Scand J Dent Res 1986;95:377-9. [ Links ]
10. Sojar HT, Lee JY, Genco RJ. Fibronectin binding domain of P. Gingivalis fimbriae. Biochem Biophyis Res Commun 1995;216:785-92. [ Links ]
11. Naito Y, Tohda H, Okuda K, Takazoe I. Adherence and hydrophobicity of invasive and noninvasive strains of Porphyromona Gingivalis. Oral Microbiology Immunol 1993;8:195-202. [ Links ]
12. Loo CY, Wilcox MD, Knox KW. Surface-associated properties of Actinomyces strains and their potential relation to pathogenesis. Oral Microbiol Immunol 1994;9:12-8. [ Links ]
13. Tajima K, Yu S, Tmaki N, Ueda H, Hori Y, Kanehisa J, et al. The mechanisms dental plaque and dental calculus formation by fibronectin. IV. Demonstration of fibronectin in dental calculus. J Jap Ass Periodontol 1984;26:701-9. [ Links ]
14. Tynelius-Bratthall G. Crevicular and salivary fibronectin before and after gingivitis treatment. J Clin Periodontol 1988;15:283-7. [ Links ]
15. Babu JP, Dabbous MK. Interaction of salivary fibronectin with oral streptococci. J Dent Res 1986;65:1094-9. [ Links ]
16. Babu JP, Dean JW, Pabst MJ. Attachement of Fusobacterium nucleatum to fibronectin immobilized on gingival epithelial cells or glass coverlips. J Periodontol 1995;66:285-90. [ Links ]
17. Murkami Y, Hanazawa S, Tanaka S, Iwahashi H, Kitano S, Fujisawa S. Fibronectin in saliva inhibits Porphyromonas Gingivalis fimbria-induced expression of inflammatory cytokine gene in mouse macrophages. FEMS Immunol Med Microbiol 1998;22:257-62. [ Links ]
18. Llena MC, Motañana C, Forner L. Fibronectin levels in stimulated whole-saliva and their relationhip with cariogenic oral bacteria. Int Dent J 2000;50: 57-9. [ Links ]
19. Sugano N, Tanaka H, Ito K, Murai S. Arg-Gly-Asp (RGD) peptides inhivit Streptococcus mitis to adherence to fibronectin. J Nihon Univ Sch Dent 1997; 39:154-5. [ Links ]
20. Su H, Boackle RJ. Interaction of the envelope glycoprotein of human immunodeficiency virus with C1q and fibronectin under conditions present in human saliva. Mol Immunol 1991;28:811-7. [ Links ]
21. Boackle RJ, Connor MH, Vasely J. High molecular weight non-immunoglo-bulin salivary agglutinins (NIA) bind C1Q globular heads and have the potential to activate the first complement component. Mol Immunol 1993;30:309-19. [ Links ]
22. Tipton DA, Braxton SD, Dabbous MK. Role of salivary components as modulators of bleaching agent toxicity to human gingival fibroblastsin vitro. J Periodontol 1995;66:766-74. [ Links ]
23. Zhan F, Wang H, Wang Z. Fibronectin in tissues and saliva of patients with oral lichen planus. Zhonghuan Kou Qiang Yi Xue Za Zhi 1996;31:235-7. [ Links ]
24. Lyons AJ, Cui N. Salivary oncofetal fibronectin and oral squamous cell carcinoma. J Oral Pathol Med. 2000; 29: 267-70. [ Links ]
25. Gómez-Lechón MJ, Castell JV. Measurement of fibronectin in human body fluids. J Clin Chem Clin Biochem 1986; 24:333-9. [ Links ]
26. Lamberts BL, Pederson ED, Bial JJ, Tombasco PK. Fibronectin levels of unestimulated saliva from naval recruits with and without chronic inflammatory periodontal disease. J Clin Periodontol 1989;16:342-6. [ Links ]
27. Gibbons RJ, Etherden I. Fibronectin-degrading enzymes in saliva and their relation to oral cleanliness. J Periodontal Res 1986;21:386-95. [ Links ]
28. Gómez-Lechón MJ, Castell JV. Enzyme-linked immunosorbent assay to quantify fibronectin. Anal Biochem 1985;145:1-8. [ Links ]
29. Kanehisa J, Doi S, Yamanaka T, Takeuchi H. Salivary fibronectin in man: an immunoblotting, radioimmunoassay and immunohistochemical study. Arch Oral Biol 1991;36:265-72. [ Links ]











 texto en
texto en