Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Oral, Patología Oral y Cirugía Bucal (Ed. impresa)
versión impresa ISSN 1698-4447
Med. oral patol. oral cir. bucal (Ed.impr.) vol.9 no.3 may./jul. 2004
Evolución del germen dental trasplantado heterotópicamente
en la dermis. Un estudio histológico en la rata
Telmo José Mezadri(1), David Rivero Tames(1), Fernanda Boabaid(1), Jose A. Armengol(2)
(1) Faculdade de Odontología, CCS, UNIVALI-SC, Brasil
(2) Dpto. Ciencias Morfológicas, Universidad de Sevilla, España
Correspondencia:
Prof. J.A. Armengol
Dpto. de Ciencias Morfológicas
Universidad de Sevilla
Avda. Sánchez Pizjuan, 4
41009 Sevilla España
Teléfono: 954 552865-66
Fax: 954 381662
E-mail: armengol@us.es
Recibido: 23-11-2002 Aceptado: 30-3-2003
| Mezadri TJ, Rivero-Tames D, Boabaid F, Armengol JA. Evolución del germen dental trasplantado heterotópicamente en la dermis. Un estudio histológico en la rata. Med Oral 2004;9:243-52. © Medicina Oral S. L. C.I.F. B 96689336 - ISSN 1137 - 2834 |
RESUMEN
En este estudio hemos analizado la potencialidad de desarrollo del germen dental en fase de corona. Para ello, los gérmenes dentales de rata recién nacida fueron trasplantados en las bolsas dérmicas de la oreja de ratas isogénicas. Siete y catorce días después del trasplante, se desarrollaron las estructuras morfológicas dentales típicas, con ameloblastos y odontoblastos bien diferenciados. Ulteriormente, los procesos de reacción inflamatoria del tejido huésped con infiltración celular abocaron a la desaparición de los tejidos dentales. Desde el primer momento de nuestro análisis, los trasplantes desarrollaron una dentina anómala u osteoide cuyo tamaño fue paulatinamente incrementando con el tiempo, llegando a sustituir al resto de los tejidos dentales. Esta dentina osteoide, fruto tanto de la transformación de los odontoblastos del trasplante en células de alta actividad secretora como de la inducción que el germen dental ejerce en el tejido huésped circundante; y a diferencia de la observada en estudios previos, mostró diversos grados de polimerización fibrilar, lo que nos induce a sugerir que nuestro modelo puede ser un buen medio de estudiar los mecanismos de reacción en la formación de tejidos reactivos a la lesión dental.
Palabras clave: Germen dental, trasplante, odontoblasto, dentina, tejido osteoide, reacción odontoblástica
INTRODUCCI&Ocute;N
Los trasplantes de gérmenes dentales, esencialmente de caninos, premolares y molares, han sido utilizados en la clínica para suplir la falta de elementos dentarios o para correcciones de oclusión dental. En estos casos, los exámenes clínicos y radiográficos, no detectaron patologías del periodonto como consecuencia del trasplante. Sin embargo, si se detectaron pérdidas, necrosis pulpar, aumento del espacio periodontal, anquilosis y, con mucha frecuencia, formación incompleta de la raíz (1-3).
En los trasplantes de embriones dentales la competencia odontogénica adquirida por el ectomesénquima es esencial. Así, solo después de adquirir la competencia odontogénica y antes de la fase coronaria, los trasplantes formaron dientes con una morfología muy semejante a la normal (4-6). No obstante, los resultados de los diversos experimentos de trasplante son contradictorios. Así, los trasplantes interespecíficos de gérmenes dentales de ratones Mus musculus y Mus caroli, en receptores neonatos de las mismas cepas y en alvéolos con la misma localización que la de los donantes, demostraron sistemáticamente la presencia de células grandes y multinucleadas en la superficie pulpar de la dentina (7). Una vez iniciada la formación de las matrices de los tejidos dentales, los autotrasplantes de gérmenes dentales siguieron un desarrollo anormal caracterizado por la presencia de focos de epitelio y matriz de esmalte en el folículo dental, metaplasia del órgano del esmalte, quistes y ausencia de continuidad en el desarrollo normal de la corona (8). Asimismo, los trasplantes heterotópicos de molares de ratón parcialmente desarrollados y con remanentes de ligamento periodontal no continuaron su desarrollo normal; el tejido pulpar fue sustituido por conectivo fibroso y la dentina por dentina osteoide (9). Sin embargo, los trasplantes de embriones dentales de ratas recién nacidas en criptas similares a las de los donantes y preparadas en animales con 6 a 9 días de edad, desarrollaron dientes normales que incluso erupcionaron (10).
La dentina osteoide es una dentina sin túbulos observada en regiones de la pulpa con pérdida de odontoblastos y neodiferenciación de otras células pulpares (11). En trasplantes heterotópicos, las células de la papila dental del primer molar se transformaron en células muy parecidas a los odontoblastos que secretaron una matriz extracelular muy similar a la dentina osteoide (12). La formación de dentina osteoide es una reacción bastante frecuente en diversas situaciones experimentales. La osteotomía subapical llevo a la formación de dentina osteoide y substitución de focos de necrosis en la pulpa por focos fibróticos (13). Distintos medicamentos inducen la formación de dentina osteoide. La administración sistémica de ciclosporina-A indujo la aparición de dentina osteoide en capas sucesivas irregulares y de morfología anormal, y numerosas formaciones globulares incluidas en la dentina o libres en la pulpa (14). De igual modo, agentes antineoplásicos como la fosfamida, ocasionaron una pérdida celular en áreas relativamente grandes de la pulpa dental en las que, ulteriormente, se formó dentina osteoide (15). Finalmente, la administración local de hidróxido de calcio para el recubrimiento de la pulpa en pulpotomías de incisivos y premolares de perros, también generó la aparición de dentina osteoide (16).
El presente estudio analiza el desarrollo y los derivados de las estructuras dentales en trasplantes heterotópicos de germen dental una vez alcanzada la fase de corona, como medio de comprobar la ulterior diferenciación de los tejidos dentales ya inducidos y de sus relaciones con el medio ambiente anómalo.
MATERIALES Y MÉTODOS
Veinte embriones dentales de ratas de la cepa albina Wistar de 1 día de edad fueron trasplantados en bolsas intradérmicas preparadas en las orejas, derecha e izquierda, de 10 ratas adultas de la misma cepa (200 gramos de peso). Las ratas huéspedes fueron anestesiadas con Zoletil 50‚ [una mezcla de clorhidrato de tiletamina (125 mg) y clorhidrato de zolazepan (125 mg), 0,20 ml/kg i.p.]. Con un bisturí se realizó una incisión superficial de 5 mm de extensión, transversal al eje mayor de la oreja y oblicua con relación a su superficie. El lecho para el trasplante se obtuvo tras separar la dermis del cartílago de la oreja con una pinza de punta fina.
Las ratas donantes se anestesiaron profundamente por la acción de vapores de éter. Los gérmenes dentales de los primeros molares superiores de ratas se obtuvieron mediante incisiones, con una lámina de acero esterilizada, transversales y longitudinales al maxilar del germen dental. Durante las incisiones se procuró que la profundidad del corte fuese aproximadamente igual a la altura del germen dental. Los gérmenes dentales se extrajeron con ayuda de una cureta esterilizada y trasplantados en las bolsas receptoras.
Un total de cinco trasplantes fueron estudiados de cada día. Así, 7, 14, 21 y 42 días después del trasplante, los animales huéspedes fueron anestesiados y los trasplantes extraídos de las orejas izquierdas en los días pares (14 y 42) y de las derechas en los impares (7 y 21). Los trozos de tejido conteniendo los trasplantes fueron fijados por inmersión en paraformaldehido al 4% en tampón fosfato 0,1M a pH 7,4, durante 24 h. a temperatura ambiente, deshidratados en baños de alcohol de concentración creciente (70, 80 y 100 %), aclarados en baños de xilol, impregnados e incluidos en parafina. De este material se realizaron cortes seriados de 7mm de espesor. Una serie de cortes fue teñida con hematoxilina y eosina o tricrómico de Mallory para el análisis morfológico de las relaciones celulares epitelio-mesenquimales y la formación de la matriz. Otras series fueron utilizadas para el marcado de la fragmentación de ADN (Apoptotag‚).
Para el análisis ultraestructural, un grupo de trasplantes de 14 días se disecaron y fijaron en una solución compuesta por glutaraldehido al 4% y paraformaldehido al 4% en tampón de cacodilato de sodio 0,1M a pH 7,3 durante 24 h. a 4 ºC. Después de su desmineralización en EDTA al 7% en el mismo tampón durante una semana a 4 ºC, los bloques de tejido fueron lavados en la solución tampón y sumergidos en tetróxido de osmio al 1% en sacarosa al 5% durante 1 hora a 4 ºC. Tras varios lavados en tampón, el tejido fue deshidratado en una serie de alcoholes de concentración creciente, sumergidos en óxido de propileno, e infiltrado gradualmente con mezclas de concentraciones crecientes de resina epóxica (Araldita‚). Los bloques fueron incluidos en Araldita pura, polimerizados durante 24 horas en estufa a 30 ºC, y durante 48 horas a 60 ºC para su polimerización total. De este material, se realizaron cortes semifinos de 200 nm de espesor en un ultramicrotomo Ultracut‚. Las secciones se colorearon con azul de toluidina y observaron al microscopio de luz para orientar la obtención de los cortes ultrafinos de 75 nm de grosor. Las secciones ultrafinas se contrastaron con acetato de uranilo y citrato de plomo. La observación se llevó a cabo en un microscopio electrónico de transmisión ZEISS EM 900.
RESULTADOS
El germen dental trasplantado desarrolla, después de 7 días, tres regiones continuas: (i) una de proliferación e inicio de diferenciación similar a la vaina radicular de Hertwig, caracterizada por la presencia de preodontoblastos; (ii) otra de odontoblastos de morfología cilíndrica, bajo los que subyace una matriz de dentina; y (iii) una última de formación de dentina osteoide que se continúa con la dentina. La pulpa dental presenta una estructura prácticamente normal, con la excepción de la existencia de un lecho vascular hipertrofiado (Figura 1A,C). Las células de la región de odontoblastos están polarizadas con sus núcleos ocupando el polo basal y adoptan una orientación en empalizada en la que no observan uniones intercelulares especializadas (Figura 1F). Estos odontoblastos tienen las características propias de las células secretoras, como demuestra la presencia de abundante retículo endoplásmico rugoso (Figura 1G), aparato de Golgi y vesículas de transporte (Figura 1H).
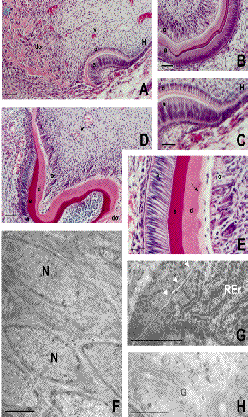 | Fig. 1. Dental germs 7 (A, C) and 14 (D-H) days after grafting, and first molar of a newborn rat (B). Dental tissues of the graft (A,D) are similar to normal ones (B). Ameloblasts (a), odontoblasts (o), enamel (e) and dentin (d) are normally organized. Odontoblasts are arranged in palisade (F,N) without specific intercellular unions (G. arrows), and possess abundant endoplasmic reticule (G, Rer), and Golgi apparatus (H). Osteoid dentin (A,D, do) lays the dental pulp and odontoblasts. Note the different staining between pre-dentin and dentin (E, arrow). Some signs of cell infiltration and hyperaemic blood vessels (v) are found within the dental pulp (A, D). H, Hertwing's root sheath. Bars mark 500 µm in A and D, 100 µm in B-D, 5 µm in F, 2 µm in G, and 0.5 µm in H. A-E, haematoxylin-eosin stain. |
| Trasplantes de 7 (A, C) y 14 (D-H) días y del primer molar de rata recién nacida (B). El germen dental desarrolla los tejidos dentales propios (A, D) con una morfología muy similar al diente normal (B). Es de destacar la perfecta organización de ameloblastos (a), esmalte (e), dentina (d) y odontoblastos (o). Los odontoblastos se organizan en empalizada (F, N) y sin uniones intercelulares evidentes (G, flechas), poseen abundante retículo endoplásmisco (G, Rer) y aparato de Golgi (H). La dentina osteoide (A, D, do) se relaciona pon las capas de odontoblastos y con la pulpa dental. Nótese la diferente apetencia tintorial de la predentina y la dentina (E, flecha). La pulpa dental (A, D) muestra signos de infiltración celular y vasos hiperémicos (v). H, vaina radicular de Hertwig. Las barras indican 500 µm en A y D, 100 µm en B-D, 5 µm en F, 2 µm en G y 0.5 µm en H. A-E, hematoxilina eosina |
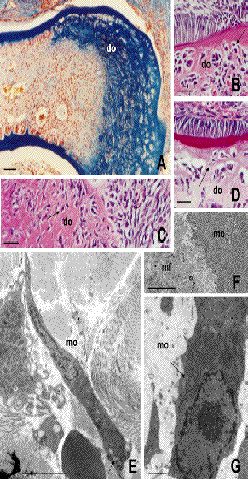
Catorce días post-trasplante se observan odontoblastos recién diferenciados, yuxtapuestos al epitelio, de morfología cilíndrica, organizados en empalizada y secretando su matriz de manera polarizada (Figura 1D). Las cantidades de dentina normal y de esmalte se incrementan, indicando la continuidad de las actividades celulares de dentinogénesis y amelogénesis (Figura 1E). A partir de este día la formación de dentina osteoide es más evidente. La región contigua a este área se caracteriza por la desorganización odontoblástica, cuyas células no se orientan en empalizada y no secretan la matriz de manera polarizada, por lo que con frecuencia quedan inmersas dentro de la matriz (Figura 2A-D).
 | F |
| Trasplantes de 14 (A-B, D, E-G) y 21 (C) días. La interfase de la dentina osteoide (A-D, do) con la dentina se caracteriza por la pérdida de la capa odontoblástica y la forma irregular de la matriz. Las células secretoras quedan incluidas en el espesor de la dentina osteoide (B-D, flechas). Estas células pierden la polaridad de los odontoblastos (E) y poseen cisternas dilatadas de retículo en su citoplasma (E, G, flechas). Las matrices rica (F, mf) y pobre (F, mo) en fibras de colágeno poseen una interfase claramente definida. Las barras indican 500 µm en A, 100 µm en B-D, 5 µm en E y G, y 2 µm en F. A, tricrómico de Mallory. B-D, hematoxilina eosina. |
La pérdida de la organización en empalizada de los odontoblastos es el resultado de la invasión de la pulpa por tejido conectivo que contiene, además de vasos hiperémicos característicos de una reacción tisular inflamatoria, muchas células mononucleadas de pequeño tamaño cuya morfología recuerda a la de los linfocitos. Es de destacar que, en estas áreas de infiltración, la predentina está prácticamente ausente. Por el contrario, y siempre en contacto con el esmalte, los ameloblastos están bien organizados, preservan la forma cilíndrica característica y están polarizados mostrando un polo secretor bien definido (Figura 2B-D). Las células que pierden la organización en empalizada (Figura 2) son semejantes a los odontoblastos; y, aunque su citoplasma las identifica como células productoras de matrices ricas en colágeno, con abundante retículo endoplásmico rugoso, carecen de una polaridad tan neta como demuestra el hecho de poseer su núcleo en el centro del soma (Figura 2E).
La dentina osteoide, de organización y estructura muy semejantes a las del hueso primario es el principal tejido neoformado y representa el mayor volumen de los tejidos desarrollados a partir de los 14 días post-trasplante. Su morfología es similar a la observada 7 días post-trasplante, con gran cantidad de células e islotes de tamaño variable de tejido conectivo incluidos en su matriz (Figura 2 A-D). Las células de la región de dentina osteoide mantienen las características de las células productoras de proteínas con abundante retículo endoplásmico rugoso, vesículas de secreción y exocíticas (Figura 2G). Estas células sintetizan una matriz que, además de contener inclusiones y/o prolongaciones celulares (Figura 3A-D), tiene dos aspectos morfológicos distintos que explican su apetencia tintorial diferente observada al microscopio de luz. De ambas, la matriz más próxima a la capa de células, y que contiene sus prolongaciones, es granular y pobre en fibras de colágeno. Aquella de localización más distal es rica en fibras colágenas entre las que se aprecian discretos restos o porciones del citoplasma de las células que contribuyeron a su formación (Figuras 2F, 3A-B).
Las células que elaboran estas matrices tienen una organización intracelular caracterizada por una región periférica con predominio del retículo endoplásmico rugoso, y otra central donde predominan el aparato de Golgi y sus vesículas de secreción con un contenido de densidad moderada. A diferencia del retículo endoplásmico de otras células secretoras, las cisternas de estas células productoras de matriz están inusualmente dilatadas, lo que probablemente indica una síntesis proteica acelerada (Figura 3C-D). No obstante, es importante resaltar que los tratamientos de descalcificación durante el procesado del tejido, como en este caso, tienden a ofrecer imágenes artefactuales como dilatación de las vesículas y desaparición de la matriz mitocondrial. El espacio extracelular es amplio y contiene un material de poca densidad por el que discurren las prolongaciones celulares. Estas prolongaciones se aponen con las de las células próximas sin establecer ningún tipo de especialización de contacto o unión intercelular (Figura 3C-D).
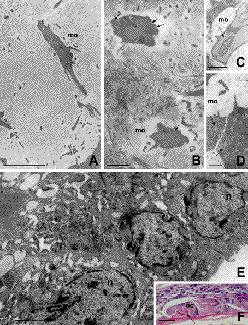 | Fig. 3. Fourteen (A-E) and twenty-one (F) days after graft. Cell prolongations embedded within the osteoid dentin possess different sizes (A-B), lack of intercellular unions (D), and contain dilated reticule cisterns (C, D, arrows). Exo- and endocityc vesicles studded the plasma membrane (B, arrows). The osteoid matrix surrounding the cell prolongation (A-B) is poor in collagen fibres (A-D, mo). Odontoclast-like cells are located near the osteoid dentin (F, oc, arrow), and possess several eccentric nuclei (E, n), and vacuoles (E). Bars mark 3 µm in A-E, and 50 µm in F. F, haematoxylin-eosin stain. |
| Trasplantes de 14 (A-E) y 21 (F) días. Las prolongaciones celulares incluidas en la matriz osteoide poseen diámetros diversos (A-B), carecen de uniones intercelulares (D) y muestran cisternas dilatadas del retículo endoplásmico rugoso (C, D, flechas). La superficie de las prolongaciones esta llena de vesículas exo y endocíticas (B, flechas). Nótese la menor electrondensidad de la matriz que circunda las prolongaciones celulares (A-B) y su pobreza en fibras (A-D, mo). Los odontoclastos situados en el límite de la dentina osteoide a la que fagocitan (F, oc, flecha), poseen varios núcleos excéntricos (E, n) y un citoplasma lleno de vacuolas (E). Las barras indican 3 µm en A-E y 50 µm en F. F, hematoxilina eosina. |
Las prolongaciones celulares incluidas en la matriz de dentina osteoide son de tamaño variado desde muy pequeñas hasta otras relativamente grandes y ramificadas. En todos los casos, vesículas de exocitosis y de endocitosis ocupan todo el contorno celular, tanto a nivel del soma como de las prolongaciones (Figuras 2G, 3A-B) y, en ocasiones, es posible observar la formación de endosomas primarios en el interior de las prolongaciones incluidas en la matriz de dentina osteoide (Figura 3B). Las vesículas de secreción poseen un contenido granular y denso con alguna similitud a la observada en la matriz. Sin embargo, hay que resaltar que en todos los casos estudiados, la matriz que está inmediatamente en contacto con las inclusiones tiene un aspecto menos electrondenso y granular (Figura 3A-D).
La actividad celular formadora de tejidos dentales prácticamente desaparece en los trasplantes de 21 días, en los que predominan signos de actividad remodeladora como grupos de células gigantes y multinucleadas en la superficie de la dentina osteoide, de la dentina y del esmalte. A veces se observan células con características morfológicas semejantes a las células gigantes que aíslan los cuerpos extraños. Estas células poseen gran cantidad de núcleos excéntricos y un citoplasma lleno de vacuolas fagocíticas indicativas de la reabsorción de la matriz (Figura 3F). Aunque nuestros resultados de microscopia óptica definen al día 21 post-trasplante como el día de mayor actividad clástica, en trasplantes de 14 días y siempre en contacto con la dentina osteoide también se aprecian células semejantes a odontoclastos: células caracterizadas por poseer varios núcleos en su polo basal y cuyo citoplasma está repleto de vesículas y cuerpos multivesiculares (Figura 3E).
La actividad secretora está completamente abolida en los trasplantes de 42 días. La ausencia de células secretoras de matriz de dentina osteoide es absoluta y contrasta con el incremento de las áreas de destrucción caracterizadas, como en la etapa precedente, por la presencia de células grandes multinucleadas. Fruto de esta reabsorción los trasplantes son de menor tamaño y quedan reducidos a restos dispersos de dentina osteoide, incluidos en un tejido conectivo reactivo repleto de vasos hiperémicos e infiltrado de células mononucleares pequeñas semejantes a linfocitos que, probablemente, es una mezcla del tejido huésped y de los restos de la pulpa dental del embrión (Figura 4A).
Los fenómenos regresivos no se caracterizan sólo por la presencia de los odontoclastos, sino que es posible además observar la presencia de imágenes de ADN fragmentado (Figura 4). Las células con ADN fragmentado, índice de la existencia de fenómenos apoptóticos, se distribuyen de manera aleatoria tanto dentro de la pulpa dental del trasplante (Figura 4B), como en las células odontoblásticas inmediatamente subyacentes a la dentina (Figura 4C-F) que se alternan con otras células de aspecto normal.
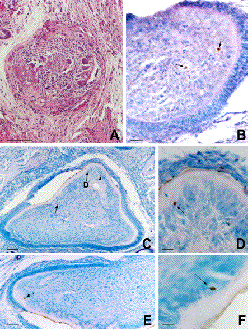 | Fig. 4. Fourteen (B-F) and forty-two (A) days after graft. The graft is a mass of osteoid dentin devoid of dental tissues (A). DNA labelled of apoptotic cells are observed within the dental pulp (B, arrows), and the odontoblast cells layer (C-F, arrows). Bars mark 500 µm in A, C and E, 100 µm in B, and 50 µm in D-F. A, haematoxylin-eosin stain. B-F, toluidine blue counterstain. |
| Trasplantes de 14 (B-F) y 42 (A) días. En el último estadio analizado el trasplante queda reducido a una masa de dentina osteoide que carece del resto de los tejidos dentales (A). Las células apoptóticas con el ADN fragmentado se distribuyen de manera aleatoria dentro de la pulpa (B, flechas) y de la capa odontoblástica (C-F, flechas). Las barras indican 500 µm en A, C y E, 100 µm en B y 50 µm en D y F. A, hematoxilina eosina. B-F, contratinción con azul de toluidina. |
DISCUSIÓN
El primer molar de la rata es un modelo muy utilizado para el análisis experimental de la odontogénesis (17). Los embriones dentales empleados en este estudio se encontraban en la fase de campana avanzada con los procesos de dentinogénesis y amelogénesis iniciados. Desde el primer día estudiado después del trasplante, los gérmenes dentales organizaron tres áreas netas de odontogénesis: (i) una región aún no diferenciada que sufre la inducción del epitelio organizado de manera semejante a la vaina radicular de Hertwig, (ii) una segunda región, en vías de diferenciación celular, en la que las células, de morfología cilíndrica y baja, se orientan en capa única y en empalizada -la región de odontoblastos diferenciados que inician la secreción de predentina- y que, como en condiciones normales, subyace a la capa de células epiteliales cilíndricas altas o preameloblastos; y (iii) una región de tejido osteoide, sin ninguna semejanza a cualquier región del desarrollo dental normal. En la evolución temporal de los trasplantes, el área de dentina osteoide, junto con la reacción del tejido huésped terminarán marcando el desarrollo del trasplante.
La determinación de la morfología coronaria está vinculada a su continuidad anatómica y a las interacciones moleculares entre el epitelio y el mesénquima (18). Los estudios precedentes de trasplantes de gérmenes dentales han obtenido resultados dispares. Así, los embriones dentales trasplantados antes de la formación de los tejidos dentales tienen una evolución prácticamente normal con formación de tejidos dental y periodontal (4-6,19). Por el contrario, los embriones trasplantados una vez iniciada la elaboración de dentina y esmalte, como es nuestro caso, se desarrollaron en unas ocasiones con éxito, (10-12,20,21) mientras que en otras sufrieron un desarrollo anómalo (8,9). Nuestros resultados demuestran, en la línea de los análisis precedentes, que la evolución final del germen trasplantado es la degeneración y reabsorción. Esta evolución, no está vinculada ni a la ausencia de alguno de los componentes embrionarios como la papila dental o el epitelio, ni a la manipulación defectuosa del embrión durante el trasplante (véase materiales y métodos). De hecho, la presencia de una región semejante a la vaina radicular de Hertwig sugiere el inicio del desarrollo de la futura raíz, donde las funciones reguladoras del mesénquima e inductoras del epitelio permiten la diferenciación celular. Esta región no presenta modificaciones histológicamente obvias en la papila y es probable que sufran las mismas modificaciones complejas observadas durante el desarrollo dentario normal. Es de esperar que en la región semejante a la vaina radicular de Hertwig se expresen también los mismos genes homeóticos que tienen una interacción con factores de crecimiento localizados en el epitelio odontógeno, de comunicación inicial entre las células epiteliales y el ectomesénquima condensado (22,23). En nuestro caso no sólo se trata del mesénquima trasplantado sino también del tejido huésped circundante. Deben existir pues otros factores que interfieran y alteren la evolución normal de la morfogénesis dental en condiciones heterotópicas y se hace necesario identificarlos, a través de ulteriores estudios, para entender mejor los mecanismos íntimos de la odontogénesis. Este es pues un modelo de estudio no solo para el análisis del juego inductivo de las interacciones epitelio-ectomesenqui-males, que sugieren la importancia de la presencia de la papila dental en la formación del diente, o la importancia del epitelio dental en la inducción de la odontogénesis (24,25), sino también de su papel inductor sobre estructuras mesenquimatosas no odontogénicas (26).
En todos los casos analizados después del trasplante, la dentina se continuó con dentina anómala, que no sólo se distingue desde el punto de vista estructural de la primera; sino por las células que la secretan que carecen de las características de los odontoblastos típicos, como son su morfología cilíndrica y su orientación en empalizada. La presencia de dentina osteoide ha sido descrita en situaciones experimentales diversas (13-16,27). No obstante y a pesar de los estudios precedentes (28,29), no existen datos previos sobre las características estructurales de la matriz de este tejido osteoide. Esta matriz presenta dos morfologías diferentes: (i) una matriz yuxtapuesta a las células, pobre en fibras de colágeno, y (ii) otra, rica en fibras, en la superficie opuesta a la precedente y distante de las células. Las células en yuxtaposición con la matriz tienen una morfología de células secretoras que no difiere notablemente de la citología típica de las células secretoras de proteínas de las matrices de predentina o pre-ósea normales, que además, y a diferencia de la matriz osteoide pobre en colágeno que circunda a dichas células, son muy bien conocidas por su riqueza en estas fibras. Los presentes resultados no dejan margen de duda sobre la existencia de una secreción de matriz, pero lo que destaca es que el colágeno de la matriz se encuentra a una distancia considerable de la superficie celular, no descrita previamente. Esta, podría ser interpretada como una secreción del procolágeno que, sólo y a distancia de la superficie celular, sufriría el proceso de polimerización del tropocolágeno; sin embargo, el por qué se realiza a tanta distancia de la superficie secretora permanece aún sin desvelar. Más aún, esta misma relación célula/matriz, se establece en aquellas prolongaciones citoplásmicas distales que están en el interior de la matriz fibrilar, ya que sistemática-mente la matriz que las envuelve inmediatamente es también pobre en fibras de colágeno, lo que indica la similitud funcional respecto a la secreción de la matriz entre las prolongaciones citoplasmáticas y el cuerpo celular.
Las prolongaciones citoplasmáticas son similares a los procesos de los odontoblastos normales. Los procesos odontoblásticos carecen casi completamente de vesículas de exocitosis (28); sin embargo, las prolongaciones de las células incluidas en la dentina osteoide poseen una cantidad importante de vesículas exocíticas liberando matriz al espacio extracelular, simultáneamente con vesículas endocíticas cubiertas. Esto quiere decir que estas células están en un activo proceso de síntesis y secreción de la matriz. Esta diferencia podría justificar el gran incremento observado en el tamaño de la matriz de los trasplantes. Pensamos pues que nuestros resultados, primeros en la literatura, abren nuevas vías para el estudio de la síntesis y secreción tanto de colágeno como de proteínas no-colágeno en aquellas matrices de carácter reactivo en las que la polimerización se realiza a una distancia considerable de la superficie celular.
La doble estructura de la matriz -presencia de fibras de colágeno en la región que se encuentra apartada de la superficie celular, y ausencia de fibrilogénesis en las regiones próximas a la superficie celular-, podría explicarse por la existencia de una actividad fibrolítica concurrente en la interfase célula-matriz, de modo que la solubilización de las fibras de colágeno justificase su ausencia. Sin embargo, la pobreza en lisosomas y vesículas o vacuolas fagocíticas de estas células no parece sustentar esta explicación.
La génesis de la dentina osteoide ha sido vinculada a la pérdida de odontoblastos con la consecuente neodiferenciación de otras células pulpares que forman un tejido sin túbulos y semejante al hueso (11). De este modo, las células mesenquimales atraviesan por un estadio previo, antes de adquirir una morfología característica del odontoblasto, y secretan y mineralizan una matriz de características similares a las de la dentina osteoide (12). Además, la dentina adulta trasplantada heterotopicamente induce la formación de tejido osteoide por parte del huésped (30,31). En nuestros trasplantes, aunque la transformación celular del trasplante es evidente, la existencia de un fenómeno inductivo del trasplante sobre el tejido huésped justificaría la gran cantidad de dentina osteoide. Mas aún, nuestras observaciones parecen sugerir que, en condiciones heterotópicas, la dentina osteoide es una etapa previa a la formación de dentina tubular normal e inclusive con capacidad de inducir la diferenciación de los ameloblastos y la formación de esmalte.
La adquisición de la forma definitiva, al final del desarrollo, de los tejidos pasa obligatoriamente por una fase de remodelación en la que la muerte celular programada o apoptosis desempeña un papel crucial (para una revisión ver ref. 32-34). Durante la odontogénesis normal, la muerte celular es activa en diversas localizaciones y estadios del diente embrionario (35-37). Nuestro análisis identifica por primera vez la presencia de este fenómeno en una fase muy concreta del desarrollo del trasplante coincidente con la fase final de máxima formación de dentina. La detección de células con el ADN fragmentado en el momento crítico del trasplante -el período de 14 días post-trasplante-, equivalente a la fase de campana avanzada del desarrollo normal en la que comienza la eliminación de los tejidos dentales formados, sugiere que estas células están siguiendo su programa de desarrollo, antes de presentar un fenómeno reactivo que, por otro lado, induciría a la aparición de fenómenos necróticos. Estudios en marcha en la actualidad y de detección inmunocitoquímica de la caspasa-3 activada, enzima final de la cascada bioquímica de la apoptosis (38,39), permitirán en un futuro no muy lejano constatar la veracidad de ésta hipótesis.
La actividad formadora de dentina osteoide declina en los trasplantes con 21 días, aunque esporádicamente se observan áreas de formación y es reemplazada por una actividad de reabsorción de los tejidos dentales, cuya característica es la presencia de células gigantes de cuerpo extraño en el tejido conectivo y de odontoclastos junto a la dentina osteoide, dentina normal y esmalte. Estos resultados difieren de los obtenidos cuando los trasplantes del embrión dental son intraóseos, en los que durante el estadio de formación de los tejidos mineralizados continúa un desarrollo anormal, con metaplasia del órgano del esmalte, presencia de matriz de esmalte en el folículo, formación de quistes, y ausencia de desarrollo del ligamento periodontal, pero sin signos de actividad de reabsorción (8,9). La actividad clástica podría estar vinculada más a la reacción del tejido huésped circundante que a la del tejido trasplantado. Así, en trasplantes no isogénicos de gérmenes dentales aparecen células gigantes multinucleadas en la superficie pulpar de la dentina (7), muy parecidas a las observadas aquí. Este fenómeno lítico reactivo ha sido también sugerido en los estudios clínicos como causa del fracaso de los autotrasplantes de gérmenes dentales (3). En nuestros resultados, el cuadro reactivo inflamatorio del tejido conectivo huésped acontece desde las primeras etapas post-trasplante, siendo más evidente en las últimas fases estudiadas que coinciden con los períodos de 21 y 42 días en los que predomina la actividad clástica. Tal coincidencia nos permite deducir que las modificaciones del tejido receptor, que ocurren como consecuencia del trasplante, deben estar estrechamente relacionadas con el rechazo del mismo.
Finalmente y aunque en los últimos diez años la técnica de trasplante de tejidos ha experimentado un uso importante, este es el primer estudio de trasplantes ectópicos de gérmenes dentales en la dermis de animales huéspedes adultos. Modelo que, después de este análisis, nos parece útil para investigar los mecanismos de formación y destrucción de los tejidos dentales.
BIBLIOGRAFÍA/p>
1. Eskici A, Drosch H, Bantleon H, Permann I. Periodontal development after tooth germ transplantation whitin the framework of orthodontic treatment. Fortschr Kieferorthop 1989;50:285-93. [ Links ]
2. Mucchitsch AP, Drocschl H, Eskici A, Bantleon HP, Weiland F, Thom M. The tooth transplant in orthodontic treatment planning. Fortschr Kieferorthop 1991;52:170-5. [ Links ]
3. Strobl V, Leja W, Norer B. Outcome of wisdom tooth germ transplantation. Forschr Kiefer Gesichtschir 1995;40:78-80. [ Links ]
4. Granholm AC. Histology, innervation and radiographic appearance of fetal rat tooth germs developing in oculo. Scan J Dent Res 1984;92:381-90. [ Links ]
5. Lumsden AG, Buchanan JA. An experimental study of timing and topography of early tooth development in the mouse embryo with an analysis of the role of innervation. Arch Oral Biol 1986;31:301-11. [ Links ]
6. Ishizeki K, Fujiwara N, Sakakura Y, Nawa T. The development of mandibular molar tooth germs isografted in the mouse spleen. Arch Oral Biol 1987;32:695-704. [ Links ]
7. Carlile MJ, Harrison VT, Lumsden AGS, Palmer MT. Development and cell fate in interspecific (Mus musculus / Mus caroli) orthotopic transplants of mouse molar tooth germs detected by in situ hybridization. Arch Oral Biol 1998;43:395-406. [ Links ]
8. Monsour FM, Adkins KF. Aberrations involving the enamel epithelium in transplanted developing teeth. J. Oral Maxillofac Surg 1983;41:377-84. [ Links ]
9. Barrett AP, Reade PC. A histological investigations of isografts of immature mouse molars to an intrabony and extrabony site. Arch Oral Biol 1982;27:451-3. [ Links ]
10. Hewage S, Heaney TG. Creation of a chimaeric periodontium in the rat by isotopic tooth germ transplantation. Arch Oral Biol 1990;35:681-4. [ Links ]
11. Ishizeki K, Fujiwara N, Nawa T. Morphogenesis of mineralized tissues induced by neonatal mouse molar pulp isografts in the spleen. Arch Oral Biol 1989;34:465-73. [ Links ]
12. Ishizeki K, Nawa T, Sugawara M. Calcification capacity of dental papilla mesenchymal cells trasplanted in the isogenic mouse spleen. Anat Rec 1990;226:279-87. [ Links ]
13. Lownie JF, Cleaton-Jones E, Coleman H, Forbes M. Long-term histologic changes in the dental pulp after posterior segmental osteotomies. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999;87:299-304. [ Links ]
14. Ayanoglou CM, Godeau G, Lesty C, Septier D, Goldberg, M. Cyclosporine-A induced alterations of dentinogenesis in rat molars. J Oral Pathol Med 1997;26:129-34. [ Links ]
15. Nasman M, Hammarstrom L. Influence of the antineoplastic agent cyclophosphamide on dental development in rat molars. Acta Odontol Scand 1996;54:287-94. [ Links ]
16. Higashi T, Okamoto H. Characteristics and effects of calcified degenerative zones on the formation of hard tissue barriers in amputed canine dental pulp. J Endod 1996;22:168-72. [ Links ]
17. Zhang CZ, Li H, Young WG, Bartold PM, Chen C, Waters MJ. Evidence for a local action of growth hormone in embryonic tooth development in the rat. Growth Factors 1997;14:131-43. [ Links ]
18. D'Souza RN, Aberg T, Gaikwad J, Cavender A, Owen M, Karsenty G et al. Cbfa1 is required for ephitelial-mesenchymal interactions regulating tooth development in mice. Development 1999;126:2911-20. [ Links ]
19. Sakakura Y, Fujiwara N, Nawa T. A simple, disposable, and improved organ culture system for maintaining three-dimensional development of mouse embryonic molars. In Vitro Cell Dev Biol 1989;25:959-64. [ Links ]
20. Lubbock MJ, Harrison VT, Lumsden AG, Palmer RM. Development and cell fate in interespecific (Mus Musculus/Mus Caroli) intraocular transplants of mouse molar tooth-germ tissues detected by in situ hybridization. Arch Oral Biol 1996;41:77-84. [ Links ]
21. Iyaruu, DM, van Croonenburg EJ, van Duin MA, Bervoets TJ, Woltgens JH, de Blieck-Hogervorst JM. Development of transplanted pulp tissue containing epithelial sheath into a tooth-like structure. J Oral Pathol Med 1999;28:293-6. [ Links ]
22. Wang YH, Upholt WB, Sharpe PT, Kollar EJ, Mina M. Odontogenic epithelium induces similar molecular responses in chick and mouse mandibular mesenchyme. Dev Dyn 1998;213:386-97. [ Links ]
23. Tucker AS, Sharpe PT. Molecular genetics of tooth morphogenesis and patterning: the right place. J Dent Res 1999;78:826-34. [ Links ]
24. Baba T, Terashima T, Oida S, Sasaki S. Determination of enamel protein synthesized by recombined mouse molar tooth germs in organ culture. Arch Oral Biol 1996;41:215-9. [ Links ]
25. Morio I. Recombinant study of the mouse molar cervical loop and dental papilla by renal transplantation. Arch Oral Biol 1985;30:557-61. [ Links ]
26. Kollar EJ, Mina M. Role of the early epithelium in the pattering of the teeth and Meckel's cartilage. J Craniofac Genet Dev Biol 1991;11:223-8. [ Links ]
27. Jepsen S, Albers HK, Fleiner B, Tucker M, Rueger D. Recombinant human osteogenic protein-1 induces dentin formation: an experimental study in miniature swine. J Endod 1997;23:378-82. [ Links ]
28. Ten Cate AR. Oral histology: development, structure and function. 5th ed. St. Louis - Missouri: Mosby; 1998. [ Links ]
29. Katchburian E, Arana V, eds. Histologia e embriologia oral. São Paulo: Panamericana; 1999. [ Links ]
30. Moehl T, Ripamonti U. Primate dentine extracellular matrix induces bone differentiation in heterotopic sites of the baboom (Papio ursinus). J Periodontal Res 1992;27:92-6. [ Links ]
31. Shimono M. Influences of 4-meta/MMA-TBB adhesive resin on osteodenti-nogenesis of transplanted rabbit dental pulp in vivo: immunohistochemical and electron microscopic studies. Bull Tokyo Dent Coll 1999;40:129-38. [ Links ]
32. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer 1972;26:239-57. [ Links ]
33 Ellis RE, Yuan JV, Horvitz HR. Mechanisms and functions of cell death. Annu Rev Cell Biol 1991;7:663-98. [ Links ]
34. Nijhawan D, Honarpour N, Wang X. Apoptosis in neural development and disease. Annu Rev Neurosci 2000;23:73-87. [ Links ]
35. Lesot. Mouse molar morphogenesis revisited by three-dimesional reconstruction. I. Analysis of initial stages of the first upper molar development revealed two transient buds. Int J Dev Biol 1996;40:1009-116. [ Links ]
36. Viriot L, Peterkova R, Vonech JL, Peterka M, Ruch JV, Lesot H. Mouse molar morphogenesis revisited by three-dimensional reconstruction. III. Spacial distribution of mitoses and apoptosis up to bell-staged first molar teeth. Int J Dev Biol 1997;41:679-90. [ Links ]
37. Vaahtokari A, Aberg T, Thesleff I. Apoptosis in the developing tooth: association with an embryonic signaling center and suppression by EGF and FGF-4. Development 1996;122:121-9. [ Links ]
38. Porter AG, Janicke RU. Emerging roles of caspase-3 in apoptosis. Cell Death Diff 1999;6:99-104. [ Links ]
39. Kuan Ch-Y, Roth KA, Flavell RA, Rakic P. Mechanisms of programmed cell death in the developing brain. Trends Neurosci 2000;23:291-7. [ Links ]











 texto en
texto en 


