INTRODUCCIÓN
Las infecciones del tracto urinario (ITU) constituyen una de las patologías infecciosas más frecuentes tanto en la comunidad como a nivel hospitalario. Representan uno de los principales motivos de consulta en Atención Primaria. Se les considera un problema de salud pública, su incidencia se estima en 150 millones de casos por año, resultando en un alto costo económico en gastos directos1. Su frecuencia es mayor en mujeres que en hombres, cerca del 25 % al 30 % de las mujeres tendrán episodios recurrentes dentro de los siguientes 12 meses2.
El principal microorganismo implicado en las ITU adquiridas en la comunidad, y que mayormente se asocia a recidivas es Escherichia coli. El cuadro etiológico incluye otras Enterobacteriaceae como Proteus mirabilis y Klebsiella pneumoniae. Así como bacterias Gram positivas como Staphylococcus saprophyticus y Streptococcus agalactiae3.
En las últimas décadas, se ha presentado un importante incremento en el aislamiento de cepas bacterianas multiresistentes, tanto de pacientes de comunidad, como hospitalizados. Lo anterior, probablemente asociado al manejo empírico inicial de estas infecciones, principalmente en el primer nivel de atención médica. Se ha documentado que tanto la cantidad de antimicrobianos utilizados como la forma de usarlos favorece de manera importante el desarrollo de la resistencia4, cuyo principal mecanismo en las enterobacterias es la producción de beta-lactamasas de espectro extendido (BLEE), codificadas principalmente por genes asociados a plásmidos. Estos elementos extracromosómicos también confieren la condición a otros grupos de antibióticos, produciendo bacterias altamente resistentes5.
Debido al alto potencial de diseminación de los plásmidos, el tratamiento empírico de las ITU, requiere la constante vigilancia de la susceptibilidad antimicrobiana de los principales uropatógenos de la institución, región o país, con la finalidad de orientar la elección apropiada del tratamiento. Esta acción permitirá fundamentar las decisiones terapéuticas en la consulta médica, incidir en la revisión y la actualización de las Guías de Práctica Clínica, así como evaluar el impacto de las intervenciones encaminadas a contener este problema de salud, identificado como tal a nivel mundial6. El objetivo del presente trabajo fue determinar los patrones de susceptibilidad antimicrobiana “in vitro” de bacterias Gram negativas aisladas de infecciones de vías urinarias bajas de pacientes ambulatorios, y relacionarla con variables de estudio como la edad, el sexo, ITU previa y presencia de diabetes mellitus tipo 2 (DM2).
MATERIAL Y MÉTODOS
Se realizó un estudio descriptivo observacional y transversal, con 278 cepas aisladas de orina de pacientes con ITU baja, que acudieron a consulta entre los meses de marzo de 2018 a febrero de 2019 a la Clínica de Medicina Familiar (CMF) Dr. Ignacio Chávez del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE). Se llevó a cabo un muestreo no probabilístico por conveniencia. Se realizó cálculo de tamaño de muestra para estudios descriptivos mediante la fórmula para variables cualitativas y distribución binominal (proporciones) y criterio de diferencia absoluta (n=278). Se incluyeron pacientes que presentaron infección de vías urinarias bajas, de cualquier edad y sexo y que aceptaron participar en el estudio mediante la firma por escrito de un consentimiento informado. No se incluyeron pacientes con tratamiento al menos quince días antes del estudio, con algún otro tipo de infección urinaria, o que presentará alguna incapacidad que no le permitiera formar parte de la investigación. Se aplicó un cuestionario para identificar variables de estudio (sexo, edad, ITU previa, presencia de DM2).
El primer aislamiento e identificación de las bacterias fue realizado en el laboratorio de bacteriología de la clínica. Para el primero, se utilizaron los medios de agar sangre, agar Mc Conkey y agar CLED (Becton-Dickinson). La identificación de especies bacterianas y la determinación de la susceptibilidad antimicrobiana, se realizaron con el sistema Phoenix 100 de Becton Dickinson. Se distinguieron patrones de susceptibilidad de acuerdo con los parámetros establecidos por CLSI (Clinical and Laboratory Standards Institute). Los antimicrobianos probados se dividieron en 9 categorías que se presentan en la tabla 1.
Se determinó el grado de resistencia de las bacterias con base en los criterios de Magiorakos AP et al7 para Enterobacteriaceae, quienes las dividen en: multi-drogo-resistente (MDR), extensivo-drogo-resistente (EDR) y pan-drogo-resistente (PDR). Se realizaron dos modificaciones en las categorías antimicrobianas: a) se unieron la ampicilina y la ampicilina-sulbactam en una sola categoría y b) se incluyó el cefoxitin en la categoría de cefalosporinas de espectro no extendido de 1ª y 2ª generación. Así los 16 antibióticos probados, quedaron incluidos dentro de 9 categorías. En esta clasificación, los autores sólo toman en cuenta la resistencia adquirida, mientras que la resistencia intrínseca no es considerada. Con base en lo anterior, se define como MDR a la resistencia adquirida a al menos un agente en tres o más categorías antimicrobianas. EDR se define como resistencia a al menos un agente en todas las categorías, a excepción de dos o menos de estas mismas, (es decir, los aislados bacterianos siguen siendo susceptibles a una o dos categorías), y PDR se define como resistencia a todos los agentes en todas las categorías7. Se consideraron además dos categorías para clasificar a todas las cepas; totalmente sensibles (TS), y moderadamente resistente (MR) para aquellas que presenten al menos una resistencia a cualquier antimicrobiano, sin alcanzar la categoría de MDR.
Se utilizó estadística descriptiva para determinar proporción de resistencias, e intervalos de confianza al 95% para proporciones. Para asociar los resultados de susceptibilidad con las variables de estudio se utilizó Chi cuadrado de independencia, o prueba exacta de Fisher. Valor de significancia de 0,05. Programa estadístico SPSS versión 22. El trabajo fue enviado para evaluación y registro en la Comisión de Investigación y Bioética del ISSSTE.
RESULTADOS
El promedio de edad de los pacientes fue de 67,19 (DE: 15,2), rango de 90 años (5-95). El 71,9 % pertenecían al sexo femenino, solamente el 19,1 % presentaban DM2.
Se aislaron e identificaron 278 enterobacterias a partir de orina del mismo número de pacientes con ITU baja: 231 Escherichia coli, 24 Klebsiella spp, 8 Enterobacter spp, 7 Proteus spp, 7 Citrobacter spp, 1 Serratia spp.
La resistencia más alta fue para: ampicilina con 74,1 % (IC 95 %: 68,6-78,9), seguida de ampicilina-sulbactam con 63,7 % (IC 95 %: 57,8-69,1) y las fluoroquinolonas: ciprofloxacino con 60,4% (IC 95 %: 54,5-66,0) y levofloxacino con 58,3% (IC 95 %: 52,4-63,9). En contraste, la sensibilidad más alta fue observada en amikacina con 100 %, seguida por tigeciclina con 95,7 % (IC 95 %: 92,6-97,5) y los carbapenems. Los resultados se muestran en la figura 1.

Figura 1. Porcentajes de resistencia antimicrobiana de 278 cepas aisladas de urocultivos. AMP= ampicilina; CFZ= cefazolina; FEP = cefepime; FOX = cefoxitina; CRO = ceftriaxona; SAM = ampicilina + sulbactam; CIP = ciprofloxacino; LVX = levofloxacino: ETP= ertapenem; IPM= imepenem; MEM= meropenem; GEN= gentamicina; TZP= piperacilina + tazobactam; TGC= tigeciclina; SXT= trimetoprim-sulfametoxazol; AMK= amikacina.
Los resultados de la resistencia antimicrobiana por género bacteriano se presentan en la tabla 2. Solo para Escherichia coli se obtuvieron cepas sensibles a la ampicilina. Al igual que en el análisis global, se destaca el bajo porcentaje de resistencia de Escherichia coli y Klebsiella spp, a las carbapenemasas.
Tabla 2. Porcentajes de resistencia antimicrobiana in vitro de 278 bacterias Gram negativas por género.

AMP= ampicilina; CFZ= cefazolina; FEP = cefepime; FOX = cefoxitina; CRO = ceftriaxona; SAM = ampicilina + sulbactam; CIP = ciprofloxacino; LVX = levofloxacino: ETP= ertapenem; IPM= imepenem; MEM= meropenem; GEN= gentamicina; TZP= piperacilina + tazobactam; TGC= tigeciclina; SXT= trimetoprim-sulfametoxazol; AMK= amikacina
Los resultados del perfil de resistencia antimicrobiana con base en la estratificación de Magiorakos AP, se presentan en la figura 2. Del total de cepas, 36 (12,9 %; IC 95 %: 9,5-17,4) fueron totalmente sensibles a los antibióticos probados, 83 (29,8 %) (IC 95 %: 24,7-35,4) fueron MR, 140 (50,4 %; IC 95 %: 44,5-56,1) MDR, 19 (6,8 %; IC 95 %: 4,4-10,4) EDR, no hubo cepas PDR. Por género bacteriano, las 36 cepas totalmente sensibles fueron Escherichia coli (15,6 %; IC 95 %: 11,4-20,8). Klebsiella spp. presentó el porcentaje más alto de cepas MR.
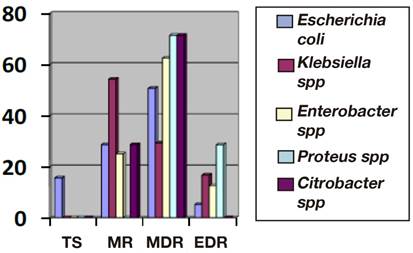
Figura 2. Estratificación de resistencia antimicrobiana de diferentes géneros bacterianos, aislados de urocultivos de pacientes ambulatorios con ITU. TS = Totalmente sensibles; MR = Moderadamente resistentes; MDR = multi-drogo-resistentes; EDR = Extensivo-drogo-resistente. Con base a los criterios de Magiorakos et al7.
La resistencia global de las cepas a diferentes números de antimicrobianos se muestra en la tabla 3. Sólo 36 cepas (12,9 %; IC 95 %: 9,5-17,4), fueron sensibles a todos los antimicrobianos probados, en contraste, un porcentaje parecido de cepas (13,3 %; IC 95 %: 9,8-17,8), fue resistente a 8 antimicrobianos. Solo 2 cepas (0,71 %; IC 95 %: 0,2-2,5) presentaron resistencia a 13 de los 16 antimicrobianos probados.
Tabla 3. Frecuencia de resistencia global de cepas Gram negativas asiladas de urocultivo, con base al número de antimicrobianos.

Al asociar las variables de estudio con la resistencia a cada antimicrobiano, sólo se obtuvo significación estadística entre las cefalosporinas de 1ª y 2ª generación; cefaxolina y cefoxitin, y el imipenem, con el sexo de los pacientes, con mayor porcentaje en los hombres.
El análisis de la resistencia de cada una de las cepas con cada uno de los antimicrobianos, permitió formar perfiles de resistencia a antimicrobianos, donde los más frecuentes estuvieron formados por la resistencia al menos a un beta lactámico y/o una quinolona, dentro de los que destacan los siguientes: 15 cepas fueron resistentes sólo a las dos flourquinolonas probadas; 11 fueron resistentes a los beta-lactámicos: ceftriaxona, cefepime, ampicilina, ampicilina-sulbactam, cefaxolina y las dos quinolonas, también11 cepas, fueron resistentes a: ampicilina, ampicilina-sulbactam, cefaxolina, ciprofloxacino, y levofloxacino, 10 cepas fueron resistentes a ampicilina, ampicilina sulbactan, y a trimetoprim-sulfametoxazol, y el mismo número de cepas fueron resistentes a ampicilina, ampicilina-sulbactam, cefazolina, cefepime, ceftriaxona, ciprofloxacino, levofloxacino y trimetoprim-sulfametoxazol. A nivel de géneros, para Escherichia coli, la combinación más común de resistencias se presentó con las dos quinolonas probadas, en 14 cepas. Para Klebsiella spp, la resistencia más frecuente se presentó en la ampicilina como único antibiótico en 8 oportunidades.
DISCUSIÓN
En las últimas décadas, se ha presentado un incremento en las tasas de resistencia de las bacterias causales de ITU frente a los antimicrobianos considerados de primera elección, jugando un papel importante la presión selectiva producida por el uso indiscriminado de estos antimicrobianos. En este estudio, obtuvimos porcentajes altos de resistencia para las flourquinolonas, para los inhibidores de la vía de los folatos, y para los betalactámicos en general, a excepción de los carbapenems. Mora Hernández et al8, en Quintana Roo, México, con 163 cepas tanto hospitalarias como de comunidad, obtuvieron 43 % de cepas resistentes a ciprofloxacino, independientemente de su origen. Galván et al5, obtuvieron porcentajes de resistencia de 94,3 % para ciprofloxacino y 86,8 % para levofloxacino, en cepas de comunidad. En contraste con lo anterior, en un estudio con cepas aisladas de clínicas de primer nivel de 6 países de Europa9, se reportó que el ciprofloxacino presentó el porcentaje de resistencia más bajo (15,1 %). En la mayoría de los estudios aquí referidos, la tasa de resistencia a quinolonas superó el 30 %; según esto, su uso empírico en infecciones urinarias estaría contraindicado. Sin embargo, existen autores como Betrán et al10 que defienden su gran utilidad en el tratamiento empírico de las cistitis no complicadas, incluso con porcentajes de resistencia del 20-30 %, debido a la alta concentración que alcanza el fármaco en la orina, fenómeno que no se ha descrito ni en penicilinas ni en trimetoprim-sulfametoxazol. Es importante mencionar que el ciprofloxacino está considerado en la primera línea de elección para las cistitis no complicadas tanto en pacientes ambulatorios como hospitalizados, de acuerdo a la Guía de Práctica Clínica del Sector Salud en México11. Sin embargo, la misma guía menciona que no se deben de administrar quinolinas en el tratamiento empírico, ya que se favorece el desarrollo de resistencias.
A nivel de géneros bacterianos, en tres de los antimicrobianos mayormente prescritos para ITU no complicadas, ampicilina, trimetoprim-sulfametoxazol y cefalotina, obtuvimos porcentajes de resistencia altos. Mayorga Marín12, en Nicaragua, con 521 cepas aisladas en un laboratorio de un campus universitario, refiere 57,7 % de cepas de Escherichia coli resistentes a trimetoprim-sulfametoxazol. Considerando los altos porcentajes de resistencia presentados, es importante señalar que el trimetoprim-sulfametoxazol también está indicado en la primera línea de elección para ITU no complicada, de acuerdo con la guía ya referida. Lo anterior genera la interrogante de cuál antimicrobiano utilizar, sobre todo en los tratamientos empíricos. Si se acepta que para poder prescribir un antimicrobiano, este debe de presentar porcentajes de resistencia menores al 20 %, con base en nuestros resultados, solo el cefoxitin, la tigeciclina, la amikacina y los carbapenems podrían ser considerados como alternativas viables en el tratamiento de las infecciones del tracto urinario extrahospitalarias, sin dejar de considerar las características propias de cada uno. Aunque para el caso del cefoxitin, como lo refieren Betrán et al10, sus tasas de recurrencias pueden ser mayores debido a su actividad anaerobicida, además de que es preciso un tratamiento más prolongado que otras opciones para lograr la misma eficacia. Y en el caso de la amikacina, son bien conocidos sus efectos nefrotóxicos y ototóxicos que limitan su uso.
Diversos autores13 han reportado que al presentarse la transmisión de material genético relacionado con la resistencia a los beta-lactámicos, conjuntamente se produce transmisión de genes contra otros grupos de antimicrobianos; tal es el caso de las quinolonas, en donde se reporta resistencia asociada a la presencia de genes que codifican la sobre expresión de bombas de eflujo, como el gen MarA presente en bacterias Gram negativas, incluida Escherichia coli. Lo anterior da como resultado la aparición de cepas MDR, que son consideradas un problema de salud a nivel mundial.
Al identificar los patrones de resistencia antimicrobiana con base en la clasificación propuesta por Magiorakos et al7, obtuvimos que más de la mitad de las cepas fueron MDR o EDR, tanto en su totalidad, como por género bacteriano, a excepción de Klebsiella spp. Hadifar et al14, en un meta análisis que incluyó 15 artículos, obtuvieron 49,4 % de MDR con cepas de Escherichia coli uropatógenas (ECUP), similar al 50,6 % obtenido en nuestro trabajo. Sin embargo, la mayoría de la información obtenida en la literatura presenta porcentajes superiores; por ejemplo, en Asia, en Nepal, Ansariet al15, con 200 ECUP de un centro de atención, obtuvieron 78 % de MDR. En Europa, Rijavec et al16, en Eslovenia, reportaron 42 % de MDR de cepas ECUP de comunidad. En América, en particular en EUA, Linder et al17, obtuvieron 7,1 % de ECUP-MDR en cepas ambulatorias. Fasubga et al18, obtuvieron únicamente 1,9 % de cepas MDR y 0,2 % de cepas EDR.
Es clara la diferencia en los porcentajes de las cepas MDR entre las distintas áreas geográficas y entre los países desarrollados y no desarrollados. Lo anterior pudiera estar asociado a la falta o incumplimiento de políticas de uso racional de antimicrobianos y la precariedad de recursos para confeccionar estrategias de contención adecuadas5.
Estos hallazgos indican que los médicos en general pueden enfrentar serias dificultades al tratar la mitad o más de los casos de ITU debido a las infecciones por ECUP y otros géneros bacterianos.
Con referencia a la relación de la resistencia bacteriana y las variables analizadas sólo se obtuvo significancia estadística con el sexo y algunas cefalosporinas y con el imipenem, resultando en todos los casos una mayor resistencia en los hombres. Calle et al19 evaluaron los factores asociados a la presentación de infecciones urinarias por Escherichia coli productoras de betalactamasas de espectro extendido, observando que el sexo masculino, la edad mayor de 45 años y la hospitalización previa fueron los factores más importantes.
En este estudio se presentaron un número importante de perfiles de resistencia diferentes. Se destaca que, en 37 cepas, se identificaron 8 resistencias a los diferentes antimicrobianos con 12 perfiles diferentes, recalcando los que involucran beta lactámicos más quinolonas y bloqueadores de la síntesis de factores metabólicos. Lo que concuerda con lo ya descrito con relación a la MDR, en la que se involucran genes que codifican para resistencia a beta-lactámicos y genes que codifican para resistencia a quinolonas.
De los beta-lactámicos combinados con inhibidores analizados en este estudio, los porcentajes de resistencia de la combinación ampicilina-sulbactam no permite su uso en terapia de primera línea de las infecciones urinarias asociadas a enterobacterias. Diversos autores20 han referido que Escherichia coli puede desarrollar resistencia a estas combinaciones por varios mecanismos, como la sobreproducción de beta-lactamasas tipo TEM-1 o AmpC, alteraciones en los canales de porinas y en menor escala, beta-lactamasas tipo TEM-1 mutantes.
El uso indiscriminado de antimicrobianos ha hecho de las ITU un problema de salud pública. La alta resistencia a los mismos obtenida en este trabajo a prácticamente todos los grupos de antimicrobianos, hacen necesario identificar los géneros bacterianos que mayormente originan la patología en cada zona, así como estar al tanto de los patrones de susceptibilidad antimicrobiana. Lo anterior favorecería la elección de un tratamiento empírico eficaz, ayudaría a la regresión a sensibilidad de las cepas actualmente resistentes, y contribuiría al uso racional de los antimicrobianos.
En las limitaciones del estudio, es importante considerar que los resultados se corresponden solo con una clínica de primer nivel del sur de la ciudad de México de pacientes de uno de los institutos de seguridad social del país, por lo que los resultados obtenidos están en función del mayor o menor uso del tipo de antimicrobianos en la región.















