INTRODUCCIÓN
Los Orthocoronavirinae son virus ARN grandes, con diámetros de 120-160 nm. Se clasifican en cuatro subtipos: a, b, g y d. El SARS-CoV-2, responsable de la COVID-19, pertenece al grupo b-coronavirus1.
Se ha propuesto que, como respuesta al virus, se produce la activación de los monocitos y células endoteliales, con liberación de citoquinas y expresión de factores tisulares y de Von Williebrand. La trombina libre circulante, junto a la falta de control por parte de los anticoagulantes naturales, sería responsable de la activación plaquetaria y la estimulación de la fibrinólisis, produciéndose una activación de la coagulación con hiperfibrinólisis secundaria.
La flebitis y periflebitis de las venas superficiales toracoepigástricas de la pared torácica y de la mama fueron descritas por Mondor2 en 1939; afectan a ambos sexos, incluidos niños, pero se da principalmente en mujeres de entre 21 y 55 años. Su etiología es muy variada, incluyendo procedimientos quirúrgicos o diagnósticos de la mama, traumatismos, procesos febriles, sepsis, virus de hepatitis C (VHC), ejercicio físico, estados de hipercoaguabilidad, artritis reumatoide y enfermedades sistémicas o neoplásicas, ente otras3,4.
La enfermedad de Mondor presenta una clínica característica con dolor mamario y de la pared lateral del tronco de aparición brusca. Posteriormente, surge un cordón fibroso, visible, palpable y doloro- so, más evidente con la abducción del brazo homolateral. Suele presentar un curso benigno y autolimitado, con resolución en 4-8 semanas, aunque puede evolucionar hacia la cronicidad y cursar con pequeñas necrosis cutáneas de la zona afectada5.
CASO CLÍNICO
Mujer de 41 años, no fumadora, sin hábitos tóxicos, nulípara, no toma anovulatorios ni ningún otro medicamento crónico. Sin patología crónica y ausencia de cirugías previas. No constan traumatismos ni procesos inflamatorios locales. Como único antecedente agudo cabe reseñar haber superado una enfermedad por COVID-19 que fue tratada con azitromicina y trimetazol.
A las 2 semanas de la negativización de la SARS-CoV-2 PCR, aparece de forma brusca una masa palpable dolorosa en el cuadrante ínfero-externo de la mama izquierda. Tras 15 días de evolución, acude a su médico de Atención Primaria. Presentaba un tracto doloroso, retráctil, de distribución vertical desde la axila hasta el surco submamario, que atravesaba la mama de forma tangencial a la areola y se prolongaba con un cordón doloroso que recorría verticalmente toda la pared abdominal (figura 1), pasando a unos 5 cm del ombligo y llegando hasta la región inguinal homolateral.
La retracción mamaria y el cordón abdominal se hacían más evidentes al elevar el brazo izquierdo y eran dolorosos tanto a la palpación como a la movilización de la extremidad superior izquierda (ESI). No se observaba calor ni rubor, la piel sobre el trayecto cordonoso era móvil y carente de lesiones. No se palpaban ganglios a nivel axilar ni inguinal.
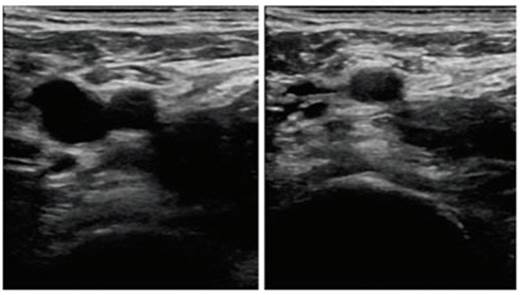
Se planteó el diagnóstico diferencial entre enfermedad de Mondor, roturas fibromusculares, granuloma intersticial por colagenopatía, angeítis subaguda, infección por larva migrans y poliarteritis nodosa. La distribución anatómica y morfología de la lesión nos llevó al diagnóstico clínico de flebitis obliterativa de las venas epigástricas superficiales superior e inferior y toracoepigástrica, o enfermedad de Mondor. El diagnóstico fue confirmado en Atención Primaria mediante eco-Doppler, identificándose, bajo la mama y en localización superficial inmediatamente bajo la piel, una imagen hipoecoica tubular, carente de flujo en su interior, de 4 cm de largo y un diámetro máximo de 1,9 mm no colapsable. No se observaron signos ecográficos de trombosis en venas yugular, subclavia ni axilar izquierdas (figuras 2 y 3). La ecografía no detectó patología mamaria alguna (figura 4), ni alteraciones ganglionares axilares ni inguinales.
Realizamos analítica sanguínea y se observó que los parámetros bioquímicos estaban dentro de la normalidad, al igual que los reactantes de fase aguda. El estudio de coagulación mostró valores en el límite de la normalidad: actividad de protrombina: 69,00% (70,00-120,00%); tiempo de protrombina: 17,6 segundos (11,0-14,0); tiempo de protrombina control: 13,7 (11,0-14,0); tiempo de protrombina ratio: 1,28 (0,80-1,20); índice internacional normalizado (INR) 1,3 (0,8-1,3); tiempo de cefalina: 35,4 segundos (25,0-40,0); tiempo de cefalina control: 31,00 (25,00-40,00); tiempo de cefalina-ratio: 1,14 (0,90-1,20).
Se instauró tratamiento estándar con HBPM a dosis de 60 mg/24 h y se observó mejoría clínica y exploratoria en los primeros días con estancamiento posterior, por lo que a los 10 días se añadió naproxeno 550/12 h. Prosiguió la mejoría hasta que 5 días más tarde el cordón se hizo prácticamente imperceptible a la palpación, y se procedió a reducir la heparina a 40 mg/día. Se realizó interconsulta en medicina interna, que mantuvo el diagnóstico y el tratamiento, y descartó otras posibles patologías concomitantes.
En 24 h reapareció el dolor y volvió a hacerse perceptible el cordón, tanto visualmente como a la palpación. Se aumentó la dosis de heparina a 60 mg/día y la evolución fue de nuevo favorable.
Al mes de tratamiento desapareció la mastodinia, persistiendo la retracción mamaria y el cordón visible en la pared abdominal, así como un discreto cordón doloroso a nivel de la fosa oval izquierda, en el punto de unión de la vena epigástrica superficial inferior con la safena accesoria.
Se repitió la analítica y se observó: actividad de protrombina de 134% (70-120) y tiempo de protrombina de 10,34 segundos (11-14). El resto de los parámetros estaban dentro de la normalidad.
El cuadro evolucionó de la forma esperada y tras 2 meses de tratamiento solo persistía la retracción a nivel mamario. Había desaparecido el dolor y el cordón abdominal y la ecografía demostró revascularización de los vasos afectados. Se suprimió la heparina y el naproxeno, y se pautó ácido acetilsalicílico a dosis de 100 mg/día, manteniéndose la evolución favorable.
DISCUSIÓN
El SARS-CoV-2 se caracteriza por su capacidad para producir lesión endotelial e hipercoaguabilidad sistémica, dos factores que, junto a las alteraciones del flujo sanguíneo, constituyen la denominada tríada de Virchow, responsable de los procesos tromboembólicos. Los procesos secundarios a la hipercoaguabilidad pueden aparecer en cualquiera de las fases de la enfermedad, si bien con relativa frecuencia surgen después de la fase aguda, e incluso tras haber superado la infección por COVID-19; en el caso que nos ocupa, apareció 15 días después de negativizarse la PCR.
Si bien el órgano mayoritariamente afectado por la enfermedad por COVID-19 es el pulmón, se ha podido comprobar que con frecuencia se produce una afectación multisistémica asociada a procesos inflamatorios y sobre todo a la apoptosis del endotelio vascular y la consiguiente trombosis6,7.
Yao et al8 han demostrado la presencia de trombos fibrinoplaquetarios en vasos de pequeño calibre y capilares de diferentes órganos. Tang et al9 refieren haber demostrado los criterios marcados para la coagulación intravascular diseminada de la Sociedad Internacional de Trombosis y Hemostasia en el 71,4% de los fallecidos por COVID-19 estudiados, lo que explicaría la alta prevalencia de episodios tromboembólicos tras superar una COVID-19.
En definitiva, se produciría un síndrome de lesión microvascular mediado por la activación de las vías del complemento y un estado procoagulante asociado. La coagulopatía por COVID-19 se presenta en un momento inicial con elevaciones significativas del dímero D y de los productos de degradación de fibrina/fibrinógeno, mientras que las alteraciones en el tiempo de protrombina, tiempo parcial de tromboplastina y recuento plaquetario son poco habituales en fases iniciales.
La incidencia acumulada de tromboembolismo venoso (TEV) en infectados por coronavirus es cercana al 50% en algunas series10. Diferentes guías (canadiense, italiana, suiza, española, etc.) proponen la profilaxis con HBPM en el manejo de la COVID-19 moderada, así como la estratificación individualizada del riesgo de TEV y de hemorragia.
En trombosis secundarias a la COVID-19 de distintas localizaciones se ha descrito, en estadios iniciales, un infiltrado denso de la pared del vaso y conformación de un trombo que obstruye la luz. La posterior proliferación de tejido conectivo en la pared vascular da origen a la formación de un cordón duro. El mismo mecanismo se puede encontrar en la enfermedad de Mondor por diferentes etiologías.
Se ha podido comprobar una elevada prevalencia de procesos trombóticos pos-COVID-19, incluso tiempo después de haber superado la fase aguda de la infección; este hecho debe hacer recapacitar al médico de familia sobre la conveniencia de individualizar la necesidad de profilaxis antitrombótica en este tipo de pacientes, así como llevar a cabo una vigilancia activa, mantenida a lo largo de varios meses, que permita detectar de forma precoz la aparición de estos cuadros.