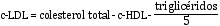INTRODUCCIÓN
Las enfermedades cardiovasculares (ECV) que incluyen la cardiopatía coronaria y el accidente cerebrovascular, siguen siendo la principal causa de muerte y discapacidad en el mundo1. En nuestro país son la primera causa de muerte, por delante de los tumores y de la COVID-19 incluso en el año de su mayor expresión clínica2. La arteriosclerosis, como proceso patológico subyacente a la mayoría de las ECV, es una enfermedad que se desarrolla durante décadas y cuyos principales factores de riesgo están bien caracterizados. Uno de los factores de riesgo cuyo tratamiento ha demostrado ser capaz de reducir la morbimortalidad cardiovascular es la dislipidemia3,4. A pesar de disponer de un amplio arsenal terapéutico para el tratamiento de la misma, el grado de control de las alteraciones lipídicas es claramente subóptimo, en especial en los pacientes de riesgo cardiovascular (muy) elevado, en los que la reducción de riesgo absoluto es más importante5-8.
Recientemente se han actualizado las guías europeas de prevención cardiovascular9, que son las suscritas por las principales sociedades científicas españolas implicadas en la atención de estos pacientes, incluido el Comité Español Interdisciplinario de Prevención Vascular (CEIPV)10-13.
Frente a un amplio consenso sobre los objetivos de tratamiento hipolipemiante ajustado al riesgo vascular, los informes de los laboratorios de bioquímica continúan ofreciendo valores de referencia basados en la distribución de los valores en la población general, eludiendo con frecuencia informar de los valores «deseables» en función del riesgo y el grado de enfermedad renal crónica (ERC) vascular de los pacientes. Pese al documento SEA-SEC 201814,15, muchos informes describen como «normales» valores lipídicos muy por encima de los valores «deseables» en términos de prevención cardiovascular16 o como «anormalmente bajos» valores lipídicos deseables desde el punto de vista de prevención cardiovascular. Esta información puede ser malinterpretada y conducir a la abstención terapéutica en pacientes con valores «normales» y a la reducción de la intensidad del tratamiento en pacientes con valores «anormalmente bajos». Por ello, un grupo de trabajo de las principales sociedades científicas implicadas en la atención de los pacientes de riesgo vascular hemos elaborado este documento con una propuesta básica de consenso sobre la determinación del perfil lipídico básico en prevención cardiovascular, recomendaciones para su realización y unificación de criterios para incorporar los objetivos de control lipídico adecuados al riesgo vascular de los pacientes en los informes de laboratorio17,18.
CONSIDERACIONES PREANALÍTICAS
¿Cómo, cuándo y a quién debemos solicitar un perfil lipídico?
La determinación del perfil lipídico es necesaria para conocer el riesgo de presentar ECV en la población aparentemente sana o condiciones clínicas de especial riesgo, incluidos los pacientes que van a ser sometidos a cirugía cardíaca. También se requiere para la monitorización de la eficacia terapéutica y la adherencia al tratamiento hipolipemiante. Es imprescindible en prevención cardiovascular, especialmente en personas de alto riesgo o con familiares de alto riesgo. Asimismo, permite descartar la posible elevación de los parámetros lipídicos secundaria a otras patologías. El grupo de trabajo considera una referencia adecuada las recomendaciones recientes de la Sociedad Europea de Cardiología9, recientemente traducidas10 y suscritas por el CEIPV13 tabla 1.
Tabla 1A. Determinación de lípidos para valoración de riesgo vascular36.
|
Pacientes sin tratamiento hipolipemiante
Se recomienda la evaluación de riesgo vascular sistemática completa para personas con cualquier factor de riesgo vascular mayor (p. ej., antecedentes familiares de ECV prematura, HF, factores de riesgo de ECV como tabaquismo, hipertensión arterial, DM, hiperlipemia, obesidad, enfermedad renal crónica o comorbilidades que aumenten el riesgo de ECV Considerar la evaluación sistemática u oportunista del RCV en hombres > 40 años y mujeres > 50 o posmenopáusicas de la población general sin factores de riesgo Considerar una revaluación tras 5 años (o antes si el riesgo se acerca a los umbrales de tratamiento) para todas las personas que hayan pasado un cribado de riesgo de ECV durante un cribado oportunista No se recomienda la evaluación sistemática del RCV en hombres < 40 años y mujeres < de 50 años sin factores de RCV conocidos |
|
Monitorización de eficacia terapéutica y adherencia al tratamiento hipolipemiante
Antes de iniciar el tratamiento con fármacos hipolipemiantes, hay que hacer dos determinaciones separadas 1-2 semanas, excepto tras un evento cardiovascular y en los pacientes con riesgo muy alto con indicación de tratamiento inmediato Después de iniciar el tratamiento hipolipemiante, repetir la determinación analítica. Tras evento vascular aterosclerótico agudo, a las 4-6 semanas En pacientes estables desde el punto de vista cardiovascular, a las 8 ± 4 semanas Una vez que el paciente ha alcanzado el objetivo de lípidos óptimo, los lípidos se deben medir anualmente |
DM: diabetes mellitus; ECV: enfermedades cardiovasculares; HF: hipercolesterolemia familiar; RCV: riesgo cardiovascular.
Tabla 1B. Objetivos lipídicos según riesgo cardiovascular9.
|
En RCV muy alto se recomienda una reducción del 50% del valor basal y un objetivo de c-LDL < 1,4 mmol/L (< 55 mg/dL) En RCV alto se recomienda una reducción del 50% del valor basal y un objetivo de c-LDL< 1,8 mmol/L (< 70 mg/dL) En RCV moderado se debe considerar un objetivo de c-LDL < 2,6 mmol/L (< 100 mg/dL) En RCV bajo se puede considerar un objetivo de c-LDL < 3,0 mmol/L (< 116 mg/dL) |
|---|
| Sospechar HF en pacientes que tengan ECV arteriosclerótica antes de los 55 años (hombres) o de los 60 (mujeres), en personas con un familiar que haya tenido ECV prematura, quienes tengan familiares con xantomas tendinosos, pacientes con c-LDL muy aumentado (adultos, > 5 mmol/L [190 mg/dL]; niños, > 4 mmol/L [150 mg/dL]) y familiares de primer grado de pacientes con HF |
| En niños, se recomienda hacer las pruebas desde los 5 años o antes cuando se sospeche HF homocigota |
ECV: enfermedades cardiovasculares; HF: hipercolesterolemia familiar; RCV: riesgo cardiovascular; c-LDL: colesterol ligado a lipoproteínas de baja densidad.
Factores que influyen en la determinación del perfil lipídico del paciente
Múltiples factores pueden influir en los parámetros analíticos; preferiblemente, la toma de muestra debe realizarse en un estado metabólicamente estable19.
Estilo de vida y condiciones fisiopatológicas del paciente:
Deben mantenerse hábitos estables las 2 semanas previas a la extracción.
No hacer ejercicio físico extremo antes de la extracción.
Permanecer sentado 15 minutos antes de la extracción.
Se recomienda para la estandarización de la flebotomía: obtención de la sangre venosa con el paciente en posición sentada (puede existir concentración más baja de colesterol total [c-T] y colesterol asociado a lipoproteínas de baja densidad [c-LDL] en posición supina).
Descartar dislipidemias secundarias y asociadas a tratamiento farmacológico (Anexo. Material suplementario. Tabla 1A 20,21).
Esperar un mínimo de 2-4 semanas tras un proceso inflamatorio agudo, pues puede provocar descenso del c-T, del del colesterol asociado a lipoproteínas de alta densidad (c-HDL) y un incremento de triglicéridos (TG)22-25.
Se recomienda una determinación de parámetros lipídicos tras síndrome coronario agudo (u otro proceso isquémico agudo) en las primeras 24 horas26-28. Si se realiza > 24 horas después del proceso agudo, debe tenerse en cuenta en la toma de decisiones que los niveles de c-T y c-LDL pueden estar disminuidos en relación con los habituales del paciente. Se recomienda la determinación de los niveles de lipoproteína (a) [Lp(a)] en los pacientes en los que no se haya determinado previamente. Aunque los niveles de Lp(a) pueden elevarse en el contexto de un proceso agudo, la variación es modesta29,30, lo que permite detectar a pacientes con Lp(a) marcadamente elevada en fase precoz.
¿Es necesario el ayuno para el análisis del perfil lipídico?
La mayor parte de las determinaciones lipídicas ofrecen resultados similares independientemente de la situación de ayuno del paciente31.
Las principales guías clínicas no exigen ayuno al menos para una evaluación inicial del riesgo o para diagnosticar una hipercolesterolemia aislada como hipercolesterolemia familiar (HF) o Lp(a) elevada sin elevación concomitante de TG. Los lípidos sin ayunas pueden predecir mejor el riesgo de ECV ya que reflejan mejor el estado posprandial del paciente y la influencia del riesgo residual32.
La concentración de TG es la única magnitud que cambia significativamente tras la ingesta32. Dada la inexactitud de la ecuación de Friedewald en pacientes con TG > 150 mg/dL, es preferible realizar la estimación de c-LDL por la fórmula de Martin/Hopkins33 (Anexo. Material suplementario. Tabla 3) o utilizar el c-no HDL en estos pacientes.
Se recomienda ayuno si TG ≥ 4,5 mmol/L (≥ 398 mg/dL) antes de iniciar tratamientos farmacológicos que pueden causar hipertrigliceridemia grave (por ejemplo, isotretinoína), en individuos genéticamente predispuestos, con historia de pancreatitis hipertrigliceridémica y cuando se hagan pruebas de laboratorio adicionales que requieran muestras en ayunas o matutinas (por ejemplo, glucosa en ayunas o marcadores con ritmo circadiano).
Las mediciones de los perfiles de lípidos en ayunas y no ayunas deben considerarse complementarias y no mutuamente excluyentes.
Las determinaciones de colesterol y TG se llevan a cabo de modo habitual mediante métodos enzimáticos, con una variabilidad de las determinaciones < 10% (Anexo. Material suplementario. Tabla 2)18. No obstante, debido a la variabilidad biológica intraindividual y en las condiciones de recolección de la muestra de los parámetros lipídicos (≈20% para TG y ≈ 10% para c-HDL y c-LDL), es razonable realizar una segunda determinación de parámetros lipídicos en los pacientes en prevención primaria que no tengan una indicación claramente establecida para iniciar tratamiento hipolipemiante sin demora18.
CONSIDERACIONES ANALÍTICAS
¿Se debe informar de la metodología analítica?
La cuantificación de parámetros lipídicos debe hacerse siempre con la misma metodología. En caso de producirse un cambio, este debe ser notificado. El conocimiento del método analítico empleado para la determinación de parámetros lipídicos es necesario, ya que pueden existir diferentes interferencias o interpretaciones erróneas.
Métodos para determinar el colesterol asociado a lipoproteínas de baja densidad
El método de referencia para la determinación de c-LDL es la separación de lipoproteínas en gradiente de densidad por ultracentrifugación, una técnica tediosa y solo disponible en laboratorios especializados. Por este motivo, tradicionalmente se hace una estimación a partir de la medición del colesterol y TG totales (por métodos enzimáticos) y la determinación directa del c-HDL. La fórmula de Friedewald es la utilizada con más frecuencia34.
Fórmula de Friedewald para la estimación del colesterol asociado a lipoproteínas de baja densidad (en mg/dL)
La fórmula de Friedewald asume la ausencia de quilomicrones y una proporción fija de colesterol/TG en las lipoproteínas de muy baja densidad (VLDL) (1/5 en mg/dL; 1/2,2 en mmol/L). Debido a que la relación TG/colesterol en las VLDL aumenta progresivamente a medida que la hipertrigliceridemia se acentúa, la ecuación sobrestima el colesterol de las VLDL y, por tanto, subestima el c-LDL en pacientes hipertrigliceridémicos. La ecuación presenta una exactitud aceptable cuando la concentración de TG es < 200 mg/dL y a partir de TG > 400 mg/dL no debe utilizarse.
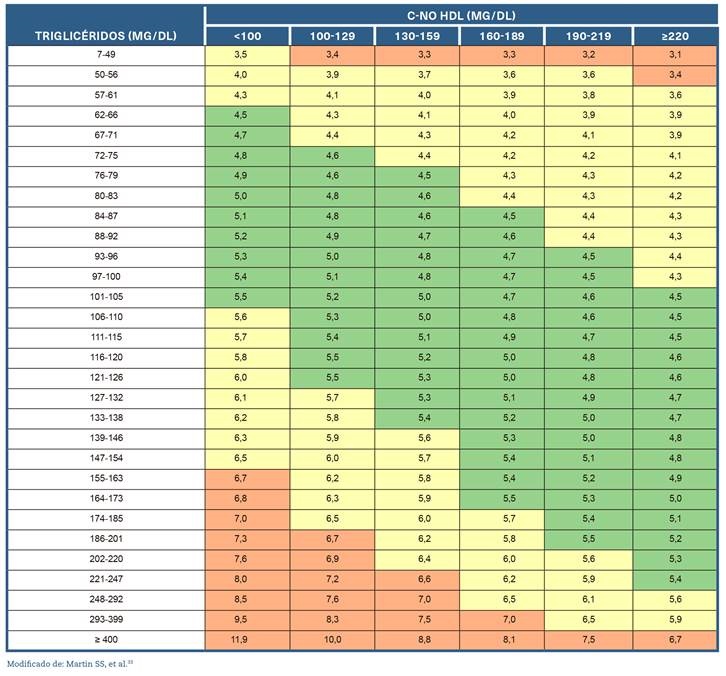
La ecuación de Martin-Hopkins reemplaza el número 5 de la estimación de Friedewald 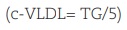 por divisores que varían según los valores de TG y c-no HDL del paciente (Anexo. Material suplementario. Tabla 3)33. La ecuación de Martin-Hopkins muestra una mejor precisión que la de Friedewald para TG > 150 mg/dL, para niveles de c-LDL < 100 mg/dL, y especialmente para < 70 mg/dL.
por divisores que varían según los valores de TG y c-no HDL del paciente (Anexo. Material suplementario. Tabla 3)33. La ecuación de Martin-Hopkins muestra una mejor precisión que la de Friedewald para TG > 150 mg/dL, para niveles de c-LDL < 100 mg/dL, y especialmente para < 70 mg/dL.
La fórmula de Sampson es más compleja y presenta resultados similares a la de Martin-Hopkins para pacientes con TG < 400 mg/dL, por lo que es de uso menos frecuente. En los pacientes con TG > 400 mg/dL no es recomendable el uso de fórmulas para la estimación del c-LDL por su menor fiabilidad.
La ultracentrifugación, método clásico de referencia para la determinación de c-LDL, es un método laborioso que solo se emplea en laboratorios muy especializados. Disponemos de un método directo para su cuantificación, preciso y ampliamente disponible en muchos laboratorios. La implementación de este marcador se recomienda cuando los TG son > 400 mg/dL o cuando las LDL son < 70 mg/dL, situación en la cual las fórmulas de estimación del c-LDL son más inexactas33.
Si no se dispone de determinación directa de c-LDL, se recomienda el uso del c-no HDL como marcador del colesterol «aterogénico»35 o la determinación de apolipoproteína B (Apo B, ver más adelante). El c-no HDL no requiere la determinación de TG, no se ve influido por el ayuno y tiene una alta correlación con los niveles de Apo B.
RECOMENDACIÓN 4
La ecuación de Friedewald es precisa en la mayoría de los pacientes con c-LDL > 100 mg/dL y TG < 150 mg/dL.
La ecuación modificada de Martin-Hopkins es preferible para el cálculo de c-LDL, sobre todo en pacientes con concentraciones bajas de c-LDL < 100 (70) mg/dL, concentraciones de TG de 150-400 mg/dL y en muestras sin ayuno.
Los ensayos de c-LDL directo deben usarse para la evaluación de c-LDL cuando la concentración de TG es ≥ 400 mg/dL.
En pacientes con elevación importante de Lp(a), la estimación de c-LDL debe corregirse con la fórmula:
La posible elevación de Lp(a) debe tenerse en consideración en especial en pacientes subsaharianos, pacientes con síndrome nefrótico, en diálisis peritoneal o con un descenso del c-LDL deficiente tras recibir tratamiento hipolipemiante.
CONSIDERACIONES POSTANALÍTICAS
Marcadores de «normalidad» y alertas
El laboratorio clínico es clave para la estimación del riesgo cardiovascular de los pacientes con dislipidemia. Es de vital importancia establecer valores de referencia diferenciados para la población pediátrica.
Es deseable que las determinaciones lipídicas se referencien a los valores deseables en términos de riesgo y prevención cardiovascular14,16. En la tabla 2 se muestran los valores deseables de los principales parámetros lipídicos de las sociedades europeas de cardiología, arteriosclerosis y medicina de laboratorio de 201917,18,36 para adultos.
Tabla 2. Valores lipídicos deseables en adultos según las sociedades europeas de cardiología, arteriosclerosis y medicina de laboratorio17,18,36.
| PARÁMETRO | VALOR DESEABLE EN ADULTOS |
|---|---|
| Colesterol total | < 200 mg/dL |
| Colesterol-HDL | > 50 mg/dL (mujeres) |
| > 40 mg/dL (hombres) | |
| Colesterol no-HDL | Valores recomendados según el RCV |
| Prevención secundaria y RCV muy alto < 85 mg/dL | |
| RCV alto < 100 mg/dL | |
| RCV moderado < 130 mg/dL | |
| Colesterol-LDL | Valores recomendados según RCV |
| Prevención secundaria y RCV muy alto < 55 mg/dL | |
| RCV alto < 70 mg/dL | |
| RCV moderado < 100 mg/dL | |
| RCV bajo < 116 mg/dL | |
| Triglicéridos | TG < 150 mg/dL en ayunas |
| (TG < 175 mg/dL no en ayunas) | |
| Apolipoproteína B 100 | Valores recomendados según RCV |
| Prevención secundaria y RCV muy alto < 65 mg/dL | |
| RCV alto < 80 mg/dL | |
| RCV moderado < 100 mg/dL | |
| Lp(a) | < 50 mg/dL (< 105 nmol/L) |
RCV: riesgo cardiovascular; Lp(a): lipoproteína (a); HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
Aquellos valores que puedan ser considerados como «críticos» deben incorporar una alerta al médico peticionario, como se muestra en la tabla 3.
Tabla 3. Alertas recomendadas para el sistema informático/informe de laboratorio.
| PARÁMETRO | VALOR CRÍTICO | ALERTA |
|---|---|---|
| Colesterol total | 310 mg/dL | Paciente de alto riesgo vascular |
| Triglicéridos | TG > 880 mg/dL | Hipertrigliceridemia grave con riesgo de pancreatitis aguda |
| Colesterol-LDL adultos | > 190 mg/dL | Considerar hipercolesterolemia familiar heterocigota |
| Colesterol-LDL adultos | > 500 mg/dL | Considerar hipercolesterolemia familiar homocigota |
| Triada lipídica aterogénica | Si TG > 150 mg/dL y c-HDL < 30 mg/dL c-LDL/Apo B < 1,3 o TG/c-HDL > 2 | Triada lipídica orientativa de dislipidemia aterogénica de muy alto riesgo vascular |
| Lp(a) | >120 mg/dL | Riesgo muy elevado de enfermedad cardiovascular aterosclerosa y estenosis de la válvula aórtica |
| Apolipoproteína A 1 | < 10 mg/dL | Valorar hipoalfalipoproteinemia |
| Apolipoproteína B-100 | < 10 mg/dL | Valorar abetalipoproteinemia |
Apo: apolipoproteína; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína (a); TG: triglicéridos.
RECOMENDACIÓN 5
Los valores de referencia de los parámetros lipídicos en los informes de laboratorio siempre deben referirse al riesgo del paciente y no a valores de normalidad poblacionales.
La presencia de asteriscos en valores fuera del intervalo de normalidad poblacional es desaconsejado.
Se recomiendan sistemas de alerta para niveles lipídicos extremos sugerentes de dislipidemias graves.
Se deben establecer valores específicos para población pediátrica.
¿Qué parámetros tienen que incluirse en un perfil lipídico básico?
El perfil lipídico básico debe incluir la determinación de c-T, c-HDL, TG, c-no HDL y c- LDL9,36-39.
Los documentos de consenso de la Sociedad Europea de Arteriosclerosis y la Sociedad Europea de Medicina de Laboratorio recomiendan también la estimación de partículas remanentes9,17. La Lp(a) elevada confiere un aumento del riesgo vascular, por lo que su determinación es también aconsejable al menos una vez en la vida del paciente, dado que los niveles están determinados sustancialmente por la genética9,17.
En los pacientes con TG > 400 mg/dL es recomendable la determinación directa del c-LDL para obtener cifras más fiables40. Si está disponible, la determinación de Apo B es un marcador de especial interés, puesto que es el mejor marcador del número de lipoproteínas aterogénicas41. Si la determinación directa de c-LDL o Apo B no están disponibles, puede usarse como aproximación el c-no HDL.
RECOMENDACIÓN 6
El perfil lipídico básico ha de consistir en la determinación de c-T, c-HDL, TG, c-no HDL y estimación del c-LDL.
La Lp(a) debería evaluarse al menos una vez en la vida.
En los pacientes con hipertrigliceridemia leve o moderada es recomendable la determinación de c-no HDL y Apo B para la valoración del riesgo cardiovascular residual.
¿Cuál es la utilidad de determinar el colesterol no asociado a lipoproteínas de alta densidad?
La estimación del c-no HDL es un cálculo sencillo (c-T - c-HDL), representa el colesterol de las lipoproteínas aterogénicas y tiene una elevada correlación con los niveles de Apo B. Es el parámetro lipídico de referencia para la estimación del riesgo vascular con las ecuaciones SCORE2 y SCOREOP9,42,43. Una ventaja adicional es que no está afectado por el ayuno, puede determinarse en pacientes con concentración de TG > 400 mg/dL o servir de orientación en laboratorios que no dispongan de determinación de LDL directo o Apo B44.
¿Cuándo usar la apolipoproteína B?
La Apo B es un excelente predictor de eventos cardiovasculares ya que esta apoproteína está presente en las principales lipoproteínas aterogénicas: LDL, Lp(a), VLDL y lipoproteínas de densidad intermedia (IDL)41,45. La medición de Apo B es equivalente a cuantificar el número de lipoproteínas aterogénicas, ya que cada una de ellas contiene una única molécula de Apo B. Los valores de Apo B no varían por la situación de ayuno. El número de lipopartículas puede también medirse mediante resonancia magnética nuclear (RNM), pero esta técnica no está disponible en práctica clínica asistencial46.
La Apo B tiene un valor especial en personas con TG elevados, diabetes mellitus, obesidad, síndrome metabólico o c-LDL muy bajo, en los que la medición o estimación de c-LDL puede ser inexacta, además de no recoger el componente aterogénico de otras lipoproteínas.
RECOMENDACIÓN 7
Se recomienda la determinación de Apo B-100 para la evaluación de riesgos, tipificación de dislipidemias y caracterización del tamaño de partículas, y puede preferirse al c-no HDL en personas con hipertrigliceridemia leve a moderada (175-880 mg/dL, diabetes, obesidad, síndrome metabólico o c-LDL muy bajo (< 70 mg/dL).
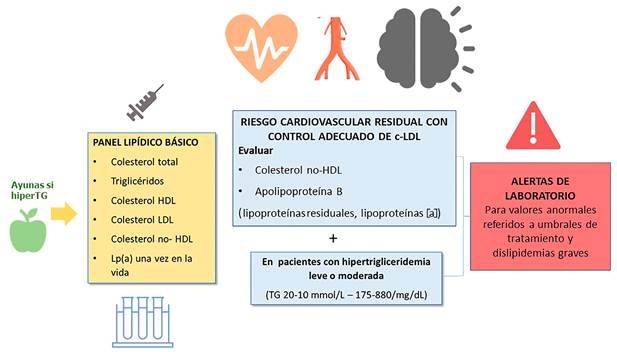
Figura 1. Recomendaciones básicas para el informe de perfil lipídico en laboratorios clínicos españoles.
La determinación de Apo B no suele formar parte del perfil lipídico estándar y de los modelos de estimación del riesgo de enfermedad cardiovascular aterosclerosa (ECVA). Los trastornos monogénicos, como la HF, se pueden reconocer fácilmente a partir del panel de lípidos estándar sin necesidad de medir la Apo B (Anexo. Material suplementario. Tabla 4)47. Por otro lado, la concentración de Apo B puede ayudar en la tipificación de dislipidemias más graves como la hiperlipidemia familiar combinada y la disbetalipoproteinemia familiar48 (Anexo. Material suplementario. Tabla 6).
¿Cuándo determinar la lipoproteína (a)?
Se recomienda determinar la Lp(a) al menos una vez en la vida para estimar el riesgo vascular9,49-52. Esta determinación es especialmente relevante en pacientes con ECV prematura, HF, pobre respuesta al tratamiento con estatinas, estenosis aórtica o eventos isquémicos recurrentes y, obviamente, en los familiares de pacientes con Lp(a) elevada. Los pacientes con Lp(a) muy elevada (> 180 mg/dL) tienen un riesgo cardiovascular equivalente al de los pacientes con HF heterocigota53,54. Uno de los problemas de la medición de la Lp(a) es la variabilidad de resultados con distintas técnicas de detección y la ausencia de una equivalencia directa entre los niveles reportados en mg/dL y nMol/L según las distintas isoformas de apoproteína (a).
La determinación de Lp(a), debido a su marcada influencia genética y falta de tratamientos farmacológicos específicos, solo debe determinarse únicamente una vez en la vida. Las excepciones a esta regla son la transición a la menopausia, el embarazo, el uso de anticonceptivos orales, la enfermedad renal crónica o el síndrome nefrótico, cuando se administre un tratamiento específico para reducir la Lp(a) o para modular las opciones terapéuticas aconsejables, como el uso de inhibidores de PCSK955.
RECOMENDACIÓN 8
Determinación de la Lp(a) una vez en la vida, salvo por el desarrollo de circunstancias que puedan implicar cambios importantes, como puede ser el síndrome nefrótico o el tratamiento para reducción de Lp(a). No se recomienda la conversión entre unidades nmol/L a mg/dL, o viceversa, ya que todos los factores de conversión dependen intrínsecamente de las isoformas (Anexo. Material suplementario. Tabla 7).
¿Debemos valorar la inflamación en el paciente con arteriosclerosis?
Los procesos inflamatorios crónicos se asocian con un aumento del riesgo cardiovascular independiente del riesgo atribuible por los factores convencionales56. La proteína C reactiva de alta sensibilidad es el parámetro analítico que más se ha empleado como marcador de inflamación de baja intensidad. Presenta alta variabilidad y no existe un consenso definido de los valores que deben considerarse como «elevados» para la estimación del riesgo vascular36.
Innovación en el diagnóstico de dislipidemias: parámetros necesarios para la resolución de una e-consulta
Con el fin de poder hacer una adecuada resolución de la consulta de manera ágil y eficaz, en la tabla 4 se recogen los parámetros mínimos recomendados que debemos incluir en las e-consultas para el diagnóstico de dislipidemias.
Tabla 4. Datos de referencia necesarios para evaluación de riesgo cardiovascular en e-consulta.
| 1. Edad, sexo, IMC y perímetro de cintura/cadera del paciente |
| 2. Breve resumen de antecedentes familiares y personales |
| 3. Factores de riesgo: hábito tabáquico, consumo de alcohol |
| 4. Breve resumen de historia lipídica y tratamientos hipolipemiantes previos |
| 5. Tratamiento completo del paciente |
| 6. Posibles efectos secundarios del tratamiento con fármacos hipolipemiantes |
| 7. Perfil lipídico básico actual: c-T, c-LDL, c-HDL, c-no HDL, TG |
| 8. Problema actual |
| 9. Existencia de estudios genéticos personales o familiares previos |
| 10. En caso de sospecha de hipercolesterolemia familiar: puntuación de la Red de Clínicas de Lípidos Holandesas/OMS (DLCN)47 |
| 11. En caso de sospecha de hipertrigliceridemia: puntuación de Moulin para diagnóstico de quilomicronemia familiar57 |
IMC: índice de masa corporal; c-LDL: colesterol ligado a lipoproteínas de baja densidad; c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-no HDL: colesterol no ligado a lipoproteínas de alta densidad; TG: triglicéridos; OMS: Organización Mundial de la Salud.