INTRODUCCIÓN
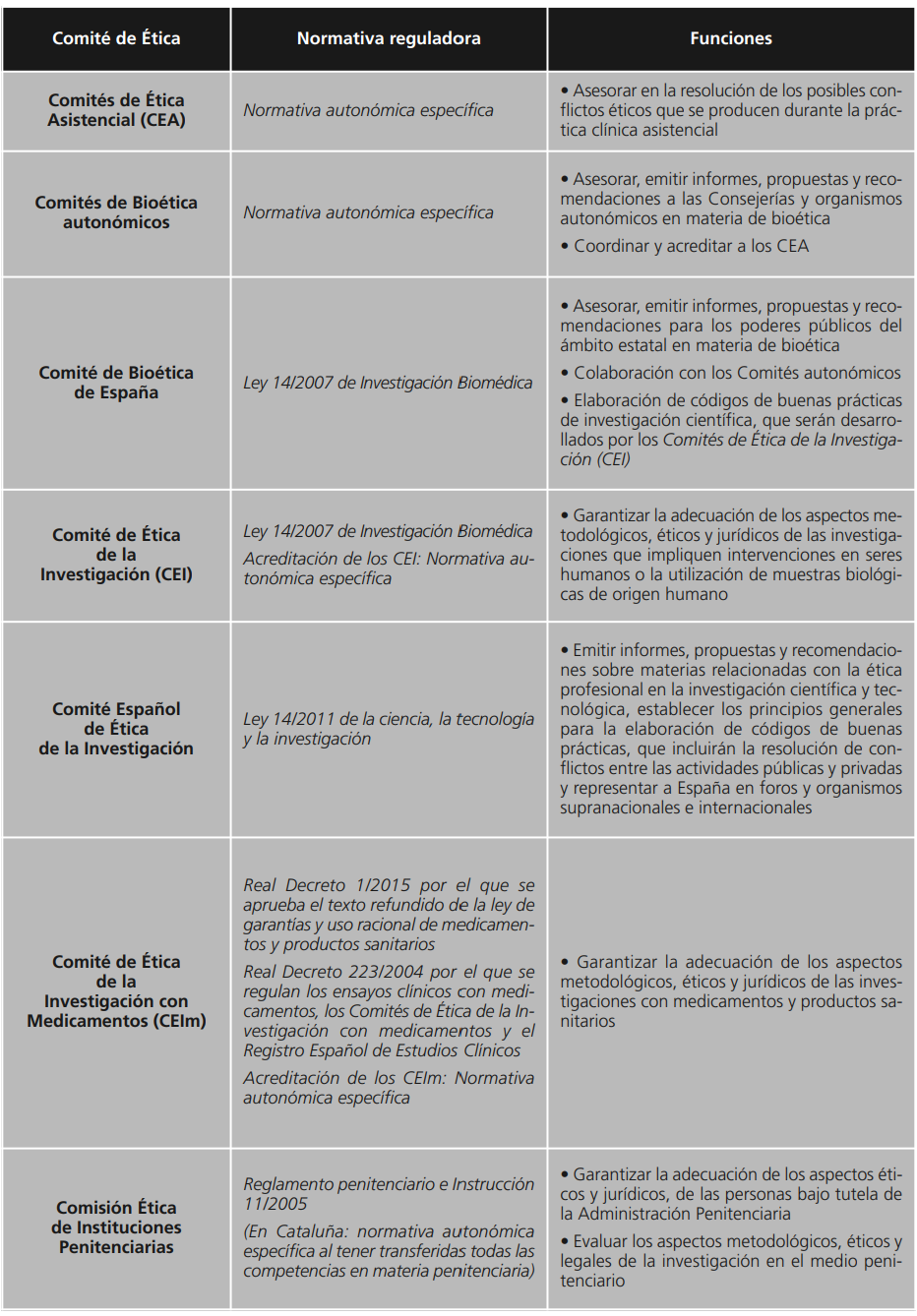
En las últimas décadas hemos asistido a una evolución y desarrollo en la Medicina que obligan a una reflexión ética más cuidadosa. Los avances científicos y tecnológicos, la aparición de nuevas enfermedades, la prolongación de la vida y el soporte vital, las intervenciones en la etapa inicial de la vida, la investigación sobre el genoma humano y las diferencias culturales y religiosas en la aceptación de intervenciones y terapias, requieren una organización e institucionalización de los procesos de toma de decisiones que puedan resultar controvertidos. La relación médico-paciente se está distanciando del tradicional modelo paternalista, situándose en un contexto en el que prevalece el respeto a la dignidad del paciente y la autonomía para decidir sobre su cuerpo y su propia vida. La necesidad de distribuir de forma equitativa los recursos sanitarios disponibles, debe conjugarse con la obligación del profesional sanitario de procurar el mayor bien del paciente, no solo según su juicio médico, sino también según su juicio económico-político. Por todos estos motivos, son necesarios órganos capaces de establecer criterios que ayuden en la toma de decisiones éticas de forma inseparable al correcto ejercicio de la práctica clínica. La Declaración Universal sobre Bioética y Derechos Humanos, aprobada por la Unesco, insta a los Estados a adoptar todas las disposiciones adecuadas, tanto de carácter legislativo, administrativo o de otra índole para instaurar medidas de protección de los derechos y la dignidad de las personas, entre las que destaca la creación de comités de ética independientes, multidisciplinares y pluralistas. Esta Declaración se suma a las Declaraciones Universales de la Unesco sobre el Genoma, los Derechos y los Datos Genéticos Humanos y se refleja en instrumentos jurídicos de fuerza vinculante, como el Convenio de Derechos Humanos y Biomedicina del Consejo de Europa, suscrito en Oviedo en 19971,2,3,4. A continuación se realiza una revisión y descripción de los diferentes comités de ética asistencial y de la investigación que existen en España y se analizan aspectos relevantes en relación a su organización, regulación y ámbito de actuación. La tabla 1 resume las principales características diferenciales en relación a su regulación y funciones.
COMITÉS DE ÉTICA ASISTENCIAL
Los Comités de Ética Asistencial (CEA) se inician en Estados Unidos (EEUU) a mediados del siglo XX, como una comisión consultiva o interdisciplinar para analizar y asesorar en la resolución de los conflictos éticos que se producen durante la práctica clínica asistencial, mejorar dicha asistencia y garantizar que los pacientes estén informados y puedan tomar las decisiones referentes a su salud de acuerdo con su libre y propia voluntad. El primer comité con contenidos similares a los actuales CEA se estableció en 1960 en Seattle, con el fin de seleccionar a los pacientes que se iban a someter a la recién desarrollada técnica de la hemodiálisis. La propuesta de Pediatría de Karen Tell en 1975, el caso de Karen Quinlan de New Jersey en 1976 y los casos de “Baby Doe” de 1983 fueron también antecedentes del origen no solo de los comités destinados a resolver dilemas éticos en el ámbito asistencial, sino también de los Comités de Ética de la Investigación. Paulatinamente fueron incorporándose a los hospitales de EEUU y ya en 1992, de acuerdo con los criterios de la Joint Commission on Accreditation of Health Care Organizations, se exigía que las instituciones hospitalarias tuviesen establecidos mecanismos para la resolución de problemas éticos en la asistencia sanitaria5. En España, el primer comité se implantó en 1974 en el Hospital San Juan de Dios de Barcelona, con ocasión de la inauguración del Departamento de Obstetricia y Ginecología para resolver los casos conflictivos desde la perspectiva ética. Pero es la década de 1990 la de mayor impulso a su creación. Con la publicación de la Orden de 14 de diciembre de 1993 de acreditación de los CEA en Cataluña, la Circular 3/1995 de creación y acreditación de los CEA en el sistema INSALUD y el Decreto 143/1995 del Gobierno Vasco, se abre la vía al efecto. La creación de los CEA en un primer momento fue de carácter voluntario, pero en algunas normativas autonómicas ya es de obligado cumplimiento. Entre sus componentes, la mayoría deben ser médicos y enfermeras, un licenciado en derecho, una persona encargada de la asistencia religiosa en el centro, una persona ajena a la institución con formación en bioética, un miembro del Comité de Ética de la Investigación, profesionales sanitarios de otras especialidades y miembros de la Comisión de Calidad y del Servicio de Atención al Paciente. La participación de un miembro de la Junta Directiva es discutible. En algunas Comunidades Autónomas (CCAA), deben formar parte del CEA ya que de esta forma el apoyo institucional es mayor y se puede disponer de mayor información para temas que tengan incidencia en la gestión del hospital. Las CCAA que no permiten un representante de la Dirección del hospital lo justifican por la influencia que pueda realizar sobre los demás miembros, cuando se debatan temas referentes a distribución de recursos económicos u otros de similar envergadura como los planes de política sanitaria. Actualmente la mayoría de las CCAA han procedido a la creación de estos comités junto a su respectivo desarrollo reglamentario, no solo en los hospitales, sino también en algunos Servicios de Atención Primaria. La tabla 2 describe las funciones de los CEA. Su funcionamiento consiste en el análisis de casos con procedimiento de decisión de ética clínica descrito en la tabla 3, realización de protocolos con orientaciones institucionales sobre el diagnóstico, pronóstico, alternativas de tratamiento y problemas éticos identificados y formación de los profesionales de la institución en bioética. Si bien existen criterios definidos para la composición y competencia de los comités, se carece de una metodología compartida para evaluar la calidad de los diálogos bioéticos. Por esta razón los criterios de evaluación de la Joint Commisssion on Accreditation of Hospitals (JCAH) continúan siendo útiles, pero el funcionamiento solo puede inferirse de manera muy indirecta. Para ciertos autores, la función del comité debiera restringirse a la educación y formación de los profesionales en esta disciplina y las discusiones de los casos clínicos que presenten conflictos éticos graves deberían confiarse a pequeños comités nombrados ad hoc. En los últimos años, tanto los CEA de EEUU como de Europa han experimentado un cierto estancamiento por la falta de formación ética de sus miembros, lo que comporta el riesgo de deslizamiento hacia una mera relatividad y subjetividad ética y lo incapacita para su correcto funcionamiento6,7,8,9,10.
COMITÉS DE BIOÉTICA AUTONÓMICOS
Con el fin de coordinar y acreditar a los CEA, evaluar los protocolos de actuación propuestos y fomentar la formación de bioética de los profesionales sanitarios, en algunas CCAA, la misma orden o decreto que regula a los CEA, establece los Comités de Bioética a nivel autonómico. Además tienen la función de asesorar y orientar a las Consejerías y organismos autonómicos. Entre los miembros se encuentra el Consejero y Viceconsejero en materia de salud y vocales designados por los mismos de reconocido prestigio profesional y científico en disciplinas que se consideren de interés. La falta de legislación estatal ha hecho que la reglamentación esté muy fragmentada en legislaciones regionales y que resulte muy complejo abordarlos como grupo. En algunas CCAA, la mayoría de los miembros pertenece al gobierno autonómico que pretende asesorar, lo que resulta inoperante y en ocasiones se carece de un discurso coordinado entre las CCAA con duplicidades o resoluciones contradictorias11.
COMITÉ DE BIOÉTICA DE ESPAÑA
Para fomentar la colaboración de los organismos autonómicos, el Comité de Bioética de España, adscrito al Ministerio de Sanidad y previsto en la Ley 14/2007 de Investigación Biomédica (LIB) es la entidad que mejor parece encajar en esta categoría. Se crea además para asesorar a los poderes públicos en el ámbito estatal. Está constituido por miembros a propuesta de las CCAA y por la Administración General del Estado (AGE), estando representados cada uno de los distintos Ministerios y el Instituto de Salud Carlos III12.
COMITÉ DE ÉTICA DE LA INVESTIGACION
Con funciones similares al Comité de Bioética de España, la Ley 14/2011 de la ciencia, la tecnología y la investigación, incorpora un conjunto de medidas que persiguen situar a la legislación española en materia de ciencia y tecnología e innovación en la vanguardia internacional, entre las que destacan la incorporación de la dimensión ética profesional, plasmada en la creación de un comité que aplique los criterios y directrices internacionalmente aceptados. Está formado por 12 miembros, seis de los cuales son propuestos por la AGE y los otros seis por las CCAA. Entre sus funciones se incluye la resolución de conflictos entre las actividades públicas y privadas y representar a España en foros y organismos supranacionales e internacionales.
En España, tanto a nivel estatal como autonómico, existen otros comités asesores que también incluyen entre sus funciones cuestiones ético-sociales y jurídicas relativas a algunas actividades biomédicas, como el Consejo Asesor de Sanidad y Servicios Sociales o la Comisión Nacional de Reproducción Humana Asistida, aunque la dimensión de asesoramiento ético pasa inadvertida 13,14.
COMITÉS DE ÉTICA DE LA INVESTIGACIÓN
Mientras que la práctica clínica asistencial se orienta a la búsqueda del beneficio de la salud del paciente, la propia naturaleza de la investigación biomédica implica incertidumbre acerca de si un individuo se podrá o no beneficiar de su participación en la misma, dado que proporcionar algún tipo de beneficio al participante no constituye el objetivo principal de la investigación. Para evaluar estos riesgos, existen los Comités de Ética de la Investigación (CEI). Los CEI surgen de forma paralela en Reino Unido y EEUU a mediados de los años 60 como consecuencia de hacerse públicos algunos experimentos carentes de toda ética, realizados en personas de los campos de concentración nazis durante la segunda guerra mundial, que dieron lugar a los juicios de Nuremberg y también otros como los denunciados por Henry Beecher en el New England Journal of Medicine. En 1964 la Asociación Médica Mundial redactó la Declaración de Helsinki en la que se asumen los principios éticos del Código de Nuremberg y se establece que el proyecto de investigación “debe enviarse para consideración, consejo y cuando sea oportuno, aprobación, a un comité de evaluación ética especialmente designado que debe ser independiente del investigador, del patrocinador o de cualquier otro tipo de influencia indebida”. En EEUU, la National Commission for the Protection of Human Subjetc of Biomedical and Behavioral Research, publica en 1978 el Informe Belmont para que los comités aseguren el cumplimiento de los principios básicos enunciados en el mismo: respeto por las personas, beneficencia y justicia (matizados en 1979 añadiendo un cuarto: no maleficencia). La necesidad de unificar criterios a nivel internacional, ha llevado a las autoridades correspondientes de la UE, EEUU y Japón, en el seno de las denominadas Conferencias Internacionales de Armonización y a la Organización Mundial de la Salud, a redactar sendos documentos de recomendaciones o Normas de Buena Práctica Clínica, que definen los principios éticos y científicos comunes a la hora de diseñar, desarrollar e informar sobre experimentación con seres humanos. Una de las tareas fundamentales de los CEI, es comprobar que los ensayos cumplan con dichas recomendaciones y normas, considerando además lo dispuesto en el Convenio de Oviedo y su Protocolo Adicional acerca de la Investigación Biomédica15,16,17,18. En España desde la aparición de los primeros CEI, a finales de los años 70, la composición y funcionamiento ha ido evolucionando en un intento de concretar y armonizar sus funciones. Este proceso de regularización comenzó con el Real Decreto de 944/1978, en el que se contemplaba la creación de los primeros comités de ensayos clínicos y desde entonces, se han publicado diversos marcos normativos para dar respuestas a las exigencias marcadas por la normativa comunitaria, buscando la simplificación de procedimientos19. Por otra parte, la LIB definió en 2007 los CEI para garantizar en cada centro en que se investigue, la adecuación de los aspectos metodológicos, éticos y jurídicos de las investigaciones que impliquen intervenciones en seres humanos o la utilización de muestras biológicas de origen humano. La LIB establece los principios generales para la elaboración de códigos de buenas prácticas de investigación científica y las funciones que serán desarrolladas por los mismos. Los CEI deberán ser debidamente acreditados por los órganos competentes de las CCAA o en el caso de centros dependientes de la AGE, por el órgano competente de la misma12.
COMITÉS DE ÉTICA DE LA INVESTIGACIÓN CON MEDICAMENTOS
En la actualidad, el Real Decreto 1090/2015 regula los Comités de Ética de la Investigación con Medicamentos (CEIm), no solo circunscritos al ámbito de los ensayos clínicos y estudios observacionales con medicamentos, sino también a toda investigación realizada con productos sanitarios. El CEIm no es más que un CEI acreditado de acuerdo con los términos del Real Decreto 1090/2015 para emitir dictamen en una investigación con medicamentos o productos sanitarios. Con la creación de los CEIm desaparecen los antiguos Comités Éticos de Investigación Clínica (CEIC) regulados por el ya derogado Real Decreto 223/2004 sobre ensayos clínicos con medicamentos20,21. El CEIm estará constituido por un mínimo de diez miembros, entre los que figurarán médicos, uno de los cuales será farmacólogo clínico, un farmacéutico de hospital o de atención primaria y un diplomado o graduado en enfermería. Si en el centro existe una comisión de investigación o un CEA, un miembro de cada uno de ellos deberá formar parte del CEIm. Al menos dos miembros deben ser ajenos a las profesiones sanitarias, uno de los cuales deberá ser licenciado o graduado en derecho. Además, al menos uno de sus miembros debe tener formación acreditada en bioética. El Real Decreto 1090/2015 establece que los CEIm serán supervisados de igual forma que los CEI, de acuerdo con la normativa reguladora de estos últimos. Sin embargo, resulta paradójico ya que existen CCAA que no han llegado a desarrollar la LIB, por lo que la situación genera una gran disparidad en el funcionamiento de los CEI/CEIm22. En el desarrollo de la LIB se prevé la creación de una Autoridad Nacional de Comités de Ética de la Investigación que se encargue de los aspectos generales de coordinación y del registro de los comités. Sin embargo, dadas las peculiaridades de la investigación clínica con medicamentos y las necesidades impuestas en la normativa europea de ensayos clínicos, la coordinación y otros aspectos de supervisión, le corresponderá según el Real Decreto 1090/2015 a la Agencia Española de Medicamentos y Productos Sanitarios, que establecerá los criterios específicos comunes para la acreditación, la inspección y la renovación de la acreditación de los CEIm en coordinación con las CCAA20. Aunque existen recomendaciones y guías encaminadas a dotar de consistencia y coherencia en las evaluaciones éticas, metodológicas y legales de los CEI/CEIm, con frecuencia se presentan conclusiones divergentes frente a un mismo protocolo. La heterogeneidad en la composición, unos con mayor carga de metodólogos y otros con predominio de profesionales implicados en labores asistenciales, la variabilidad en la interpretación de las leyes o el sentido común de aquellos miembros más influyentes, juegan un papel fundamental en la opinión final. Otra cuestión en la que también puede influir la composición estructural, es la independencia de los comités. La mayoría están ubicados en instituciones hospitalarias, de atención primaria o clínicas especializadas, por lo que en función de su relación con los investigadores del centro y con el propio centro o la necesidad de realizar un determinado estudio en término de ahorro económico, pueden verse condicionados al emitir una opinión. Conflictos de orden intelectual, si se trata de una opinión publicada o mantenida públicamente generan servidumbres de tanta o mayor fuerza que los intereses económicos19.
La evaluación por parte de un CEI/CEIm no exime del cumplimiento de otros requisitos regulatorios y específicos que se establezcan, tanto a nivel autonómico, como estatal o comunitario, para llevar a cabo una investigación clínica en España. Por ejemplo, en España existe una regulación específica para los estudios observacionales con medicamentos, que ha sido ampliamente desarrollada a nivel autonómico y algunas CCAA, como la Comunidad Valenciana amplía el desarrollo legislativo a los productos sanitarios. En estas CCAA es frecuente la constitución de comités autonómicos asesores en materia de evaluación y autorización de estudios observacionales con medicamentos e investigaciones con productos sanitarios. Estos comités están más orientados a la gestión y control del uso racional de los productos farmacéuticos y garantizar la correcta ejecución de la investigación clínica en el ámbito local y actúan de forma independiente a la evaluación y el dictamen emitido por el CEIm23,24,25.
COMISIÓN ÉTICA DE INSTITUCIONES PENITENCIARIAS
Cabe destacar las comisiones éticas especializadas y adecuadas al ámbito penitenciario. Las personas bajo tutela de la Administración Penitenciaria están expuestas al riesgo de estigmatización, por lo que el tratamiento de los datos debe manejarse con extrema precaución. Las características de la atención sanitaria en el medio penitenciario, que debe conjugar el derecho a la salud de los internos con la vinculación que estos tienen con la Administración, precisa también un particular esmero a la hora de afrontar los aspectos que trascienden de los meramente asistenciales. Para asegurar que las necesarias cautelas no hurten a los internos y garantizar la libertad de decisión de los interesados, el respeto a la confidencialidad de datos médicos y que los internos no sean objeto de investigaciones médicas más que cuando obtengan un beneficio directo, con idénticas garantías que una persona en libertad, el Ministerio de Interior publica la Instrucción 11/2005 sobre trabajos, estudios e investigaciones en el medio penitenciario, que complementa al Reglamento Penitenciario, de ámbito estatal, a excepción de Cataluña, que dispone de una normativa específica al tener transferidas las competencias en materia penitenciaria26,27.
CONCLUSIÓN
Los Comités de Ética Asistencial y de la Investigación juegan un papel importante en la tutela y protección de los derechos, la equidad y la dignidad de la personas. Un marco normativo adecuado permite dar respuesta a los nuevos retos científicos, al mismo tiempo que garantiza la protección de los derechos de las personas. La interdisciplinariedad fomenta el debate social y el trabajo en equipo, no solo entre expertos, sino también entre estos y las personas implicadas. Deberá dilucidarse la eficacia y la eficiencia de la extensa red de comités locales, autonómicos, estatales, comisiones asesoras y órganos consultivos que disponemos en nuestro país y la introducción de mejoras que minimicen la heterogeneidad de opiniones y agilice la gestión administrativa de la investigación biomédica, sin perjudicar los derechos de los participantes.