INTRODUCCIÓN
El cáncer de estómago es el sexto en frecuencia en el mundo con una tasa estandarizada por edad de 1,1 casos por 100.000 habitantes1. Presenta diferente distribución geográfica, siendo Asia el conteniente en el que se produjeron el 74,4% de los casos en 20181. En Europa, durante ese mismo año, se registraron 133.065 casos, de los cuales, 7.684 fueron en España1. En cuanto a la mortalidad, representa la tercera causa de muerte por cáncer en hombres y la quinta en mujeres en todo mundo1.
Entre los factores de riesgo para desarrollar cáncer gástrico se encuentran el sexo masculino, ya que la incidencia en hombres es el doble que en mujeres1, alimentarios como el consumo de sal o ahumados y escasa ingesta de frutas y verduras, presencia previa de gastritis atrófica, gastrectomía parcial, enfermedad de Menetrier, consumo de tabaco y la infección por Helicobacter pylori, siendo este último el principal factor de riesgo2,3,4.
Aproximadamente del 3 al 5% de los casos de cáncer gástrico se relacionan con síndromes genéticos que predisponen para este tipo de cáncer. Entre ellos, se encuentran el cáncer gástrico difuso hereditario, en el que se encuentra mutado el gen supresor de tumores CDH1 y en el que se recomienda la gastrectomía profiláctica, el síndrome de Lynch, el síndrome de poliposis juvenil, el síndrome de Peutz-Jeghers o la poliposis adenomatosa familiar3.
Respecto a la histología, la Organización Mundial de la Salud clasifica los tumores gástricos en adenocarcinomas (tumores generados a partir de las glándulas, aproximadamente el 95% de los casos), carcinoma de células en anillo y carcinoma indiferenciado5. Existe otra clasificación, conocida como clasificación de Lauren en la que se distinguen: cáncer gástrico difuso (con células poco diferenciadas) o intestinal (células más diferenciadas)4,5. También se van a diferenciar en función de la expresión de HER-2.
No hay evidencia suficiente para establecer un cribado en Europa. No existen signos específicos para el diagnóstico del cáncer gástrico; en estadios avanzados pueden aparecer síntomas que van a establecer la sospecha: pérdida de peso, disfagia, dispepsia, anemia o sensación de plenitud. Para poder confirmar el diagnóstico se debe realizar una biopsia con una gastroscopia4.
El tratamiento de primera línea del cáncer gástrico metastásico según la última versión de la guía clínica de la Sociedad Europea de Oncología Médica (ESMO)2 consiste en la combinación de dos o tres fármacos siendo uno de ellos derivado del platino y otro derivado de fluoropirimidinas. Un metanálisis publicado en 2009, demostró superioridad de aquellos regímenes basados en tres fármacos, añadiendo a los dos anteriores una antraciclina6. Entre los regímenes usados habitualmente se encuentran: ECF o Cunningham modificado (epirubicina, cisplatino y 5-fluoruracilo), EOX (epirubicina, oxaliplatino y capecitabina) o EOF (epirubicina, oxaliplatino y 5-fluoruracilo)2. Además, en el caso de que el tumor exprese HER-2, se debe asociar trastuzumab.
En cuanto a la segunda línea de tratamiento, se recomienda un taxol (docetaxel o paclitaxel), irinotecan o ramucirumab en monoterapia o en combinación con paclitaxel en pacientes con un buen estado funcional aptos para el tratamiento2.
Ramucirumab es un anticuerpo monoclonal humanizado IgG1 dirigido contra el receptor 2 del factor de crecimiento del endotelio vascular que actúa bloqueando la cascada de señalización que provoca la angiogénesis. Está indicado en monoterapia o combinación con paclitaxel en el tratamiento de segunda línea del adenocarcinoma gástrico metastático (AGM) o adenocarcinoma de la unión gastroesofágica metastásico (AUGEM) tras la progresión a quimioterapia previa con derivado de platino y fluoropirimidina7.
La posología recomendada es de 8 mg/kg los días 1 y 15 de ciclos de 28 días. En ficha técnica, está contemplada la disminución de dosis a 6 mg/kg y una posterior a 5 mg/kg, siendo necesario interrumpir el tratamiento en casos de proteinuria mayor a 3 gramos7.
El presente estudio, realizado en condiciones de práctica clínica habitual, tiene como objetivo evaluar la efectividad y seguridad de ramucirumab en el tratamiento de AGM y AUGEM en un hospital de clase 5 según la clasificación clúster de hospitales8.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional retrospectivo que incluyó a todos los pacientes con AGM y AUGEM tratados con ramucirumab que iniciaron tratamiento desde su comercialización hasta marzo de 2019.
Se realizó un seguimiento de los pacientes a través de la historia clínica electrónica (HCE) de la que se recogieron la edad, el sexo, el diagnóstico, estado funcional según la escala ECOG diseñada por el Grupo Cooperativo de Oncología del Este (Eastern Cooperative Oncology Group) y líneas previas de tratamiento. Para evaluar la tolerancia al tratamiento, se recogieron el número de ciclos con el que se trató a cada paciente, así como las reducciones en la dosis y los retrasos en los ciclos. Como variables de efectividad se calcularon la supervivencia libre de progresión (SLP) y supervivencia global (SG) con el método de Kaplan-Meier. Como variables de seguridad se analizaron los efectos adversos recogidos en la HCE y se categorizaron por gravedad según los criterios comunes de terminología para eventos adversos (CTCAE) (v.5)9.
RESULTADOS
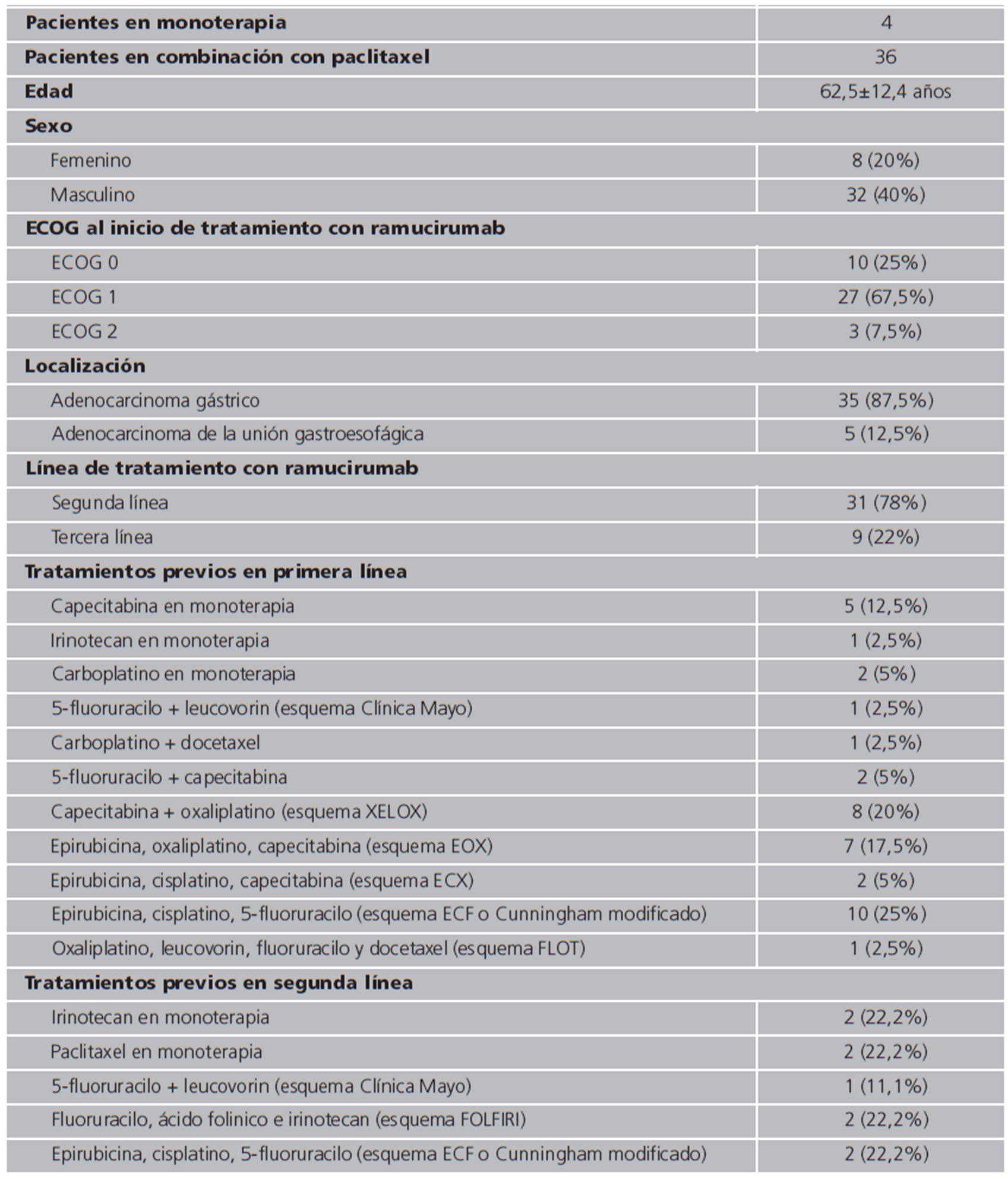
Se analizó un total de 40 pacientes (20% mujeres) con edad media al inicio del tratamiento de 62,5±12,4 años. El 87,5% de los pacientes tenían AGM y el 12,5% de los pacientes AUGEM, HER-2 negativo en el 65,8% de los casos. Al inicio de tratamiento con ramucirumab, el 67,5% de los pacientes tenían ECOG 1 (Tabla 1).
El 78% de los tratamientos con ramucirumab fueron en segunda línea y el 22% en tercera. Respecto a la primera línea de tratamiento previa, el 75% de los tratamientos tenían al menos dos fármacos: uno derivado de platino y otra fluoropirimidina, nueve pacientes fueron tratados en monoterapia de los cuales el 67% fueron con un derivado de fluoropirimidina. El esquema más frecuente el Cunningham modificado (ciclos de 21 días de: epirubicina 50 mg/m2 día 1, cisplatino 60 mg/m2 día 1 y 5-fluoruracilo 200 mg/m2 en infusión continua), utilizado para el tratamiento del 24,4% de los pacientes (n=10).
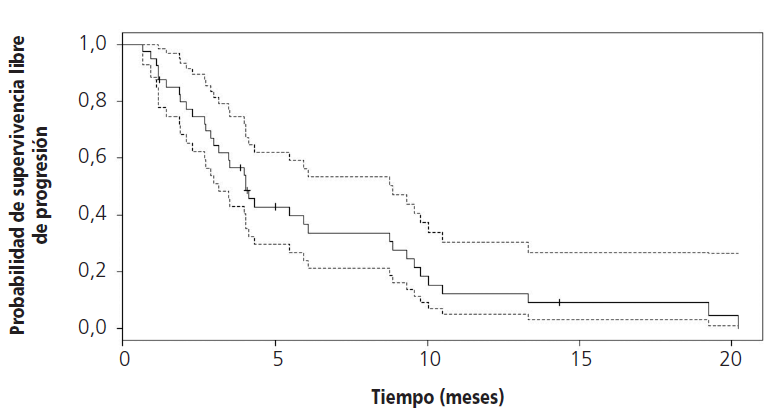
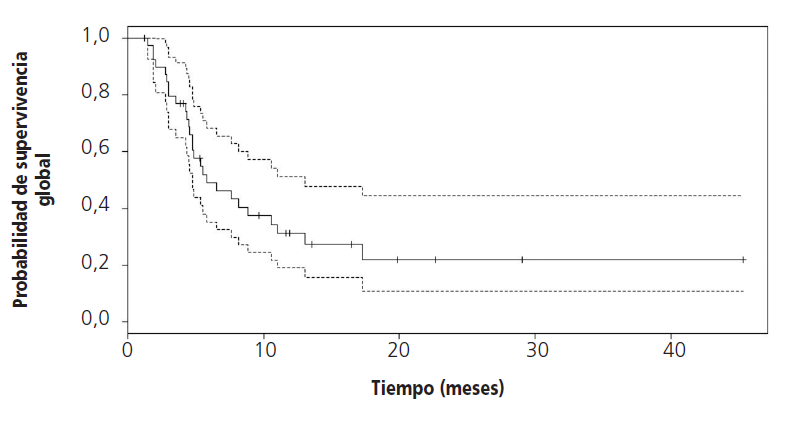
EL 90,1% (n=36) de los pacientes fueron tratados con la combinación de paclitaxel 80 mg/m2 más ramucirumab 8 mg/kg; el resto se trató en monoterapia a la misma dosis. Los pacientes recibieron de media 5,1±4,1 ciclos. Las razones para la discontinuación de tratamiento fueron en todos los casos progresión oncológica y empeoramiento clínico. La SLP fue de 4 (IC95% 3,1-8,9) meses y la SG fue de 5,8 (IC95% 4,7-13) meses (Figuras 1y 2). No se pudo calcular la SLP y la SG en los subgrupos de ramucirumab en combinación con paclitaxel y ramucirumab en monoterapia debido al tamaño muestral.
En cuanto a la seguridad, el 75,6% de los pacientes (n=31) presentó algún efecto adverso. El efecto adverso más observado fue la astenia en el 48,8% de los pacientes (n=20) siendo de grado uno en siete pacientes y de grado dos en trece. Presentó hipertensión el 17,1% de los pacientes, siendo en uno de ellos de grado 3. Los siguientes efectos adversos más observados fueron rash cutáneo (12,2%), alopecia (12,2%), neutropenia (9,7%), mucositis (9,7%) y nauseas (9,7%). No se realizaron disminuciones de dosis, pero sí hubo retrasos en la administración del ramucirumab en el 39% de los pacientes, dos de ellos por proteinuria.
DISCUSIÓN
La indicación de ramucirumab para la indicación en adenocarcinoma gástrico y de la unión gastroesofágica, se obtuvo a partir de los ensayos clínicos de fase III, aleatorizados y doble ciego, RAINBOW y REGARD. En el ensayo clínico REGARD se comparó el tratamiento con ramucirumab 8 mg/kg o placebo cada dos semanas en segunda línea tras cisplatino y/o 5-fluoruracilo y se obtuvo una SLP de 2,1 meses (IC95% 1,5-2,7) y una SG de 5,2 meses (IC95% 4,4-5,7) en el grupo de ramucirumab y una SLP de 5,2 meses (IC95% 4,4-5,7) y una SG de 3,8 meses (IC95% 2,8-4,7) en el grupo placebo10. En el otro ensayo clínico, RAINBOW, se comparó el tratamiento con ramucirumab 8 mg/kg cada dos semanas junto con paclitaxel 80 mg/kg semanal durante tres semanas seguido de una semana de descanso frente a placebo y el mismo esquema de paclitaxel. En el ensayo, se obtuvo una SLP de 4,4 meses (IC95% 4,2-5,3) y de SG de 9,6 meses (IC95% 8,5-10,8) en el grupo de la combinación con ramucirumab y una SLP de 2,9 meses (IC95% 2,8-3,0) y una SG 7,4 meses (IC95% 6,3-8,4) en el grupo de paclitaxel11.
En nuestro estudio, la SLP fue similar a la obtenida en el ensayo clínico RAINBOW, aunque el valor de la SG obtenida fue de casi la mitad, más similar a la del ensayo REGARD. No obstante, la efectividad y seguridad del tratamiento con ramucirumab en pacientes tratados fuera de ensayo clínico está menos estudiada.
Con relación a la efectividad de ramucirumab en el tratamiento del cáncer gástrico, hay varios estudios publicados. En el trabajo publicado por Di Tolomeo et al., un estudio observacional retrospectivo en una cohorte italiana de 167 pacientes tratados tanto en monoterapia con ramucirumab (10,2%) como en combinación con paclitaxel (89,8%), tras un seguimiento medio de 11 meses, se obtuvo una SG de 8 meses (IC95% 7,09-8,9) y una SLP de 4,5 meses (IC95% 4,1-4,7)12. Paulson et al. evaluó el tratamiento en monoterapia con ramucirumab en comparación con el tratamiento en combinación de ramucirumab con paclitaxel. En este estudio, observacional retrospectivo con un total de 505 pacientes: 115 en monoterapia y 390 en combinación con paclitaxel, se obtuvo una SG de 5,5 meses (IC95% 4,3-7,8) en monoterapia y 7,4 meses (IC95% 6,6-8,8) en combinación13.
Con respecto a estos trabajos en condiciones reales, en nuestro estudio, el porcentaje de pacientes tratados con ramucirumab en monoterapia (9,9%), fue similar al trabajo de Di Tolomeo et al., aunque el dato de SG (5,8 meses (IC95% 4,7-13)) es inferior al de aquel. Esta diferencia no es significativa y puede deberse a un tamaño muestral pequeño en nuestro estudio, ya que las características de los pacientes en ambos grupos son similares (edad, porcentaje de pacientes en monoterapia o combinación, ECOG, sexo y expresión de HER2).
Respecto a la seguridad de ramucirumab, no se ha producido ninguna reacción adversa durante el tratamiento que no estuviera descrita ya en los ensayos clínicos. Todos los eventos adversos fueron en grado 1 o 2 excepto hipertensión que en un paciente llegó a ser de grado 3. En el EC RAINBOW, en la rama de pacientes tratados con ramucirumab más paclitaxel, un 47% de los pacientes experimentaron reacciones adversas de grado 3, mucho mayor que en los pacientes en práctica clínica habitual.
CONCLUSIONES
Ramucirumab, está clasificado por la ESMO dentro de su escala de magnitud de beneficio clínico, dentro de los tratamientos no curativos, como tipo 114. Esta puntuación, indica beneficio insignificante y quiere decir que este tratamiento añade poco a la terapéutica y el beneficio clínico es escaso. En base a los resultados obtenidos, con una SLP parecida a los ensayos clínicos y otros estudios publicados en vida real similares y una SG incluso inferior, se puede concluir que el beneficio clínico en pacientes en práctica clínica habitual también es escaso. No obstante, se debe tener en cuenta que, en muchas ocasiones, debido a la línea de tratamiento del paciente, en las que ya ha agotado todas las alternativas, o al estado funcional, no existen alternativas terapéuticas comercializadas.
En cuanto a la seguridad, el tratamiento con ramucirumab fue seguro y presentó un perfil de efectos adversos manejable por el clínico.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.