INTRODUCCIÓN
La psoriasis es una enfermedad cutánea inflamatoria crónica y recurrente que afecta a 2,3% de la población en España1 y a un 1-3% de la población en mundial2. En los últimos años, se ha confirmado la asociación de las formas graves de psoriasis con una serie de comorbilidades de riesgo cardiovascular, así como con un deterioro importante de la calidad de vida3.
En este contexto, los objetivos del tratamiento de la psoriasis son tanto el control de la afectación cutánea, como el control de la inflamación sistémica a largo plazo y la prevención de la aparición y progresión de las comorbilidades sistémicas. Actualmente las posibles opciones de tratamiento son: psoralenos, acitretina, apremilast, agentes inmunomoduladores sistémicos y agentes biológicos. Entre estos últimos se encuentran los antagonistas del factor de necrosis tumoral (anti-TNF) como adalimumab, etanercept, certolizumab e infliximab, e inhibidores de interleucinas (anti-IL) como ustekinumab (anti-IL 12/23), secukinumab, ixekizumab y brodalumab (anti-IL 17) y guselkumab, tildrakizumab y risankizumab (anti-IL 23). Diferentes fármacos autorizados por las agencias reguladoras en base a ensayos clínicos que, con diferentes diseños y objetivos demuestran su superioridad frente a placebo o frente a comparadores activos, pero no aclaran si existen diferencias relevantes entre ellos. A consecuencia de ello por el momento existen escasas evidencias en cuanto al fármaco biológico a utilizar en primera línea4, siendo necesario posicionar las diferentes opciones terapéuticas considerando criterios clínicos y de eficiencia.
En este contexto, resulta fundamental la confirmación de estos resultados en práctica clínica real, donde algunos autores se han planteado cuál debería ser un indicador adecuado para la evaluación de la efectividad, surgiendo un consenso en la propuesta del tiempo de persistencia. Éste se define como el tiempo que los pacientes permanecen en tratamiento con una terapia específica5, y se propone como un marcador general del éxito del tratamiento y de la adherencia al mismo, ya que representa simultáneamente información sobre la efectividad, la seguridad y la satisfacción del paciente siendo, además, una medida útil y accesible en la evaluación de terapias biológicas en psoriasis5.
Así pues, el presente estudio se planteó con el objetivo principal de evaluar y comparar el tiempo de persistencia, y secundariamente, analizar los motivos de suspensión, con fármacos anti-TNF frente a anti-IL en primera línea de tratamiento biológico en pacientes con psoriasis moderada/grave.
MATERIAL Y MÉTODOS
Estudio retrospectivo observacional realizado en un hospital general universitario público perteneciente a un departamento de salud de 270.000 habitantes.
Se incluyeron pacientes adultos mayores de 18 años diagnosticados de psoriasis moderada/grave en tratamiento con anti-TNF o anti-IL que iniciaron dicho tratamiento biológico en primera línea durante el periodo del 01/2010 al 12/2018.
Se excluyeron aquellos pacientes en los que el motivo principal de la prescripción era la presencia de artropatías concomitantes (artritis psoriásica o bien espondilitis anquilosante) con sintomatología no controlada.
Las variables demográficas recogidas fueron sexo y edad, y las relacionadas con el diagnóstico, como el tiempo desde el diagnóstico de la patología hasta el inicio del tratamiento con fármacos biológicos, la presencia de artropatías concomitantes reconocidas por un reumatólogo y la gravedad al inicio del tratamiento biológico, expresada en términos de índice de severidad del área de psoriasis (PASI). Las variables relacionadas con el tratamiento recogidas fueron: fármaco de estudio, tratamiento previo y concomitante al periodo de evaluación, y pauta posológica, así como tiempo con la dosis de ficha técnica, intensificado u optimizado.
Se calculó el tiempo de persistencia con el fármaco de estudio, calculando la diferencia entre la fecha de inicio y la fecha de suspensión. En el caso de que el paciente continuara en tratamiento, la persistencia se calculó a partir de la fecha de finalización del seguimiento (31/05/2019). De producirse alguna suspensión del tratamiento, el tiempo de persistencia se calculó hasta la primera suspensión. Las pérdidas de seguimiento, entendidas como pacientes que no acudieron a la consulta con el dermatólogo ni con el farmacéutico en un periodo superior a un año, se consideraron como fallos en el análisis del tiempo de persistencia. Se recogió también el porcentaje de pacientes que suspendieron el tratamiento, así como los motivos de suspensión, pudiendo ser estos: la falta de efectividad, entendido PASI ≥5, la presencia de eventos adversos o bien otros motivos. En el caso de presentarse algún evento adverso, se evaluó la relación causal a través del algoritmo de Naranjo6.
Los resultados de las variables categóricas se describieron a través de frecuencias (%) y se compararon a través de la Chi de Pearson. Se utilizó el riesgo relativo como medida de asociación entre anti-TNF y anti-IL. Los resultados de las variables cuantitativas (excepto el tiempo de persistencia) se describieron a través de medias y desviación estándar (DE) en el caso de que fueran normales, siendo previamente confirmado este supuesto a través del test de normalidad de Shapiro-Wilk, y a través de medianas y rangos intercuartílicos (RIQ) en el caso de que no fueran normales. Sus resultados se compararon a través de T de Student, U de Mann-Whitney, ANOVA o a través de Kruskal-Wallis. Se realizó un análisis del tiempo de persistencia a través de la elaboración de curvas de Kaplan-Meier, que fueron comparadas a través de la prueba de Mantel-Haenszel, calculándose la probabilidad de persistencia en función del tiempo. El análisis estadístico se realizó mediante el paquete estadístico STATA v13.0.
El presente estudio se llevó a cabo en consonancia con el código ético de la Organización Mundial de la Salud sobre estudios con humanos (Declaración de Helsinki). Todos los pacientes participantes fueron informados debidamente y cumplimentaron y firmaron el consentimiento informado. Los investigadores asignaron un código de identificación a cada uno de sus pacientes para así mantener la confidencialidad de los datos (Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de derechos digitales). El proyecto fue aprobado por el Comité de Ética de la Investigación con medicamentos del hospital.
RESULTADOS
Durante el periodo de estudio se reclutaron 94 pacientes, 46 pacientes tratados con anti-TNF (48,9%; 35 con adalimumab y 11 con etanercept) y 48 pacientes tratados con anti-IL (51,1%; 25 con secukinumab, 16 con ustekinumab y 7 con ixekizumab). El 41,5% (39/94) fueron mujeres, con una media de 49 (DE 13) años de edad, con diagnóstico de psoriasis en los 3 (RIQ 5,1) años previos al inicio del tratamiento con fármacos biológicos, siendo los pacientes tratados con anti-TNF diagnosticados con anterioridad respecto al grupo tratado con anti-IL (3,9 (RIQ 5,1) años con anti-TNF vs. 2,3 (RIQ 5) años con anti-IL; p>0,05). El 24,5% de la población (23/94) también presentó afectación articular, siendo su prevalencia un 15,9% superior en el grupo de anti-TNF (32,6% vs. 16,7%; p>0,05). Respecto a la gravedad al inicio del tratamiento biológico, expresada en términos de PASI, no se encontraron diferencias entre ambos grupos de tratamiento (13,2 (DE 4,3) con anti-TNF vs. 12,6 (DE 5,1) con anti-IL; p>0,05). Las características demográficas y diagnósticas en los pacientes tratados con anti-TNF y anti-IL se resumen en la tabla 1, y desglosadas por fármaco, en la tabla 1 del material suplementario.
Tabla 1. Variables demográficas y diagnósticas en los pacientes tratados con anti-TNF vs. anti-IL

Anti-TNF: antagonista del factor de necrosis tumoral
anti-IL: antagonista de interleucina
DE: desviación estándar
RIQ: rango intercuartílico
AP: artritis psoriásica
EA: espondilitis anquilosante
PASI: índice de severidad del área de psoriasis
*Chi de Pearson
ΔT de Student
+U de Mann-Whitney
Tabla 1. Material suplementario. Variables demográficas y diagnósticas por fármaco

DE: desviación estándar
RIQ: rango intercuartílico
AP: artritis psoriásica
EA: espondilitis anquilosante
*Chi de Pearson
ΔT de Student
+U de Mann-Whitney
La proporción de pacientes en tratamiento inmunosupresor previo y concomitante al periodo de estudio fue superior en el grupo de pacientes tratados con anti-TNF (previo 71,7% vs. 60,4%; p=0,247 y concomitante 23,9% vs. 8,3%; p=0,039). Estos resultados se detallan en la tabla 2 del material suplementario.
Tabla 2. Material suplementario. Tratamiento previo y concomitante al periodo de estudio por fármaco

**comparación entre los diferentes fármacos
Al analizar los pacientes tratados con anti-TNF y anti-IL, se encontraron diferencias en la mediana del tiempo que permanecieron con la pauta posológica intensificada (3,7 meses con anti-TNF vs. 13,1 meses con anti-IL; p=0,003). Al desglosar por fármaco, ustekinumab fue el que requirió que un 37,5% (6/16) de los pacientes tratados recibieran pautas posológicas intensificadas durante periodos de tiempo más prolongados (13,1 (RIQ 8,3) meses con ustekinumab vs. 4,1 (RIQ 2,8) meses con adalimumab vs. 3,6 (RIQ 1,2) meses con etanercept). En la tabla 2 se resumen las pautas posológicas y el tiempo en tratamiento con las diferentes pautas en los pacientes tratados con anti-TNF y anti-IL, y desglosadas por fármaco en la tabla 3 del material suplementario.
Tabla 2. Pautas posológicas en los pacientes tratados con antiTNF vs antiIL y tiempo en tratamiento con las diferentes pautas

Anti-TNFantagonista del factor de necrosis tumoral
anti-ILantagonista de interleucina
RIQrango intercuartílico
*Chi de Pearson
ΔU de Mann-Whitney
Tabla 3. Material suplementario. Pautas posológicas en los pacientes tratados por fármacos y tiempo en tratamiento con las diferentes pautas

RIQrango intercuartílico
*Chi de Pearson
ΔU de Mann-Whitney
La mediana del tiempo de persistencia en primera línea de tratamiento biológico fue de 18,4 (RIQ 22,2) meses, siendo 9,3 (RIQ 21,7) meses superior en los pacientes tratados con anti-IL (24,7 (RIQ 22,9) vs. 15,4 (RIQ 20,4); p=0,002).
Ustekinumab fue el fármaco que presentó mayor persistencia, con una mediana de 28,0 (RIQ 19,5) meses, seguido de secukinumab con 26,4 (RIQ 21,5), adalimumab 15,7 (RIQ 23,6), etanercept 15,1 (RIQ 23,7) e ixekizumab 11,4 (RIQ 2,9) meses respectivamente (p=0,010), datos que se ilustran en las figuras 1 y2. Las probabilidades de persistencia con el tiempo, así como el número de pacientes en riesgo, se describen en la tabla 4 del material suplementario.
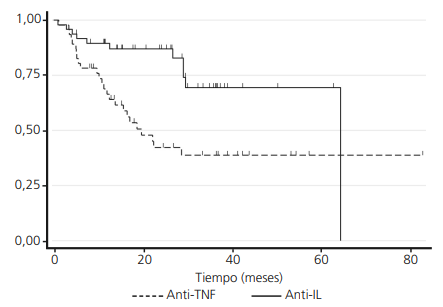
Figura 1. Probabilidad de persistencia del fármaco en los pacientes tratados con anti-TNF vs. anti-IL
Tabla 4. Material suplementario. Probabilidad de persistencia
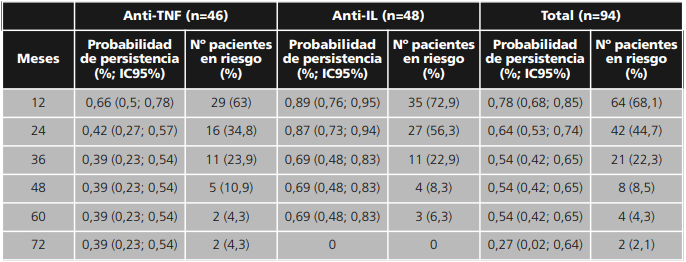
Anti-TNF: antagonista del factor de necrosis tumoral
anti-IL: antagonista de interleucina
IC95%: intervalo de confianza al 95%
En el momento de finalización del seguimiento el 38,3% de los pacientes (36/94) habían interrumpido el tratamiento con el fármaco de estudio (un paciente fue pérdida de seguimiento). El 54,3% (25/46) de los pacientes en tratamiento con anti-TNF interrumpieron el tratamiento frente al 22,9% (11/48) del grupo de anti-IL (riesgo relativo=2,37; p=0,002).
Los motivos de suspensión de tratamiento en el grupo de anti-TNF fueron: 34,8% (16/46) falta de efectividad, 2,2% (1/46) presencia de un evento adverso y 17,4% (8/46) otros motivos. Un paciente suspendió adalimumab a causa de la presentación de una psoriasis paradójica, reacción adversa clasificada como probable según el algoritmo de Naranjo5, que fue notificada al Centro de Farmacovigilancia. Los motivos de suspensión de tratamiento en el grupo de anti-IL fueron: 14,6% (7/48) falta de efectividad y 8,3% (4/48) otros motivos. Las suspensiones por falta de efectividad fueron estadísticamente superiores en el grupo de pacientes tratados con anti-TNF (riesgo relativo=2,37; p=0,003).
No hubo diferencias estadísticamente significativas entre ambos grupos en la suspensión por otros motivos (riesgo relativo=2,09; p>0,05). Los otros motivos por los cuales los pacientes interrumpieron el tratamiento con anti-TNF fueron: deseo gestacional (1/46), infecciones no relacionadas con el tratamiento (1/46), PASI 0 (4/46), voluntad del paciente (1/46) y pérdida de seguimiento (1/46); mientras que los otros motivos por los cuales los pacientes interrumpieron el tratamiento con anti-IL fueron: éxitus (1/48), infecciones no relacionadas con el tratamiento (1/48), nódulo pulmonar a estudio (1/48) y voluntad del paciente (1/48).
DISCUSIÓN
En la práctica clínica, el tiempo de persistencia en primera línea de tratamiento biológico en pacientes con psoriasis moderada/grave fue de 18,4 (RIQ 22,2) meses, siendo significativamente superior en el grupo de pacientes tratados con fármacos anti-IL (diferencia de 9,3 meses; p=0,002). Por fármacos, ustekinumab fue el fármaco con mayor tiempo de persistencia, seguido de secukinumab, adalimumab, etanercept e ixekizumab.
Los pacientes tratados con anti-TNF presentaron mayor tiempo transcurrido desde el diagnóstico de la patología hasta el inicio del tratamiento con fármacos biológicos, aunque sin diferencias estadísticamente significativas entre ambos grupos, lo que sugiere que la comercialización de los nuevos fármacos ha fomentado una indicación de tratamiento más precoz, que podría haber condicionado una peor respuesta a los anti-TNF. Al respecto se han publicado datos en artritis reumatoide que apoyan la idea de que el uso precoz de fármacos biológicos modifica la actividad inflamatoria y la gravedad7,8, pero hasta ahora no se dispone de datos en psoriasis9.
La proporción de pacientes en tratamiento inmunosupresor previo y concomitante al periodo de estudio tendió hacia la superioridad en el grupo de pacientes tratados con anti-TNF, aunque sin alcanzar diferencias estadísticamente significativas, resultado probablemente condicionado por una mayor presencia de pacientes con afectación articular en dicho grupo. Sin embargo, el porcentaje de pacientes con necesidad de optimizaciones y/o intensificaciones de tratamiento fueron similares entre ambos grupos.
En cuanto al análisis por fármaco, el que presentó mayor mediana de tiempo de persistencia fue ustekinumab. Respecto a la comparación del objetivo principal frente a otros estudios, destaca el metanálisis realizado en práctica clínica real publicado por Pei-Tzu et al. 10. En el subgrupo de pacientes naïvea fármacos biológicos se concluye que el 87% de los pacientes tratados con ustekinumab continúan con el fármaco de estudio tras 4 años de seguimiento (n=321), seguidos por un 63% con adalimumab (n=1.547) y un 52% con etanercept (n=1.319)10.
También en una revisión sistemática publicada por No et al.11 en pacientes naïvey pretratados se concluye que ustekinumab presenta una mayor mediana de tiempo de persistencia con 38 meses, seguido de adalimumab con 37 meses, infliximab con 27 meses y etanercept con 25 meses11. Resultados similares a los publicados por Villarasa et al.12 en pacientes naïvey pretratados, en el que ustekinumab presenta un tiempo de persistencia superior a 48 meses, seguido por adalimumab con 30,5 (IC95% 24,1; 37,1) meses y etanercept con 24,8 (IC95% 19,4; 30,2) meses.
Las publicaciones anteriormente descritas presentan resultados próximos a los obtenidos en nuestro grupo de pacientes tratados con ustekinumab (tiempo de persistencia de 28 meses), superiores también a la del resto de fármacos evaluados. Sin embargo, los resultados obtenidos no son tan concordantes en el grupo de pacientes tratados con adalimumab (15,7 meses frente a 37 meses11 y 30,5 meses12 respectivamente). Estas discrepancias pueden ser debidas a una mayor proporción de pacientes con afectación articular en dicho subgrupo (28,6%), que han requerido durante el seguimiento tratamiento concomitante con inmunomoduladores (53,3%).
Tampoco hemos de perder de vista el factor de la intensificación de tratamiento respecto a la dosis descrita en ficha técnica: el 37,5% de los pacientes tratados con ustekinumab fueron intensificados durante 13,1 meses. Estos resultados pueden haber condicionado la efectividad del fármaco respecto al resto de alternativas terapéuticas, que presentaron menor prevalencia de intensificaciones (17,1% para adalimumab) e inferior tiempo con dicha pauta posológica (4,1 (RIQ 2,8) meses), dado que es esperable una mejor respuesta clínica de pacientes que reciben esquemas de intensificación13. Sin embargo, se desconoce el efecto de las intensificaciones sobre la seguridad del tratamiento a largo plazo.
En estudios realizados en nuestro entorno clínico en pacientes naïvey pretratados con fármacos biológicos se obtuvo que entre un 45,3%14 y un 36,4%15 de los pacientes suspendieron la terapia por falta de efectividad, siendo el primer motivo de suspensión también en nuestra serie, especialmente en el subgrupo de pacientes tratados con antiTNF (34,8% con anti-TNF vs. 14,6% con anti-IL).
En el presente estudio, sólo un paciente (1,1% de los pacientes incluidos) presentó una psoriasis paradójica, efecto adverso atribuido a adalimumab según el algoritmo de Naranjo. Ningún otro paciente suspendió el tratamiento con el fármaco de estudio a consecuencia de la presentación de efectos adversos. En una publicación de Warren et al.16 realizada en 3.523 pacientes naïvea tratamiento biológico se presentaron suspensiones de tratamiento relacionados con la presencia de eventos adversos en un 5,4% de la población. Siguiendo la misma proporción, era esperable que localizáramos en nuestra población al menos a 4 pacientes que suspendieran tratamiento por este motivo. Sin embargo, en dicho estudio el 87% de la población estaba tratada con anti-TNF frente a un 48,9% en nuestro caso, a los que se les atri0.
Como fortalezas del estudio, hemos de tener en cuenta que la persistencia del fármaco se define como un marcador general del éxito del tratamiento. Sin embargo, algunos estudios únicamente evalúan el tiempo de persistencia del fármaco suspendido por motivos de pérdida de efectividad o presencia de efectos adversos10, sin valorar la presencia de otros factores que puedan sobrestimar la estimación de dicho parámetro.
Como limitaciones del estudio, hemos de destacar que los pacientes incluidos en el grupo de anti-TNF eran pacientes con mayor tiempo transcurrido desde el diagnóstico de la patología hasta el inicio del tratamiento, pretratados en mayor medida con inmunomoduladores, con mayor incidencia de afectación articular y con menos tiempo con pautas posológicas intensificadas. Estas condiciones pueden haber determinado la menor persistencia observada en el grupo de pacientes tratados con anti-TNF, con las limitaciones añadidas derivadas de la obtención de conclusiones a partir de estudios retrospectivos con un tamaño muestral reducido.
El hecho de realizar un análisis agrupado por grupo farmacológico, con un número reducido de pacientes en algunos subgrupos, no permite discriminar si los hallazgos son debidos a un efecto de clase o a las propias diferencias existentes entre los fármacos evaluados, como sugiere la publicación de Lunder et al.17, en la que se atribuye un mayor tiempo de persistencia a los anti-IL 12/23, seguidos de anti-IL 17 y anti-TNF, tendencia que se observa igualmente en nuestro estudio.
En el escenario inicial, la falta de disponibilidad de alternativas terapéuticas condicionaba la utilización de los fármacos biológicos18. Sin embargo, durante los últimos años se han ampliado las opciones de tratamiento. En este contexto, es necesario profundizar en el conocimiento de los mismos en relación a la idoneidad del fármaco en función de las comorbilidades del paciente19, de la pauta posológica, asegurando la seguridad de las intensificaciones a largo plazo, o de la adherencia al tratamiento, que nos proporcionen soporte a la decisión clínica, ampliando el análisis a todas las moléculas de reciente comercialización con indicación en psoriasis moderada/grave.
CONCLUSIÓN
El tiempo de persistencia en primera línea de tratamiento biológico en pacientes con psoriasis moderada/grave fue de 18,43 meses, siendo significativamente superior para fármacos anti-IL. El fármaco con mayor tiempo de persistencia fue ustekinumab, aunque también fue el que se asoció a un mayor porcentaje de intensificaciones de su pauta posológica mantenidas durante más tiempo. El principal motivo de suspensión fue la falta de efectividad en ambos grupos de tratamiento, siendo las suspensiones por este motivo estadísticamente superiores en el grupo de pacientes tratados con anti-TNF. El estudio de factores predictores de respuesta que dirijan la elección del tratamiento puede contribuir a la optimización y selección de la terapia biológica más adecuada para cada paciente.















