INTRODUCCIÓN
La psoriasis en una enfermedad sistémica cutánea inflamatoria crónica caracterizada por una alteración de la respuesta inmune, con una pérdida del balance entre la producción de citoquinas proinflamatorias y antiinflamatorias1,2. La psoriasis palmo-plantar (PP) en placas se localiza en las palmas de las manos y en las plantas de los pies y se caracteriza por presentarse como áreas eritematosas descamadas o engrosadas con o sin presencia de pústulas3. Entre un 6 y un 17% de los pacientes con psoriasis presentan este tipo de afectación4,5, presentando un mayor grado de discapacidad, en parte a causa del deterioro de la movilidad por afectación de las plantas de los pies, y una peor percepción de la calidad de vida en relación a los pacientes con psoriasis en placa con lesiones en otras localizaciones4,6.
En este contexto, los objetivos del tratamiento de la psoriasis PP son tanto el control de la afectación cutánea, como el control de la inflamación sistémica a largo plazo y la prevención de la aparición y progresión de las comorbilidades sistémicas.
La terapia tópica y la fototerapia son las primeras líneas de tratamiento de la psoriasis PP. Sin embargo, en ocasiones es necesario recurrir a la utilización de tratamientos sistémicos, como los retinoides o los inmunomoduladores, que tienen asociado un perfil de toxicidad que limita su utilización, o como los agentes biológicos, con un importe económico muy elevado. Por estos motivos resulta necesaria la optimización de las primeras líneas, reservando los inmunomoduladores y los fármacos biológicos para los pacientes no respondedores.
En el caso de la psoriasis PP, la evidencia disponible en esta población es limitada y se describe una elevada variabilidad en la respuesta al tratamiento4,7-10.
La combinación de calcipotriol 0,05 mg con betametasona dipropionato 0,5 mg por gramo de especialidad, está comercializada en nuestro país en forma de pomada y de espuma, empleándose tradicionalmente en el tratamiento de la psoriasis11-13, tal y como se refleja en la guía clínica del National Institute for Health and Care Excellence (NICE)14, en la que se indica el tratamiento con esta combinación, siempre y cuando la monoterapia con corticoides o la utilización de alquitranes, ambos administrados de forma tópica, no haya sido efectiva, habiéndose planteado la hipótesis de que puedan presentar efectos aditivos o sinérgicos15. También la adaptación de la Guía Clínica Canadiense de 2016 reconoce esta combinación como una opción de tratamiento en primera línea en psoriasis moderada con grado de recomendación A16.
En una revisión sistemática realizada por Yan et al.17 se evaluó la eficacia y la seguridad de la administración tópica de calcipotriol y betametasona dipropionato en combinación. Dicha revisión incluyó diez ensayos clínicos aleatorizados con más de 6.590 pacientes con psoriasis en los que se comparaba la monoterapia con calcipotriol o bien con betametasona respecto a la asociación de ambos principios activos en una única formulación, demostrándose una mayor eficacia de la combinación con un aceptable perfil de seguridad.
Sin embargo resulta necesaria la utilización de los patient reported outcome measures (PROMs) con el fin de evaluar, además de los resultados en salud del tratamiento en psoriasis de localización PP, la percepción del paciente respecto a su tratamiento en términos de mejora de la calidad de vida o de satisfacción con el tratamiento, con la finalidad de personalizar la asistencia en función de las necesidades de atención clínica de cada paciente.
Así pues, el presente estudio se planteó con el objetivo principal de evaluar la efectividad, la seguridad, la calidad de vida y la satisfacción de pacientes con psoriasis PP tratados con espuma de calcipotriol y betametasona dipropionato (Cal/BD) para administración tópica.
MATERIAL Y MÉTODOS
Estudio prospectivo descriptivo llevado a cabo en dos hospitales generales universitarios públicos durante el periodo comprendido entre marzo y julio del año 2019. Se incluyeron pacientes diagnosticados de psoriasis en placa con afectación PP no controlada que recibieron tratamiento tópico con Cal/BD en espuma.
Se incluyeron pacientes adultos mayores de 18 años diagnosticados de psoriasis en placa con afectación PP no controlada para los que estuviera indicado iniciar, según las guías de práctica clínica, tratamiento tópico con Cal/BD.
Se excluyeron aquellos pacientes diagnosticados de psoriasis pustulosas o eritrodérmicas, o bien que presentasen placas en otras localizaciones distintas a palmas y plantas, así como aquellos que hubiesen recibido tratamiento sistémico o tópico en las dos semanas previas al inicio de tratamiento con Cal/BD.
Los pacientes que cumplían los criterios de inclusión y ninguno de los criterios de exclusión se incluyeron en el estudio de forma consecutiva, en el mismo orden en el que se les prescribió el tratamiento con Cal/BD.
El seguimiento clínico de los pacientes en tratamiento incluidos en el estudio se realizó durante 4 semanas.
Se recogieron variables demográficas (sexo y edad), antropométricas (índice de masa corporal (IMC)), relacionadas con la patología (antecedentes familiares de psoriasis, hábito tabáquico, comorbilidades, tiempo desde el diagnóstico de la patología, localización de las lesiones (sólo palmas, sólo plantas o ambos) y el Body Surface Area (BSA), categorizado como <10% o bien ≥10%) y relacionadas con el tratamiento (tratamientos farmacológicos previos al inicio del tratamiento con Cal/BD), todas ellas recogidas al inicio del tratamiento con Cal/BD.
La presentación evaluada en el presente estudio fue Enstilar®, cuya composición es calcipotriol monohidrato 0,05 mg con betametasona dipropionato 0,5 mg por gramo de especialidad en espuma cutánea, comercializada por el laboratorio Leo Pharma®, con indicación en adultos con psoriasis vulgaris para administración tópica una vez al día18.
La efectividad se valoró a través de Palmoplantar Psoriasis Area Severity Index (PPPASI; resultado cuantitativo de 0 a 72)19 y del Physician’s Global Assessment (PGA; resultado cuantitativo de 0 a 4)19.
La seguridad del tratamiento se describió en términos de incidencia y gravedad de los efectos adversos a las 4 semanas de tratamiento según clasificación de la Common Terminology Criteria for Adverse Events (CTCAE) versión 5.020.
En el caso de presentarse algún evento adverso, se evaluó la relación causal a través del algoritmo de Naranjo21.
La calidad de vida se evaluó a través del Dermatology Life Quality Index (DLQI, resultado cuantitativo de 0 a 30)22 y la satisfacción a través del Treatment Satisfaction Questionnaire for Medication (TSQM-14, resultado cuantitativo de 0 a 100)23.
La versión abreviada del cuestionario TSQM-14 consta de 14 ítems divididos en cuatro dominios: eficacia (3 ítems: "tratamiento o prevención", "alivio de los síntomas" y "rapidez de acción" con puntuaciones de 1 a 7 [de "sumamente insatisfecho/a" a "sumamente satisfecho/a"]); efectos adversos (cinco ítems: "presencia de efectos adversos" con puntuación 0 o 1 ["no"/"sí"], "molestia de los efectos adversos" con puntuaciones de 1 a 5 [de "molestias excesivas" a "ninguna molestia"] y "salud física y capacidad de funcionamiento", "capacidad mental" y "satisfacción general" con puntuaciones de 1 a 5 [de "muchísimo" a "nada"]; comodidad (tres ítems: "facilidad de uso" y "facilidad de planificación" con puntuaciones de 1 a 7 [de "sumamente difícil" a "sumamente fácil"] y "facilidad seguimiento de la posología" con puntuaciones de 1 a 7 [de "nada práctico" a "sumamente práctico"]); y por último, satisfacción global con la medicación (tres ítems: "confianza en el fármaco" con puntuaciones de 1 a 5 [de "ninguna confianza" a "confianza absoluta"], "confianza en las ventajas fármaco" con puntuaciones de 1 a 5 [de "nada convencido" a "totalmente convencido"] y "satisfacción global" con puntuaciones de 1 a 7 [de "sumamente insatisfecho/a" a "sumamente satisfecho/a"])24.
La efectividad y la calidad de vida se evaluaron al inicio y a las 4 semanas de tratamiento, calculándose la diferencia en términos absolutos entre ambas, mientras que la satisfacción se evaluó únicamente a la semana 4 de tratamiento.
Los resultados de las variables categóricas se describieron a través de frecuencias (%) y se compararon a través de la Chi de Pearson. Los resultados de las variables cuantitativas se describieron a través de medias e intervalos de confianza (IC95%) en el caso de que fueran normales, siendo previamente confirmado este supuesto a través del test de normalidad de Shapiro-Wilk, y a través de medianas y rangos intercuartílicos (RIQ) en el caso de que fueran no normales. Sus resultados se compararon a través de T de Student, U de Mann-Whitney, ANOVA o través de Kruskal Wallis. El análisis estadístico se realizó mediante el paquete estadístico STATA v13.0.
Las variables relacionadas con la efectividad y la seguridad del tratamiento se recogieron a partir de los cuestionarios cumplimentados por los facultativos cuyos resultados se registran en la historia clínica informatizada (Orion Clinic® v.11 EVERIS BPO S.L.U), mientras que las variables de calidad de vida y satisfacción se recogieron a partir del resultado de los cuestionarios cumplimentados por los pacientes.
El presente estudio se llevó a cabo en consonancia con el código ético de la Organización Mundial de la Salud sobre estudios con humanos (Declaración de Helsinki). Todos los pacientes participantes fueron informados debidamente y cumplimentaron y firmaron el consentimiento informado. Los investigadores asignaron un código de identificación a cada uno de sus pacientes para así mantener la confidencialidad de los datos (Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de derechos digitales). El proyecto fue aprobado por el Comité de Ética de la Investigación con medicamentos del hospital.
RESULTADOS
Se incluyeron 19 pacientes (11 mujeres), realizándose en todos ellos las evaluaciones correspondientes en la semana 0 y 4, por lo que no se produjo ninguna pérdida de seguimiento ni abandono precoz del tratamiento con Cal/BD en espuma.
Los pacientes incluidos presentaron una mediana de edad de 59 (RIQ 11,4) años y un IMC de 25,9 (RIQ 6,0) kg/m2, el 11% (2/19) de los cuales con antecedentes familiares de psoriasis. El 53% (10/19) de los pacientes eran fumadores y el 21% (4/19) exfumadores en el momento de la inclusión en el estudio, presentando el 84% comorbilidades (16/19): dislipemia 47% (9/19), hipertensión arterial 26% (5/19), ansiedad 26% (5/19), apnea del sueño 15% (3/19) entre otras. La mediana de tiempo desde el diagnóstico de la psoriasis fue de 4,5 (RIQ 4,4) años, presentando todos ellos afectación en palmas y plantas y un BSA <10%.
En relación al tratamiento previo del paciente, el 74% (14/19) recibieron otros tratamientos tópicos, el 48% (9/19) acitretino y el 26% (5/19) inmunosupresores entre otras opciones de tratamiento.
En las figuras 1 a 3 se muestra la evolución del PPASI, del PGA y del DLQI a la semana 0 y a la semana 4 de tratamiento.

Figura 1. Evolución del PPASI a la semana 0 y a la semana 4 de tratamiento con Cal/BD en espuma.PPASI: Palmoplantar Psoriasis Area Severity Index.

Figura 2. Evolución del PGA a la semana 0 y a la semana 4 de tratamiento con Cal/BD en espuma.PGA: Physician’s Global Assessment.

Figura 3. Evolución del DLQI a la semana 0 y a la semana 4 de tratamiento con Cal/BD en espuma.DLQI: Dermatology Life Quality Index.
En términos de efectividad, el tratamiento con Cal/BD en espuma produjo una mediana de reducción en el PPASI de 3,6 (RIQ 7,8) puntos y una reducción del PGA de 1,0 (RIQ 2,0) punto. En ambos casos se alcanzaron diferencias estadísticamente significativas entre las medianas de valores de efectividad obtenidas en la semana 0 y 4 (p=0,0284 y p=0,0047).
Dos de los pacientes incluidos (10,5%) reportaron haber presentado efectos adversos, que fueron prurito y sequedad de la piel. El facultativo responsable aplicó el algoritmo de Naranjo, obteniendo una calificación numérica de cero en ambos casos, por lo que las causalidades de los efectos adversos se categorizaron como dudosos, atribuyéndose a la patología de base y no al tratamiento en estudio.
En términos de calidad de vida el tratamiento produjo una mediana de reducción en el DLQI de 3,0 (RIQ 4,0) puntos. En este caso no se alcanzaron diferencias estadísticamente significativas entre la mediana de valores de calidad de vida obtenidas en la semana 0 y 4 (p=0,1592).
En la tabla 1 se detallan los resultados de efectividad del tratamiento y de calidad de vida en la semana 0 y en la semana 4 de tratamiento.
Tabla 1. Resultados de efectividad del tratamiento y de calidad de vida en la semana 0 y en la semana 4 de tratamiento con Cal/BD en espuma.
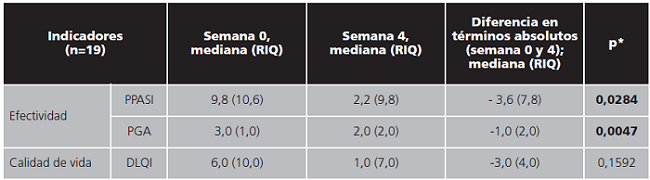
RIQ: rango intercuartílico; PPASI: Palmoplantar Psoriasis Area Severity Index (resultado cuantitativo de 0 a 72); PGA: Physician’s Global Assessment (resultado cuantitativo de 0 a 4); DLQI: Dermatology Life Quality Index (resultado cuantitativo de 0 a 30)
*U de Mann-Whitney.
La mediana de satisfacción con el tratamiento con Cal/BD en espuma valorada a través del cuestionario TSQM-14 fue de 76,9 (RIQ 32,2). En la figura 4 se detallan los resultados de los pacientes incluidos desglosados en función de las diferentes áreas evaluadas a través del TSQM-14 (eficacia, efectos adversos, comodidad y satisfacción global con la medicación).
DISCUSIÓN
La mayoría de los pacientes con psoriasis leve-moderada manejan su enfermedad con terapias tópicas. Sin embargo, la adherencia al tratamiento tópico sigue siendo un desafío. Los vehículos en espuma para administración tópica son alternativas innovadoras a las cremas y ungüentos: se extienden fácilmente sobre grandes áreas de la piel y no dejan restos grasos tras la aplicación25.
A través de la utilización de la espuma de Cal/BD nuestros pacientes presentaron una reducción en el PPASI a las 4 semanas de 3,6 puntos, lo que supone una reducción porcentual del 37% en este marcador respecto al inicio de tratamiento. Según la revisión bibliográfica realizada, no se dispone de referencias previas en las que se evalúe la efectividad de la espuma de Cal/BD en pacientes con psoriasis PP en términos de PPASI. En la revisión sistemática publicada por Yan et al.17 a partir de diez ensayos clínicos y con resultados acumulados de 4.628 pacientes con psoriasis vulgaris de cualquier localización con Psoriasis Area Severity Index (PASI) basales ≥7,8, las reducciones del PASI a la semana 4 fueron de entorno al 70%, resultados difícilmente comparables con los obtenidos en el presente trabajo en términos de PPASI.
Según los estudios publicados es esperable una incidencia de efectos adversos relacionados con la utilización de esta combinación de fármacos de entre un 14 y un 3,1%26, de entre ellos los más destacables las reacciones cutáneas en el sitio de administración18. En nuestra población de 19 pacientes, sería esperable encontrar entre tres y ningún paciente con efectos adversos, lo cual resulta concordante respecto a nuestros resultados, en los que dos pacientes reportaron haber presentado efectos adversos, que según el algoritmo de Naranjo, se categorizaron como dudosos, atribuyéndose la presencia de ambos a la patología de base y no al tratamiento en estudio.
En el ensayo clínico fase III PSO-FAST publicado por Leonardi et al.27 se comparó la calidad de vida en 426 pacientes con psoriasis vulgaris de cualquier localización en tratamiento con calcipotriol 0,05 mg y betametasona dipropionato 0,64 mg por gramo de especialidad en espuma comparada con la administración del vehículo de la misma especialidad sin los principios activos incorporados, evaluada a las 4 semanas de tratamiento. Los resultados mostraron una reducción del DLQI de 7 puntos en el grupo de pacientes tratado con Cal/BD frente a una reducción de 4,4 puntos en el grupo tratado con el vehículo sin principios activos (p<0,001).
Sin embargo, nuestros resultados sí fueron muy similares a los obtenidos en el estudio PSO-ABLE publicado por Griffiths et al.28 realizado en 463 pacientes con psoriasis vulgaris de cualquier localización en tratamiento con calcipotriol 0,05 mg con betametasona dipropionato 0,5 mg por gramo de especialidad administrada en forma de espuma comparada con la administración en forma de gel, evaluada a las 4, 8 y 12 semanas de tratamiento. Los resultados a la semana 4 mostraron una reducción de DLQI de 4,3 (DE 4,5) puntos en el grupo tratado con la espuma frente a una reducción de 3,8 (DE 5,0) puntos en el grupo de pacientes tratados con el gel (p<0,001).
Estas semejanzas con los resultados del estudio PSO-ABLE28 y las diferencias respecto al estudio PSO-FAST27 puede deberse a las discrepancias en los valores basales entre los diferentes subgrupos: el DLQI basal de nuestros pacientes fue de 6 (RIQ 10) puntos, en el estudio PSO-ABLE28 fue de 7 (DE 5,2) puntos mientras que en el estudio PSO-FAST27 fue de 9,9 puntos.
En términos de satisfacción con el tratamiento, hemos de destacar el trabajo publicado por Velasco et al.29 en el que se incluyeron a 446 pacientes con psoriasis en placas en tratamiento con calcipotriol monohidrato 0,05 mg con betametasona dipropionato 0,5 mg por gramo de especialidad en espuma cutánea en los que se utilizó el TSQM-9 para la evaluación de esta variable a las 4 semanas del inicio del tratamiento.
En dicho estudio, al analizar el dominio de eficacia del cuestionario, se observó que el 84% de los pacientes se mostraron entre "satisfechos" y "sumamente satisfechos" con la capacidad de Cal/BD de prevenir o tratar su psoriasis, el 84% de los pacientes se mostraron entre "satisfechos" y "sumamente satisfechos" con la capacidad de Cal/BD de aliviar los síntomas de la psoriasis y el 83% de los pacientes se mostraron entre "satisfechos" y "sumamente satisfechos" con el tiempo que tarda Cal/BD en ejercer su acción terapéutica. En nuestro caso estos resultados fueron del 63%, 58% y 58%, respectivamente. Estas diferencias podrían deberse a diferencias en la situación clínica basal de los pacientes tratados en ambos trabajos, hipótesis que no podremos confirmar dado que no se detallan en el trabajo de Velasco et al. los valores basales de PPASI y PGA de los pacientes incluidos en el estudio, siendo criterio de inclusión una afectación de la superficie corporal máxima del 30%.
La mayoría de los pacientes del estudio de Velasco et al. valoraron la aplicación de Cal/BD en espuma como "fácil" o "muy fácil", o bien como "práctico" o "sumamente práctico" para los ítems del dominio de comodidad. El 92% clasificó la aplicación del Cal/BD en espuma entre "fácil" y "sumamente fácil", el 94% lo hizo para la planificación del uso del tratamiento y el 90% para el seguimiento de la posología. En nuestro trabajo estos porcentajes resultaron también similares: 89%, 95% y 84%, respectivamente, poniéndose de manifiesto la comodidad del dispositivo, la forma farmacéutica y la posología.
Asimismo, en dicho trabajo la confianza global y el grado de satisfacción con el tratamiento obtuvo tasas de satisfacción elevadas. El 75% de los participantes manifestaron entre "mucha" y "confianza absoluta" en que el tratamiento con Cal/BD en espuma es efectivo para ellos. Resultados similares se obtuvieron con la confianza de que las ventajas del tratamiento superaban las desventajas, con el 75% de los pacientes entre "muy" y "totalmente" convencidos de este atributo. Por último, la satisfacción global con el tratamiento resultó en el 85% de pacientes considerados "satisfechos" o "sumamente satisfechos". Sin embargo, estos resultados fueron inferiores en nuestro estudio, siendo del 58%, 68% y 63%, respectivamente. Estos resultados son coherentes con los resultados del dominio de efectividad, que probablemente se relacionan con una mayor adherencia al tratamiento.
Como fortalezas del estudio, hemos de tener en cuenta que hasta el momento no existía referencia bibliográfica alguna en la que se evaluara la utilización de Cal/BD en espuma para el tratamiento de la psoriasis PP en términos no sólo de efectividad y seguridad en práctica clínica diaria, sino también en términos de percepción del paciente en relación al tratamiento, evaluada como cambios en la calidad de vida y en la satisfacción con el mismo. Esta completa evaluación nos permite poner de manifiesto las ventajas de la utilización de determinados tratamientos desde el punto de vista del paciente.
Sin embargo, como limitaciones del estudio, el hecho de realizar un análisis con un número reducido de pacientes, no nos permite discriminar si nuestros hallazgos son debidos a un factor aleatorio o al propio tratamiento farmacológico.
CONCLUSIÓN
La espuma de Cal/BD para administración tópica en pacientes con psoriasis palmo-plantar demuestra ser efectiva y segura, demostrando diferencias estadísticamente significativas en términos de resultados en salud, no pudiendo llegar a demostrarse que su utilización suponga una mejora de la calidad de vida del paciente, obteniendo un buen resultado en términos de satisfacción global con la medicación.















