INTRODUCCIÓN
El nuevo SARS-CoV-2, identificado por primera vez en Wuhan, China en diciembre 2019, es el agente causal de la enfermedad COVID-19, misma que ha causado un impacto en la salud pública global1. Este virus se ha identificado en los murciélagos y posiblemente fue trasmitido a humanos a través de un intermediario desconocido2. Los coronavirus se clasifican en cuatro géneros: α-coronavirus, β-coronavirus, γ-coronavirus y δ-coronavirus, de los cuales, sólo los dos primeros se han identificado en los seres humanos. El nuevo coronavirus SARS-CoV-2, pertenece al género β-coronavirus (subgénero Sarbecovirus, subfamilia Orthocoronavirinae), que está formado por una envoltura en forma de corona y una cadena de genoma no segmentado de ácido ribonucleico (ARN)3.
Actualmente, no existe un tratamiento para la enfermedad de COVID-19, pero se han realizado esfuerzos a nivel global, en conjunto de la Organización Mundial de la Salud (OMS), la cual tiene recomendaciones muy generales para el manejo de los signos y síntomas4. Así como lineamientos para la prevención, diagnóstico y seguimiento de esta pandemia. Uno de los medicamentos que se han utilizado como tratamiento del COVID-19 es lopinavir/ritonavir (Lpv/r), que es un inhibidor de la proteasa utilizado para tratar el virus de inmunodeficiencia humana (VIH)5. En un ensayo in vitro, en el que se usó lopinavir en conjunto con el inmunomodulador interferón beta-1b, se demostró que lopinavir actúa contra la proteasa viral 3CL, teniendo una modesta actividad antiviral contra SARS-CoV-2, si consideramos que el uso conjunto de lopinavir con ritonavir aumenta la biodisponibilidad del lopinavir, se asume que podría presentar un adecuado efecto para el síndrome respiratorio agudo (SARS)6.
El estudio clínico aleatorizado “LOTUS China” (Cao et al.), evaluó la eficacia y seguridad clínica del medicamento lopinavir/ritonavir en pacientes con infección de COVID-19 y neumonía asociada, demostrando que el perfil de seguridad del uso de lopinavir/ritonavir fue ligeramente menor (48,4%) comparado al tratamiento estándar (49,5%) en pacientes COVID-19, identificando los eventos adversos de mayor frecuencia: náuseas, vómito y diarrea7.
Los estudios de farmacovigilancia tienen el objetivo de evaluar el perfil riesgo-beneficio de los medicamentos para comunicar y evitar los riesgos en la población. Estos estudios buscan identificar reacciones adversas al medicamento en estudios clínicos, en post-comercialización; así como cuando son utilizados fuera de la indicación autorizada por el Ministerio de Salud que aprobó el registro sanitario correspondiente. Es importante resaltar que durante esta pandemia, medicamentos como lopinavir/ritonavir han sido utilizados en el esquema de uso compasivo, siendo relevante evaluar este balance riesgo-beneficio antes mencionado8,9.
MATERIALES Y MÉTODOS
Diseño del estudio
Estudio de farmacovigilancia en una cohorte retrospectiva en los pacientes sospechosos o confirmados por COVID-19 hospitalizados en el Instituto Nacional de Cardiología Ignacio Chávez de la Ciudad de México, México en el periodo 01 abril a 30 julio del 2020.
Selección de los pacientes
Los pacientes seleccionados (Figura 1) en el estudio de farmacovigilancia cumplieron con los criterios establecidos por la Secretaría de Salud de México para identificar a los pacientes con COVID-1913, a quienes se les administró el esquema farmacoterapéutico de dosis inicial de 2 tabletas de lopinavir/ritonavir 200mg/50mg y 1 tableta cada 12 horas por 6 días como mantenimiento, teniendo un tratamiento total de 7 días.
Identificación de las reacciones adversas al medicamento
Se evaluaron a los 140 pacientes sospechosos o confirmados de COVID-19, que se les administró el medicamento, por dos farmacéuticos clínicos, identificando las reacciones adversas a medicamentos con base a la clasificación del diccionario médico MedDRA versión 23.015; clasificándolas por órganos y sistemas (SOC).
Para evaluar la alteración o trastornos de enzimas hepáticas, utilizamos la guía de la FDA DILI14 (siglas en inglés, DrugInduced Liver Injury), que son aquellos medicamentos que inducen daño hepático y tomamos como referencia que niveles mayores de 3x límite superior normal como alteración clínicamente relevante y 5x límite superior normal como trastorno hepáticos 14 con base en los rangos del laboratorio clínico del Instituto Nacional de Cardiología, en el cual los valores para las enzimas AST fueron 13-39 u/L y ALT fueron 7-52 u/L.
Evaluación de la severidad, gravedad y causalidad de las reacciones adversas al medicamento
Para llevar a cabo la evaluación de la severidad y la gravedad, se utilizaron los criterios de la regulación vigente en farmacovigilancia en el territorio mexicano con la Norma Oficial Mexicana NOM220-SSA1-2016 “Instalación y operación de farmacovigilancia”16. Además, para evaluar la causalidad de las reacciones adversas al medicamento, se utilizó el algoritmo de la Organización Mundial de la Salud (OMS)17.
RESULTADOS
Los datos demográficos de los pacientes fueron los siguientes: la edad promedio de los pacientes sospechosos o confirmados de COVID-19 (Tabla 1), a los cuales se les administró el tratamiento lopinavir/ritonavir (Lpv/r) fue: 54,73 años, el sexo en los pacientes fue: 34,75% mujeres y 65,25% hombres. La media del peso es de: 78,63 kg, la estatura promedio fue: 1,64 m y el índice de masa corporal (IMC) 29,12. Las comorbilidades que se identificaron en los pacientes del estudio, son: hipertensión arterial sistémica (HAS) en 56 pacientes (de los cuales 57,1% son hombres y 42,9% son mujeres); diabetes mellitus tipo II en 46 pacientes (de los cuales 58,7% son hombres y 41,3% son mujeres) y se identificaron 3 pacientes con enfermedades autoinmunes (2 pacientes femeninos con lupus eritematoso sistémico (1,41%) y un paciente masculino con síndrome anti-fosfolípidos (0,70%)).
Tabla 1. Características demográficas de pacientes sospechosos o confirmados con COVID-19 con el tratamiento Lpv/r.

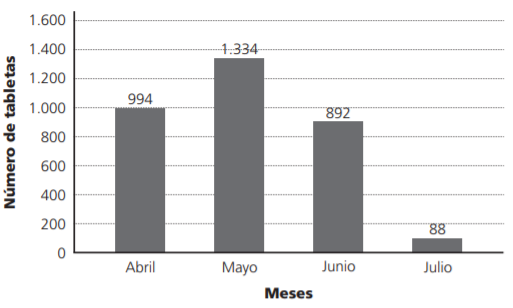
El consumo del medicamento lopinavir/ritonavir (Lpv/r) en los pacientes COVID-19 fueron 3, 308 tabletas (Figura 2), donde el comportamiento de consumo fue el siguiente: 30,0% en abril, 40,3% en mayo, 27,0% en junio y el resto en julio. Es importante mencionar que en el mes de julio se muestra un decremento en el consumo de Lpv/r y lo relacionamos a la modificación del criterio médico basado en la información publicada del estudio RECOVERY, que mencionaba que el tratamiento Lpv/r, no tiene beneficio en los pacientes infectados por COVID19. Después de conocer el consumo mensual del medicamento, se clasificó en dos grupos a los pacientes: quienes terminaron el tratamiento en ≥7 días y quienes no terminaron el tratamiento en <7 días. El número de pacientes que terminaron el tratamiento fue de 91 pacientes (65%); mientras que los pacientes que no terminaron el tratamiento fueron 50 pacientes (35%). Es importante señalar que las causas de la suspensión del tratamiento fueron evaluadas (Figura 3), siendo las más comunes: alta por mejoría y defunción, es relevante destacar que las defunciones no tienen una relación causal con el uso del medicamento Lpv/r, asociándolas a la enfermedad y posteriormente tenemos en orden descendente el inicio del rutoxolitinib, entre algunas otras de relevancia encontramos la interacción Lpv/r con atorvastatina, diarrea, aumento de enzimas hepáticas e interacción Lpv/r con tracolimus.

Figura 3. Causas de suspensión del tratamiento lopinavir-ritonavir en pacientes COVID-19, México, 2020.
De los 140 pacientes, se identificaron 8 reacciones adversa al medicamento (5%), una por paciente, de los cuales 5 reacciones adversas al medicamento se encuentran asociada con diarrea (3%) trastornos gastrointestinales y las otras 3 con hipertransaminasemia (2%) trastornos hepáticos (ver Figura 4).

Figura 4. Reacciones adversas al medicamento clasificado por órganos y sistemas (SOC). México, 2020.
Una vez identificadas las reacciones adversas al medicamento, se llevó a cabo la valoración de la severidad (Figura 5). De los pacientes que presentaron reacciones adversas al medicamento de trastornos gastrointestinales (diarrea): 2 son moderas y 3 son leves; mientras que las que causaron trastornos hepáticos (hipertransaminasemia): 2 severas y 1 moderada. De todas las reacciones adversas al medicamento identificadas, ninguna cumple con los criterios de gravedad en los pacientes tratados con Lpv/r.
Por último, se evaluó la causalidad de las reacciones adversas al medicamento, utilizando el algoritmo de la Organización Mundial de la Salud (OMS). Determinando que las 5 reacciones adversas al medicamento por diarrea, fueron posibles. Así mismo, se estableció que de los pacientes que presentaron hipertransenasemia las 3 presentaron causalidad posible, tomando en cuenta los criterios de la valoración clínica para determinar la relevancia de la reacción adversa.
DISCUSIÓN
En nuestro estudio de farmacovigilancia encontramos que las reacciones adversas a los medicamentos causadas por el esquema farmacoterapéutico Lpv/r en los pacientes sospechosos o confirmados de COVID-19 fueron: diarrea e hipertransenasemia, esto lo podemos comparar con el estudio de revisión sistemática que realizó el equipo de evaluación de riesgo-beneficio (BRAT) sobre el mismo medicamento, donde identificaron que las reacciones adversas de lopinavir/ritonavir por diarrea son comunes10. Además, en la información para prescribir de este medicamento, las reacciones adversas gastrointestinales como la diarrea, náuseas y vómito son consideradas también comunes11, habiendo una concordancia con nuestros 5 casos de diarrea. Además, observamos hipertransenasemia (ALT/AST) en 3 de los pacientes tratados con Lpv/r, ocasionando que dos pacientes requirieron la suspensión del tratamiento, porque se observó que en el día 3 de la administración del medicamento Lpv/r se presentó un incremento de 5 veces el límite superior normal de los niveles de las enzimas hepáticas en los estudios de laboratorio. A la suspensión se observó un decremento progresivo de las enzimas hepáticas en los pacientes, lo cual sugiere que el medicamento Lpv/r sí presenta una relación causal. Misma correlación fue observada en el estudio Lepage et al., que evaluó una serie de casos retrospectivos de 12 pacientes enfermos por COVID-19, de los cueles 5 pacientes presentaron un incremento de enzimas hepáticas con el mismo tratamiento12. Cabe resaltar que dos de estos pacientes que incrementaron enzimas hepáticas presentaron la interacción fármaco-fármaco de Lpv/r con atorvastatitna, la cual esta descrita que aumenta el riesgo de incremento de enzimas hepáticas18, con esta información se pudo reducir el riesgo de la interacción al identificar de forma temprana a los demás pacientes que tomaban atorvastatina evitando que se les indicara Lpv/r.
CONCLUSIONES
El perfil de seguridad del esquema farmacoterapéutico Lpv/r en los pacientes sospechosos o confirmados por COVID-19 deberá de ser monitoreado para identificar los trastornos gastrointestinales y transtornos hepáticos, lo cual no deberá de ser atribuible al COVID-19. Por lo tanto, se sugiere que se realice un seguimiento estrecho de los pacientes que se les administra Lpv/r identificando las interacciones y las reacciones adversas que presenten los pacientes y así identificar posibles señales de farmacovigilancia.