INTRODUCCIÓN
La leucemia mieloblástica aguda (LMA) es una forma de cáncer que se caracteriza por la infiltración de la médula ósea, la sangre y otros tejidos por células proliferativas, clonales, anormalmente diferenciadas y ocasionalmente poco diferenciadas del sistema hematopoyético. Es la leucemia aguda más frecuente del adulto, (80% de las leucemias agudas) con una mediana de edad al diagnóstico de 68 años. Según datos del programa de Vigilancia, Epidemiología y Resultados Finales (SEER) se estima una incidencia anual de 4,2 por cada 100.000 habitantes. El porcentaje de incidencia en menores de 20 años es 5,1% y en personas entre 65-84 años, es 46,5%1. La tasa de supervivencia a 5 años varía en función de la edad de los pacientes, siendo en menores de 20 del 67% y en mayores a dicha edad disminuye al 25%. Algunos factores que contribuyen a desarrollar LMA en el adulto: tabaquismo, exposición a radiación, el benceno, la anemia de Fanconi, el síndrome de Shwachman, y el síndrome de Down2. La principal clínica que caracteriza esta patología es la fiebre, cansancio, facilidad de hemorragias. Las alteraciones citogenéticas más frecuentes son: traslocación (8;21), inversión cromosoma 16, traslocación (16;16), trisomía del cromosoma 8 y deleciones en los cromosomas 5 y 7, mutación en el gen FLT3 (13q12), la cual está presente en el 30% de los nuevos diagnósticos. El tratamiento estándar de quimioterapia sigue basándose en el esquema intensivo de inducción 3+7 que consiste en citarabina 200 mg/m2 con antraciclinas (idarrubicina 1 mg/m2 o daunorrubicina 60 mg/m2), seguido de una consolidación con citarabina y trasplante de precursores hematopoyéticos (TPH) dependiendo del estado del paciente y del grupo de riesgo. El objetivo de las nuevas terapias en LMA es el tratamiento dirigido debido a los avances en el diagnóstico y la tipificación. Recientemente la Agencia Europea del Medicamento aprobó midostaurin para el tratamiento LMA con la mutación FTL3, fue evaluado en el ensayo RATIFY en combinación con quimioterapia (QT) mostró un aumento de la supervivencia global frente a QT más placebo3. A pesar de ello existe una clara necesidad de nuevos tratamientos, con terapias dirigidas frente a las nuevas dianas moleculares que mejoren los resultados ofrecidos por la quimioterapia.
DESCRIPCIÓN DEL CASO CLÍNICO
Paciente de 56 años, sin alergias medicamentosas conocidas, que acudió al servicio de Urgencias por presentar astenia, molestias bucales y anorexia. En analítica de control se objetiva leucocitosis (202,720 × 103/µL) y bicitopenia( plaquetas 51.2 x 103/µL y glóbulos rojos 1.9 x 106/µL). Se ingresó en la planta de hospitalización de Hematología para estudio de hemopatía aguda.
Se realizó una biopsia de médula ósea para completar su estudio e inició un tratamiento citoreductor (ciclofosfamida), cuyo objetivo es disminuir el recuento leucocitario hasta disponer de un diagnóstico claro y empezar un tratamiento específico. Se diagnosticó a la paciente de LMA con mutación FTL3.
Al paciente se le administró el esquema intensivo de quimioterapia de inducción de primera línea según PETHEMA (Programa Español de Tratamientos Hematológicos)6: citarabina 200 mg/m² (7 días) + daunorrubicina 60 mg/m² (3 días). El esquema 3+7 consigue respuestas completas en el 7080% de los pacientes, por lo que se mantiene como esquema estándar4. Además de esquema de QT se decidió combinar con midostaurin 50 mg/12h los días 8-21 del ciclo, debido a la mutación en el gen FTL3. Midostaurin inhibe la transducción de señales del receptor FLT3 e induce la detención del ciclo celular y la apoptosis en células leucémicas que expresan los receptores mutados FLT3.
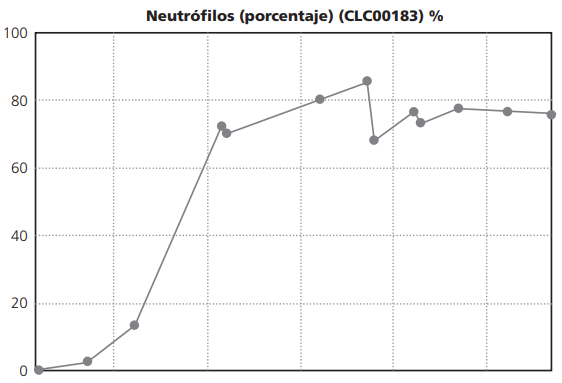
La paciente desarrolló pancitopenia severa debido a la proliferación de la serie blanca no madura. Con respecto a la alteración de la serie blanca, un aspecto muy importante a tener en cuenta es que se debe administrar antibioticoterapia de amplio espectro y antifúngicos en profilaxis de infecciones, y en este caso fue necesario factores de estimuladores de granuloctos como tratamiento de neutropenia febril Figura 1. Además de otras medidas como uricolíticos (rasburicasa), antieméticos, abundante hidratación para evitar síntomas asociados a la lisis tumoral según protocolo Programa Español Tratamiento Hematológico5.
La paciente hasta el momento estaba en tratamiento domiciliario con enalapril y alprazolam. Se evualuó las posibles interacciones mediante micromedex® y Uptodate interactions ®, se recomendó la sustitución del ansiolítico en el caso que lo necesitara por lorazepam por su posible interacción con antifúngicos.
La paciente toleró bien el tratamiento de inducción y mostró una recuperación en el recuento con <5% de blastos, considerando como respuesta completa. Posteriormente recibió la terapia de consolidación con citarabina 3 g/m2 en combinación midostaurin.
CONCLUSIÓN
El tratamiento combinado de midostaurin con los esquemas convencionales de quimioterapia de inducción y de consolidación ha demostrado ser eficaz, siendo una opción de tratamiento en pacientes entre 18-60 años de edad con LMA de nuevo diagnóstico que presenten mutación FLT3. Aunque existe todavía cierta incertidumbre en el subgrupo de pacientes mayores ya que el empleo de midostaurin en mayores de 60 años no ha sido estudiado. En aquellos pacientes con un estado general adecuado sin comorbilidades significativas y aptos para recibir quimioterapia el tratamiento con midostaurin podría valorarse de forma individualizada.
Aún son necesarios nuevos estudios para verificar la eficacia de midostaurin en el subgrupo de pacientes de edad superior a los 60 años, así como papel en el mantenimiento.