INTRODUCCIÓN
El cáncer de mama (CM) es una proliferación descontrolada de las células que integran los lóbulos y conductos mamarios. La metástasis está relacionada con la adhesión a los tejidos de dichas células cancerosas que se diseminan a través de la sangre y/o vasos linfáticos1.
El CM es el cáncer más frecuente entre las mujeres españolas, con una estimación para el año 2020 de alrededor de 33.000 nuevos casos. La determinación actual es que en torno al 12% de las mujeres españolas tendrán esta enfermedad en algún momento de su vida. La supervivencia para estas pacientes es del 81% a los 5 años, con un 6% de pacientes que se diagnostican en etapas avanzadas de la enfermedad1,2.
Aproximadamente, el 75% de los CM invasivos presenta receptores hormonales estrogénicos (RHE) y/o progestágenos (RHP) positivos. La presencia o ausencia de estos receptores, va a influir en la agresividad de la enfermedad, en cuanto a la evolución y el tiempo de recurrencia3.
La señalización a través de la vía quinasas dependiente de ciclinas 4/6-Retinoblastoma (CDK4/6) presenta un papel fundamental en la regulación del ciclo celular. La pérdida de regulación en esta vía es común en el CM, entre otras enfermedades4,5.
Palbociclib es un inhibidor selectivo de CDK4/6 disponibles para el CM metastásico o localmente avanzado (CMm), con RH positivos y receptor del factor de crecimiento epidérmico humano 2 (HER2) negativo, impidiendo la progresión de las células de la fase G1 a la fase S del ciclo célular6,7
Para evaluar la eficacia de palbociclib en mujeres con CMm o localmente avanzado, se dispone de dos ensayos clínicos de fase III, aleatorizados y doble ciego: PALOMA-2 y 3. El ensayo PALOMA-2 evaluó la eficacia y seguridad del tratamiento con palbociclib más letrozol frente a placebo más letrozol, en mujeres postmenopáusicas, que no habían recibido tratamiento previo para la enfermedad metastásica, obteniendo un beneficio en supervivencia libre de progresión (SLP) estadísticamente significativo a favor del brazo de palbociclib (HR 0,65 (IC95%; 0,51-0,84), p=0,001) y sin datos maduros de supervivencia global (SG). El ensayo PALOMA-3 evaluó la combinación de palbociclib más fulvestrant frente a placebo más fulvestrant, en mujeres pre/peri- y postmenopáusicas, tras progresión de la terapia hormonal en contexto adyuvante o metastásico, con un beneficio en SLP a favor de la combinación con palbociclib (HR 0,46 (IC95%; 0,36-0,59), p<0,0001) y sin mostrar beneficio estadísticamente significativo en SG frente al comparador (HR 0,81 (IC95%; 0,64-1,03), p=0,09)8,9,10,11.
El objetivo del presente estudio es evaluar la efectividad y seguridad del tratamiento con palbociclib para la primera línea en pacientes con CMm en estado postmenopáusicas, y para la segunda línea de pacientes con CMm en estado post-, pre- y perimenopáusicas.
MATERIALES Y MÉTODOS
Estudio descriptivo retrospectivo, donde se incluyó a todas las mujeres diagnosticadas de CMm, con RHE y RHP positivos y HER2 negativos, desde enero del 2017 hasta julio del 2020, en un hospital de segundo nivel.
Para iniciar tratamiento, las pacientes debían cumplir los criterios de uso según el Informe de Posicionamiento Terapéutico (IPT) de palbociclib, con primera publicación en enero de 2018 y posteriormente una actualización en 2019, donde se priorizaba el uso para los inhibidores de CDK4/6 tanto en primera como segunda línea metastásica.
Las pacientes recibieron 125 mg de palbociclib cada 24 horas durante 21 días, seguido de 7 días de descanso, junto a un antiestrógeno o un inhibidor del estrógeno sintasa.
Para recoger los datos de las pacientes, se empleó la historia clínica digital (Diraya®), el programa de dispensación de pacientes externos Dominion (Farmatools®), y el programa de prescripción de quimioterapia Farmis-Oncofarm®, siendo procesados mediante el programa Microsoft Access® 2019. Se registraron las siguientes características poblacionales y clínicas de las pacientes: edad, ECOG, estadios al inicio del diagnóstico, tipo de tumor mamario, RH, HER2 y ki67, estado menopáusico, localización de las metástasis, terapia adyuvante o neoadyuvante previa y tratamiento hormonal junto a palbociclib.
Las variables del estudio fueron la “supervivencia libre de progresión” (SLP) definida como el tiempo desde el inicio del tratamiento hasta la fecha de la primera documentación de progresión objetiva de la enfermedad o muerte debido a cualquier causa, y la “supervivencia global” (SG) definida como el tiempo desde la fecha de inicio del tratamiento hasta la fecha de fallecimiento, debido a cualquier causa, de la población global del estudio, y de las características poblacionales definidas en los estudios pivotales PALOMA-2 (primera línea endocrina en estadio metastásico para pacientes postmenopáusicas) y PALOMA-3 (segunda línea endocrina en estadio metastásico para pacientes post-, pre- y perimenopáusicas). Se empleó el programa SPSS Statistics® versión 26 para emplear el método de Kaplan-Meier. La seguridad fue valorada según el número de reacciones adversas (RAM), el grado de severidad según criterios de “Common Terminology Criteria for Adverse Events” (CTCAE) versión 5.0, el número de retrasos y el porcentaje de reducción de dosis asociados a RAM recogidas a partir de la historia clínica digital.
RESULTADOS
Características clínicas de las pacientes
Durante el periodo de estudio, se incluyeron un total de 60 pacientes. Las características basales se recogen en la tabla 1. La mediana de edad fue de 58,7 años, con un ECOG 0 en el 56,7% de las pacientes y un estadio IV al inicio del diagnóstico del 30%. Todas las pacientes expresaron RHE+ y HER2- y un 90% expresaron RHP+. Además, el 43,3% de las pacientes presentaban un valor del ki67 por encima del 30%. A nivel morfológico, el tipo de cáncer más frecuente diagnosticado fue el carcinoma ductal, y más de la mitad de las pacientes presentaban metástasis óseas al inicio del tratamiento con palbociclib. El porcentaje de pacientes pre/perimenopáusicas fue del 35%. Las dos terapias hormonales más frecuentemente utilizadas de manera concomitante junto a palbociclib fueron fulvestrant (51,6%) y letrozol (38,3%).
Efectividad de palbociclib
Ocurrieron un total de 21 eventos de progresión y 10 eventos de muerte para el global de las pacientes. La mediana de SLP fue de 34,14 meses (IC95%; NA-NA) y no se alcanzó el valor de la mediana para la SG (figura 1A y 1B respectivamente). Para las pacientes postmenopáusicas en primera línea endocrina la mediana de SLP fue de 21,18 meses (IC95%; NA-NA), sin alcanzarse la mediana en SG (figura 2A y 2B respectivamente). En pacientes en segunda línea endocrina, pre-/peri-/postmenopáusicas, la mediana de SLP fue de 17,79 meses (IC95%; 7,18-28,39) y no alcanzándose en SG (figura 3A y 3B respectivamente).
Eventos adversos
Hubo un total de 269 eventos adversos (EA) relacionados con el tratamiento (tabla 2). Los EA hematológicos más frecuentes (de cualquier grado) fueron la neutropenia y anemia en el 73,3% y 55% de las pacientes respectivamente. La neutropenia con grado 3-4 ocurrió en el 36,67% de las pacientes. Los eventos adversos no hematológicos más comunes (de cualquier grado) fueron alteraciones en los niveles enzimáticos (45%), astenia (30%), infecciones (13,3%) y mucositis (11,6%). Los eventos no hematológicos grado 3 fueron astenia y alteraciones en los niveles de GGT (6,67% de las pacientes).
Un total de 31 (51,6%) pacientes necesitaron discontinuaciones intermitentes del tratamiento como consecuencia de los EA. El EA más común que condujo el retraso del tratamiento fue la neutropenia (92,2% de los eventos) seguido de trombocitopenia (6,49% de los eventos) e infecciones (5,19% de los eventos). La terapia de soporte más empleada para paliar los EA fueron la eritropoyetina y factor estimulante de colonias granulocíticas.
DISCUSIÓN
Diversos estudios reafirman que la adición de inhibidores CDK4/6 junto a fulvestrant o inhibidores de la aromatasa, mejora significativamente la supervivencia de las pacientes con esta patología12,13,14.
En este estudio, se han seleccionado a las pacientes basándose en los criterios de selección del IPT, con intención de valorar la efectividad y perfil de seguridad de palbociclib en la práctica clínica respecto a los resultados obtenidos de los ensayos clínicos pivotales que dieron la indicación al tratamiento
Las pacientes del estudio, con un perfil similar al del ensayo PALOMA-3, tuvieron un mayor beneficio en SLP que los obtenidos en los resultados del ensayo clínico (17,9 meses vs 11,2 meses), sin embargo, esto no ocurrió con el subgrupo de pacientes semejantes al ensayo PALOMA-2 (21,18 meses vs 30,5 meses). No se pudo comparar los resultados de SG por falta de madurez en ninguna de las poblaciones estudiadas, ni en la población global8,11.
Otros estudios publicados en vida real, dan resultados heterogéneos con los obtenidos en nuestro estudio y en los EC. Tal es caso del estudio de Porte et al., donde se incluían pacientes similares a los de nuestro estudio, obteniendo una mediana en SLP para la población general de 21,3 meses, o en pacientes en segunda línea endocrina, como en el estudio de Dhakal et al., donde se obtiene un valor de mediana para la variable SLP de 2,9 meses15,16,17.
Tabla 1. Características demográficas y clínicas
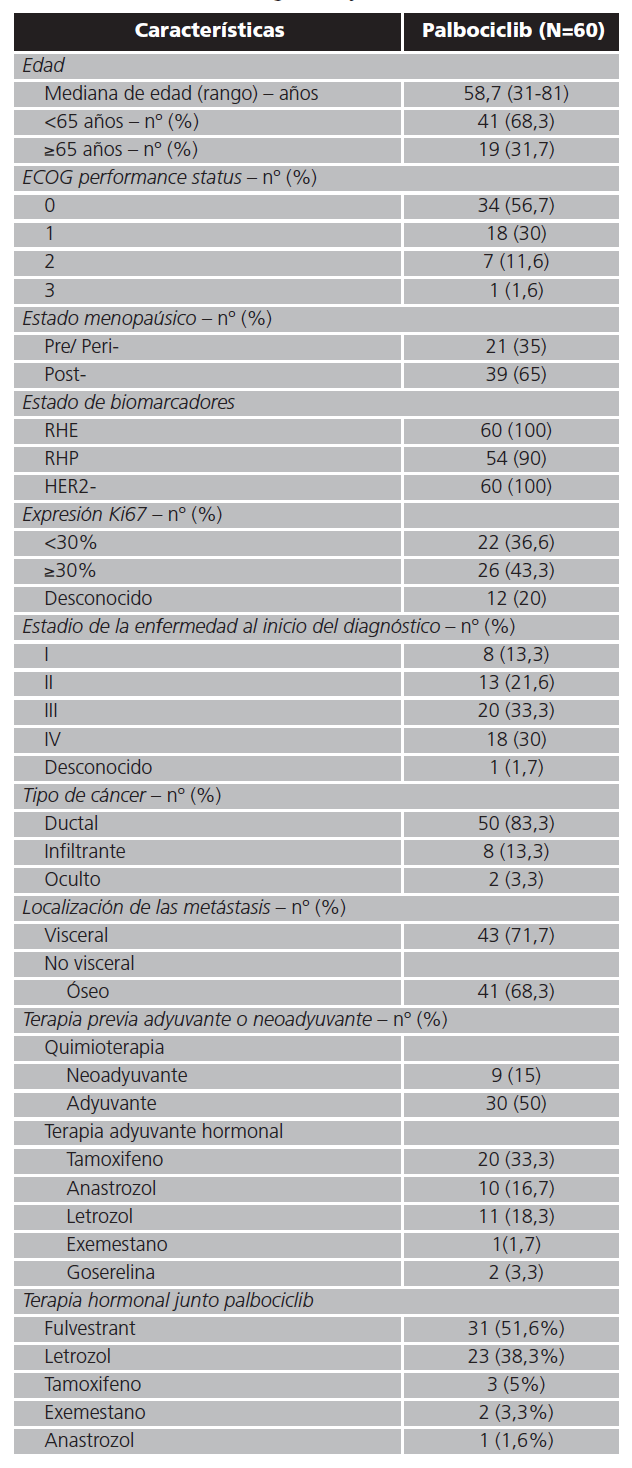
RHE: receptores hormonales de estrógenos; RHP: receptores hormonales de progesterona.
Tabla 2. Reacciones adversas relacionadas con palbociclib

GGT: gamma glutamil transpeptidasa; GOT: glutamato-oxalacetato transaminasa; GPT: glutamato-piruvato transaminasa; LDH: lactatodeshidrogenasa.
Con respecto al perfil de seguridad de palbociclib, más del 75% de las pacientes tuvieron neutropenia como efecto adverso más frecuente en los resultados de los ensayos, siendo también común en las pacientes de este estudio, pero con una incidencia menor (aproximadamente el 40%)8,9.
Las principales limitaciones del estudio son el diseño, la falta de tamaño muestral y el tiempo de observación. La ausencia de un comparador relevante nos impide valorar la magnitud del efecto con palbociclib en la práctica diaria. Además, la falta de madurez en SG al no alcanzar la mediana en ninguno de los tres escenarios, no nos permite comparar los resultados con los obtenidos en el ensayo PALOMA-3 (PALOMA-2 sin resultados maduros en SG). Por último, la falta de registro de los EA en la historia clínica digital, puede conllevar una infraestimación de los resultados en seguridad.
Sería interesante prolongar el seguimiento de nuestros pacientes para valorar futuros resultados en SG, añadiendo un comparador como ribociclib o abemaciclib con criterios de inclusión semejantes.
CONCLUSIÓN
Palbociclib, junto a un antiestrógeno o un inhibidor del estrógeno sintasa, supone una terapia efectiva en pacientes con CMm postmenopáusicas en primera línea endocrina y en pacientes post-, pre- y perimenopáusicas en segunda línea endocrina, consiguiendo obtener resultados relevantes en la supervivencia de los pacientes.
En cuanto al perfil de seguridad de palbociclib, la totalidad de los pacientes sufrieron de algún evento adverso, la mayoría de grado 1, sin embargo, un tercio de la población del estudio sufrieron neutropenia grado 3 como evento adverso más grave, siendo este el principal motivo de retraso del tratamiento y el empleo de terapia de soporte.

















