INTRODUCCIÓN
El indicador de calidad es un instrumento de medición cuantitativa que permiten evaluar la calidad de los procesos. Miden el nivel de cumplimiento de las especificaciones establecidas para una determinada actividad o proceso, sirviendo como guía para controlar y valorar la calidad de aspectos importantes de la práctica asistencial. Los indicadores pueden clasificarse en:
Indicadores de estructura: miden cómo está organizado y equipado el sistema de salud, observando si los recursos están disponibles y en condiciones para facilitar la atención al usuario. Evalúan aspectos relacionados con los recursos tecnológicos, humanos, financieros y materiales, necesarios para la práctica asistencial, así como la estructura organizativa.
Indicadores de proceso: analizan la manera en que se desarrolla la práctica asistencial, realizada con los recursos disponibles, protocolos y evidencia científica.
Indicadores de resultado: miden las consecuencias del proceso asistencial, en términos de mortalidad, complicaciones, calidad de vida, etc.1
Desde la introducción de los antibióticos, se ha comprobado cómo los microorganismos pierden, con el tiempo, su sensibilidad natural a estos agentes a través de la selección y transmisión de diversos mecanismos de resistencia2,3. Los factores relacionados con este fenómeno son múltiples y con frecuencia difícilmente individualizables, pero cabría destacar la transmisión horizontal así como la influencia de la exposición a los antimicrobianos4. La pérdida de sensibilidad a los antibióticos ha sido resuelta, hasta hace poco, mediante el desarrollo de nuevos antimicrobianos. Sin embargo, las escasas perspectivas de desarrollo de nuevos antimicrobianos durante la próxima década5,6, indican que este modelo no puede mantenerse.
En la práctica clínica, cada vez es más complicado acertar en la elección empírica de un antimicrobiano activo en pacientes con infecciones graves, lo que conduce a peores resultados clínicos. Se estima que en Europa fallecieron aproximadamente 25.000 personas en 2008 en relación con infecciones producidas por microorganismos resistentes, siendo esperable que este escenario empeore en los próximos años7. Según la OCDE se estima que en España morirán más de 78.000 personas a causa de la resistencia bacteriana de aquí al año 2050. La mayoría de estas muertes estarán provocadas por un uso excesivo e inadecuado de los antibióticos y tres cuartas partes de estos fallecimientos serían evitables. El documento de consenso8 elaborado por las Sociedades científicas GEIH-SEIMC (Grupo de estudio de infecciones hospitalarias de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica), SEFH (Sociedad Española de Farmacia Hospitalaria) y SEMPSPH (Sociedad Española de Medicina Preventiva, Salud Pública e Higiene) sobre los programas de optimización de antimicrobianos (PROA) en hospitales españoles, define como objetivos de estos programas: mejorar los resultados clínicos de los pacientes con infecciones, minimizar los efectos adversos asociados a la utilización de antimicrobianos, incluyendo aquí las resistencias, y garantizar la utilización de tratamientos costeeficaces. Las principales recomendaciones para lograr estos objetivos son la constitución de un equipo multidisciplinario experto en el correcto manejo de antibióticos, dependiente de la Comisión de Infecciones, contando con el apoyo institucional y debiendo incluir indicadores para la evaluación de sus resultados y su impacto.
Atendiendo a los objetivos de los PROA se han formulado indicadores de resultados clínicos como disminución de la incidencia de enfermedad por Clostridium difficile9, así como de la mortalidad y de la estancia hospitalaria en infecciones seleccionadas10. También se han propuesto indicadores de resultados ecológicos plasmados en la disminución de las tasas de resistencias bacterianas a los antibióticos10,11. Estos indicadores sin duda son necesarios, aunque difíciles de valorar, porque sus resultados son variables multifactoriales cuya vinculación con el uso adecuado de los antimicrobianos no es directa ni inmediata. Por otra parte, se han definido indicadores de proceso, por ejemplo para calibrar la calidad del uso de los antimicrobianos en los hospitales, se han empleado auditorías o encuestas de prevalencia12. Sin embargo, su utilidad está limitada por la elevada carga de trabajo que acarrean y por la falta de estandarización de la evaluación de la prescripción13,14.
La monitorización del consumo de antimicrobianos es una de las actividades descritas en los PROA8. Su función es detectar puntos susceptibles de acciones de mejora y evaluar el impacto de intervenciones a través de la comparación entre hospitales del mismo nivel y el análisis de series temporales en un mismo centro, así como servir de soporte para el estudio del impacto ecológico15,16. Sin embargo, los indicadores de consumo de antimicrobianos en el ámbito de la Atención especializada no estaban definidos, hasta que José María Gutiérrez-Urbón y cols.17 identificaron unos indicadores del uso de antimicrobianos en los hospitales mediante el análisis comparativo de los datos de consumo entre hospitales del mismo nivel por medio del juicio colectivo de un grupo de expertos. Estos indicadores por tanto, no van a tener un estándar establecido, sino que adquieren valor por la comparación con hospitales del mismo nivel o en su evolución temporal.
Se ha demostrado que la administración precoz de antimicrobianos con espectro adecuado influye en la evolución favorable de los pacientes críticos18, especialmente en sepsis. En los últimos años, se ha constatado también el aumento del desarrollo de resistencias bacterianas, siendo este problema más acuciante en los pacientes ingresados en la Unidad de Cuidados Intensivos (UCI)19, por lo que en estos pacientes, la elección del tratamiento antibiótico y su adaptación mediante el ajuste o desescalada a cada momento de la evolución, debe ser una práctica basada en el conocimiento profundo de las posibilidades terapéuticas de los antimicrobianos, así como de las peculiaridades farmacocinéticas que afectan a los pacientes críticos20. El objetivo de esta investigación es obtener los indicadores de consumo definidos por José María Gutiérrez-Urbón y cols.17 en una UCI donde aún no se ha implantado el PROA comparando los años 2018 y 2019.
OBJETIVO
Evaluación de indicadores del uso hospitalario de antimicrobianos basados en el consumo en la Unidad de Cuidados Intensivos sin implantación de PROA en un hospital de tercer nivel comparando temporalmente los años 2018 y 2019.
MÉTODO
Estudio retrospectivo en el que se calcularon los indicadores recomendados por un panel de expertos formado por miembros de la Sociedad Española de Farmacia Hospitalaria (SEFH) y de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) mediante un método Delphi modificado, correspondientes a los años 2018 y 2019 del Servicio de Medicina Intensiva de adultos en un hospital de tercer nivel. Estos indicadores se basan en el consumo de uso hospitalario de antimicrobianos utilizando datos agregados por Servicio, principio activo y forma farmacéutica, en este caso con temporalidad trimestral correspondiente a 2018 y 2019. Nuestro centro se trata de un hospital general de gestión pública con 1.066 camas y un área de influencia de 490.696 habitantes con una Unidad de Cuidados Intensivos de 30 camas. Los datos de consumo se obtuvieron del programa de gestión económica del Servicio de Farmacia, Farmatools®, así como las dosis diarias definidas (DDD) por cada 100 estancias (E), siguiendo las recomendaciones de la Organización Mundial de la Salud (OMS) sobre Estudios de Utilización de Medicamentos. La DDD es una unidad técnica de medida que corresponde a la dosis de mantenimiento en la principal indicación para una vía de administración determinada en adultos. Las DDD de los principios activos las establece la OMS y están publicadas en la web de WHO Collaborating Centre for Drug Statistics Methodology. Las estancias se obtuvieron del Servicio de Gestión Sanitaria. En la tabla 1 se describen los indicadores analizados, su definición y utilidad. El análisis estadístico se realizó con SPSS/PC (versión 24.0 para Windows, SPSS, Inc, Chicago, IL). La prueba de KolmogórovSmirnov se utilizó para evaluar la distribución normal de los indicadores evaluados. La prueba t-test de medidas pareadas se empleó como contraste de hipótesis para evaluar el cambio entre los resultados de los indicadores entre 2018 y 2019. Un valor de p≤0,05 se consideró significativo para la prueba de contraste de hipótesis.
RESULTADOS
En la tabla 2 se muestran los resultados obtenidos para cada indicador evaluado distribuidos trimestralmente, así como la diferencia entre las medias anuales y el valor de la significación estadística.
Cabe destacar como indicadores con resultados negativos, el aumento en el consumo global de antimicrobianos, incluyendo antifúngicos, el escaso consumo de metronidazol, consumo preferente de fluorquinolonas frente a macrólidos, y escasa realización de terapia secuencial. Este bajo ratio de metronidazol frente a otros podría justificarse por el perfil de nuestro centro, donde los pacientes postoperatorios ingresan preferentemente en la Unidad de Reanimación no en UCI. Sin embargo, aquellos indicadores que han presentado resultados positivos son: el consumo de fluconazol frente a equinocandinas, mayor consumo de amoxicilinaclavulánico frente a piperacilina-tazobactam, la disminución en el consumo de carbapenémicos y fluorquinolonas. Se puede observar como no se encontraron diferencias estadísticamente significativas entre las medias anuales de 2018 vs 2019 en el 85% de los indicadores evaluados, mostrándose diferencias estadísticamente significativas sólo en dos de los trece indicadores, correspondientes al consumo de fluorquinolonas, que logró reducirse en 2019 y el ratio fluconazol/equinocandinas que también mejoró significativamente en este último año.
DISCUSIÓN
Dado que estos indicadores han sido publicados recientemente17, no disponemos de publicaciones que expongan los resultados de todos los indicadores evaluados en nuestro estudio, ni a nivel general ni por Servicios, como es nuestro caso, por lo que de momento no es posible realizar comparaciones entre centros, sino comparaciones temporales. Sin embargo, alguno de estos indicadores, como el consumo global de antimicrobianos se han publicado en diferentes series, algunos correspondientes a hospitales de similares características al nuestro, pero donde se han implantado equipos PROA, como es el caso del Hospital La Fe (Valencia), donde se implantó el PROA en UCI en 2013, consiguiendo reducir el consumo total de antimicrobianos medido en DDD/100 estancias de 380,6 a 295,2 (-22,4%; p=0,019) tras un año de implantación, con una reducción en el gasto total en antimicrobianos de 119.636 €, siendo mayor el impacto sobre penicilinas + inhibidores de b-lactamasas, linezolid, cefalosporinas y aminoglucosidos. El consumo de meropenem, quinolonas y antifungicos tambien se redujo considerablemente, aunque no se alcanzo diferencias significativas entre ambos periodos. Por el contrario, indicadores ecológicos o clínicos como el número de aislamientos de especies multirresistentes e infecciones nosocomiales por cada 100 pacientes/dia, la estancia hospitalaria o mortalidad en UCI tras el período de intervención no mostraron diferencias significativas21. Si comparamos nuestros resultados, cabe destacar que a pesar de no disponer de equipos PROA partimos de unos datos de consumo global de antibióticos de un 47% por debajo de la cifra de partida de este estudio e incluso, un 32% de la cifra obtenida postintervención. Esto posiblemente está relacionado con el período temporal evaluado que difiere al del estudio, donde probablemente existan diferencias en la comercialización de genéricos y nuevos antibióticos además de la propia preocupación por la Administración Sanitaria y, en consecuencia, entre los prescriptores, en mejorar el uso de antimicrobianos ante campañas del Plan Nacional frente a las Resistencias a Antibióticos (PRAN)22, cuya primera estrategia para reducir las resistencias a antibióticos data de 2014, así como recomendaciones publicadas en 201723 por el grupo de trabajo de enfermedades infecciosas y sepsis de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) donde se define que deben establecerse liderazgos en el control de la infección y en la optimización en el empleo de antimicrobianos, de manera que se dispongan de profesionales líderes en este ámbito en coordinación con otras especialidades Un ejemplo de ello, es el I Curso de Optimización de antimicrobianos en pacientes críticos dirigido tanto a farmacéuticos hospitalarios como a médicos intensivistas, organizado por el grupo de trabajo de enfermedades infecciosas y sepsis de la SEMICYUC en colaboración con la SEFH.
Tabla 2. Indicadores distribuidos trimestralmente (Tr). Diferencia temporal entre 2018 y 2019
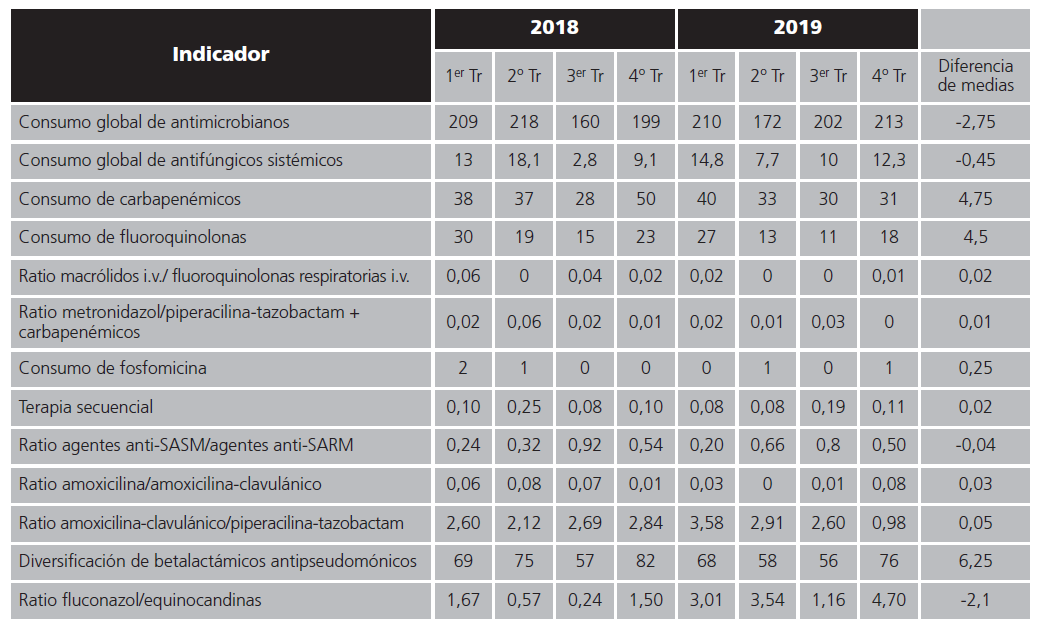
Media comparadas con la prueba t-Student para muestras independientes.
Un metanálisis publicado por Karanika y cols.11 que finalmente incluyó 26 estudios para evaluar los resultados tras la implantación de PROA incluyendo períodos de evaluación entre los seis meses y los tres años, mostró resultados significativos en la reducción en el consumo y costes de antimicrobianos, siendo mayor el beneficio en el entorno de cuidados críticos con una reducción del 39,5% siendo la diferencia con cuidados no críticos del 27%, siendo esta diferencia estadísticamente significativa. También mejoraron indicadores clínicos como la reducción de infecciones debidas a patógenos resistentes así como la estancia hospitalaria, sin embargo, no mostraron diferencias en cuanto a la tasa de infecciones o de mortalidad, por lo que sus autores concluyen que futuros estudios deberían centrarse en la evaluación a largo plazo de estos indicadores clínicos, coincidiendo con lo establecido en el documento consenso8 y en la publicación de José María Gutiérrez-Urbón y cols.17. Este metanálisis refuerza la necesidad de implantar equipos PROA en las UCI.
Otros estudios24 evaluaron el uso de antimicrobianos expresados no como DDD/100E sino como DDD por 1.000 días de paciente y días de terapia (DOT) por 100 días de cama ocupados en una unidad de cuidados intensivos de un hospital general antes y después de la implementación de PROA (2007 a 2010 vs 2011 a 2015). Sus resultados mostraron que el porcentaje de pacientes tratados con uno o más antimicrobianos disminuyó del 88,6 al 77,2% (p<0,001). Los DDD disminuyeron de 246,8 a 192,3 (diferencia de medias, -54,5; p=0,001) y DOT de 66,7 a 54,6 (diferencia de medias, -12,1; p=0,066). Los costes promedio por trimestre disminuyó de 115.543€ a 73.477€ (diferencia media, -42.065,4€; p<0,001), lo que supuso un ahorro superior a 800.000€ en el período de estudio. Debido a la diferencia en los parámetros evaluados, no es posible hacer comparaciones con los resultados de nuestros indicadores.
Por tanto, podemos concluir que existe heterogenicidad en la forma de evaluar resultados, radicando en este punto la complejidad para realizar comparaciones objetivas entre centros. A la vista de los resultados encontrados en nuestro estudio, existe un margen de mejoría para el resto de indicadores evaluados. Por ello, consideramos que es útil y necesario que estos indicadores basados en el consumo de antimicrobianos a nivel hospitalario, se utilicen como referencia en la evaluación de resultados en el uso de antibióticos, teniendo en cuenta sus posibles limitaciones por las características intrínsecas de cada centro. La incorporación de equipos PROA incluyendo entre otros profesionales sanitarios, un farmacéutico hospitalario dentro de las UCI, podría facilitar la detección de puntos críticos y medidas correctoras que permitan una mejoría en resultados clínicos, ecológicos y económicos.















