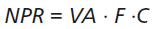INTRODUCCIÓN
El suministro de medicamentos a Hospitales es crítico para la Salud Pública1, y acontecimientos recientes han evidenciado la necesidad de herramientas que permitan mantener el servicio2. La elaboración, en la Farmacia Hospitalaria (SFH), de fórmulas magistrales, en respuesta a una prescripción médica, y preparados oficinales, tipificados en formularios, es una de dichas herramientas que, con cierto nivel de riesgo, es una buena alternativa para mantener el suministro, especialmente en situaciones de desabastecimiento3-6.
En España, la actividad elaboradora está contemplada en el RD175/20017. Sin embargo, la Guía de Buenas Prácticas de Preparación de Medicamentos en Centros de Salud publicada por el Esquema de Cooperación para la Inspección Farmacéutica (PIC/S) va un poco más lejos contemplando la elaboración de productos para stock, que se mantienen en el almacén del SFH hasta su dispensación a los servicios médicos8. En este contexto, la guía incide en la importancia de su control de calidad, fisicoquímico y microbiológico, para evitar cualquier efecto negativo a raíz de un fallo en la elaboración.
Aunque esta guía no explicita la necesidad de validar los métodos para el control de calidad, la validación es necesaria para asegurar la capacidad de éstos para controlar la calidad de las formulaciones9. Puesto que la prioridad de un SFH elaborador es proporcionar un servicio rápido, efectivo y seguro a los pacientes, los esfuerzos que se pueden dedicar a la validación de métodos de control de calidad son limitados. Recientemente, este grupo de investigación ha publicado un método teórico para establecer prioridades de validación de métodos de control de calidad10. Siguiendo esta línea, los objetivos de este trabajo son: a) poner a prueba el método teórico descrito con 65 formulaciones y, b) optimizar dicho método para que resulte de mayor utilidad a los SFH.
MÉTODOS
En este trabajo se han analizado 65 formulaciones elaboradas en la sección de Farmacotecnia de la Clínica Universidad de Navarra. De éstas, 22 son parenterales de pequeño volumen; 7 son colirios, 10 son semisólidos tópicos; 14 líquidos tópicos; 7 soluciones orales; y 5 son formas sólidas orales.
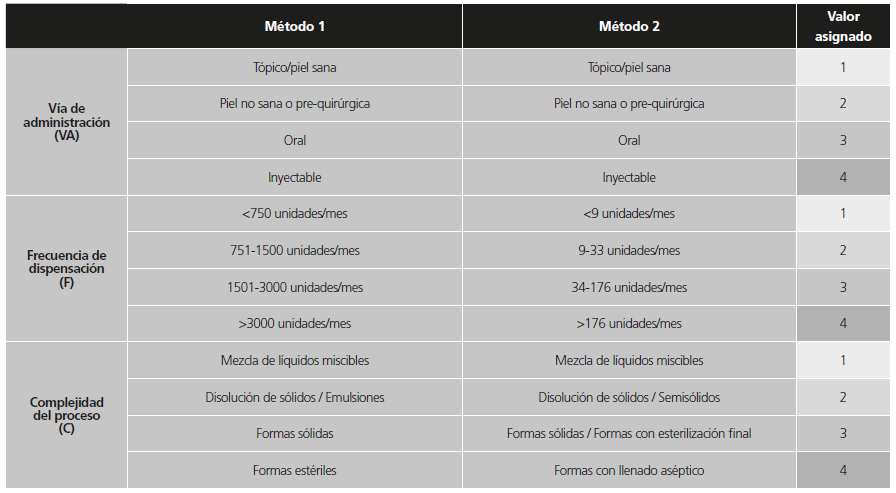
En la Tabla 1 se muestran las particularidades del Método 1 (M1) y las modificaciones realizadas para dar lugar al Método 2 (M2). En ambos métodos, se evalúan 3 parámetros diferentes en cada fórmula elaborada: vía de administración (VA), frecuencia de dispensación (F) y complejidad del proceso de elaboración (C); asignándoles 4 niveles de gravedad a cada uno. Cada nivel de gravedad de estos parámetros tiene una gradación del 1 al 4, siendo el de mayor peligro el 4 y el menor el 1. Los grados obtenidos para cada uno de los parámetros se multiplican obteniendo un Número de Prioridad de Riesgo (NPR) (Ecuación 1).
Este cálculo tiene hasta 64 combinaciones posibles que dan como resultado 16 niveles de prioridad diferentes.
La vía de administración (VA): influye en la inmediatez con la que el paciente sufriría el daño y en el tiempo de reacción tras la administración. Representa el impacto que un defecto de calidad podría tener sobre el paciente si el medicamento le fuese administrado. Este parámetro es igual en ambos métodos. Los cuatro niveles son 1) tópico/piel sana; 2) tópico/piel no sana o pre-quirúrgica; 3) oral; y 4) inyectable.
La frecuencia de dispensación (F) en unidades por mes (ud/mes): un fallo en un medicamento del que se dispensen más unidades por mes llega, con mayor probabilidad, a más pacientes que uno que se dispense en reducidas ocasiones. Considera la posibilidad, por frecuencia, de que un medicamento defectuoso sea administrado a un paciente, independientemente de la gravedad del defecto y sus posibles consecuencias. Para asignar la F de M1 se ordenan las unidades dispensadas por mes de todos los productos en orden creciente y se escogen los límites de cada nivel de gravedad atendiendo a las frecuencias absolutas, es decir, sin prestar atención a su significancia estadística; no se presta atención a la desviación entre las frecuencias más altas y las más bajas. Para M2, sin embargo, se hace un pretratamiento de los datos a analizar para calcular los cuartiles de las frecuencias y se emplean éstos como límites de cada nivel.
La complejidad del proceso de elaboración (C): una mayor complejidad del proceso de elaboración aumenta la posibilidad de que se produzca un error que genere un fallo de calidad. Expresa la posibilidad de que acontezca un fallo de calidad durante la elaboración del producto. Este parámetro también presenta diferencias en ambos métodos porque se tiene en cuenta la forma farmacéutica de cada preparado. En M1, todas las fórmulas estériles están en el nivel 4 de gravedad; pero en M2 se diferencia entre los medicamentos expuestos a una esterilización final en envase cerrado (nivel 3) y las elaboradas mediante un procedimiento de llenado aséptico (sin esterilización final en envase cerrado), lo que implica mayor riesgo de contaminación, se mantienen en el nivel de gravedad 4. A pesar de que sólidos y estériles expuestos a esterilización final en envase cerrado son formas farmacéuticas totalmente diferentes, el nivel de complejidad ese considera similar.
RESULTADOS
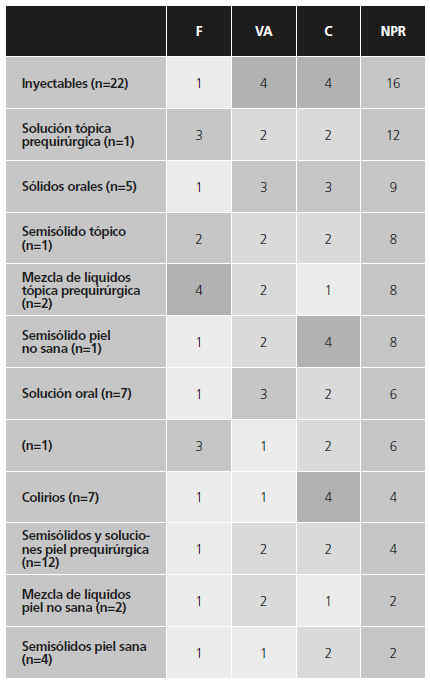
La aplicación de M1 a los medicamentos elaborados en la Unidad de Farmacotecnia segrega las formulaciones en 7 grupos según el NPR obtenido para cada uno de ellos: 2, 4, 6, 8, 9, 12 y 16 (Tabla 2). Además del reducido número de grupos que se obtienen, el 33,85% de las formulaciones quedan dentro del primer grupo de mayor prioridad (NPR = 16).
Al estudiar de forma separada los datos empleados, se observa, en primer lugar, que en la frecuencia de dispensación de las 65 fórmulas analizadas, 60 (un 92,31%) están en el primer nivel de gravedad, quedando 5 fórmulas distribuidas en los otros 3 niveles. Por lo que refiere a la complejidad del proceso de elaboración, el nivel 2 y 4 de gravedad contienen, en conjunto, el 86,15% de las fórmulas evaluadas. En cuanto a la vía de administración, es un parámetro capaz de separar los medicamentos analizados en los cuatro niveles con el 18,46%, el 29,23%, el 18,46% y el 33,85% de ellos en cada nivel.
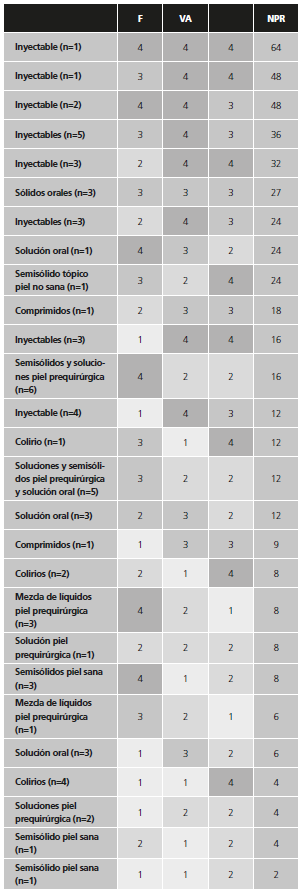
En M2, los resultados obtenidos tras el análisis de las fórmulas dieron lugar a 14 grupos, de los 16 posibles, con valores de NPR de 2, 4, 6, 8, 9, 12, 16, 18, 24, 27, 32, 36, 48 y 64 (Tabla 3). En los 3 grupos de mayor prioridad se encontraron 1, 3 y 5 fórmulas, respectivamente.
La gradación de la frecuencia de dispensación por cuartiles dio lugar a que en cada uno de los 4 niveles se encuentren, aproximadamente, el 25% de las fórmulas, generando una segmentación de las fórmulas más uniforme. La complejidad del proceso de elaboración, en M2, distribuye las fórmulas estériles en los niveles de gravedad 3 y 4. De este modo, aunque el nivel 2 sigue conteniendo un elevado porcentaje de las fórmulas, el 40,00%, los niveles 3 y 4 separan grupos del 29,23% y 24,62%, respectivamente.
DISCUSIÓN
Dado que un fallo en la calidad puede tener efectos negativos directos en los pacientes, estos métodos son herramientas para la toma de decisiones basada en riesgos12 partiendo de una modificación del análisis de modos de fallo definido por AENOR13.
Los dos métodos empleados son más simples que otras herramientas, como la que propone la Joint Commission en que los parámetros que se evalúan son severidad, ocurrencia y detección de los riesgos, asignadoles 10 niveles de gravedad en lugar de 4. Los parámetros evaluados en cada formulación, en M1 y M2, (vía de administración, frecuencia de dispensación y complejidad del proceso) también son una modificación de los que, generalmente, se emplean para el cálculo del NPR14,15. Esto se debe a que en esta evaluación, el foco del riesgo a evaluar recae, directamente, sobre el daño que puede sufrir el paciente. Por el contrario, los métodos empleados en este trabajo prestan más atención al proceso de elaboración y a las características galénicas de cada fórmula.
La evaluación de la vía de administración, igual en ambos métodos, es capaz de segregar los medicamentos de forma representativa. Además, es un parámetro relativamente limitado debido a que las instalaciones y capacidades de un SFH no permiten la elaboración de fórmulas complejas como aerosoles. Este parámetro, por tanto, se demuestra eficaz en la segregación de las fórmulas.
Respecto a la frecuencia de dispensación, la actividad elaboradora implica una gran dispersión; tanto es así que, en el caso de las fórmulas analizadas, la media aritmética de unidades dispensadas por mes de las 65 fórmulas fue de 279 y su desviación estándar 746,20, lo que indica una elevada dispersión en las frecuencias de dispensación. Los resultados obtenidos corroboran esto, pues el análisis mediante M1 agrupa más del 90% de las fórmulas en el primer nivel de gravedad. Por eso, a pesar de que el tratamiento estadístico para separar por cuartiles puede enmascarar tendencias, e implica una mayor complejidad en el uso de M2, se demuestra necesario para que este parámetro presente valor en cuanto a la determinación del NPR.
En cuanto a la complejidad de proceso de elaboración, cabe destacar que, aunque un defecto relacionado con la esterilidad de un medicamento implique el mismo grado de riesgo para el paciente, no es lo mismo la ejecución de una esterilización final que la necesidad de realizar una elaboración por llenado aséptico. Por este motivo, M2, además de ser más efectivo a la hora de segregar las fórmulas por la complejidad de su elaboración, también refleja mejor los procesos elaboradores, considerando sus riesgos concretos.
En las tablas 2 y 3 se puede ver claramente que, mientras M1 acumula los 22 parenterales de pequeño volumen en el grupo de mayor prioridad (NPR=16), M2 es capaz de separarlos en 7 grupos de prioridad diferentes (NPR= 64, 48, 36, 32, 24, 16, 12). Además, usando el M2, a pesar de que la mayoría de los inyectables ocupan los grupos más prioritarios, hay fórmulas con NPR altos dada su frecuencia de administración y su complejidad.
Además de los 3 parámetros numéricos para calcular el NPR, se emplean 2 parámetros cualitativos para escoger entre fórmulas con el mismo nivel de prioridad:
Si los medicamentos se controlan mediante técnicas diferentes, podrán realizarse validaciones de forma simultánea. De este modo, no es necesaria la priorización entre productos con el mismo NPR.
Si se emplease la misma técnica analítica esto no permitiría la validación simultánea de métodos para medicamentos con el mismo NPR. Entonces se priorizará la validación del método para el control de calidad del medicamento que antes se vaya a elaborar. Así se conseguirá aumentar los niveles de calidad del servicio que se va a dar con mayor premura.
CONCLUSIONES
En definitiva, M1 se presenta como un método más sencillo que los recomendados por instituciones como la Joint Commission, pero no consigue segregar los medicamentos analizados de una forma que permita la priorización de métodos de control de calidad a validar. Las modificaciones aplicadas hacen que M2 tenga mayor capacidad de separar las diferentes fórmulas consigue que el NPR permita una priorización más optimizada. Así, aunque éste sea ligeramente más complejo que el M1, se considera que su uso facilita el cumplimiento de los objetivos propuestos.