INTRODUCCIÓN
Según la Agencia Europea del Medicamento (EMA), los medicamentos biosimilares son medicamentos biológicos que contienen una versión del principio activo de un producto biológico original ya autorizado (denominado medicamento de referencia) una vez haya finalizado su periodo de exclusividad en el mercado, y tras haber demostrado similaridad con el producto de referencia1.
Los biosimilares están elaborados en organismos vivos, por lo que pueden presentar algunas pequeñas diferencias con respecto al medicamento de referencia. Estas pequeñas diferencias no son clínicamente significativas, es decir, no se esperan diferencias en cuanto a la seguridad y a la eficacia. La variabilidad natural es inherente a todos los medicamentos biológicos y siempre se aplican controles estrictos para garantizar que no afecta al funcionamiento del medicamento ni a su seguridad2.
La autorización de los biosimilares sigue un riguroso proceso normativo, ya que, está sujeta a las mismas normas de calidad farmacéutica, seguridad y eficacia que se aplican a todos los demás medicamentos biológicos aprobados en la Unión Europea2.
El objetivo del desarrollo de biosimilares es demostrar la biosimilitud: alto grado de similitud en términos de estructura, actividad biológica y eficacia, seguridad y perfil de inmunogenicidad2.
La EMA ha desarrollado una serie de directrices científicas para medicamentos biosimilares que establecen los principios básicos requeridos para demostrar comparabilidad entre dos medicamentos biológicos, proporcionando así un proceso normativo sólido que sirve a la industria farmacéutica de guía a la hora de solicitar la autorización de comercialización de un medicamento biosimilar. Estas guías son revisadas de forma regular de manera que se puedan ir incorporando los distintos avances científicos y tecnológicos3.
En Estados Unidos, la Food and Drug Administration (FDA) también desarrolló y publicó una guía con el objetivo de que sirviera de base a la industria farmacéutica de cara a la presentación de solicitud de comercialización de medicamentos biosimilares. La guía ofrece una visión general del enfoque de la FDA para determinar la biosimilaridad4.
La Organización Mundial de la Salud (OMS) ha elaborado sus propias directrices sobre la regulación de los biosimilares y los anticuerpos monoclonales con el objetivo de orientar a las agencias reguladoras de todo el mundo. Estas directrices de la OMS incorporan muchos de los principios científicos utilizados por la EMA5.
Según la EMA, la intercambiabilidad hace referencia a la posibilidad de intercambiar un medicamento por otro que se espera que tenga el mismo efecto clínico. Esto podría significar cambiar un medicamento biológico original por un biosimilar (o viceversa) o bien un biosimilar por otro. La intercambiabilidad puede realizarse mediante un cambio (switch) cuando es el prescriptor el que decide cambiar un medicamento por otro con el mismo fin terapéutico, o mediante una sustitución (automática), cuando el farmacéutico dispensa un medicamento en lugar de otro equivalente e intercambiable sin necesidad de consultar con el prescriptor1.
La EMA no emite recomendaciones sobre la intercambiabilidad del biosimilar con su medicamento de referencia o entre biosimilares. Dichas decisiones se deben tomar por las agencias nacionales correspondientes de cada estado miembro.
En España, según la Orden Ministerial SCO/2874/2007, por la que se establecen los medicamentos que constituyen excepción a la posible sustitución por el farmacéutico, no se permite la sustitución automática de un medicamento biológico por otro6.
La Sociedad Española de Farmacia Hospitalaria (SEFH) ha publicado su posicionamiento a favor de una intercambiabilidad consensuada y bajo la supervisión del médico prescriptor. Según se recoge en el documento de posicionamiento de la SEFH sobre los medicamentos biosimilares: “cada Comisión de Farmacia y Terapéutica (CFyT) establece si se puede intercambiar un biosimilar y los criterios a aplicar mediante el consenso de todas las partes interesadas (médicos, farmacéuticos hospitalarios, farmacéuticos de atención primaria, gestores sanitarios y pacientes). Se permite el intercambio en el hospital si ha sido aprobado por las CFyT de los hospitales, los comités autonómicos y el médico, que tiene representación en estos comités”7.
Las CFyT tienen entre sus funciones posicionar los medicamentos (incluidos biosimilares) dentro del arsenal farmacoterapéutico del hospital y establecer las medidas adecuadas para garantizar la trazabilidad y la notificación de reacciones adversas8.
Actualmente hay comercializados en Europa distintos tipos de medicamentos biosimilares, indicados en el tratamiento y prevención de distintas enfermedades y situaciones clínicas, y que incluyen proteínas como factores de crecimiento, hormonas, proteínas de fusión y anticuerpos monoclonales, así como polisacáridos como las heparinas de bajo peso molecular9.
A fecha de marzo de 2021, encontramos en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) 54 medicamentos biosimilares comercializados, correspondientes a 16 principios activos10.
Adalimumab es un anticuerpo monoclonal que se une específicamente al TNF (factor de necrosis tumoral) y neutraliza su función biológica.
La EMA autorizó la extrapolación de indicaciones del medicamento original al biosimilar. Ambos presentan estas indicaciones en ficha técnica para varias patologías: reumáticas (artritis reumatoide, artritis idiopática juvenil, espondiloartritis axial, artritis psoriásica), digestivas (enfermedad de Crohn, enfermedad de Crohn pediátrica, colitis ulcerosa), dermatológicas (psoriasis, psoriasis en placas pediátrica, hidradenitis supurativa) y oftálmicas (uveítis y uveítis pediátrica)11.
Se estima que actualmente los medicamentos biológicos representan el 27% del valor de las ventas totales de fármacos en Europa, en gran medida gracias a los anticuerpos monoclonales12. En España, los biológicos supusieron en 2011 un gasto total de 2.800 millones de euros, lo que representó el 30% del gasto global en medicamentos del Sistema Nacional de Salud (SNS), y el 46% del gasto hospitalario en fármacos13.
Los biológicos son sustancias que aportan nuevas opciones de tratamiento, pero que su coste es un reto para la sostenibilidad de los sistemas sanitarios. En este contexto, los biosimilares pueden jugar un papel importante contribuyendo a mejorar la eficiencia14.
Debido al aumento del uso y al gran impacto económico que suponen los medicamentos biológicos, el presente estudio tiene como objetivo principal determinar el ahorro derivado del intercambio del medicamento biológico adalimumab por su biosimilar.
MATERIAL Y MÉTODOS
Estudio descriptivo, observacional, longitudinal, retrospectivo y unicéntrico realizado en un hospital de tercer nivel que incluye pacientes a los que se les realizó el cambio de tratamiento de adalimumab original por su biosimilar desde enero de 2019 a febrero de 2021.
Este cambio fue autorizado por la Comisión Asesora Técnica para el uso racional de los medicamentos del Área de salud de la comunidad autónoma con la participación del servicio de farmacia aportando la información necesaria a los médicos prescriptores en cuanto a la similaridad e intercambiabilidad de los medicamentos biosimilares.
Los recursos empleados fueron, por un lado, el programa de prescripción y validación de medicamentos Athos Prisma APD® mediante el cual se registran las dispensaciones de medicación a pacientes externos que se empleó para obtener las dispensaciones de ambos medicamentos y determinar la fecha de las mismas. Y, por otro lado, se empleó el programa Athos Stock APD® para obtener el listado de consumo de estos medicamentos y el gasto asociado en las fechas correspondientes.
El análisis estadístico se realizó empleando el programa Microsoft Excel®. Las variables cuantitativas se analizaron mediante la media y la desviación estándar y las variables cualitativas se estudiaron mediante frecuencias y porcentajes.
RESULTADOS
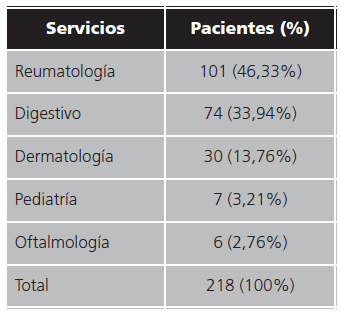
El número total de pacientes que realizaron el switch de Humira® a Hyrimoz® desde enero de 2019 a febrero de 2021 fue de 218.
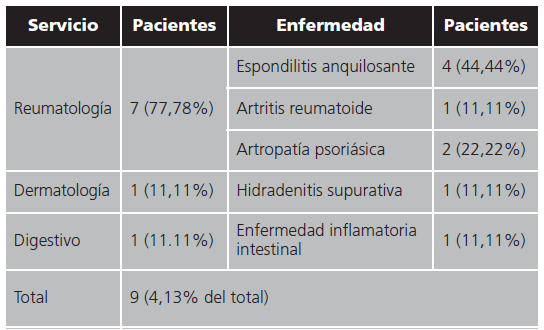
Los servicios que están a cargo de estos 218 pacientes son: Reumatología, Digestivo, Dermatología, Pediatría y Oftalmología. Los datos se exponen en la tabla 1.
Tabla 1. Porcentaje de pacientes que realizan switch de adalimumab por su biosimilar agrupados por servicios.
La enfermedad más prevalente de los pacientes en tratamiento con adalimumab fue la enfermedad inflamatoria intestinal con 79 pacientes (36,24%). Los pacientes con artritis reumatoide eran 49 (22,48%), a continuación, se encontraban los pacientes con psoriasis, que eran 28 (12,84%) seguidos por los 27 pacientes con espondilitis anquilosante (12,39%). Veintitrés pacientes presentaban artropatía psoriásica (10,55%), tres pacientes padecían uveítis (1,38%), dos pacientes pediátricos presentaban artritis idiopática juvenil (0,92%); dos, hidradenitis supurativa (0,92%) y a los cinco pacientes restantes se les autorizó el medicamento adalimumab fuera de indicación: tres de ellos padecían enfermedad de Behcet (1,38%); uno, síndrome de Vogt Koyanagi Harada (VKH) y otro, enfermedad de Moreen (0,05%)
De estos 218 pacientes en los que se realizó el switch al medicamento biosimilar, nueve pacientes han tenido que volver al tratamiento con el medicamento original (4,13%). De estos nueve pacientes, uno está a cargo de Dermatología (11,11%), otro a cargo del servicio de Digestivo (11,11%) y los otros siete están a cargo de Reumatología (77,78%). Los resultados se exponen en la tabla 2.
Las causas que motivaron el cambio fueron: reducción de la eficacia en cinco de ellos (55,56%), reacción de hipersensibilidad en tres (33,33%) y en uno de ellos mala tolerancia (11,11%).
En los cinco en los que se redujo la eficacia, cuatro de ellos estaban a cargo de Reumatología. Uno de ellos presentaba diagnóstico de espondilitis anquilosante y el cambio de nuevo al original se produjo a los tres meses de estar con el biosimilar. En otra paciente con artropatía psoriásica con una pauta trisemanal de adalimumab, el cambio tuvo lugar tras tres dosis del biosimilar. Según el informe médico: reaparición de psoriasis cutánea (estando en remisión con adalimumab original) y a nivel articular, dolor en mano derecha y hombro derecho. En otra de las pacientes cuya indicación de adalimumab era espondilitis anquilosante, el cambio al medicamento original se produjo por presentar brote de psoriasis que relacionaron con el inicio de adalimumab biosimilar. Otro paciente con espondilitis anquilosante, con una pauta de adalimumab cada 28 días al cambiar al biosimilar el paciente notó empeoramiento de su enfermedad y se les redujo la pauta posológica a cada 14 días con el medicamento biosimilar y finalmente retornó al medicamento original. La otra paciente en la que se redujo la eficacia con el cambio al biosimilar estaba a cargo de Dermatología, presentaba hidradenitis supurativa. Con el cambio notó claro empeoramiento de su enfermedad y retornó al medicamento original.
Los tres pacientes que presentaron reacción alérgica al medicamento biosimilar estaban a cargo del servicio de Reumatología (espondilitis anquilosante, artritis reumatoide y artropatía psoriásica). Y el otro paciente que retornó al medicamento original fue un paciente pediátrico con enfermedad de Crohn que no toleraba el medicamento biosimilar por dolor en el lugar de inyección.
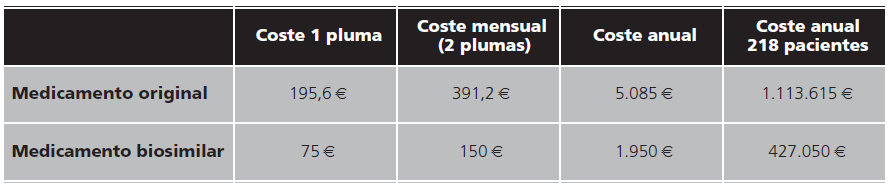
El coste de adquisición que supone a nuestro hospital una unidad del medicamento original es de 195,6 €, mientras que del biosimilar es de 75 €. Atendiendo a una pauta cada dos semanas de adalimumab, que es la más frecuente en nuestros pacientes, supondría un gasto al año de 5.085 € en el caso de adalimumab original y 1.950 € en el caso del biosimilar.
Teniendo en cuenta que el número total de pacientes que realizaron switch fue de 218, en nuestro hospital se ha conseguido un ahorro anual de 686.565 €. (Datos reflejados en la tabla 3).
DISCUSIÓN Y CONCLUSIONES
El desarrollo de biosimilares es un proceso complejo que requiere demostrar una eficacia, seguridad, inmunogenicidad y farmacocinética entre el medicamento biosimilar y el medicamento de referencia. Es necesario demostrar que no hay diferencias clínicamente significativas entre el biosimilar y su medicamento original. Las directrices de la EMA exigen que se adopte un plan de gestión de riesgos/farmacovigilancia de acuerdo con la legislación de la UE1.
Adalimumab fue aprobado para el tratamiento de la artritis reumatoide de moderada a grave y ha demostrado eficacia significativa, con mejoras en la actividad de la enfermedad del paciente, la calidad de vida y la prevención del daño estructural y la discapacidad.
Los problemas de seguridad están bien definidos y son similares a las de otros productos biológicos, incluido el riesgo de infecciones. Adalimumab ha sido aprobado para otras indicaciones, como la psoriasis, la artritis psoriásica, espondilitis anquilosante, artritis idiopática juvenil, la enfermedad inflamatoria intestinal, la hidradenitis supurativa y uveítis intermedia y posterior no infecciosa; es uno de los biológicos más prescritos en la práctica clínica15.
Tras la extinción de la patente de adalimumab original en 2018, la EMA ha aprobado numerosos biosimilares de adalimumab lo que ha llevado a un aumento de la competencia produciendo una reducción de precios significante16.
A continuación, se exponen diversos ensayos en los que se estudia el cambio de adalimumab original al biosimilar.
Un ensayo fase III aleatorizado, doble ciego comparó el medicamento biosimilar adalimumab (ABP 501) con su medicamento original en pacientes con artritis reumatoide de moderada a grave y respuesta deficiente a metotrexato. Los datos de este estudio concluyen que la eficacia clínica, la seguridad e inmunogenicidad del biosimilar son similares a las del medicamento original. Además, las propiedades analíticas, biofuncionales y farmacocinéticas de ABP 501 demostraron ser muy similares a las del original17.
En otro estudio también fase III, aleatorizado y doble ciego se demostró la similitud clínica de ABP 501 con adalimumab original en pacientes con psoriasis de moderada a grave en cuanto al porcentaje de mejora del PASI en la semana 16. Los perfiles de efectos adversos fueron comparables a lo largo de las 16 semanas que duró el estudio, y no hubo impacto en la seguridad ni en la inmunogenicidad tras la transición del medicamento original al ABP 50118.
En un hospital Universitario de Reino Unido que realizó switch de tratamiento con adalimumab biosimilar, según el estudio de Padilla y colaboradores, de 109 pacientes que presentaban enfermedad inflamatoria intestinal (97 enfermedad de Crohn y 12 colitis ulcerosa), el 88% de ellos continuaron tras 12 meses con el medicamento biosimilar. De los que discontinuaron el tratamiento, el motivo de uno de ellos fue por desarrollar anticuerpos frente al fármaco y el resto por pérdida de respuesta. Ninguno de ellos presento efectos adversos graves. En nuestro estudio, como ya he comentado, la enfermedad más prevalente era la enfermedad inflamatoria intestinal con 79 pacientes. De estos 79 pacientes, la gran mayoría continuaron el tratamiento con el biosimilar (98,7%), solo uno de ellos cambió de nuevo al medicamento original (paciente pediátrico que no toleraba el dolor del pinchazo con el biosimilar).
En el estudio de Yeoh y colaboradores, realizado en una cohorte de pacientes con artritis reumatoide a los que se les realizó switch del medicamento original de adalimumab por biosimilar, el 93% permaneció estable tras 32 semanas. Al 3% les suspendieron el medicamento por otros motivos (infecciones, progresión de la enfermedad…) y el 4% volvió a emplear el medicamento original siendo revisadas las solicitudes por un grupo directivo de biosimilares. Dentro de este 4%, el 1% presentaba alergia a un material del medicamento biosimilar (látex) y el 3% restante fue por falta de eficacia demostrada o por efecto adverso anteriormente no descrito con el medicamento original19.
En otro estudio de Mazumder y colaboradores el 88% de 356 pacientes con artritis reumatoide a los que se les realizó switch con el medicamento biosimilar permanecían con el tratamiento al cabo de 12 semanas sin incidencias. Igual ocurre con los que presentaron artropatía psoriásica, el 86% de 218 mantenían el biosimilar tras 12 semanas20.
Al igual que en nuestro estudio, la mayoría de pacientes con artritis reumatoide y artropatía psoriásica continuaron con el medicamento biosimilar sin complicaciones. Concretamente, en nuestro estudio, solo un paciente con artritis reumatoide tuvo que volver a emplear el medicamento original por reacción de hipersensibilidad (1,27% de los pacientes con artritis reumatoide), y otro con artropatía psoriásica por falta de eficacia tras el cambio al biosimilar (4,35% de los pacientes con artropatía psoriásica).
Como hemos podido comprobar en este estudio el switch de un biológico original al biosimilar supone un importante ahorro económico sin que se reduzca la efectividad en el proceso de su enfermedad. Los medicamentos biosimilares contribuyen a la eficiencia y sostenibilidad del sistema sanitario.
En nuestra población, solamente el 4,13% tuvo que volver al medicamento original. Sería conveniente realizar estudios en un número mayor de pacientes con un seguimiento a largo plazo para obtener conclusiones más firmes.