1. INTRODUCCIÓN
Nunca desde la crisis de los misiles de Cuba en 1962, la humanidad ha estado tan cerca de un conflicto nuclear como en la actualidad con la guerra de Ucrania. El único episodio de guerra nuclear acontecido en la historia de la humanidad ha sido el ataque americano sobre Hiroshima y Nagasaki en 19451. En todas las guerras aparece el concepto de “tierra quemada”, pero en una confrontación nuclear esto es literal, el entorno queda contaminado por un tiempo prolongado que dependerá de la vida media de los radioisótopos depositados. La desintegración radiactiva de núcleos pesados de uranio o plutonio genera multitud de elementos radiactivos como I131, Sr91, Zr95, Mo99, Ru106, Te132, Te134, Cs137, Ba140, La141 y Ce1442.
La capacidad destructiva de las bombas nucleares es mayoritariamente por impacto mecánico y térmico, existiendo modelos predictivos que permiten estimar el área afectada por el impacto de una bomba nuclear (onda de choque, área afectada térmicamente y zona de radiación)3. La lejanía al punto de impacto es lo único que realmente puede salvar vidas, según los principios ALARA (as low as reasonable achievable)4 y lo prioritario, en un supuesto caso de guerra o accidente nuclear, es el soporte vital y la atención médica de las víctimas afectadas5. Sin embargo, también es importante la protección frente al daño derivado de la radiactividad en las zonas limítrofes, pudiendo en este caso actuar tanto de manera preventiva como paliativa. Por otra parte, los radioprotectores, a diferencia de los agentes terapéuticos utilizados para reducir y prevenir la exposición a radionúclidos, actúan aumentando la supervivencia celular o mejorando la repoblación por las células sanas a través de la reducción de radicales libres, la disminución de la respuesta inflamatoria o la atenuación de las vías de señalización de la apoptosis6. Históricamente, el primer radioprotector ensayado fue el aminoácido cisteína, durante el desarrollo del Proyecto Manhattan en el que la mayoría de los compuestos con actividad radioprotectora, eran moléculas azufradas con grupos tiólicos como la cisteamina, 2-aminociclohexanotiol o el 2,3 dimercaptopropanosulfonato sódico (Unitiol®). Otros compuestos azufrados como fosforotioatos, tioureas o tiazolinas se han ensayado sobre todo en roedores con éxito como radioprotectores, pero muy pocos han dado el salto a humanos por su toxicidad asociada6,7.
La Agencia Española de Cooperación Internacional para el Desarrollo, en colaboración con el Ministerio de Sanidad, ha lanzado recientemente una nueva convocatoria para completar el róster de profesionales sanitarios necesarios para movilizar el Equipo Técnico Español de Ayuda y Respuesta en Emergencias (START, Spanish Technical Aid Response Team)8. Entre estos profesionales sanitarios se encuentra el farmacéutico, por ser una figura clave tanto por su conocimiento en la elaboración individualizada del medicamento como en su experiencia en la propuesta y gestión integral farmacoterapéutica de medicamentos utilizados en condiciones especiales. En esta revisión, se recogen las diferentes alternativas terapéuticas, tanto disponibles comercialmente como en formulación magistral. Además, también se presentan potenciales terapias aplicables en un futuro que podrían ser utilizadas como tratamiento preventivo y/o paliativo frente a los potenciales daños causados por exposición a radiaciones. Para ello, se ha llevado a cabo la búsqueda de información inicialmente mediante localización de artículos a través de los términos “nuclear war and pharmacy” y “radioprotectans and pharmacy” en PubMed en un espacio temporal de 20 años. Además se han consultado las recomendaciones de agencias santiarias como los Centros para el Control y Prevención de Enfermedades (CDC), Food and Drug Administration (FDA) y Agencia Española del Medicamento y Productos Sanitarios (AEMPS), así como libros, comunicados a congresos y las fichas ténicas de los diferentes fármacos recomendados.
2. MEDIDAS FARMACOLÓGICAS FRENTE A UNA SITUACIÓN DE IRRADIACIÓN
Ante una situación de exposición a compuestos radiactivos, tanto masiva como puntual por un radionúclido concreto, puede recurrirse tanto a fórmulas magistrales elaboradas desde los Servicios de Farmacia u oficinas de farmacia, así como a medicamentos comercializados. A continuación, se recoge la posología, modo de administración y disponibilidad como medicamento comercial o fórmula magistral de diferentes medicamentos empleados como tratamiento de los radionúclidos más frecuentemente hallados en eventos nucleares (figura 1).
2.1 Medidas preventivas recomendadas frente a yodo radiactivo:
Entre los principales iones liberados a la atmósfera en los accidentes de Chernobyl y Fukushima se encuentra una variedad de radioisótopos del yodo, siendo el 131I el de mayor relevancia de exposición9. La mayor parte del material radiactivo se libera en forma de gas y aerosoles.
Una vez absorbido en el organismo, la ruta que sigue el yodo radiactivo es la misma que la del yodo estable y se acumula en el tiroides, representando la mayor fuente de emisión de radiación a esta glándula, que es la responsable de la destrucción de los tirocitos y daño al tejido tiroideo10. Como medida de prevención ante una exposición específica a yodo radiactivo puede recurrirse a fórmulas magistrales. Existen diferentes formulaciones válidas, presentando cada una de ellas ventajas para su empleo en distintos escenarios según las características del paciente:
Yoduro potásico: Una de las sustancias químicas con más evidencia de utilidad ante una exposición por yodo radiactivo es la administración de yodo estable en forma de yoduro potásico (KI)11. El estudio de Wolff y Chaikoff de 1948, demostró que niveles plasmáticos elevados de yoduros obtenidos tras su administración oral, pueden reducir la captación de yoduros radioactivos por el tiroides12. Por ello, la administración precoz de yoduro potásico, que aporta yodo estable, reduce el riesgo derivado de la radiación por la exposición a yodo radiactivo. La acción del KI es rápida y los efectos beneficiosos pueden apreciarse a los 30 minutos de la ingesta. La administración en pocas horas previas o durante el exposición puede reducir la radiación del tiroides hasta un 95%, si bien retrasar el inicio a las 6 horas reduce esta efectividad al 50%13. Debido a que la duración del efecto de KI es temporal, es necesario una administración diaria del yodo estable mientras dure el riesgo de contaminación11.
La FDA tiene aprobada en la actualidad una presentación de yoduro potásico en forma de solución oral a concentración de 65 mg/mL14. En España no se dispone de ninguna presentación comercial, y tampoco es posible el acceso a las mismas como solicitud de medicamentos en situaciones especiales. La única opción comercial de esta molécula son complementos alimenticios empleados como aporte de yodo durante el embarazo, pero las cantidades de yodo incluidas en los mismos son mínimas (~150-200 mcg habitualmente), y por tanto su utilidad es nula como bloqueante del yodo radiactivo15. Debido a la imposibilidad de acceso a presentaciones comerciales en España, la única opción disponible sería la elaboración de fórmulas magistrales desde los Servicios de Farmacia Hospitalaria u oficinas de farmacia. La población diana en la que se debe priorizar la administración son los niños, en los que la exposición a un mismo nivel de radiación representa una dosis recibida entre 8-9 veces superior a la de adultos. En cambio, existe discusión sobre su uso en personas mayores de 60 años o adultos con trastornos cardiovasculares11. Las dosis de yoduro potásico recomendadas por los Centros para el Control y la Prevención de Enfermedades (CDC) son: 130 mg para adultos de 18-40 años, mujeres embarazadas y en lactancia; 65 mg de yoduro para población entre 3 y 18 años; 32.5 mg para niños de entre 1 mes a 3 años y 16,25 mg para neonatos de hasta 1 mes16. Teniendo en cuenta las dosis recomendadas, el diseño óptimo serían cápsulas elaboradas en dosis de 65 mg. En general, las cápsulas de KI son bien toleradas. Los principales efectos adversos que pueden aparecer son de tipo gastrointestinal (vómitos, diarreas, dolor epigástrico…) o cutáneo (rash), pero con incidencias muy bajas17.
Solución de lugol al 5%: Como alternativa a las formas sólidas orales, puede prepararse una solución de lugol al 5% útil para pacientes con problemas de deglución o para facilitar la dosificación y administración en niños. La composición de esta fórmula es 5 gramos de yodo, 10 gramos de yoduro potásico y agua estéril hasta 100 mL. Su estabilidad protegido de la luz en envase de vidrio topacio y a temperatura inferior a 30ºC es de 3 meses18. La posología recomendada en caso de exposición a yodo radiactivo es de 16 gotas/día (equivalente a 100 mg de yodo activo) en adultos, incluyendo mujeres embarazadas y madres lactantes; 8 gotas/día (50 mg de yodo activo) en niños de 3-12 años; 4 gotas/día (25 mg de yodo activo) en niños de 1 mes a 3 años; y 2 gotas/día (12,5 mg de yodo activo) para menores de 1 mes. El tratamiento debe iniciarse tan pronto como sea posible y repetirse diariamente hasta que el riesgo o la exposición hayan terminado19.
Perclorato: En el caso de pacientes alérgicos al yodo, la alternativa disponible como protección frente a la captación de yodo radiactivo por el tiroides es el perclorato (ClO4-). El perclorato es un anión inorgánico que disminuye el transporte activo del yodo al interior del tiroides debido a su mayor afinidad por el transportador de yoduro. El perclorato se absorbe rápidamente en el tracto gastrointestinal tras la ingestión y se elimina inalterado en orina. Tiene una vida media de 6-8 horas en humanos20. Actualmente no existe comercializada en España ninguna presentación con este principio activo. La única opción comercial a la que podría accederse es una solución oral de perclorato sódico 300 mg/mL a través del portal de Medicamentos en Situaciones Especiales al tratarse de un medicamento extranjero. En ficha técnica cuenta con la indicación de bloqueo tiroideo en pruebas diagnósticas con yodo radiactivo, por lo que aunque no se recoja la indicación en caso de exposición masiva por un evento nuclear, podría ser una alternativa viable21. Desde los servicios de Farmacia puede prepararse una solución de perclorato potásico a concentración de 10 mg/mL como fórmula magistral19. La preparación de la misma se realiza con 2,5 gramos de perclorato potásico que se llevan hasta 250 mL de volumen final utilizando agua estéril, benzoato de sodio y jarabe simple como excipientes. La estabilidad de la solución conservada en envases de vidrio topacio a Tª ambiente es de 6 meses22. Además de la solución de perclorato potásico, también pueden elaborarse cápsulas según la Farmacopea de Estados Unidos23. La posología de esta fórmula de perclorato potásico es de 20-40 mL/día para adultos; 20 mL/día para niños de 2-12 años; y 10 mL/día para menores de 2 años22,24.
2.2 Medidas preventivas frente a otros radionúclidos frecuentes:
En un accidente nuclear, además del yodo radiactivo también se liberan otra gran variedad de radioisótopos tóxicos. Los más relevantes son el cesio y talio radiactivo cuyo tratamiento preventivo es el azul de Prusia (hierro III hexacianoferrato), junto con el americio, plutonio, curio, indio e iridio para los que se utiliza como tratamiento el pentaacetato de dietilentriamina (DTPA).
Azul de Prusia: Frente al cesio y talio radiactivo está disponible a nivel comercial una presentación de azul de Prusia (Radiogardase®), en forma de cápsulas de 500 mg. La adquisición se realiza como medicamento extranjero a través de la página de la AEMPS de acceso a medicamentos en situaciones especiales. El azul de Prusia corresponde a la molécula de hierro III hexacianoferrato, la cual es insoluble y no se absorbe a través de la mucosa tras la administración oral. Una vez en el tracto gastrointestinal, une cationes monovalentes, siendo la afinidad mayor por aquellos de mayor radio iónico (especialmente cesio y en menor medida el talio). Debido a que el cesio en el organismo experimenta circulación enterohepática, la unión del azul de Prusia con el cesio radiactivo en el intestino tras la eliminación por la bilis evita la reabsorción del cesio e interrumpe el ciclo, favoreciendo su eliminación a través de las heces y por tanto disminuyendo el tiempo de exposición a este radiosisótopo25.
La posología habitual en caso de una exposición aguda a radiactividad es de 6 cápsulas 3 veces al día para adultos y niños mayores de 12 años, 2 cápsulas 3 veces al día para niños de entre 2-12 años. Estas cápsulas deben tragarse enteras, pero en caso de pacientes con problemas de deglución pueden abrirse y mezclar el contenido con alimentos o líquidos25. El tratamiento con azul de Prusia debe iniciarse lo antes posible. En caso de que esto no sea posible, sigue estando recomendada la administración, aunque haya transcurrido cierto tiempo desde la exposición, ya que se sigue considerando eficaz. La duración del tratamiento debe ser de al menos 30 días, aunque depende de factores como la gravedad de la exposición y el juicio del facultativo. Una vez ha disminuido considerablemente la radiactividad interna, puede reducirse la dosis a 1-2 gramos tres veces al día con el fin de mejorar la tolerancia gastrointestinal. Los ensayos realizados en humanos han demostrado que la administración diaria de 3 gramos vía oral reduce la semivida biológica del cesio radiactivo desde 110 días hasta 40 días. En el caso del talio, la reducción es de 8 días a unos 3 días26.
En el ámbito experimental, también se ha probado una técnica in vitro de depuración extracorpórea que ha arrojado resultados prometedores en el aclaramiento de cesio radiactivo (137Cs) del organismo mediante columnas de hemoperfusión recubiertas con azul de Prusia27.
Pentaacetato de dietilentriamina (DTPA): El DTPA puede encontrarse en forma de dos sales distintas, una sal cálcica (Ca-DTPA) y otra de zinc (Zn-DTPA), estando aprobadas para esta indicación desde el 2004 por la FDA28. El DTPA, mediante el intercambio del ión divalente asociado (calcio o zinc), forma quelatos estables con los iones metálicos de americio, plutonio, curio, indio e iridio, por los que presenta mayor capacidad de unión. Posteriormente, estos quelatos son excretados a la orina a través de la filtración glomerular. La eliminación de estos metales no es completa, pero la disminución de sus niveles ayuda a reducir los efectos secundarios de su radiactividad29,30. La eficacia de la sal cálcica es mayor que la del Zn-DTPA cuando la administración ocurre dentro del primer día tras el inicio de la contaminación interna, por lo que la recomendación en las primeras 24 horas es el empleo de Ca-DTPA. Tras las primeras 24 horas, la eficacia de ambas formas es similar31. Transcurridas las 24 horas, de necesitar tratamiento adicional, se recomienda que los adultos reciban el Zn-DTPA. Si no hay disponible Zn-DTPA, los pacientes podrían recibir el Ca-DTPA, pero debido a que compleja elementos minerales necesarios para el organismo, en tratamientos prolongados debe administrarse concomitante suplementos minerales y vitamínicos con zinc28,31.
Actualmente la sal cálcica está como medicamento extranjero a través de la página de medicamentos en situaciones especiales de la AEMPS29. La presentación es una ampolla de 1000 mg en 5 mL, cuya ficha técnica recoge la posología aprobada, sin embargo, las recomendaciones posológicas del CDC varían ligeramente siendo para los adultos 1 ampolla/día y para niños <12 años 14 mg/kg/día. Las mujeres lactantes que se hayan contaminado internamente con plutonio, americio o curio pueden tratarse con el Ca-DTPA o el Zn-DTPA31.
La administración del Ca-DTPA puede ser vía intravenosa directa en un bolo de 3-4 minutos, o mediante una perfusión intravenosa intermitente tras dilución en 100-250 mL de suero glucosado al 5%, Ringer lactato o suero salino fisiológico29. Los principales efectos adversos son de tipo gastrointestinal (náuseas, diarrea, vómitos…), calambres musculares, o fiebre.
En la tabla 1, se recogen de manera resumida la información previamente descrita para los medicamentos actualmente disponibles para la prevención de los posibles daños causados por los radioisótopos que más frecuentemente se podrían encontrar en un evento nuclear. Además, en la misma, también se recogen otros medicamentos que podrían usarse ante otros elementos radiactivos menos frecuentes32.
Tabla 1. Tratamiento farmacológico para determinados radionúclidos frecuentes en eventos nucleares.
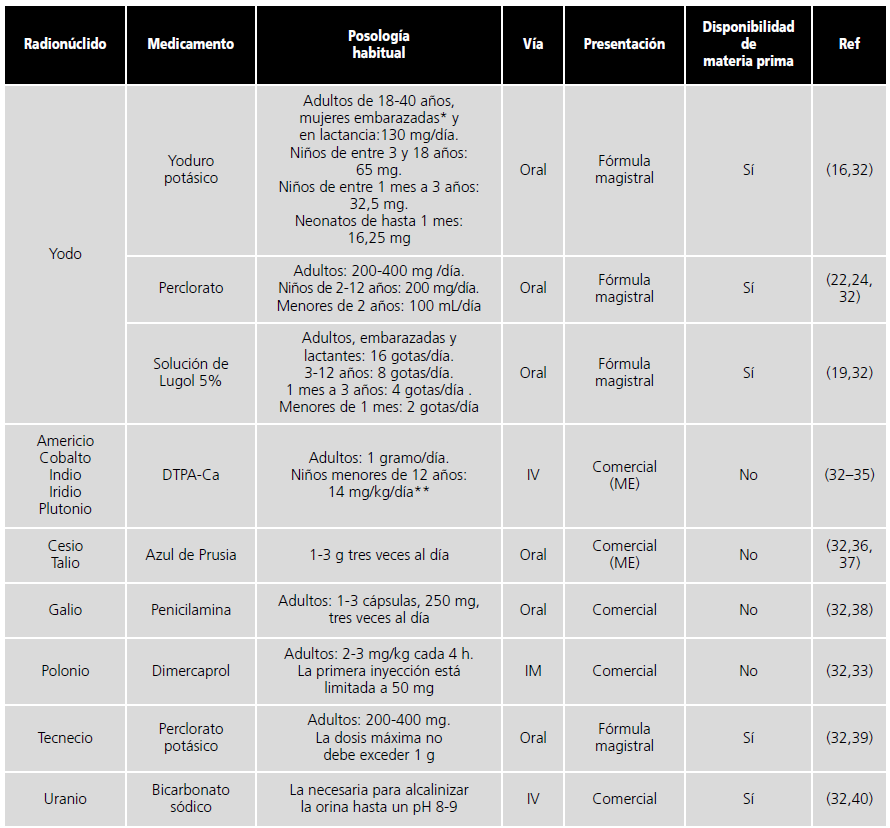
*La recomendación para la dosificación del yoduro potásico en caso de embarazadas y mujeres en lactancia puede oscilar entre los 65-130 mg.
**La posología recogida en la tabla hace referencia a las recomendaciones de los CDC, mientras que la ficha técnica no recoge su empleo en niños.
3. RADIOPROTECTORES
Los radioprotectores son sustancias capaces de reducir los efectos secundarios de las radiaciones, pudiendo utilizarse tanto como agentes preventivos como de tratamiento5. Cada vez se descubren más agentes con potencial radioprotector, sin embargo, la mayoría de las sustancias con capacidad radioprotectora, aún están en estudio y cuentan con pocos ensayos que respalden su eficacia (figura 2). Actualmente el único radioprotector aprobado por la FDA es la amifostina, estando indicado en la protección contra la xerostomía inducida por radiación ionizante en pacientes con cáncer de cabeza y cuello41,42.
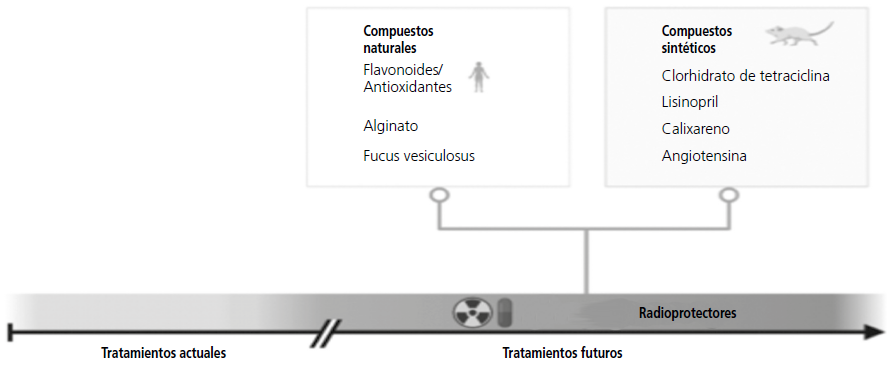
Figura 2. Radioprotectores naturales y sintéticos más estudiados. Únicamente las sustancias flavonoides y antioxidantes cuentan con estudios en humanos.
3.1 Compuestos naturales:
Una consideración importante para los radioprotectores utilizados como profilácticos en situaciones de emergencia, es si se pueden tomar de forma segura en dosis repetidas. Este requisito se debe a la incertidumbre de cuándo tendrá lugar la exposición. Por este motivo, este grupo de compuestos presentan una ventaja importante, y es su menor toxicidad5.
Flavonoides y antioxidantes: Los flavonoides son los compuestos más ampliamente estudiados debido a su acción antioxidante, antiinflamatoria y a su potencial quelante de metales43. Algunos de estos compuestos, como la curcumina, han sido estudiados en humanos con resultados prometedores44. Otro grupo de interés, son los antioxidantes naturales como el selenio y la coenzima Q10, los cuales también tienen un potencial efecto radioprotector respaldado en ensayos en humanos43,45. Se ha observado que la administración combinada de antioxidantes puede tener un efecto sinérgico, así un estudio en niños expuestos al área contaminada de Chernobyl mostró que la administración combinada de tocoferol y ácido lipoico es más eficaz en comparación con la administración de cada uno de los agentes por separado46,47. En la tabla 2 se indican los flavonoides y antioxidantes con estudios en humanos.
Tabla 2. Compuestos naturales y sintéticos con potencial radioprotector. RUESA* Registro Unificado de Empresas de Sustancias Activas78.
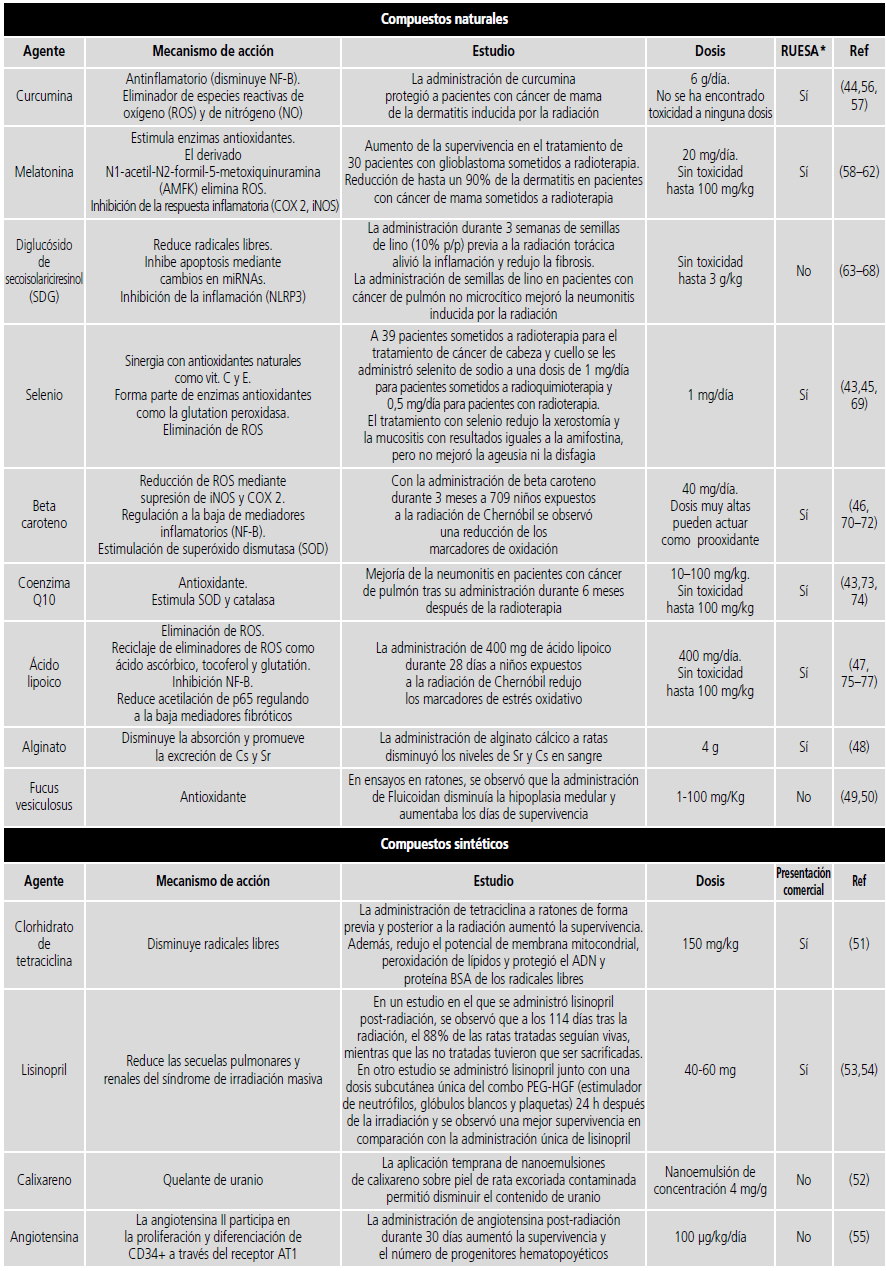
Alginato: El poder radioprotector del alginato reside en su capacidad de disminuir la absorción y promover la excreción de Cs y Sr. En un estudio preclinicos, se administraron soluciones de diferentes concentraciones de alginato cálcico (ALA Ca) y alginato sódico (ALA Na) y se midieron las concentraciones plasmáticas de Cs y Sr a los 7 y 14 días. ALA Ca disminuyó los niveles de Sr y Cs, mientras que ALA Na solo tuvo un efecto notorio sobre los niveles de Sr. La Agencia Internacional de Energía Atómica (OIEA) ha recomendado 4 g de ALA Na al día para el tratamiento de pacientes expuestos a grandes cantidades de Sr radiactivo48.
Fucus vesiculosus: El fucoidan es un polisacárido sulfatado purificado de algas pardas que incluye Fucus Vesiculosus y Laminaria Japónica. Posee propiedades antioxidantes y eliminadoras de radicales libres. Además, presenta un alto contenido en yodo. Hay varios estudios que respaldan la capacidad radioprotectora del fucoidan, en uno de ellos se observó que el día 28 post radiación, en el grupo tratado con fucoidan la hipoplasia medular era significativamente menor49. Otro ensayo demostró que el fucoidan aumentaba la viabilidad de las células de la médula ósea gracias a un mecanismo de acción basado en la inhibición de la apoptosis (aumento de la expresión de Bcl-2) y la movilización de progenitores hematopoyéticos cuando se administraba una dosis de 50 µg/ml durante 24 horas y posteriormente tenía lugar la exposición50.
3.2 Compuestos sintéticos:
En este grupo se incluye un número más reducido de agentes con un mecanismo de acción muy variado. En la tabla 2, se recogen los compuestos sintéticos más estudiados, su dosis y disponibilidad como materia prima de cara a su utilización potencial como formulación magistral en caso de necesidad.
Clorhidrato de tetraciclina: La administración de tetraciclina a ratones de forma previa a una radiación de 8 Gy, proporcionó una supervivencia del 87,5%, mientras que cuando la administración se retrasaba 24 horas tras las radiación, se reducía la supervivencia al 35%. Se observó que la inyección intraperitoneal de clorhidrato de tetraciclina previamente a la radiación disminuyó los radicales libres, lo que se tradujo en una disminución del potencial de membrana mitocondrial y peroxidación lipídica a nivel cerebral51.
Calixareno: Se ha mostrado su utilidad radioprotectora al compararse el uranio absorbido a través de la piel, cuando se descontaminaba con una microemulsión cargada con calixareno frente a agua jabonosa52. La aplicación temprana de las nanoemulsiones de calixareno sobre piel de rata excoriada contaminada permitió disminuir el contenido de uranio en alrededor de un 85% en fémures, 95% en riñones y 93% en orina. Además, se observó que el agua jabonosa favorece la difusión transcutánea del uranio en ausencia del estrato córneo52.
Lisinopril: En un estudio en el que se administró lisinopril después de 114 días tras la radiación, el 88% de las ratas tratadas seguían vivas, mientras que las no tratadas tuvieron que ser sacrificadas53. Además, otro estudio evaluó la eficacia del lisinopril administrado con estimuladores de colonias. Se administró una dosis subcutánea única de PEG-HGF (estimulador de neutrófilos, glóbulos blancos y plaquetas) 24 horas después de la irradiación seguida de lisinopril (60 mg /L en ratones o 40 mg/L en ratas) en el agua de bebida a partir del día 7 después de la radiación y se continuó la administración durante toda la duración del estudio. La combinación mejoró la supervivencia a los 150 días hasta el 100% en comparación con el lisinopril solo54.
Angiotensina: En un estudio realizado en ratas se administró 100 µg/kg/día de angiotensina mediante inyección subcutánea a las 48 h post radiación y desde este instante hasta el día 30. Posteriormente se realizó la necropsia en la cual se extrajo médula ósea para evaluar los progenitores hematopoyéticos. Se obtuvieron datos que reflejaron una mayor supervivencia (del 60% a más del 90%), además, la administración de angiotensina aumentó los progenitores hematopoyéticos en más de tres veces55.
CONCLUSIONES
Ante un evento que suponga una exposición masiva a radiactividad, el soporte vital y la distancia respecto al punto de impacto es lo prioritario. Sin embargo, el papel de la Farmacia Hospitalaria desempeña un importante papel en dos aspectos claves para protegerse ante la radiación: por un lado, al encargarse de la gestión integral farmacoterapéutica de medicamentos comerciales utilizados en condiciones especiales, y por otro en la elaboración de medicamentos individualizados como fórmulas magistrales. En la presente revisión se presentan los tratamientos preventivos y/o paliativos frente a las exposiciones radioactivas procedentes de lo radionuclidos de yodo, cesio, talio, galio, polonio, tecnecio o uranio, estando actualmente disponibles para su tratamiento 6 medicamentos comercializados y 4 fórmulas magistrales que deberían formar parte de un stock de emergencia en lugares cercanos amenazados por la exposición radioactiva. Por otra parte, existen 9 compuestos naturales que por sus propiedades antioxidante, antiinflamatoria y/o potencial quelante de metales podrían utilizarse como radioprotectores en este tipo de eventos, estando la mayoría disponibles registrados como materia prima y siendo por tanto valorable su elaboración como formulación magistral.















