My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Bioética y Derecho
On-line version ISSN 1886-5887
Rev. Bioética y Derecho n.33 Barcelona 2015
https://dx.doi.org/10.4321/S1886-58872015000100003
ARTÍCULO
Objeciones planteadas por los comités éticos a las traducciones de los documentos de consentimiento informado en investigación clínica: análisis e implicaciones para el trabajo del traductor
Analysis of the objections raised by ethics committees in Spain to the translations of clinical research patient information sheets and informed consent forms: Implications for translators
Lorenzo Gallego Borghini
Licenciado en Traducción e Interpretación, Universitat Autonoma de Barcelona. Profesor asociado (UAB).
Correo electrónico: lorenzogallego@gmail.com
RESUMEN
En muchos ensayos clínicos internacionales, la versión en castellano de los documentos de consentimiento informado (CI) presenta deficiencias atribuibles a la traducción. Para conocer las objeciones que formulan los comités éticos de investigación clínica a las traducciones, como paso previo a la elaboración de un manual sobre la traducción de estos documentos, se analiza un corpus de 100 solicitudes de aclaración.
El 67,63% de las peticiones hacen referencia al CI y de éstas, el 31,80% tienen alguna relevancia para la traducción. La mayoría de estas objeciones conciernen a la redacción general (43,62%); también son objeto de crítica la terminología (34,31%) y los aspectos culturales (22,05%). En este artículo se describen estas objeciones y se analiza qué implicaciones tienen para el trabajo del traductor.
Palabras clave: consentimiento informado; hoja de información; investigación clínica; traducción; legibilidad; ensayo clínico; calidad.
ABSTRACT
In many international clinical trials submitted for approval in Spain, the Spanish versions of the patient information sheets and informed consent forms (PIS/ICFs) have problems that may be attributed to the translation. A sample of 100 clarification letters from Spanish ethics committees has been analyzed to assess the objections posed by these ethics committees to the translation of PIS/ICFs, as a previous step for the preparation of a handbook on PIS/ICF translation.
As many as 67.63% of all clarification requests relate to the PIS/ICF. Of these, 31.80% is somehow relevant to the translation. Most of these objections concern general style and writing (43.62%), whereas the other two points of attention are terminological issues (34.31%) and cultural issues (22.05%). Following the analysis of these objections, the implications for the work of translators are discussed.
Key words: informed consent form; patient information; clinical research; translation; Spanish; Spain; legibility; clinical trial; quality.
Introducción y objetivo
Con la espectacular internacionalización que ha vivido en los últimos decenios, la investigación biosanitaria se ha convertido en una de las principales subespecialidades de la traducción médica. Uno de los documentos más importantes en este ámbito es el consentimiento informado (CI)[1], pieza clave de la bioética de la experimentación con seres humanos cuya principal particularidad estriba en que el lector es un lego, no un especialista, y además es la persona en quien se disponen los investigadores a probar el nuevo fármaco, aparato o intervención.
Los comités éticos de investigación clínica (CEIC) prestan especial atención a estos documentos en la evaluación que hacen de los ensayos clínicos, comprobando que cumplan todo lo dispuesto en la legislación, en los principios de la bioética y en las normas que rigen la buena práctica clínica, pero fijándose también en la legibilidad y en la comprensión de la información que pretenden transmitir.
Los problemas de legibilidad de los CI en el ámbito de la investigación ya han sido objeto de estudio en nuestro país. En 1999, Ordovás y cols.[2] llegaron a la conclusión de que presentan profundas deficiencias tanto en la legibilidad formal (complejidad lingüística) como en la cantidad y la calidad de la información que se pretende transmitir al paciente, deficiencias que, según los autores, pueden poner en entredicho la correcta obtención del consentimiento informado y plantean un problema ético. Aunque en ese estudio no se indica qué porcentaje de los CI analizados son traducciones, cabe suponer que es importante teniendo en cuenta la cantidad de ensayos internacionales que se realizan en nuestro país y los criterios de selección de su muestra; así, es muy probable que parte de los problemas referidos se deban a deficiencias de las traducciones al español. De hecho, otros autores se quejan explícitamente de los problemas de calidad de las traducciones, como la literalidad, la gran cantidad de tecnicismos difíciles [3] e incluso la falta de adecuación cultural a nuestro medio[4].
Sin embargo, no hace falta acudir a la bibliografía para constatar esta problemática: quienes trabajamos en el ámbito de la investigación clínica en España observamos deficiencias graves tanto en el plano conceptual como lingüístico, problemas que van más allá de la comprensión de lo que es un ensayo clínico o que puedan achacarse a un escaso conocimiento de la medicina, sino que obedecen a un empleo pobre de la lengua castellana, a un desconocimiento de los usos y los giros que en ella son habituales y a un apego servil a la morfosintaxis inglesa, quizás por un exceso de celo a la hora de conservar todos los elementos de lo que no deja de ser un instrumento jurídico. Se respetan las dos primeras reglas de oro de la buena traducción —decir todo lo que dice el original y no decir nada que el original no diga— pero se olvida la tercera y quizás la más importante: decirlo todo con la máxima corrección y naturalidad que permita la lengua a la que se traduce[5].
El objetivo del análisis que se presenta aquí es describir con mayor rigor las objeciones que plantean los CEIC a las traducciones de los CI, como paso previo a la elaboración de un manual o compendio de consejos y orientaciones para mejorar la traducción de estos documentos en el ámbito de la investigación clínica en España, con miras no sólo a agilizar el trabajo de los laboratorios, las CRO y los CEIC, sino sobre todo como requisito ético para con el lector último —el paciente—, que es al y al cabo el verdadero interesado.
Corpus
Para este estudio se ha seleccionado un corpus aleatorio de 100 solicitudes de aclaraciones correspondientes a 97 ensayos multicéntricos internacionales, de lo cual se desprende que los CI evaluados por los CEIC son todos traducciones al castellano. El 74% las solicitudes corresponden al lustro comprendido entre 2009 y 2013, lo cual señala la contemporaneidad del corpus. Las solicitudes proceden de 28 CEIC españoles, con los del Hospital 12 de Octubre (Madrid), el Vall d'Hebron (Barcelona) y el Gregorio Marañón (Madrid) a la cabeza, aunque se ha contado sólo el CEIC que actúa como referencia. Respecto a las áreas terapéuticas, las tres más frecuentes son oncología-oncohematología (que suman del 35% del total), neurología (con el 25%) e inmunología-reumatología (16%), con porcentajes que coinciden aproximadamente con los datos del proyecto BEST[6] y dan por tanto una idea de la validez y representatividad de la muestra.
Todas las solicitudes menos una (es decir, el 99%) contienen peticiones concernientes al CI. En total, sin contar las aclaraciones locales, que carecen de relevancia para este trabajo, las 100 solicitudes suman 1898 observaciones o peticiones de aclaración, es decir, un promedio de 18,98 cada una (intervalo de 3-78). De éstas, 1283 (media de 12,83 e intervalo de 0-55 por solicitud) conciernen al documento de información para el sujeto y consentimiento informado, o sea el 67,63% del total, cifra casi idéntica a la que encuentran Dal-Ré y cols. en su análisis del tipo y la magnitud de los cambios requeridos por los CEIC en estos documentos[7]. En la tabla 1 se presenta el análisis cuantitativo del corpus.
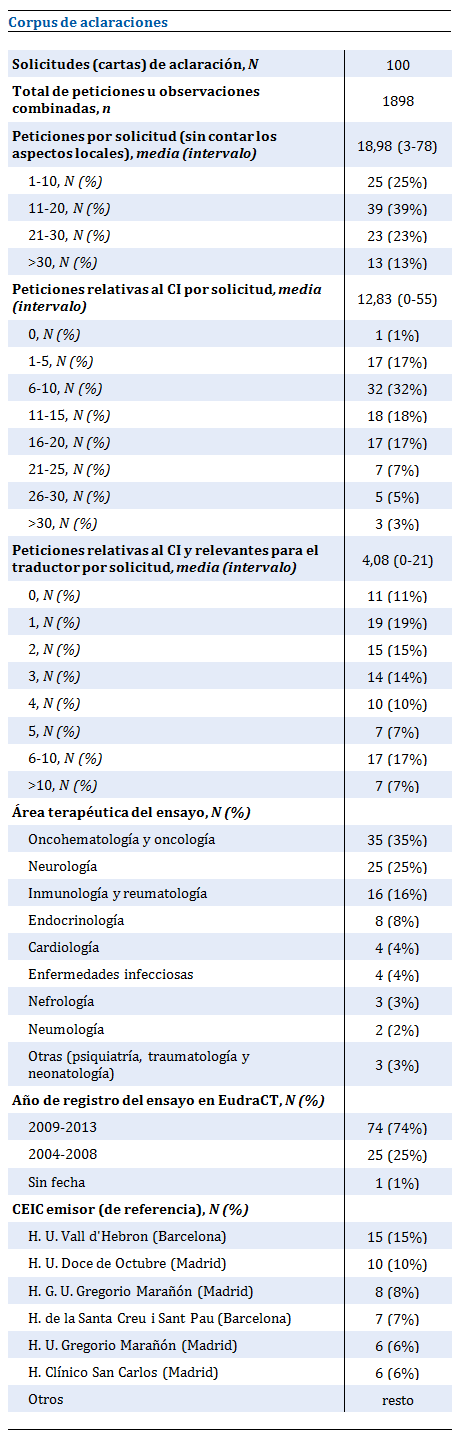
Tabla 1. Descripción cuantitativa del corpus de solicitudes de aclaración.
Clasificación de las peticiones e implicaciones para la traducción
Después de la descripción cuantitativa de las peticiones de aclaración, y una vez apartadas las que no conciernen estrictamente al CI sino al protocolo y al diseño de la investigación (los aspectos generales), se ha procedido a un análisis cualitativo para determinar cuáles tienen alguna relación con la traducción o la calidad de la redacción y por tanto pueden considerarse de algún modo relevantes para el trabajo del traductor: se señalan 408 que cumplen estas características (el 31,80% de las peticiones relativas al CI y el 21,49% del total).
A partir de aquí, se han analizado una por una las peticiones y se han clasificado en tres grandes grupos: las relativas a cuestiones generales de estilo y de redacción (el 43,62%), las relativas a cuestiones de terminología o léxico (el 34,31%) y las relativas a cuestiones culturales o conceptuales (el 22,05%). A continuación se analiza con mayor detalle cada una de estas categorías.
Estilo y redacción
La peticiones más numerosas (con el 47,19%) requieren que se modifique o se elimine una frase o apartado por redacción confusa o que se mejore la redacción general del documento. Observaciones como las siguientes ponen de manifiesto los problemas que se apuntan en la introducción de este artículo, como la literalidad: «se observa en muchos párrafos la traducción literal del inglés, […] demasiado dura y agresiva […]»; «[…] deben revisar la hoja, evitando anglicismos […]»; «Los CI son demasiado farragosos». Es muy probable que detrás de la percepción de pesadez y mala redacción haya problemas de traducción, como el apego excesivo a las estructuras del original, los calcos sintácticos y las repeticiones léxicas, que se comentan más adelante.
A modo de ejemplo, un problema de la traducción de estos documentos son los tiempos verbales. En inglés son habituales las fórmulas de cortesía como you will be asked to, que trasladadas al español literalmente quedan demasiado largas (se le pedirá que...), sobre todo cuando se repiten una y otra vez en el texto; mejor será decir tendrá que o recurrir a otros giros más ligeros como por ejemplo habrá cinco visitas en el hospital en lugar de se le pedirá que acuda a cinco visitas en el hospital. Este tipo de soluciones son las que, bien empleadas a lo largo de todo el texto, contribuyen a deshacer la sensación de pesadez y la torpeza lectora.
En el cuadro 1 se expone un ejemplo real de traducción al español y cómo podría simplificarse y mejorarse. Resulta notable cómo, con más de 20 palabras menos, se puede decir lo mismo, no omitir nada y además obtener una lectura mucho más fluida y natural.
Cuadro 1. Fragmento de una traducción real de un CI y propuesta de mejora 
Foco especial de críticas es el apartado relativo al tratamiento de datos, y en el epicentro de muchas objeciones está la mala traducción de disclose por divulgar, cuando en realidad es comunicación o cesión de datos, actuación contemplada en el ordenamiento español y facultad jurídica limitada (muy distinta, pues, de lo que entendemos por divulgar). Es preciso que el traductor conozca la legislación española y los términos y expresiones que se utilizan en los códigos vigentes, no por capricho estilístico, sino porque está trabajando con un instrumento jurídico que surte efectos legales.
Asimismo, debe ser consciente el traductor de que no deja de estar ante un texto legal, y por tanto debe utilizar las expresiones que son propias del tecnolecto jurídico español, porque el texto debe leerse como tal; por ejemplo, dirá a los efectos de en vez de para los propósitos de (for the purposes of); manifiesto o declaro en vez de confirmo (I confirm); la firma del presente documento no implica… en vez de firmando este documento no renuncio… (by signing this form, I do not waive…); etc.
Por otro lado, también son muy prominentes (36,52%) las objeciones a la extensión del documento y las peticiones de que se resuma o abrevie o todo o algún apartado concreto (que suelen ser el de procedimientos y el de riesgos) y de que se supriman redundancias.
Si bien es cierto que no compete al traductor acortar lo que le plazca —y podría sostenerse así que dichas observaciones no tienen relevancia para su trabajo—, una traducción que suene natural y se lea con fluidez suavizará la sensación de pesadez y repetitividad que perciben los CEIC. El discurso de estos documentos se caracteriza por una marcada tendencia a la repetición léxica y morfosintáctica y a las frases cortas, en una evidente búsqueda de sencillez, un recurso que la lengua inglesa tolera con facilidad pero que en castellano puede volverse gris y monótono. Se imponen así, en una buena traducción, el empleo de sinónimos que confieran cierta variedad —por ejemplo, no traduciendo la palabra study por estudio cada vez que aparezca, sino recurriendo a otras opciones como investigador por study doctor, ensayo clínico o investigación por research study o protocolo por study plan— y el respeto por la información implícito-contextual que posee el lector o que ya se ha mencionado en otra parte del texto[8], algo mucho más acorde con la tradición discursiva de una lengua sintética como la nuestra, por ejemplo no repitiendo del estudio o del ensayo cada vez que se menciona un elemento de la investigación, porque se sobreentiende por la situación comunicativa que el fármaco, el tratamiento, las visitas, las pruebas, etc., son, precisamente, del ensayo.
Siguen (con un 5,06%) las peticiones de que no se presente un borrador, sino un documento definitivo con un tamaño de letra y un formato uniforme. Considerando que muchas veces le llegan para traducir documentos que han pasado por varias manos o que se han confeccionado a partir de plantillas, el traductor también puede colaborar en este punto como profesional del procesamiento de textos, presentando un producto final y acabado.
Aunque numéricamente son menos (4,49%), también son muy importantes para el traductor las peticiones de que se supriman signos (por ejemplo, los de «mayor que» o «menor que»), símbolos y siglas, elementos lingüísticos a los que debe prestar especial atención. Aunque el uso de símbolos y siglas no esté reñido con un texto comprensible para los pacientes, debería limitarse a los de dominio común (p. ej., mg o TAC), explicando adecuadamente los que no lo sean y recordando que en español tendemos a usar menos siglas que en inglés —con lo cual resulta más natural y comprensible decir, por ejemplo, enfermo de Parkinson que enfermo de EP— y tenemos otros recursos para acortar términos complejos, por ejemplo pasando a decir lupus a secas (en vez de LES) después de las primeras veces que se hable del lupus eritematoso sistémico.
Terminología y léxico
Dentro de los problemas terminológicos, el primer grupo (33,57%) es el del campo semántico de la investigación clínica: los CEIC piden que se sustituyan o se expliquen términos como aleatorización, placebo, cohorte, doble ciego, etc. Destaca muy especialmente la petición de que se dé preferencia a la voz ensayo clínico sobre estudio o estudio de investigación (este último un pleonasmo calcado de research study e innecesario en español[9]), que resulta muy útil para aportar variedad de sinónimos al texto, tal como se apuntaba en párrafos anteriores. El traductor debe mantenerse alerta ante estos términos, recordando que el autor es un técnico versado en el diseño de ensayos clínicos pero el lector, no, y recurrir a términos trasparentes o perífrasis explicativas, como pueden ser asignar por aleatorizar o el placebo (sustancia inactiva), etc.
El segundo grupo (30%) que más llama la atención de los CEIC son los tecnicismos médicos, cuando piden que se corrijan anglicismos o malas traducciones (como espécimen por muestra o niño no nacido por feto) o que se mejoren las definiciones aportadas de algunos términos, por ejemplo: «La sinusitis fúngica no es una “hinchazón de las fosas nasales”». Intervienen aquí dos cuestiones básicas para el traductor especializado en medicina: en primer lugar, debe conocer muy bien la terminología médica correcta en español, como es obvio; pero en segundo lugar, y quizás esto sea menos evidente, debe respetar la tradición en las definiciones, tratándolas casi como unidades léxicas fijas; en este caso, en español siempre empezaríamos definiendo la sinusitis, como casi cualquier término con el sufijo -itis, como una inflamación, no una hinchazón. Esto también se debe a un problema de traducción, ya que en el original se empleó swelling para rebajar el registro de inflammation, un término percibido por su origen latino como más culto, pero este recurso en español carece de sentido porque los términos latinos son mucho más claros para el hablante medio.
En tercer lugar (22,14%) figuran los términos jurídicos, especialmente los que guardan relación con la protección de datos de carácter personal o con la historia clínica, por ejemplo cuando piden «[…] cambiar “eliminar” por “cancelar”, dado que ésta es la denominación correcta de este derecho contemplado por la LO 15/1999» o «Cambiar la expresión “notas médicas” por “historia clínica”». Como se ha dicho ya, el apartado relativo al tratamiento de datos es especialmente sensible y el traductor debe conocer bien el tecnolecto correspondiente para producir un texto que surta los efectos legales contemplados en nuestro ordenamiento; por ejemplo, conviene recordar que en España hablamos de datos personales de salud en vez de información médica (medical information), de cesión en lugar de compartir (share), de responsable del tratamiento en lugar de controlador (data controller), de tratamiento de datos en lugar de procesamiento (processing), de cancelación en lugar de destrucción (destroy), etc., aunque sin duda las que más críticas suscitan son las malas traducciones de release y disclose, que no es divulgar, sin autorizar el tratamiento o comunicar.
Los CEIC se fijan también en términos de la lengua general (10%), por ejemplo razonable o pedir (calcos de reasonable y ask) en las peticiones siguientes: «[…] sustituir “gastos razonables” por “los gastos que se ocasionen al paciente como consecuencia de su participación” […]» o «Decir “Se le invita a participar” en vez de “Se le pide que participe”».
Aspectos culturales y conceptuales
En primer lugar destacan los problemas de adaptación a la sanidad española (38,89%), que comprenden tanto el funcionamiento económico de nuestro sistema universal como la situación de las prestaciones o de los fármacos mencionados en el texto, que vertidas literalmente en una traducción acrítica dan resultados carentes de sentido en nuestro medio.
Por ejemplo, los CEIC solicitan que se eliminen frases y expresiones como «usted es responsable de su cobertura sanitaria desde el punto de vista económico» o «autorización para proporcionar sus facturas del médico y del hospital», procedentes de un sistema sanitario privado gestionado con seguros individuales y copagos. De nuevo quizás pueda pensarse que el traductor no está facultado para eliminar estos fragmentos, y sin duda no debería hacerlo a la ligera, pero el traductor es también un mediador cultural, y como tal puede asesorar al cliente y proponerle las modificaciones que procedan para que el texto meta se ajuste correctamente al entorno de llegada.
Más importante si cabe es el conocimiento de las prestaciones sanitarias en nuestro medio; por ejemplo, cuando en el original se mencionan marcas comerciales de fármacos, habrá que comprobar si en España son las mismas y si no, cambiarlas, tal como exigen los CEIC: «Los nombres de antiácidos referidos son de marcas comerciales americanas. Cambiar por Almax, etc.». Otras veces no habrá simetría entre la cultura de partida y la de llegada, como en el caso de los anticoagulantes más utilizados; lo pone de manifiesto la siguiente petición, según la cual habría que mencionar un principio activo distinto como ejemplo porque en España es el más habitual (el acenocumarol donde en inglés decía Coumadin® o warfarina): «[…] debe mencionarse claramente que el acenocumarol (Sintrom®) es el medicamento anticoagulante estándar en España […]».
También puede ocurrir que un fármaco que en Estados Unidos se adquiere en farmacia o se administra en el domicilio sea en España de dispensación exclusivamente hospitalaria, con lo cual carecerán de sentido las indicaciones de que el paciente devuelva la medicación o la conserve según las instrucciones del médico; los CEIC no pasan estas cuestiones por alto: «Eliminar “se le pedirá que devuelva la medicación no utilizada” puesto que son tratamientos intravenosos y no los va a tener el paciente en su casa». El traductor debe entender a fondo el tema del que traduce y, aunque no se tome la libertad de suprimir por su cuenta estas informaciones inapropiadas, debería poder detectarlas para avisar al cliente.
Con un 27,78%, siguen las peticiones de modificación o adaptación de los organismos oficiales y la legislación y reglamentos mencionados. Si bien es habitual que el documento de CI pase un proceso de adaptación a la realidad jurídica española antes de la traducción[10], en muchos casos, ya sea por las prisas o por el uso de plantillas, persisten cuestiones como éstas en los textos que se mandan a traducir. Los CEIC piden que se supriman las referencias a la FDA como autoridad de registro farmacéutico o que en todo caso se mencionen también la AEMPS y la EMA, y lo mismo en relación con las disposiciones legales: «Suprimir el párrafo “Las regulaciones federales de privacidad de EEUU […]”. La regulación de privacidad de EEUU no es aplicable en nuestro medio». Los CEIC insisten en que se mencionen claramente las disposiciones legales de aplicación en España —sobre todo la Ley Orgánica 15/1999, la Ley 14/2007 y el Real Decreto 223/2004— y aunque es habitual que ya se hayan incluido en la adaptación previa (9), en un texto formal deben citarse por su nombre completo oficial (rango de disposición, fecha de promulgación entre comas y denominación), como deja patente esta petición: «Indicar el nombre completo del RD 223/2004».
También encontraremos menciones a los IRB (institutional review boards), que en un texto para España deberían convertirse siempre en «comités éticos de investigación clínica» porque así es como se llaman estas comisiones en nuestro país; en la siguiente petición, por ejemplo, vemos que los miembros del CEIC ni siquiera entendían de dónde procedían las siglas «JIR» y «CE» (por junta institucional de revisión y comité de ética): «Detallar qué es “JIR y CE”».
Por último, otro aspecto cultural que centra la atención de los CEIC es la adaptación de los pesos y medidas (8,89%) al sistema métrico decimal, que sí compete claramente al traductor. Se trata sobre todo de las medidas de volumen referidas a cantidades de sangre a extraer o de líquidos que debe consumir el paciente; así, donde en inglés se indique que one teaspoon of your blood will be collected, en español habremos de decir que se extraerá una muestra de 5 mililitros; donde recomiende al paciente tomar la dosis con 8 fluid ounces of water, en español diremos junto con 250 ml de agua, aunque el equivalente exacto de ocho onzas sean 236 ml, porque ésa es la medida aproximada que tiene de un vaso la mente colectiva de la cultura de llegada.

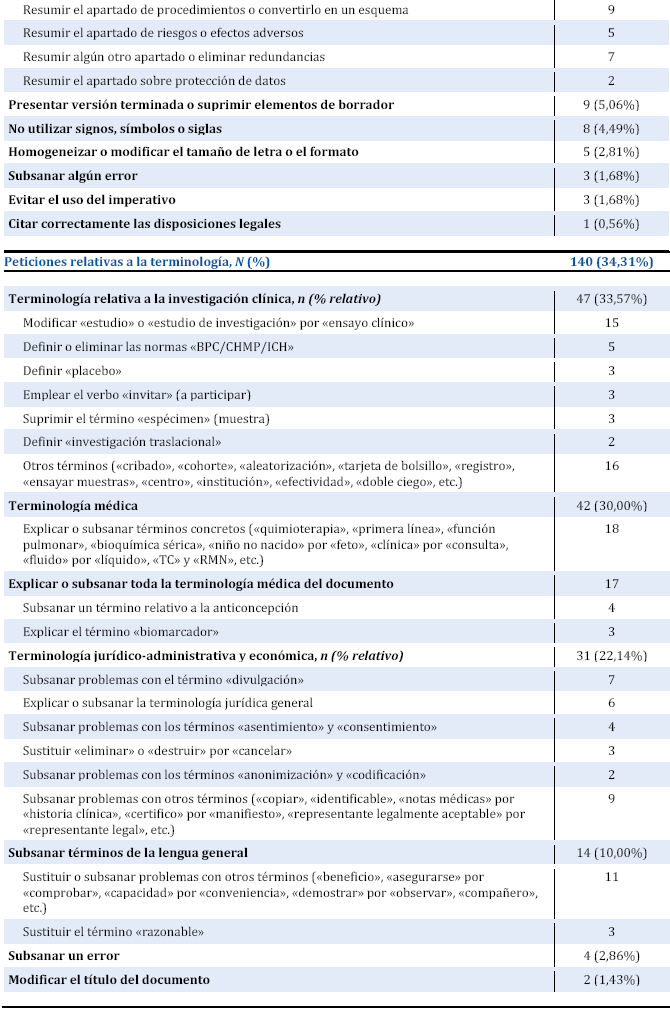
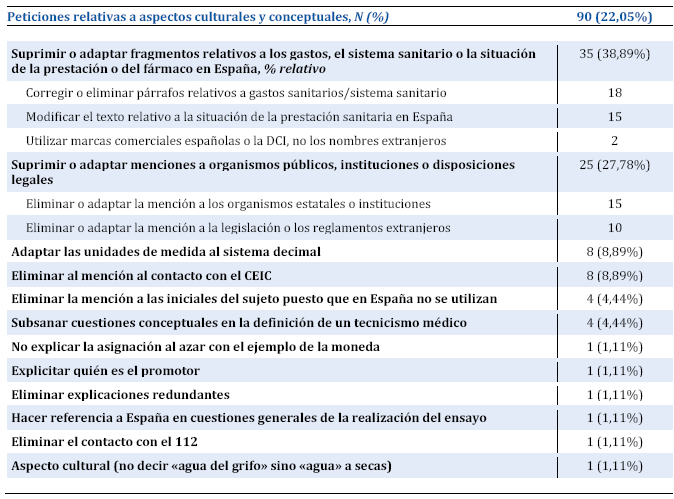
Tabla 2. Clasificación de los tipos de peticiones relevantes formuladas por los CEIC.
Discusión
El método científico difícilmente es aplicable a las humanidades, y mucho menos a debates subjetivos como qué es la calidad en la traducción. Por eso, el presente análisis puede considerarse objetivo hasta la descripción cuantitativa de la muestra de solicitudes: no habrá duda en considerar qué peticiones atañen al CI y cuáles, a otros documentos o a los aspectos metodológicos del ensayo. Ahora bien, el análisis cualitativo sí es susceptible de diversas interpretaciones, según lo que entienda cada cual que concierne o no concierne al trabajo del traductor. Así, un intento de reproducir este estudio desde la perspectiva de alguien con una concepción distinta de nuestro trabajo o de la involucración que debemos alcanzar posiblemente arrojaría resultados distintos.
Para este análisis se ha aplicado un criterio laxo a la hora de definir qué es relevante para el traductor, como se ha ido comentando punto por punto, y presupone un grado de colaboración estrecha entre el traductor y el responsable último de la confección del documento en nuestro país o de su tramitación ante las autoridades, por ejemplo del departamento competente de una CRO o del laboratorio promotor; podríamos decir pues que se le presupone al traductor una función casi análoga a la del redactor médico. Por tanto, en las situaciones reales, no todas las recomendaciones formuladas serán válidas, pero sí pretenden reflejar el que sería el grado idóneo de participación de un traductor en un proceso con un claro componente de adaptación cultural como es el que nos ocupa.
Conclusiones
Los documentos de consentimiento informado (CI) en el ámbito de la investigación clínica siguen presentado diversos problemas en cuanto a estilo, terminología y adecuación cultural, como ya han denunciado otros autores, y parece que una de las causas son las traducciones deficientes o demasiado literales. La mayoría de las aclaraciones solicitadas por los CEIC atañen a estos documentos y un porcentaje importante de estas aclaraciones tiene relevancia para el trabajo del traductor o del redactor científico-médico.
El traductor que se ocupe de estos documentos no sólo debe dominar a la perfección la lengua castellana y respetar las reglas de oro de la traducción —decir todo lo que dice el original, no decir nada que el original no diga y decirlo todo con la corrección y la naturalidad que permita la lengua a la que se traduce (4)— sino que además debe poseer un elevado grado de especialización y conocer muy bien la realidad de la investigación clínica y el entramado jurídico-administrativo en el cual se desarrolla, para poder expresar sus conceptos con fluidez y naturalidad.
Retomando la idea expresada por otros autores sobre lo sensible y delicado de la situación comunicativa en la que se enmarca el consentimiento informado en la investigación clínica[11], la calidad de la traducción de estos textos, más allá de la responsabilidad profesional y deontológica del traductor, constituye un deber ético para con los pacientes.
[1] En este trabajo se entiende por documento de consentimiento informado («CI») tanto la parte de información para el paciente (la «hoja» de información) como la declaración de consentimiento informado propiamente dicha.
[2] Ordovás Baines, Juan Pablo y cols. (1999): «Análisis de las hojas de información al paciente para la obtención de su consentimiento informado en ensayos clínicos». Medicina Clínica (Barcelona) 1999; 112:90-4, vol. 112, núm. 3.
[3] Gálvez Múgica, M. Á. y De Pablo López de Abechuco, I. (2007): «El proceso de evaluación de un ensayo clínico desde la perspectiva de un comité ético de investigación clínica». Rev Clin Esp 2007; 207(1): 29-33.
[4] López-Parra, María, Moreno-Quiroga, Coloma. Lechuga-Pérez, Javier (2012): «Revisión de las observaciones más frecuentes en la hoja de información al paciente para ensayos clínicos». Medicina Clínica (Barcelona) 139: 176-179.
[5] Regla formulada en 1970 por el célebre académico y traductólogo Valentín García Yebra en la primera edición de su traducción de la Metafísica de Aristóteles. Véase también: García Yebra, Valentín (1997): Teoría y práctica de la traducción. Madrid: Gredos (tercera ed.), pág. 45.
[6] Proyecto BEST (Investigación Clínica con Medicamentos) (2012): «BDMetrics. Datos y análisis de la 12.ª publicación» [presentación de PowerPoint]. 27 de septiembre de 2012. En línea: http://www.medicamentos-innovadores.org.
[7] Dal-Ré, Rafael, Morejón, Elena y Ortega, Rafael (2004): «Tipo y magnitud de los cambios requeridos por los comités éticos de investigación clínica en las hojas de información para el paciente en los ensayos clínicos multicéntricos internacionales». Medicina Clínica (Barcelona) 2004: 123(20): 770-774.
[8] López Ciruelos, Andrés (2002): «El mito de la brevedad del inglés». Panacea 3 (9-10): 90-95. En línea: http://www.tremedica.org/panacea/IndiceGeneral/Pana9_revision_lopezciruelo.pdf.
[9] Gallego Borghini, Lorenzo (2014): «Cinco términos de investigación clínica en el Libro rojo». Blog de Cosnautas, 11 de marzo de 2014. Cosnautas. En línea: http://www.cosnautas.com/blog/58-cinco_teminos_de_investigacion_clinica.html.
[10] Fernández Piera, María y Ardura Ortega, Mónica (2012): «Adaptación del consentimiento informado a la legislación española en los ensayos clínicos internacionales». Panacea 13 (36): 291-293. En línea: http://www.tremedica.org/panacea/IndiceGeneral/n36-revistilo_MFPiera-MArduraOrtega.pdf.
[11] Villegas, Álvaro (2008): «Análisis de los requisitos de idioma en la legislación española sobre ensayos clínicos». Panace@ IX (28): 64-66. http://www.tremedica.org/panacea/IndiceGeneral/n27_tribuna-villegas.pdf.
Fecha de recepción: 29 de marzo de 2014
Fecha de aceptación: 18 de julio de 2014














