Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Sanidad Militar
versión impresa ISSN 1887-8571
Sanid. Mil. vol.67 no.3 Madrid jul./sep. 2011
https://dx.doi.org/10.4321/S1887-85712011000400004
PREMIO FIDEL PAGÉS MIRAVÉ 2011
Desarrollo de una nueva forma farmacéutica líquida necesaria en una situación de accidente nuclear
Development of a new liquid pharmaceutical form needed in a situation of a nuclear accident
Juberías Sánchez A.1, Verón Moros M.2, Cabrera Merino J.I.1, Zamanillo Sainz A.3, Broncano Berenguer F.J.4
1Tcol. Farmacéutico. Centro Militar de Farmacia de la Defensa. Burgos. España.
2Lda. en Farmacia. Centro Militar de Farmacia de la Defensa. Madrid. España.
3Tcol. Farmacéutico. Inspección General de Sanidad de la Defensa. Madrid. España.
4Col. Farmacéutico. Centro Militar de Farmacia de la Defensa. Madrid. España.
Dirección para correspondencia
RESUMEN
Introducción: La administración de yodo estable, en forma de yoduro, es empleado como protector frente a los efectos nocivos de la radiación, esta pauta profiláctica también es asumida por la OTAN en su STANAG 2461 NBC/MED. El dificultoso suministro a determinados grupos de población, con dificultades en la deglución, de formas orales sólidas de yodo estable, obliga a disponer de determinados preparados que soslayen los inconvenientes de estas formas farmacéuticas y faciliten la administración de este activo.
Lugar de realización: Centro Militar de Farmacia de la Defensa.
Objetivo: Diseñar y evaluar una preparación estable de yoduro potásico en solución, para administración oral, que complete la laguna existente en el arsenal terapéutico español y europeo. Producción y validación del proceso a escala industrial de una solución oral de yoduro potásico. Definición de los parámetros indicativos de la calidad del producto. Evaluación de la estabilidad del preparado. Tratamiento estadístico de los resultados obtenidos.
Material y métodos: Componentes del producto fabricado. Equipos de proceso y control utilizados en la fabricación farmacéutica industrial de soluciones. Definición de límites aplicados a especificaciones de producto. Estudio de estabilidad según protocolo ICH 1QE para zonas climáticas III y IV sobre los lotes industriales fabricados. Paquete estadístico SPSS versión 15.
Resultados: Los resultados corroboran la calidad y estabilidad de tres lotes industriales sometidos a estudio (Volumen envasado 18-22 ml; densidad: 1,100-1,300 g/ml; pH:5,5-6,5; contenido yoduro: 90%-110%, yodo molecular ≤ 2%; aerobios totales a 37oC y 25oC<100 col/g; ausencia microorganismos patógenos). El nivel de significación obtenido en el análisis de varianza en la uniformidad de volumen, densidad, pH, contenido de yoduro y valoración de Yodo libre es superior a 0,05. Los lotes cumplen valores establecidos para todas las especificaciones durante 2 años. En tercer y cuarto año se observa deterioro del envase y elevación de la concentración de la solución, sin ninguna otra alteración.
Discusión: La ausencia de significación en la comparación de las medias, en las variables estudiadas en los tres lotes, muestra que el proceso es robusto y repetitivo. Los resultados de estabilidad permiten asignar un periodo de validez de al menos 2 años. El mantenimiento de las especificaciones del producto, salvo la concentración de la solución, a pesar del deterioro observado en el envase, permite asegurar un elevado grado de estabilidad de la fórmula diseñada.
Conclusiones: Se diseña y fabrica a escala industrial una solución estable de yoduro potásico. Los datos obtenidos, referentes a la calidad del producto fabricado, permiten asegurar la ausencia de variaciones significativas entre los diferentes lotes estudiados, demostrando el adecuado diseño del proceso. Los datos obtenidos permiten asegurar, igualmente, un comportamiento estable de la solución, tanto desde el punto de vista químico como microbiológico, al menos durante dos años.
Palabras clave: Accidente nuclear. Yoduro potásico. Solución oral. Grupos de población especiales.
SUMMARY
Introduction: The administration of stable iodine in the form of iodide, is used as a buffer against the harmful effects of radiation, this prophylactic regimen is also assumed by NATO STANAG 2461 in NBC / MED. The difficult delivery to specific population groups with difficulties in swallowing solid oral forms of stable iodine, requires the availability of certain preparations that would circumvent the disadvantages of these formulations and facilitate the management of this asset.
Place: Center Pharmacy Military Defense.
Objective: Design and to evaluate a stable preparation of potassium iodide in solution for oral administration to complete the gap in the Spanish and European therapeutic arsenal. Production and validation of industrialscale process of an oral solution of potassium iodide. Defining the parameters which determine the quality of the product. Evaluation of the stability of the preparation. Statistical treatment of results.
Material and methods: Components manufactured product. Process and control equipment used in industrial pharmaceutical manufacturing solutions. Definition of limits applied to product specifications. Stability study according to protocol 1QE ICH climatic zones III and IV on manufactured industrial lots. SPSS version 15.
Results: The results corroborate the quality and stability of three industrial lots under study (18-22 ml packed volume, density :1,100-1, 300 g / ml, pH :5,5-6, 5; iodide content: 90%-110%, molecular iodine <2% total aerobes at 37o C and 25o C <100 col / g; no pathogens). The level of significance obtained from analysis of variance in the uniformity of size, density, pH, content of iodine and free iodine value is greater than 0.05. The values set for lots meet all specifications for 2 years. Third and fourth year there is damage to the packaging and elevated concentration of the solution, without any alteration.
Discussion: The absence of significance in the comparison of the means in the variables studied in the three lots, shows that the process is robust and repetitive. The results of stability allow to assign a validity period of at least 2 years. The upkeep specifications product, despite the deterioration observed in the package, ensures a high degree of stability of the scheme drawn up.
Conclusions: A stable solution of potassium iodide has been designed and manufactured on an industrial scale. The data obtained concerning the quality of the manufactured product helps to ensure the absence of significant variations between different batches studied, confirming that process design is the proper. The data obtained allow us to ensure, also a stable behavior of the solution, both from the standpoint of chemical and biological.
Key words: Nuclear accident. Potassium iodide. Oral solution. Special populations.
Introducción
El yodo es un oligoelemento esencial para nuestro organismo y está especialmente implicado en la síntesis de hormonas tiroideas. La administración de yodo estable, en forma de yoduro, es empleado como protector frente a los efectos nocivos de la radiación. El mecanismo de acción consiste en provocar una saturación de la citada glándula con el fin de impedir la captación de yodo radioactivo1.
La exposición a radiaciones de origen artificial puede estar originada por accidentes nucleares voluntarios, como en caso de guerras nucleares, incidentes terroristas; o involuntarios, como en el caso de fugas radioactivas de centrales nucleares, buques de propulsión nuclear, etc.
Para la medida de la dosis absorbida por algunos órganos, en concreto el tiroides, se utiliza el gray (Gy) y sus fracciones. Todas estas unidades del Sistema Internacional han sido aceptadas por los países pertenecientes a la OTAN para unificar criterios2.
Los límites de dosis actualmente vigentes en España se recogen en el Reglamento de Protección Sanitaria contra Radiaciones Ionizantes3. En él se establecen límites anuales para el público y para trabajadores que puedan estar expuestos profesionalmente.
Son numerosos los antecedentes que manifiestan el uso de yoduro potásico como agente protector frente a las radiaciones. La FDA (Food and Drug Administration) estadounidense en el Registro Federal de 15 de diciembre de 19784, anunció como conclusión, el uso de yoduro potásico como medio seguro y efectivo para el bloqueo de la glándula tiroidea tras exposición a yodo radiactivo, bajo ciertas condiciones específicas de uso. En el Registro Federal de 29 de junio de 1982, la FDA anunció finalmente la recomendación de administrar a la población yoduro potásico en caso de emergencia por radiación, cuando la radiación sea superior a 250 mSv5.
La NRC (Nuclear Regulatory Commission), organismo asimismo estadounidense, en 19976 consideró como norma el uso de yoduro potásico dentro de los planes de emergencia. La ATA (American Thyroid Association) en 1997 y través de su comité consultivo (Public Health Committee) recomendó sólidamente el uso de yoduro potásico como profilaxis frente a accidentes nucleares. La WHO (World Health Organization) en 19997 a través de una guidelines recomendó el uso de yoduro potásico tras un accidente nuclear.
Después de la cuidadosa revisión de los datos relativos al accidente de la planta nuclear de Chernobyl, nuevamente la FDA, en 20018 publica su última Guidance, referente a las recomendaciones para la administración de yoduro potásico, como agente bloqueante del tiroides, basada en la edad y exposición con el fin de obtener una óptima profilaxis.
Esta pauta profiláctica también es asumida por la OTAN en su STANAG 2461 NBC/MED9, y es la profilaxis que se está llevando a cabo en la actualidad en Japón, como consecuencia del terremoto que ha provocado una situación de emergencia nuclear en la central de Fukushima.
El inadecuado suministro de esta especie química, ya sea debido a inestabilidad de la sustancia activa o a un incumplimiento de la pauta posológica profiláctica, puede originar un fracaso de las medidas tendentes a reducir la nociva influencia de la radiación nuclear. En este sentido, el Comité Científico de las Naciones Unidas para los efectos de la radiación Atómica (UNSCEAR), en su informe de 6 de junio de 2.000, descubre que los efectos relacionados directamente con las radiaciones, en la población general afectada por el accidente de Chernobyl, han consistido en un incremento agudo de los cánceres de tiroides en niños, no evidenciándose ningún otro impacto en la población, atribuible a la exposición, catorce años después del accidente. Algunas publicaciones10 establecen que el riesgo es máximo en niños, adolescentes y mujeres embarazadas.
Desde el punto de vista militar, la doctrina OTAN establece una adecuada gestión del riesgo producido por un incidente NBQR (nuclear, biológico, químico y radiológico)11-13 que incluye contramedidas médicas así como preparaciones farmacéuticas. La capacidad preventiva en un ambiente NBQR determinando, incluye aplicación de medidas profilácticas y curativas14, entre las que cabe considerar el bloqueo tiroideo de las fuerzas expuestas a posibles radiaciones.
En el ámbito cívico-militar los países aliados aprobaron en Praga una serie de medidas destinadas a potenciar sus planes de defensa, frente a un posible ataque con armas nucleares, biológicas, químicas o radiológicas; entre ellas se consideran una mejora de los equipos de protección de las fuerzas y el apoyo a las autoridades civiles en caso de emergencia15.
La efectividad del Yoduro potásico está relacionada con el periodo de tiempo transcurrido desde la exposición1. La capacidad protectora se cifra en un 97% si el suministro se efectúa de manera simultánea a la exposición, en un 90 a un 70% si se hace 24 horas antes de la exposición y en un 85 al 50% si se lleva a cabo entre 1 y 3 horas posteriores a la exposición; mientras que, la eficacia del bloqueo del tiroides será prácticamente nula transcurridas 24 horas. Resultará, por tanto, de vital importancia, procurar un suministro rápido, seguro, cómodo y bajo una forma farmacéutica estable de las dosis de yoduro potásico requeridas por la población.
Para conseguir el bloqueo tiroideo, se suministra yoduro potásico en comprimidos o cápsulas de gelatina dura. En determinados grupos de población, con dificultades en la deglución, el uso de estas formas farmacéuticas dificultará tanto su administración, como el mantenimiento de la pauta posológica establecida para ellos, por lo que en ocasiones será necesario llevar a cabo determinado tipo de manipulaciones16 que pueden ser fuente de errores.
En relación con lo indicado, el CDER (Center for Drug Evaluation and Research) de la FDA8, reconoce que en situaciones de emergencia, las especificaciones de dosificación para determinados estratos poblacionales puede ser complicado; debido a ello, las recomendaciones referidas a las dosis proporcionadas deberían ser interpretadas con flexibilidad; no obstante, se enfatiza que los beneficios proporcionados por el suministro de yoduro potásico, como bloqueante tiroideo, superan los posibles riesgos derivados de la sobredosificación, especialmente en niños.
En este mismo sentido, el citado informe de UNCSEAR, de junio de 2000, alude a la inferior protección de la población infantil frente a radiaciones originadas por el accidente nuclear; esta menor protección tiene su origen en una ausencia de formas farmacéuticas adecuadas para el suministro del ión yoduro, con las debidas garantías de eficacia, seguridad y calidad, que debe proporcionar un medicamento; tal y como se refleja en el sumario del National Center for Disasters Preparedness (Columbia University) 200317, según el cual debería facilitarse el desarrollo de formas pediátricas para administración de yoduro potásico. También el Proyecto Bioshield (US Department of Health and Human Services), aprobado en 2004, con la intención de acelerar la investigación, desarrollo, adquisición y disponibilidad de las denominadas contramedidas médicas frente a los efectos adversos de agentes NBQR, utilizados en bioterrorismo contempla la necesidad de disponer de solución de yoduro potásico, en cuanto puede ser más fácilmente suministrada a niños en lugar de comprimidos18,19. Esta deficiencia es satisfecha en el mercado estadounidense con la aprobación por la FDA, del medicamento Thyroshield solución (Fleming & Company, Pharmaceuticals).
Esta situación, es también puesta de manifiesto en nuestro país; concretamente, la Unidad de Protección Civil, de la Subdelegación del Gobierno de Burgos, en el ámbito del Plan de Emergencia Nuclear de la Provincia de Burgos (PENBU), solicita al Centro de Farmacia del Ejército del Aire (Burgos), en octubre de 2001, la posibilidad contemplar una formulación y presentación farmacéutica de yoduro potásico para niños muy pequeños; esta petición se basa en el mencionado informe del UNSCEAR. A raíz de la misma se inician estudios tendentes a dotar al arsenal de medicamentos NBQR del petitorio de Farmacia Militar con un medicamento que satisfaga ese requerimiento. Hasta la fecha no se dispone en el arsenal terapéutico español ni europeo de una preparación estable de yoduro potásico en solución diseñada para la administración a todos los sectores de la población.
El inconveniente de preparar soluciones extemporáneas de yoduro potásico16 radica en su elaboración doméstica, en la que no se tiene en cuenta la estabilidad del yoduro potásico disuelto en estos líquidos, pues su única finalidad es disolver y enmascarar el sabor del yoduro potásico, sin certeza de la dosis suministrada, además una vez preparada debe mantenerse en refrigeración por un corto periodo de tiempo, al no disponer de estudios que avalen la estabilidad de la solución obtenida. Además, se ha comprobado la dificultad de mantener la pauta terapéutica, cuando es necesaria la manipulación del medicamento de manera previa al suministro, observándose un incremento el error en la misma20.
Para la elección de la nueva forma farmacéutica se estudian las diferentes alternativas, que se disponen al uso de formas orales y sólidas, que son las que a continuación se indican:
- Soluciones para uso oral
- Soluciones para uso parenteral
- Supositorios
Las soluciones para uso parenteral son descartadas, ya que no permiten una autoadministración de forma masiva en la población.
El uso de supositorios, si bien evita problemas derivados del mal sabor u olor de los medicamentos, la absorción de numerosos principios activos es errática, ya que se produce a través de las venas hemorroidales21, lo que desaconseja su utilización al impedir un mantenimiento adecuado de los niveles plasmáticos22.
Las soluciones para administración oral son las que presentan más ventajas para el objeto de este estudio entre otras presentan las siguientes:
- Buena aceptación por facilidad de ingestión (pediatría, geriatría, etc). Fácil utilización y deglución.
- Mayor biodisponibilidad que las formas sólidas. Mejor absorción. Actúa más rápidamente.
- Concentración determinada (%p/v) y fácil dosificación. A demás, se consideran las mejores formas de dosificación en casos de pacientes dependientes de un tercero que suministre la dosis20.
Por contra, presentan los siguientes inconvenientes:
- Una estabilidad comprometida y riesgo de contaminación alto, por lo que es necesario el uso de conservantes
- Difícil enmascarar malos caracteres organolépticos
- Las formulaciones son complejas, con la utilización de un gran número de sustancias coadyuvantes (solubilizantes, conservantes, estabilizantes, cosolventes, edulcorantes, aromatizantes, reguladores pH, viscosidad etc.)
- No se puede administrar a pacientes inconscientes
- Acondicionamiento caro, frágil y de gran volumen
- Presentan un mal comportamiento en condiciones ambientales extremas (Congelación, evaporación, ajuste cierre envase)23.
Los inconvenientes descritos, deberán solventarse con un adecuado diseño de la formulación, del envase y los correspondientes estudios que demuestren la validez de la preparación en el tiempo.
Objetivo
Desarrollo y estudio de un nuevo medicamento de Yoduro Potásico bajo forma farmacéutica de solución para administración oral en envases de 20 ml conteniendo 65 mg/ml, con gotero para administración de las dosis adecuadas, desde 0,25 ml a 1 ml, necesaria para un grupo de población, que por sus características especiales no son capaces de deglutir correctamente un sólido oral (comprimido o cápsula de gelatina dura).
Proponer una fórmula partiendo de la información obtenida en la preformulación del activo, y realizar un estudio de los excipientes más adecuados conservantes, antioxidantes, enmascaradores del sabor, reguladores de pH, etc.
Aplicar un estudio de estabilidad que demuestre la validez de la fórmula seleccionada a lo largo del tiempo de caducidad propuesto. Así mismo, se deberá comprobar la idoneidad del envase elegido, mediante estudios de fotoestabilidad con exposición controlada a radiación luminosa visible, al tratarse el ión yoduro de una especie fotosensible.
Material y métodos
Diseño de la solución
La solubilidad en agua de la molécula de yoduro potásico es elevada (1g/0,7ml)24. En relación con su estabilidad, el ión yoduro puede degradarse a yodo molecular o ión yodato, estas especies químicas carecen de efecto protector sobre la glándula tiroidea; esta degradación se produce por exposición al aire o a la luz. La presencia de yodo origina un color amarillento y pardeamiento del yoduro potásico. Esta alteración obliga a su almacenamiento en contenedores bien cerrados y protegidos de la luz25. Un medio ligeramente alcalino y/o la adición de compuestos reductores retrasan esta degradación26.
Respecto a sus propiedades organolépticas, cabe considerar el sabor, demasiado salado para beber16, de la solución de yoduro potásico, por lo que puede ser rechazada por el consumidor, sobre todo si es de corta edad; justificándose, por tanto la utilización de agentes saborizantes enmascarantes.
En las preparaciones líquidas para uso oral el vehículo empleado se elige teniendo en cuenta la naturaleza del principio activo. Partiendo de la información obtenida en la preformulación del activo, se realiza un estudio de los excipientes más adecuados, conservantes, antioxidantes, enmascaradores del sabor, reguladores del pH, etc. Se propone la fórmula recogida en la Tabla 1, en orden a las características de sus componentes, descritas a continuación. El diseño busca conseguir una sencilla fabricación, ya que todos sus componentes son solubles en agua, unas características organolépticas agradables debido a la población a la que va destinada, y con un número mínimo de excipientes, ya que en situación de emergencia su adquisición podría complicar el éxito de una rápida fabricación. El acondicionado se lleva a cabo en envases multidosis de plástico color topacio, polipropileno rígido, con tapón provisto de una cánula dosificadora por gotero, cuyo dispositivo es apropiado para medir el volumen de dosificación prescrito.
Materias primas y materiales de acondicionamiento empleados en la formula patrón propuesta
- Yoduro potásico cristalizado con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por la Farmacopea Española27. Es el principio activo cuyas características principales es su alta solubilidad en agua y su facilidad para la oxidación.
- Sorbitol con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por la Farmacopea Española27. Actúa como un vehículo adecuado para la sustancia activa inhibiendo la cristalización, proporcionando una acción edulcorante apta para diabéticos, enmascarando además el sabor metálico de la sacarina, y aumentando la palatabilidad.
- Sacarina con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por la Farmacopea Española27. Actúa como edulcorante, el sabor dulce es la primera sensación que ofrece a las papilas gustativas.
- Ácido cítrico con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por la Farmacopea Española27. Actúa como regulador del pH para conferir una mejor estabilidad química manteniendo la forma iónica y evitando la oxidación. También ayuda a enmascarar el sabor debido a la acción sinérgica con los aromatizantes frutales. Y por ultimo coadyuvante en la conservación, incrementando la efectividad del conservante antimicrobiano.
- Citrato potásico con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por la Farmacopea Española27. Actúa como pareja Buffer reguladora del pH junto con el ácido cítrico para poder mantener el pH adecuado a lo largo del tiempo.
- Colorante naranja con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por Real Decreto 1465/2009 de 18 de septiembre28. Se establece su uso para obtener un medicamento con color consistente uniforme y estable de apariencia agradable, que de confianza al paciente al que va destinado, con el objetivo de ayudar a seguir el tratamiento. Y acorde con los correctores del sabor.
- Esencia de melocotón con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por el Real Decreto 1477/1990 de 2 de noviembre29. Es un aromatizante utilizado para la corrección del sabor. La preferencia en niños suelen ser preparaciones dulces con sabor a fruta, por lo que se seleccionó dicha esencia.
- Metabisulfito potásico con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por la Farmacopea Española27. Es el conservante de elección en esta formulación, limita, retarda y previene la proliferación de microorganismos. Es utilizado como antioxidante y antiséptico, su uso está altamente avalado a lo largo de la historia y ha sido muy utilizado en jugos de fruta y vinos. Otros conservantes que se estudiaron para introducirlos en esta formulación fueron los Benzoatos y los Parabenos, cuyo uso está muy extendido, pero se descartaron por los siguientes motivos: El benzoato sódico está presente en la mayoría de las bebidas gaseosas y refrescos pero hay numerosos estudios que avalan la existencia de una posible toxicidad, sobre todo en niños30. Parabenos son de menor toxicidad, pero proporcionan, incluso a bajas dosis, cierto olor y sabor fenólico.
- Agua purificada con criterios de pureza y calidad de acuerdo a las especificaciones establecidas por la Farmacopea Española27. Es el vehículo disolvente de la sustancia activa y de los excipientes sólidos.
- Acondicionamiento primario. Se escoge un envase de polipropileno rígido color topacio con tapón provisto de una cánula dosificadora por gotero, de 20 ml.
- Acondicionamiento. Se utiliza un estuche de cartoncillo, incluyendo un prospecto.
Materiales y equipos utilizados
Materiales
- Yoduro potásico patrón lote F-67029
- Agua desionizada
- Estándares de pH (4,7,14)
- Yodato potásico 0,05M
- Ácido clorhídrico al 37%
- Tiosulfato sódico 0,01N
- Biobolas tituladas de patógenos (E.coli, P. aeruginosa, C. albicans y S. aureus)
- Medio Agar B y C en placa
- Cloruro sódico estéril
Equipos para el control analíticos
- Probeta de 50 ml.
- Densímetro ANTON PAAR
- Peachímetro digital Crison.
- Potenciómetro Crison Compact Titrator, con electrodo RE-DOX
- Vaso de plástico de 100ml
- Balanza Mettller Toledo A 260
- Cabina de seguridad microbiológica y biotecnológica BIO-II-A
- Estufas de cultivo Selecta INCUDIGIT 80L
Equipos para la fabricación de los lotes
- EQUIPO ELIX Millipore, para la producción de agua purificada
- Cabina de pesaje y Equipo de pesaje industrial, Mettler
- Depósitos con agitación y calentamiento de 100 L, E .Bachiller
- Sistema de filtración clarificante, Millipore
- Bomba de transvase, Sertec
- Llenadora de líquidos J. Esquerda
- Loteadora Image 9020
Equipos para los ensayos de estabilidad
- Cámara climática Modo: Binder KBF 115 con humedad y temperatura controlada (20o a 70oC) / (0 a 100% HR)
- Cámara climática Modo: Binder KBF 240 con humedad y temperatura controlada (20o a 70oC) / (0 a 100% HR) y sistema de iluminación ICH con una fuente de iluminación en fluorescencia blanca-fría y U.V. próximo, (5 lámparas en cada puerta) con una potencia de 4000 lux (1,7 UVA W/qm)
- Equipos descritos en el punto 2.2
Métodos para el control de la fórmula propuesta
De acuerdo al contenido de la International Conference on Harmonization ICH Q6A "Especificaciones para nuevos principios activos y nuevos medicamentos: sustancias químicas", se proponen las siguientes especificaciones, para evaluar la calidad del preparado.
Características organolépticas
Procedimiento: Observar que la solución de yoduro tenga un color amarillo anaranjado, olor característico a iodo y un aspecto homogéneo sin turbidez, ni precipitados.
Criterios de aceptación: Cumplen con las especificaciones que se establecen.
Uniformidad de volumen
Procedimiento: Se vierte el contenido de cada envase en una probeta de 50 ml, anotando el volumen. Se realiza con 10 unidades y se obtiene la media.
Criterios de aceptación: Sobre 10 unidades de cada lote, no se admitirá en ninguna de ellas, una desviación superior a un ± 10% sobre el volumen teórico de 20ml (18ml-22ml).
Densidad
Procedimiento: Se introduce la muestra problema observando que no contiene burbujas, anotamos la medición arrojada por el equipo, una vez que se haya estabilizado. Criterios de aceptación: A una temperatura entre 20o-22a, la densidad deberá estar comprendida entre 1,100 g/ml -1,300 g/ml.
pH
Procedimiento: Se estabiliza el peachímetro aproximadamente 20 minutos. Se realiza una calibración inicial para posteriormente realizar la medida de pH de la muestra. Criterios de aceptación: El pH deberá estar comprendido entre 5,5 y 6,5.
Valoración
Procedimiento: Se realiza la valoración del contenido de ión yoduro en solución por potenciometria. Se toman 5 ml de la solución a analizar de ioduro potásico a los que se añaden 40 ml de ácido clorhídrico al 37%, y se agita. El potenciómetro está provisto de un electrodo redox, y yodato potásico 0,05M como solución titradora. Se detecta el salto del potencial obteniendo los mililitros consumidos, que están directamente relacionados con el equivalente molar de la sustancia activa a examinar. (1ml solución titradora corresponde con 16,60 mg IK). Criterios de aceptación: El contenido de Yoduro potásico debe estar comprendido entre el 90 % y el 110 % de la cantidad etiquetada.
Cantidad de yodo molecular
Procedimiento: Se realiza la valoración del contenido Yodo libre en la solución mediante potenciometria. Se toman 40 ml de la solución a analizar de ioduro potásico a los que se añaden 10 ml de agua, y se agita. El potenciómetro está provisto de un electrodo redox, y tiosulfato sódico 0,01N como solución titradora. Se detecta el salto del potencial obteniendo los mililitros consumidos, que están directamente relacionados con el equivalente molar de la sustancia activa a examinar. (1ml solución titradora corresponde con 1,269 mg I2). Criterios de aceptación: El contenido de Yodo molecular deberá ser inferior al 2%.
Control microbiológico
Procedimiento: El control microbiológico se realizará según Real Farmacopea Española 3a Edición27. Criterios de aceptación:
- Recuento de microorganismos a 30o -35o: < 100 u.f.c/g
- Recuento de microorganismos a 20o -25o: < 100 u.f.c/g
- Ausencia de Patógenos (Escherichia coli, Pseudomonas aeruginosa, Cándida albicans y Staphilococcus aureus).
Eficacia del conservante
Procedimiento: Se realiza según establece la Real Farmacopea Española 3a Edición27. Criterios de aceptación: Se considera eficaz si a los 14 días se produce una reducción logarítmica del número de microorganismos viables, inicialmente sembrados, de valor 3 y a los 28 días no existe incremento de microorganismos. Para hongos la reducción logarítmica aceptada tiene valor 1 a los 14 días y no incremento a los 28 días, en relación a los valores correspondientes del inóculo sembrado.
Escalado industrial y fabricación de tres lotes piloto
El proceso industrial propuesto, se ha diseñado con la información proporcionada por los estudios de desarrollo galénico realizados. Los lotes industriales fabricados proporcionan los datos necesarios para validar el proceso y son los que se someten a estudios de estabilidad. Se conforma el lote con un tamaño teórico de 3.300 unidades (envases de 20 ml).
Proceso de producción
Se establecen las siguientes fases del proceso de producción, con el siguiente diagrama de flujo (Figura 1):
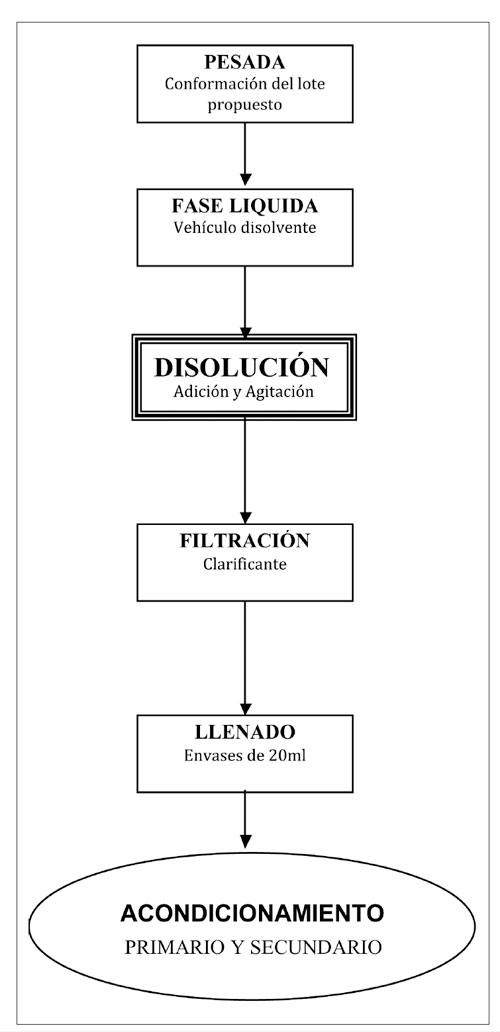
Figura 1. Fases del proceso de producción.
- Elaboración del lote propuesto: Pesada y conformación
- Añadir al depósito fusor no1 los vehículos disolventes, sorbitol y agua. Agitar 3 minutos y atemperar
- Añadir todo el yoduro potásico y agitar hasta disolución (aprox 5 minutos)
- Añadir todo el metabisulfito sódico, agitar hasta disolución (aprox 5 minutos)
- Añadir todo el citrato potásico, agitar hasta disolución (aprox 3 minutos)
- Añadir todo el ácido cítrico, agitar hasta disolución (aprox 5 minutos)
- Añadir toda la sacarina, la esencia y el colorante disuelto, agitar hasta disolución (aprox 5 minutos)
- Comprobar el pH de la solución obtenida
- Trasvase por filtración clarificante, al depósito fusor no2
- Envasado primario de la solución clarificada, en envases de polipropileno rígido color topacio con tapón provisto de una cánula dosificadora por gotero, de 20 ml
- Envasado secundario en estuche de cartón más prospecto.
Se consideran las siguientes variables críticas en el diseño del proceso de fabricación:
1. Orden de adición y parámetros de agitación: El orden de adición es crítico en el proceso ya que sólo se consigue un pH estable con este orden. La velocidad de agitación debe ser constante, estando prefijada en el reactor.
2. Control de la temperatura: El proceso no requiere una alta temperatura ya que todos sus componentes tienen una buena solubilidad en agua a temperatura ambiente, no obstante se recomienda controlar la temperatura entre 23-25oC.
3. Control del pH: debe estar comprendido entre 5,5 y 6,5 una vez añadidos todos los componentes y tras 5 minutos de agitación.
4. Filtración clarificante: La solución se hace pasar por un filtro clarificante recogiéndose en la tolva de la llenadora para, posteriormente, pasar al acondicionamiento primario.
5. Parámetros de llenado y acondicionamiento: Se efectúa ajuste del equipo llenador para proporcionar la uniformidad de volumen establecido en especificaciones, y el marcado de lote y fecha de caducidad en el envase primario; en estuchado el estuche se marca con lote y fecha de caducidad y contiene prospecto en su interior.
Estudios de estabilidad: acelerada, a tiempo real y fotoestabilidad
Se utiliza el protocolo experimental establecido en la Normativa de la International Conference on Harmonization (ICH) "Evaluation of stability data" ICH 1QE, Febrero de 2003. International Conference on Harmonization (ICH) "Stability data package for registration in climatic zones III y IV" ICH Q1F, Febrero 2003. Committee for proprietary medicinal products. "Stability testing of existing active substances and related finished products" CPMP/QWP/556/96 y su revisión CPMP/QWP/122/02, y la normativa internacional de Fotoestabilidad de nuevos medicamentos (CPMP/ICH/279/95). Se establecen las oportunas correlaciones entre los resultados obtenidos en los estudios de estabilidad a tiempo real y estabilidad acelerada.
El objetivo de los estudios de estabilidad consiste en obtener información que nos permita definir el periodo de validez del medicamento, así como las condiciones de conservación, determinando cómo varía la calidad del medicamento, bajo la influencia de una serie de factores medioambientales, a lo largo del tiempo. Se entiende por calidad de un medicamento, las propiedades organolépticas, propiedades físico-químicas, la cantidad de sustancia activa, y pureza (limitación o ausencia de productos de descomposición de las sustancias activas, etc.). Estando establecida la fotolabilidad del ión yoduro, se efectúa una evaluación de la eficacia protectora del envase primario a la radiación luminosa31.
Lotes estudiados
Los estudios de estabilidad se realizan sobre tres lotes de producto Yoduro Potásico solución, fabricados a escala industrial, en las instalaciones Centro Militar de Farmacia de la Defensa.
- Lote A-02 (3.329 frascos de 20 ml.): fabricado el 27 de Febrero de 2007
- Lote A-03 (3.327 frascos de 20 ml.): fabricado el 1 de Marzo de 2007
- Lote A-04 (3.298 frascos de 20 ml.): fabricado el 5 de Marzo de 2007
Condiciones de conservación
Estudio de estabilidad a tiempo real
Se han introducido unidades suficientes para la realización de los análisis, de los lotes A-02 A-03 y A-04, los cuales se almacenaron en la cámara climática Mod: Binder KBF 115 No de S erie: 01-23637, con regulación de temperatura y humedad a 25o C ± 2o C, 60% ± 5 % HR, según el procedimiento usado para medicamentos como casuística general. Debido a que el ión yoduro es una especie química sensible a la luz se conecta la lámpara de emisión de radiación luminosa de la cámara durante el desarrollo del estudio, con el fin de evaluar la eficacia protectora del envase. La duración que se propone para el estudio es de 4 años. El estudio comienza en Marzo de 2007.
Estudio de estabilidad acelerada
Igualmente se introdujeron unidades suficientes, de los lotes A-02, A-03 y A-04, que se almacenaron en la cámara climática Mod: Binder KBF 115 No de Serie: 01-24117, con regulación de temperatura y humedad a 40o C ± 2o C, 70% ± 5 % HR, según el procedimiento usado para medicamentos en estudios acelerados. La duración que se propone para el estudio es de 6 meses. El estudio comienza en Marzo de 2007.
Toma de muestra y duración del estudio
a) Estudio de estabilidad acelerada: El muestreo de los lotes y los análisis correspondientes se realizan, inicialmente (To), a los 3 meses y a los 6 meses
b) Estudio de estabilidad a tiempo real: El muestreo de los lotes y los análisis correspondientes se realizan, inicialmente a tiempo inicial (To), y a 3, 6, 9, 12, 18, 24, 36 y 48 meses.
Parámetros a estudiar y especificaciones
Los métodos de control analítico, los parámetros a estudiar y las especificaciones de calidad que se requieren a estos ensayos son los correspondientes a características organolépticas (color, olor, aspecto), uniformidad de volumen, pH, densidad, contenido en yoduro potásico, contenido en yodo, y recuento de microorganismos.
Tratamiento estadístico
Para el tratamiento de los datos o resultados obtenidos se utiliza el paquete estadístico "Statistical Package for the Social Sciences" (SPSS) versión 15. Se realiza el análisis la varianza con el procedimiento Oneway de dicho programa, comprobándose además de la asunción de normalidad, la homogeneidad de las varianzas con la prueba de Levene de los lotes a comparar. Se realiza la prueba Fisher con al corrección de Bonferroni, con riesgo global α igual a 0,05.
Resultados
La tabla 2 muestra los estadísticos descriptivos para los ensayos de uniformidad de volumen, densidad, pH y valoración del yodo libre, referidos a los tres lotes industriales elaborados, que son sometidos a estudio.
Los resultados del ensayo para la eficacia del conservante se recogen en la tabla 3.
La tabla 4 muestra un resumen de la calidad de los lotes fabricados a escala industrial y que serán sometidos al correspondiente estudio de estabilidad; los tres lotes satisfacen inicialmente las especificaciones establecidas, por lo que cualquier alteración aparecida será ocasionada por el desarrollo del estudio.
El nivel de significación del estadístico F de Snedecor obtenido en el análisis de varianza en la uniformidad de volumen, densidad, pH y valoración del contenido de Yodo libre es en todos ellos superior a 0,05. La comparación múltiple de las medias entre los tres lotes con la prueba de Bonferroni en las cuatro variables demuestra que no existe diferencia significativa (P>0,05).
La tabla 5 recoge los resultados, obtenidos en los estudios de estabilidad acelerada, de los lotes fabricados a escala industrial. Las tablas 6, 7 y 8 recogen los resultados obtenidos en los estudios de estabilidad a tiempo real en estos mismos lotes; en ellos se evalúan las variaciones de los diferentes parámetros definidores de la calidad del producto, de acuerdo a especificaciones.
En estas condiciones, una vez cumplido el periodo de tres años, se evidencia un deterioro del cierre del envase, que puede ser observado en la fotografía recogida en la Figura 2. En relación con este deterioro se observa una contracción del volumen, pero no se detecta la aparición de precipitados. Cabe destacar los bajos niveles existentes en la solución de yodo molecular, considerado producto de degradación, ya que este no sería efectivo para la protección del tiroides. El aspecto de la solución, cumple con las especificaciones, durante todo el periodo de estudio, a pesar de la reducción del volumen. A sí mismo, se constata el mantenimiento del pH al término del periodo de cuatro años y la ausencia de crecimiento bacteriano a lo largo del periodo de ensayo.
Discusión
Los resultados reflejados en la tabla 2 muestran valores similares y acordes a las especificaciones establecidas para el producto (uniformidad de volumen, densidad, pH y valoración), tanto para cada uno de los lotes, considerado individualmente (medidas de dispersión reducidas), como en los diferentes lotes entre sí (medidas de centralización y dispersión similares).
La homogeneidad de resultados mostrados en dicha tabla 2, para cada uno de los lotes utilizados para la validación del proceso, así como la ausencia de diferencias significativas entre ellos, demuestra que el proceso es robusto y repetitivo, pudiendo considerarse validado.
La ausencia de significación en el análisis de varianza permite aceptar la hipótesis nula de que no existen variaciones diferenciales entre los tres lotes en las variables estudiadas.
La efectividad del conservante microbiológico a la concentración propuesta, queda demostrada al cumplir la especificación establecida en la Farmacopea Española27, según se recoge en la tabla 3.
Los resultados correspondientes a las especificaciones de calidad de los diversos lotes fabricados [A02, A 03 y A 04], que serán sometidos a estudios de estabilidad, recogidos en la tabla 4, proporcionan valores similares, cuya justificación estadística ha sido ya comentada, por lo que los resultados que arrojen los estudios de estabilidad, para cada uno de los lotes y especificaciones, podrán ser comparados entre sí.
Los datos correspondientes a las especificaciones de los lotes sometidos a estabilidad acelerada (tabla 5) nos indican un buen comportamiento de la solución propuesta, en condiciones extremas, pero en un corto periodo de tiempo (6 meses) lo que nos permitirá asegurar la estabilidad del producto en determinadas situaciones de estrés para este medicamento, como periodos de transporte o almacenamiento en tránsito hasta almacenes farmacéuticos, con temperatura y humedad estables.
Los datos correspondientes a los lotes sometidos a condiciones a tiempo real, tablas 6, 7 y 8 nos muestran la estabilidad de la formula diseñada durante, al menos, dos años; periodo superior al establecido para preparaciones líquidas de administración oral elaboradas en el ámbito hospitalario32-34, tanto a temperatura ambiente como en refrigeración o preparaciones extemporáneas confeccionadas con formas orales sólidas para la administración de yoduro potásico16. El deterioro observado en el envase, provoca, debido a una evaporación del disolvente, una elevación de concentración de ión yoduro; esta concentración de la solución es puesta de manifiesto a los tres y a los cuatro años de almacenamiento. N o obstante, no se observa alteración de ningún otro parámetro de la especificación.
El contenido de ión yoduro a los tres años se sitúa fuera de la especificación establecida, pero lo hace cerca del límite de tolerancia superior; por lo que, inicialmente, se configurará como periodo de almacenamiento seguro, con este envase, al menos dos años, pudiendo fabricarse a escala industrial con este periodo de validez.
El deterioro del gotero, debido a la actuación constante de la radiación luminosa, muestra la necesidad de utilizar otros materiales y un diseño diferente de envase, con el fin de asegurar su integridad y proseguir el estudio de estabilidad de la solución; para ello, se propone el que se muestra en la fotografía recogida en la Figura 3 (envase con tapón de rosca de seguridad y con jeringa de dosificación independiente), con el que se inician nuevos estudios de estabilidad a tiempo real.

Figura 3. Nuevo envase y dosificador
Es necesario considerar que las condiciones habituales de almacenamiento del envase serán menos agresivas que las empleadas en el ensayo, ya que se introduce en un estuche que le protegerá de la luz recibida.
Si bien los valores correspondientes a las soluciones almacenadas durante cuatro años, presentan una pérdida en la especificación de "uniformidad de volumen" y "contenido en yoduro", debido a su concentración, el resto de parámetros definidores de la calidad del producto permanecen dentro de los límites de aceptación establecidos.
El mantenimiento de las especificaciones en las soluciones afectadas por la contracción de volumen, derivada del deterioro del envase, nos confirma la buena solubilidad de todos sus componentes, la efectividad del buffer propuesto, y la eficacia del conservante, evidenciando, por tanto, una fórmula robusta que nos permite prever un comportamiento estable en los estudios iniciados con el nuevo modelo de envase.
La confirmación de este comportamiento será de suma importancia, toda vez que la solución presentará un periodo de validez similar a las cápsulas de gelatina dura de yoduro potásico -entre cuatro y cinco años-, lo que facilitaría la rotación conjunta de los stocks de solución y cápsulas de gelatina dura; cuestión a considerar en los aspectos logístico y operativo.
Conclusiones
- Se ha procedido al diseño, fabricación a escala industrial y evaluación de una solución estable de yoduro potásico en envase multidosis, destinado a diversos grupos de la población, como agente preventivo frente a la exposición a yodo radiactivo, en respuesta a la necesidad, manifestada por diversos organismos nacionales e internacionales, y a la ausencia en el mercado Español y Europeo de un medicamento de características semejantes.
- Se han adecuado y puesto a punto los métodos analíticos necesarios para el control de los materiales de partida y del producto terminado.
- Los datos obtenidos, una vez efectuado el proceso de fabricación de la solución, referentes a la calidad del producto, permiten asegurar la ausencia de variaciones significativas entre los diferentes lotes fabricados, objeto de validación del proceso, demostrando que el diseño del proceso es robusto y repetitivo, siendo factible la fabricación de dicho medicamento a escala industrial.
- Los datos obtenidos, relativos a las especificaciones de calidad de la preparación, durante el sometimiento de los lotes fabricados a estudios de estabilidad normalizados, de acuerdo a la directiva internacional ICH (International Conference of Harmonisation), permiten asegurar un comportamiento estable, tanto desde el punto de vista químico como microbiológico, al menos durante dos años.
Bibliografía
1. Información de Medicamentos para el Profesional Sanitario. Ministerio de Sanidad y Consumo. 2a Edición Española 1995: 1559-1560. [ Links ]
2. NATO Standardization Agency. STANAG 2957: International System Units used by Armed Forces in the Radiological/Nuclear Field. Agosto 2009. [ Links ]
3. Reglamento sobre protección sanitaria contra radiaciones ionizantes. Real Decreto 783/2001 de 6 de julio (Boletín Oficial del Estado número 178 de 26 de julio de 2001). [ Links ]
4. United States Federal Register Vol. 43, No. 242, december 15, 1978. [ Links ]
5. United States Federal Register Vol. 47, No. 125, june 29, 1982. [ Links ]
6. United States Nuclear Regulatory Commission, No. 102, july 1, 1997. [ Links ]
7. World Health Organization. "Guidelines for iodine prophylaxis following nuclear accidents". Update 1999. Geneva. [ Links ]
8. United States Department of Health and Human Services. Food and Drug Administration (FDA). Center for drug evaluation and research (CDER). Guidance: Potassium iodide as a thyroid blocking agent in radiation emergencies. December 2001. [ Links ]
9. NATO Standardization Agency. STANAG 2461 N BC/MED (EDITION 1): NATO Handbook on the Medical Aspects of NBC Defensive Operations (Nuclear). AM edP-6 (C). Volume I. Febrero 2005. [ Links ]
10. The Medical Letter. Edición Española. Yoduro potásico para la protección tiroidea en un accidente o ataque nuclear. Vol. XXIV-2002: 107-108. [ Links ]
11. NATO Standardization Agency. STANAG 2150: NATO Standards of Proficiency for NBC Defence. 25 octubre 2002. [ Links ]
12. NATO Standardization Agency. STANAG 2426: Chemical, Biological, Radilogical and Nuclear (CBRN) Hazard Management Doctrine for NATO Forces. 14 febrero 2008. [ Links ]
13. NATO Standardization Agency. STANAG 2984: Graduated Levels of Chemical, Biological, Radiological and Nuclear Threats and Associated Protective Measures. 8 agosto 2007. [ Links ]
14. NATO AM edP-7(D). Concept of operations of medical support in chemical, biological radiological and nuclear environments. December 2007. [ Links ]
15. NATO. Resoluciones de la Cumbre de Praga 2002. 20 y 21 de noviembre. [ Links ]
16. FDA-CDER. Home preparation procedure for emergency administration of potassium iodide tablets to infants and small children. http://www.fda.gov/cder/drugprepare/kiprep.htm [ Links ]
17. Columbia University. National Center for Disaster Preparedness. Pediatric Preparedness for Disasters and Terrorism A National Consensus Conference. Executive Summary 2003: 25. [ Links ]
18. United States Department of Health and Human Services. Project Bioshield Annual Repport to Congress. July 2004 through July 2006. [ Links ]
19. United States Department of Health and Human Services. Project Bioshield Annual Repport to Congress. August 2006 through July 2007. [ Links ]
20. Sierra JF, Gallardo V, Ruiz MA. Situación actual de formas de administración pediátricas de fármacos del grupo M01A (Antiinflamatorios y antirreumáticos no esteroideos). VI Congreso SEFIG y 3a Jornadas de Tecnología Farmacéutica. Granada 2003. Libro de Comunicaciones. Ed Comares: 503-505. [ Links ]
21. Vila Jato JL. Tecnología Farmacéutica 2: Formas Farmacéuticas. Editorial Sintesis 1997. [ Links ]
22. Santos B, Guerrero MD. Administración de Medicamentos: Teoría y Práctica. Ediciones Diaz de Santos, S .A. 1994. Capítulo 3: 31. [ Links ]
23. Vila Jato JL. Tecnología Farmacéutica 2: Formas Farmacéuticas. Editorial Sintesis 1997. [ Links ]
24. The Merck Index. Thirteenth Edition 2001. Potassium iodide: 1370. [ Links ]
25. Ficha de datos de seguridad: yoduro de potasio (MSDS, FDS). http://www.fichasdeseguridad.com/yoduro_potasio.htm [ Links ]
26. USP 31-NF 26. Edición Española 2008. Página 3332. [ Links ]
27. Real Farmacopea Española 3a Edición 2005. Agencia Española de Medicamentos y Productos Sanitarios (Ministerio de Sanidad y Consumo). [ Links ]
28. Real Decreto 1465/2009 de 18 de septiembre por el que se establecen las normas de identidad y pureza de los colorantes utilizados en los productos alimenticios. BOE número 243 de 8 de octubre: 84828-84873. [ Links ]
29. Real Decreto 1477/1990 de 2 de noviembre por el que se aprueba la Reglamentación Técnico-Sanitaria de los aromas que se utilizan en los productos alimenticios y de los materiales de base para su producción. BOE número 280 de 22 de noviembre: 34604-34611. [ Links ]
30. European Food Safety Authority (EFSA). Assessment of the results of the study by McCann et al. (2007) on the effect of some colours and sodium benzoate on children's behavior. The EFSA Journal (2008) 660: 1-53. [ Links ]
31. Torres Suarez AI., Gil Alegre ME. Monografías de AEFI (Asociación Española de Farmacéuticos de Industria). 2004. Estabilidad de medicamentos. Requisitos de los estudios según la normativa actual: 24-25. [ Links ]
32. Soy D. Roca M., Deulofreu R., Montes E., Codina C., Ribas J. Estabilidad de las soluciones orales de clorhidrato de metadona al 0,1% y 0,5% en suero fisiológico. Farm Hosp 1998; 22 (5): 249-251. [ Links ]
33. Ruiz Caldes MJ., San Martín Ciges E., Ezquer Borrás J., Rodilla Calvelo, F., Ferriols Lisart F. Jarabe de midazolam: estudio de estabilidad de una solución oral para uso hospitalario. Farm Hosp 1995; 19 (1):41-44. [ Links ]
34. Morales ME., Gallardo V., López G., Atienza M., Marín R., Ruiz M.A.. Estabilidad de una formulación oral líquida de morfina para pediatría. Farm Hosp 2006; 30(1): 29-32. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
A. Juberías Sánchez.
Centro Militar de Farmacia de la Defensa.
Paseo de las Fuentecillas, s/n. 09001 Burgos.
ajubsan@oc.mde.es
Recibido: 28 de junio de 2011
Aceptado: 4 de julio de 2011


















