Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Sanidad Militar
versión impresa ISSN 1887-8571
Sanid. Mil. vol.67 no.3 Madrid jul./sep. 2011
https://dx.doi.org/10.4321/S1887-85712011000400005
ACCESIT FIDEL PAGÉS MIRAVÉ 2011
Efecto de la adición de plasma seminal en el semen equino descongelado
Effect of seminal plasma addition on frozen-thawed equine semen
Lozano Benito D.1, Gil Huerta L.2, Álvarez San Martín C.3
1Tte. Veterinario. Unidad de Servicios de Base Jaime I. Bétera. Valencia. España.
2Doctora Veterinaria. Universidad de Zaragoza. Dpto de Patología Animal. Zaragoza. España.
3Cte. Veterinario. Centro Militar de Cría Caballar de Zaragoza. España.
Dirección para correspondencia
RESUMEN
Antecedentes y objetivos: El semen criopreservado ofrece beneficios adicionales no presentes en el semen refrigerado. Sin embargo, varios factores afectan al éxito en la inseminación artificial con semen congelado de caballos. El objetivo del trabajo es evaluar si la adición de plasma seminal a diferentes concentraciones, sobre espermatozoides equinos descongelados, afecta a la motilidad espermática, viabilidad y a nivel de membrana.
Material y métodos: Se utilizaron diferentes razas, cuatro sementales de silla, y dos sementales de tiro. En un primer experimento el semen descongelado se centrifugó, mientras en el segundo no se centrifugó. A continuación, se adicionó el plasma seminal al 10, 20, 30% suspendido en solución tampón fosfato y plasma seminal puro (100%).
Resultados: En los caballos de silla el plasma seminal no afectó a los parámetros estudiados (p>0,05), pero se apreció un posible efecto tóxico del plasma seminal puro sobre las características espermáticas. En las muestras con plasma seminal de los caballos de tiro, se observaron unos índices mejores en espermatozoides vivos con acrosoma intacto que en las muestras control. Asimismo se obtuvo un porcentaje menor en espermatozoides reaccionados que en las muestras control, encontrando en esta categoría una diferencia significativa (p<0,05).
Conclusiones: La incubación de los espermatozoides descongelados con plasma seminal puede frenar la reacción acrosómica, reflejado este hecho, en los bajos porcentajes de espermatozoides que han sufrido la verdadera reacción acrosómica.
Palabras clave: Plasma seminal, Espermatozoides descongelados, Equino, Reacción acrosómica, Inseminación artificial.
SUMMARY
Background and objectives: Stallion sperm cryopreservation offers benefits not available in cooled semen. However various factors affect the success of artificial insemination with frozen-thawed equine semen. This study aims to evaluate if adding different concentrations of seminal plasma on frozen-thawed equine spermatozoa affects sperm motility, viability and membrane status.
Material and Methods: Different breeds were used; four saddle stallions and two draft stallions. In the first experiment thawed semen was centrifuged and in the second one it was not. Subsequent to that, the spermatozoa resuspended with 10, 20, 30% seminal plasma in phosphate buffered saline and pure seminal plasma (100%).
Results: semen parameters of saddle stallions were not affected (p>0,05), but a possible toxic effect of pure seminal plasma was observed on sperm characteristics. Seminal plasma samples in draft breed got better rates in viable sperm with intact acrosome. A lower percentage was also found on spermatozoa with acrosome reaction than in control samples. This category showed signif icant differences (p<0,05).
Conclusions: Post-thawing spermatozoa incubation with seminal plasma can stop acrosome reaction, due to the low percentage of spermatozoa suffering true acrosome reaction.
Key words: Seminal plasma, Frozen-thawed spermatozoa, Equine, Acrosome reaction, Artificial insemination.
Introducción
En la especie equina, normalmente el plasma seminal (PS) es apartado del semen durante el proceso de criopreservación, dejando aproximadamente un 0-5% del volumen original de PS1. Sin embargo, se han obtenido porcentajes altos de motilidad en espermatozoides equinos después de la criopreservación, cuando el esperma centrifugado fue reconstituido con un 20% de PS y posteriormente incubados a 5oC durante 2 horas antes de congelar, en comparación con las muestras controles en las cuales todo el PS fue retirado2. Asimismo, espermatozoides equinos que exhibían bajas motilidades post-descongelación (<20%), fueron complementados con PS (30%) de sementales que producían semen con índices altos de criosupervivencia (motilidad ≥30%), consiguiendo así, que un gran número de espermatozoides superara la criopreservación. Por el contrario, en sementales con buena calidad seminal post-descongelación, la adición de PS de caballos con baja calidad seminal tras la descongelación, disminuyó la motilidad progresiva post-descongelación3. Se demostró así, que la composición del PS es uno de los factores que determina la capacidad de los espermatozoides de un semental, para sobrevivir tras la criopreservación. En un estudio posterior no se observó ningún efecto al resuspender tras centrifugar, distintas concentraciones de PS (0,5,10,20,40,80%), y medidas a los 10 y 90 minutos post-descongelación. En cambio, si que se vio un efecto perjudicial del PS en la criosupervivencia espermática, al incubar los espermatozoides con niveles superiores al 20% de PS durante largos periodos antes de la congelación4.
Similarmente, se ha visto que una variabilidad individual en el PS tiene un papel importante en la motilidad de los espermatozoides refrigerados5,6. El PS equino es diluido y apartado mediante centrifugación ya que ha demostrado ser un medio dañino durante el enfriamiento y almacenamiento7,8. Se sabe que aplicando una alta dilución, se reduce el efecto negativo del PS en el semen enfriado8,9. Sin embargo, la centrifugación y separación de todo el PS provoca una motilidad espermática más pobre después del almacenamiento a 5oC durante 24h, comparado con las muestras que contienen 5-20% de PS10. Brinsko y cols.5 observaron que la centrifugación y eliminación parcial del PS son beneficiosas para aquellos caballos cuyos eyaculados tienen poca tolerancia a la refrigeración y almacenamiento. Esto provoca un aumento en el porcentaje de espermatozoides con motilidad progresiva.
Diferentes autores han encontrado componentes en el PS que son importantes para el desarrollo y maduración de los espermatozoides en el tracto genital femenino. El incremento del transporte espermático, la precipitación de la ovulación, y el aumento del flujo sanguíneo al útero y oviducto se han asociado a la presencia de PS en caballos y cerdos11-14.
Troedsson y cols.15 encontraron que el PS protege a los espermatozoides viables de la fagocitosis por los polimorfonucleares, aumentando la supervivencia en un medio uterino hostil y asegurando que un suficiente número de espermatozoides alcance el oviducto para fertilizar. El PS equino participa en la regulación del sistema inmune, y parece ser un factor importante en la regulación de la endometritis inducida por la cubrición16,17. El PS equino reduce o inhibe la quimiotaxis, la fagocitosis y la activación del complemento in vitro18.
Diferentes estudios, utilizando la tinción de clortetraciclina, han confirmado que la criopreservación puede causar cambios en el estado de la membrana funcionalmente equivalentes a la capacitación en espermatozoides de ratón19, verraco20, y morueco21. Los resultados de Schembri y cols.22 están en concordancia con los descubrimientos de estos autores, indicando que la criopreservación induce un cambio similar a la capacitación en espermatozoides equinos. Se ha demostrado en espermatozoides ovinos que el PS limita el desarrollo de la capacitación post-descongelación23. Estos autores publicaron que la resuspensión de los espermatozoides tras su descongelación en solución tampón fosfato (PBS) con un 20% de PS mejora la motilidad espermática, retrasa los cambios similares a la capacitación y por consiguiente la reacción acrosómica, y además, aumenta la integridad de membrana permitiendo incrementar la fertilidad después de la IA cervical. Estos resultados demuestran que los daños funcionales de los espermatozoides durante la criopreservación pueden ser evitados mediante la adición de PS, probablemente a través del efecto de descapacitación combinado con la mejora en el transporte espermático.
Por lo tanto, se ha observado que el proceso de capacitación inducido por la criopreservación es reversible resuspendiendo PS a distintas concentraciones, lo que parece que alargaría la vida útil de los espermatozoides descongelados post-inseminación.
Material y métodos
Animales y preparación del semen
Para la realización del trabajo se utilizaron seis sementales, cuatro caballos de silla (tres Pura Raza Española, uno Pura Raza Árabe) y dos caballos de tiro (Raza Bretona), elegidos entre los 57 que poseía el Ejército Español en el Depósito de Sementales de Zaragoza, en base a los óptimos índices de fertilidad obtenidos en las temporadas reproductivas anteriores. Todos ellos se encontraban en un correcto estado de salud y sus edades se comprendían entre los 7 y 15 años.
Las extracciones seminales se realizaron durante los meses de Febrero y Marzo de 2006, obteniendo un único eyaculado de cada animal, haciendo así, un total de seis eyaculados para el trabajo experimental. Para la colección del semen se utilizó una vagina artificial, modelo Hannover, con ayuda de una yegua en celo. Las características de los sementales seleccionados y sus eyaculados se reflejan en la Tabla 1:
El semen nativo mantenido a 37oC, se mezcló en una proporción 1:4 con el diluyente comercial Equi-Pro de la casa Minitüb y se centrifugó a 600g durante 15 minutos. Después de la centrifugación se eliminó el sobrenadante del tubo de centrífuga, dejando un 5% del medio de centrifugación junto con el pellet y fue resuspendido en el medio de congelación Gent (Minitüb). La dilución se realizó en función de la concentración deseada (cada pajuela llevaría 200 x 106 espermatozoides / 0,5 ml). El llenado de pajuelas de 0,5 ml se llevó a cabo manualmente en una habitación a 4oC, permaneciendo en esta cámara el tiempo necesario para completar las 2,5-3 horas de la curva de enfriamiento. A continuación preparamos una congelación mediante exposición a vapores de nitrógeno. Las pajuelas se colocaron horizontalmente sobre la rejilla de congelación a 5 cm con respecto al nitrógeno líquido. Se dejó actuar a los vapores durante 10 minutos, que hicieron descender la temperatura hasta los -120oC. Por último se volcaron las pajuelas con cuidado y fueron introducidas en un tanque de nitrógeno líquido que hizo descender la temperatura rápidamente hasta los -196oC definitivos de conservación.
Preparación del plasma seminal
Se contó con 3 caballos de fertilidad conocida y el protocolo fue el utilizado por Maxwell y cols.23, en el cual para la obtención del PS estos autores centrifugaron el semen a 3500g durante 15 minutos y retiraron rápidamente el supernadante de PS. Añadieron en PBS el PS con una concentración final de 10, 20 ó 30%. El medio obtenido fue filtrado con un filtro de 0,22 μm y conservado a -20oC hasta el día de su utilización. También preparamos un pool de PS puro.
Diseño experimental
En la primera experiencia se descongeló el semen (37oC/30s). Se hizo diferenciación entre razas, por lo que dos pajuelas de diferentes caballos de tiro (CT), o dos pajuelas de diferentes caballos de silla (CS), eran descongeladas y mezcladas para trabajar con dosis heteroespérmicas. Se vertían sobre un eppendorf y se realizaba la primera contrastación a tiempo 0 del semen puro tras su descongelación. A continuación se fraccionó la muestra, suspendiendo 150 μl del se men recién descongelado en cuatro eppendorfs que contenían 150 μl de PBS con PS al 10, 20 y 30% y PS puro respectivamente, todo ello atemperado a 37oC. El semen restante se dejó como muestra patrón. Las resuspensiones resultantes se incubaron durante 15 minutos en un baño de agua a 37oC, y se procedió a contrastarlas.
La segunda fase experimental seguía el mismo protocolo con la salvedad de que antes de la resuspensión en PS el semen era centrifugado. Los espermatozoides fueron sometidos a una fuerza gravitatoria de 600g durante 5 minutos. El sedimento obtenido de espermatozoides, fue reconstituido con PBS con PS a las distintas concentraciones (10, 20 y 30%), así como con el PS puro, previamente atemperados a 37oC. Todo ello se incubó durante 15 minutos en un baño de agua a 37oC, y se procedió a las evaluaciones.
Contrastación seminal
Motilidad
Los porcentajes de motilidad total y motilidad progresiva espermática fueron determinados en cada experiencia con un analizador espermático asistido por ordenador (CASA).
Viabilidad celular
La tinción de eosina-nigrosina24 fue empleada para las muestras a tiempo 0, mezclando en el porta objetos una gota de semen y otra del colorante, siendo extendida con un cubre. La lectura fue hecha con microscopio de campo claro con objetivo de 40x. Se evaluaron 100 espermatozoides y se hizo el porcentaje de células vivas (sin colorante), y el de las células muertas (con colorante). Para ver las células viables tras la adición de PS se utilizó una doble tinción (DS)25, que evaluaba a la vez la integridad acrosómica. Una alícuota de 100 μl procedente del semen resuspendido se depositó en un tubo; añadimos un volumen de 100 μl de azul tripano al 2% en PBS. El tubo fue incubado en el baño durante 10 minutos a 37oC. Después de la incubación, se diluyeron los espermatozoides con 1 ml de PBS y después se centrifugaron a 600g durante 6 minutos. Se quitó el sobrenadante y el esperma se resuspendió en 1 ml de PBS y se centrifugó igual que antes. Se colocó una gota de 10 μl de la suspensión de esperma sobre un porta objetos y se realizó la extensión con un cubre objetos. El frotis se secó sobre una placa calefactora (37oC). Los espermatozoides en los portas fueron teñidos a continuación durante 40 minutos con solución de Giemsa al 10% en PBS, preparada inmediatamente antes de su uso. A continuación los portas fueron secados sobre la platina térmica y se leyeron los campos en el microscopio con el objetivo de 40x.
Las cuatro categorías de espermatozoides originadas por la DS:
1. Espermatozoides muertos con acrosoma intacto.
2. Espermatozoides muertos con acrosoma separado (FAR).
3. Espermatozoides vivos con acrosoma intacto.
4. Espermatozoides vivos con acrosoma separado (TAR).
Acrosomas
Para determinar la integridad acrosómica de los espermatozoides a tiempo 0 había que fijar 10 μl de semen en 90 μl de glutaraldehído26, para luego analizar 100 células bajo el objetivo de inmersión 100x. A partir de los 15 min tras la adición del PS, los acrosomas se midieron conjuntamente con la viabilidad gracias a la DS.
Endósmosis
Se utilizó el HOS-test27. Para medir la funcionalidad de la membrana plasmática, se diluyeron 10 μl de semen en 90 μl de lactosa (100 mosm), en un tubo de ensayo de 5 cm³ en un baño maría a 37oC durante 30 minutos. A continuación se fijó con 100 μl de glutaraldehido a temperatura ambiente. El recuento se realizaba con el objetivo de 40x. Se contaron 100 espermatozoides y se realizó el porcentaje de las células con reacción endosmótica positiva.
Análisis estadístico
Para analizar estadísticamente los datos se utilizó el programa SPSS 12.0., aplicándose el análisis de varianza (ANOVA), prueba de Duncan y modelos lineales generalizados (GLM).
Resultados
El factor tiempo influye en las variables analizadas, obteniendo resultados significativos o altamente significativos en todos los parámetros, excepto en los acrosomas de los sementales de tiro. Esto nos demuestra el hecho de que todos los valores disminuyen según aumenta el tiempo de descongelación, menos la integridad acrosómica.
Enfrentando las categorías espermáticas de la DS al factor tiempo, se aprecia de nuevo la mejor congelabilidad de los espermatozoides de los sementales de tiro. Nos lo demuestra las medias de M-ACR y V-ACR de cada raza. Los espermatozoides TAR muestran valores similares entre las dos clases de caballos. Llama la atención el pobre número de espermatozoides FAR encontrados en la lectura de la técnica DS.
Observamos una significación en todos las variables, excepto en los espermatozoides FAR, fácilmente entendible debido al bajo número de espermatozoides encontrados dentro de este patrón, como para encontrar una significación. Las otras tres variables si dependen del tiempo, siendo altamente significativas M-ACR Y V-ACR, aumentando la primera y disminuyendo la segunda a lo largo del tiempo. La variable TAR es significativa disminuyendo a lo largo del tiempo de forma menos acusada que en V-ACR.
Cuando enfrentamos los cuatro patrones de la DS al factor tratamiento (PS), en los CS no se puede ver un efecto beneficioso ni perjudicial en los espermatozoides con PS en comparación con la muestra control. Si que se aprecian unos valores medios superiores de M-ACR e inferiores de V-ACR en los espermatozoides con el PS puro, pudiendo significar una toxicidad del PS puro.
En los CT, si que se intuye un ligero beneficio del PS, siendo los resultados medios de la muestra control los más altos en M-ACR y más bajos en V-ACR. La muestra patrón también muestra los valores medios más altos en espermatozoides reaccionados.
En los CS, no se observa diferenciación significativa en ninguna categoría según la concentración de PS utilizada, en comparación con la muestra control. En los CT, ocurre lo mismo excepto en el grupo de espermatozoides reaccionados donde encontramos una diferencia significativa.
Respecto a la centrifugación tras la descongelación para retirar el diluyente de congelación, se observa que es perjudicial para los espermatozoides. El efecto negativo es más acusado en los CS. Se aprecia una diferencia altamente significativa en la variable V-M de los espermatozoides de los CS, disminuyendo la viabilidad espermática tras la centrifugación. También se apunta una diferencia altamente significativa en ACR, pero sorprendentemente este parámetro mejora después de la centrifugación. En la otra raza se observa una diferencia altamente significativa solo en END, manteniéndose el resto de los parámetros seminales prácticamente similares.
Discusión
Los valores obtenidos en los parámetros estudiados tras el proceso de congelación-descongelación, nos confirman el éxito de la congelación. Aunque se han realizado numerosas investigaciones para el desarrollo de métodos que sirvan como pronóstico de fertilidad del semen, la evaluación de la calidad seminal se sigue basando en la evaluación de la motilidad.
Una motilidad post-descongelación ≥ 30%28 ó ≥35%29 se requiere para el uso de semen congelado-descongelado en programas de IA. Se puede observar (tabla 2 y 3) que tras la descongelación estos porcentajes se superan con creces tanto en los CS como en los CT (68,38 ± 5,797 / 89,50 ± 6,054%). Samper30, también recomienda utilizar el semen que presente como mínimo el 20% de la motilidad progresiva 15 minutos después de la descongelación. Como se puede apreciar en la tabla 3, la media de motilidad progresiva de los CT sobrepasa este valor (32,80 ± 2,816%).
Los valores medios de espermatozoides vivos tras el proceso de criopreservación en ambas razas son satisfactorios. Samper30 sugiere que la morfología normal después de la descongelación debería ser del 70%, o un porcentaje muy similar al recomendado en el semen fresco.
Las medias mostradas son de 61,00 ± 2,632 y 66,83 ± 1,400% en los CS y CT respectivamente, evaluadas con la tinción eosinanigrosina a tiempo 0.
Podemos concluir por tanto que el proceso de congelación-descongelación ha sido satisfactorio, aunque hay que tener en cuenta que antes de dar por buena esta valoración, habría que realizar un ensayo de fertilidad in Vivo con lotes de yeguas homogéneos.
Tabla 4. Influencia del tiempo en las categorías espermáticas de la DS en
los sementales de silla. Comparación anova y duncan. Medias ± SEM. 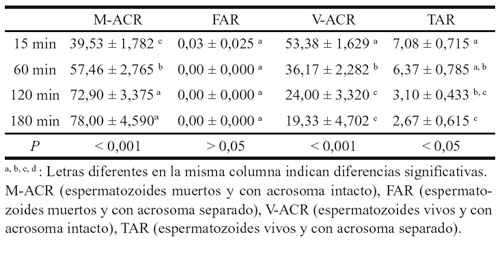
Tabla 5. Influencia del tiempo en las categorías espermáticas de la DS en
los sementales de tiro. Comparación anova y duncan. Medias ± SEM. 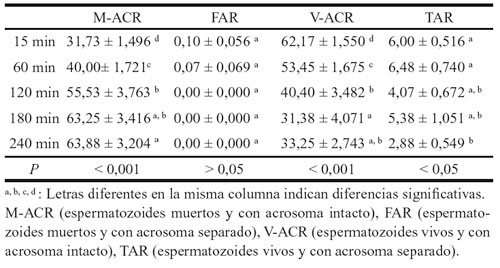
Como ya hemos indicado los CT han presentado unos parámetros post-criopreservación excelentes. Se conoce muy poco de la influencia de la raza en la criopreservación de los espermatozoides en la especie equina. En un estudio de campo con semen de CT en Francia, se informa de los resultados de la criopreservación, pero solo respecto a ciertos parámetros31. Nuestros resultados no coinciden con los de otro estudio32, que utilizó para sus experimentos 2 sementales bretones y 2 sementales percherones. Los cuatro CT empleados presentaron motilidades inferiores al 30%, es decir no alcanzaron el mínimo porcentaje requerido para entrar en programas de IA. Estos autores sugieren que la gran cantidad de PS emitida durante la eyaculación en los sementales de tiro, puede contribuir a la pobre congelabilidad observada en el estudio. Otro grupo de investigación33, también trabajó con dos percherones y dos bretones, obteniendo un rango de motilidad comprendido entre 13,8%-26,3%, y un intervalo de espermatozoides vivos entre 19,5%-38,0%.
El éxito de nuestro proceso de criopreservación, se puede atribuir también al uso de diluyentes comerciales (Equi-Pro y Gent). A tenor de los resultados obtenidos, se puede afirmar que el uso de diluyentes de semen químicamente definidos reduce la variabilidad potencial entre lotes, asociada a los diluyentes basados en leche desnatada o yema de huevo. El diluyente Equi-Pro contiene caseinatas y proteínas seleccionadas del suero de la leche en lugar de leche desnatada, y una cantidad de diferentes azúcares y glicina. Por lo tanto, un diluyente de proteínas definidas de la leche, provoca una calidad seminal similar o mejor a los diluyentes basados en leche descremada. Los efectos protectores de estos diluyentes están presentes también durante la centrifugación. También afirmamos que se obtienen mejores resultados con medios de congelación comerciales, que con diluyentes realizados en el propio laboratorio a partir de los diferentes ingredientes (yema de huevo, glicerol, etc).
La centrifugación resultó ser perjudicial para los parámetros seminales de ambas razas (tabla 8 y 9). Provocó una mayor mortalidad en los espermatozoides centrifugados de los CS, mostrando una diferencia altamente significativa (p<0,001). En los CT, la acción mecánica de la centrífuga no causó un daño tan manifiesto, pero también se encontró una diferencia altamente significativa en la endósmosis, por lo que la centrifugación afectó a la funcionalidad de membrana y de la bomba iónica.
Como ya se ha indicado, existe una gran controversia sobre el efecto del PS en los espermatozoides criopreservados. La separación del PS fue divulgada como necesaria para la criosupervivencia celular1. Sin embargo, otros autores indican el beneficio del PS en los espermatozoides equinos criopreservados2.3. En otro estudio4 no se observó ningún efecto sobre los espermatozoides al resuspenderlos con distintas concentraciones de PS (0, 5, 10, 20, 40, 80%) tras la centrifugación. Recientemente, se ha visto que la separación del PS disminuye los valores de motilidad, pero no la integridad de la membrana plasmática, tanto en semen refrigerado como en semen congelado34.
La DS ha resultado ser una prueba útil y objetiva de evaluación de la viabilidad espermática y de la verdadera reacción acrosómica, en el estudio del semen equino post-criopreservado. Tras el estudio estadístico de los resultados de la DS (tabla 6), no se encuentra ninguna diferencia significativa en los CS. Por tanto, el PS ni beneficia ni perjudica a los espermatozoides de esta raza, tras su reconstitución post-descongelación. Analizando los valores del PS puro en los espermatozoides V -ACR y M -ACR, parece ser que el PS sin dilución alguna muestra efectos tóxicos.
Tabla 6. Influencia del tratamiento en las categorías espermáticas de la DS
en los sementales de silla. Comparación anova y duncan. Medias ± SEM. 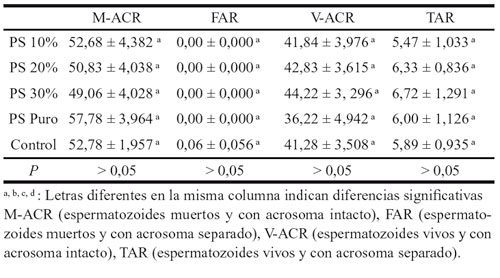
En los CT (tabla 7), si que se aprecia un ligero beneficio del PS, siendo los resultados medios de la muestra control los más altos en M-ACR y más bajos en V-ACR. Se ha encontrado una diferencia significativa en los espermatozoides reaccionados, registrando la muestra patrón los valores medios más altos.
Tabla 7. Influencia del tratamiento en las categorías espermáticas de la DS en
los sementales de tiro. Comparación anova y duncan. Medias ± SEM. 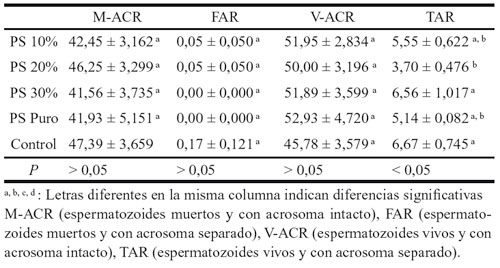
La criopreservación induce cambios en la membrana espermática que hacen a los espermatozoides comportarse como si estuvieran parcialmente capacitados35. La resuspensión de los espermatozoides equinos centrifugados en el PS homólogo no produce cambios parecidos a la capacitación22. Estos datos indican que el proceso de congelación-descongelación del semen equino induce cambios similares a la capacitación en los espermatozoides y que la mayoría de los cambios son debidos a la separación del PS.
Cuando los espermatozoides (o capacitados o no capacitados) son expuestos al PS, ellos son incapaces de llevar a cabo la reacción acrosómica y completar la fertilización36,37. La adición de PS previene de la prematura capacitación espermática y puede hacer que los espermatozoides capacitados vuelvan a un estado de no capacitados, el cual puede permitir que espermatozoides criopreservados lleguen a ser fértiles durante un intervalo más grande.
Los hallazgos de estos autores, podrían explicar los resultados encontrados en el presente trabajo. La causa del bajo número de espermatozoides TAR, puede deberse a que tras la adición del PS, este retrase la reacción acrosómica de los espermatozoides capacitados durante la criopreservación. Esta categoría es significativa en los TAR de los CT, presentando la muestra control los valores medios más altos en espermatozoides reaccionados, con lo que el PS puede frenar en cierta manera la reacción acrosómica. Además en esta misma raza, los valores de M-ACR y V-ACR se ven beneficiados en presencia de PS. Para certificar el efecto positivo del PS tras la reconstitución de los espermatozoides descongelados de CT, sería importante señalar la mayor longevidad del semen que contenía PS respecto a la muestra control, en especial el PS al 10%.
En casos de capacitación inapropiada o repentina, como la inducida por la criopreservación, no se dispone de un suministro continuo de espermatozoides recién capacitados. Esto provoca, la necesidad de monitorear ecográficamente cada 6-12 horas a las yeguas, e inseminarlas lo más cercano posible al momento de la ovulación para obtener buenos resultados con el semen congelado-descongelado38,39.
La separación del PS en la preparación del semen para la criopreservación, aumenta la duración de la respuesta inflamatoria del útero después de la inseminación con semen descongelado. Este hecho ha sido observado en yeguas inseminadas con semen descongelado, al cual se le había quitado todo el PS, y sufrieron una inflamación postinseminación más marcada y prolongada18. Este autor encontró que la presencia de PS en la dosis de inseminación acortaba la duración de la inflamación inducida por la IA. Además si la ovulación no ha ocurrido entre las 12-24h después de la primera inseminación, las yeguas reciben una segunda dosis de inseminación con el fin de asegurar la presencia de espermatozoides viables en el oviducto a la hora de la ovulación. Esta práctica podría exponer a los espermatozoides de la segunda inseminación a un ambiente uterino inflamado40.
Estas investigaciones apoyan a nuestro estudio en la idea de incluir PS en el medio de descongelación. Con el fin de dar a nuestro estudio una utilidad en la práctica diaria, sería necesario realizar una evaluación in vivo inseminando a yeguas con el PS al 10%. De esta manera, analizaríamos si dentro de la hembra en contacto con los fluidos uterinos, se cumple también la mayor longevidad mostrada en el laboratorio por el PS al 10%, y si se da el retraso en la reacción acrosómica tras la resuspensión de los espermatozoides equinos descongelados en PS, proveyendo por lo tanto, de una población espermática más heterogénea en la dosis de inseminación.
De ser así, permitiría reducir la frecuencia con la que es ecografiada una yegua en celo, y por consiguiente un menor coste económico. Además, también disminuiría la inflamación uterina en una segunda inseminación, aumentando los índices de fertilidad con semen congelado.
Conclusiones
1. La evaluación de los parámetros seminales post-descongelación ha demostrado el éxito de la criopreservación con los diluyentes comerciales Equi-Pro y Gent, tanto en el semen de caballos de silla como en los de tiro, especialmente en este último.
2. El efecto de la reconstitución de los espermatozoides descongelados con diferentes concentraciones de plasma seminal, ha resultado ser nulo en los caballos de silla. El plasma seminal puro presenta efectos tóxicos sobre los espermatozoides.
3. La resuspensión de los espermatozoides descongelados de los caballos de tiro con diferentes concentraciones de plasma seminal, muestra unos valores de motilidad y endósmosis inferiores que sin plasma seminal. Sin embargo, presentan unos porcentajes mejores en espermatozoides vivos con acrosoma intacto y un tanto por ciento menor en espermatozoides reaccionados que la muestra control. La concentración de plama seminal al 10% en PBS es la mejor, además muestra una longevidad mayor que el resto de las muestras.
4. La incubación de los espermatozoides descongelados con plasma seminal puede frenar la reacción acrosómica, reflejado este hecho, en los bajos porcentajes de espermatozoides que han sufrido la verdadera reacción acrosómica (TAR).
5. La centrifugación de los espermatozoides descongelados para la retirada del diluyente, ha sido perjudicial en los parámetros seminales de ambas razas, en especial en la viabilidad de los espermatozoides de los caballos de silla.
6. La doble tinción es una prueba útil y objetiva de evaluación de la viabilidad espermática y de la verdadera reacción acrosómica, en el estudio del semen equino post-criopreservado.
Agradecimientos
Los autores agradecen al personal militar del Centro de Reproducción Equina "Torre Abejar" de Garrapinillos (Zaragoza) y al área de Reproducción de la Facultad de Veterinaria de Zaragoza.
Bibliografía
1. Amann R P & Pickett BW. Principles of cryopreservation and a review of cryopreservation of stallion spermatozoa 1987. [ Links ]
2. Katila T, Andersson M, Reilas T & Koskinen E. Post-thaw motility and viability of fractionated and frozen stallion ejaculates. Theriogenology 2002; 58: 241-244. [ Links ]
3. Aurich JE, Kühne A, Hoppe H & Aurich C. Seminal plasma affects membrane integrity and motility of equine spermatozoa after cryopreservation. Theriogenology 1996; 46: 791-797. [ Links ]
4. Moore AI, Squires EL & Graham JK. Effect of seminal plasma on the cryopreservation of equine spermatozoa. Theriogenology 2005; 63: 2372-2381. [ Links ]
5. Brinsko SP, Crockett EC & Squires EL. Effect of centrifugation and partial removal of seminal plasma on equine spermatozoal motility after cooling and storage. Theriogenology 2000; 54: 129-136. [ Links ]
6. Dawson GR, Webb GW, Pruitt JA, Loughlin TM & Arns MJ. Effect of different processing techniques on motility and acrosomal integrity of cold-stored stallion spermatozoa. JE quine Vet Sci 2000; 20: 191-194. [ Links ]
7. Pickett BW, Sullivan JJ, Byers WW, Pace MM & Remmenga EE. Effect of centrifugation and seminal plasma on motility and fertility of stallion and bull spermatozoa. Fertil Steril 1975; 26: 167-174. [ Links ]
8. Jasko DJ, Moran DM, Farlin ME & Squires EL. Effect of seminal plasma dilution or removal on spermatozoal motion characteristics of cooled stallion semen. Theriogenology 1991; 35: 1059-1068. [ Links ]
9. Varner DD, Blanchard TL, Love CC, Garcia MC & Kenney RM. Effects of semen fractionation and dilution ratio on equine spermatozoal motility parameters. Theriogenology 1987; 28: 709-718. [ Links ]
10. Jasko D J, Hathaway JA, Schaltenbrand V L, Simper WD & Squires EL. Effect of seminal plasma and egg yolk on motion characteristics of cooled stallion spermatozoa. Theriogenology 1992; 37: 1241-1252. [ Links ]
11. Claus R, Moshammer T, Aumuller R & Weiler U. Replenishment of AI-doses with oestrogens in physiological amounts: effect on sow proliferacy in field trial. J Vet Med 1989; 36: 797-800. [ Links ]
12. Weitze KFH, Roth D, Willmen T & Waberski D. Advancement of ovulation in the sow related to seminal plasma. Reprod Dom Anim 1990; 25: 61-67. [ Links ]
13. Willmen T, Rabele T, Everwand A, Waberski D & Weitze K. Influence of seminal plasma and oestrogens in the inseminate on fertilization rate, sperm transport and ovulation time. Reprod Dom Anim 1991; 1(Suppl.): 379-383. [ Links ]
14. Bollwein H, Sowade C & Stolla R. The effect of semen extender, seminal plasma and raw semen on uterine and ovarian blood flow IPSI-and contralateral to the preovulatory follicle in mares. Anim Reprod Sci 2001; 68: 346 (abstract). [ Links ]
15. Troedsson MHT, Desvousges A, Alghamdi AS, Dahms B, Dow CA, Hayna J, Valesco R, Collahan PT, Macpherson M L, Pozor M & Buhi WC. Components in seminal plasma regulating sperm transport and elimination. Anim Reprod Sci 2005; 89: 171-186. [ Links ]
16. Troedsson MHT, Crabo BG, Ibrahim NM, Scott M & Ing M. Mating-induced endometritis: mechanisms,clinical importance, and consequences. Proc Am Assoc Equine Pract 1995; 41: 11-12. [ Links ]
17. Alghamdi AS, Foster DN & Troedsson MHT. Equine seminal plasma reduces sperm binding to polymorphonuclear neutrophils (PMNs) and improves the fertility of fresh semen inseminated into inflamed uteri. Reproduction 2004; 127: 593-600. [ Links ]
18. Troedsson MHT, Lee CS, Franklin R & Crabo BG. The role of seminal plasma in post-breeding uterine inflammation. J Reprod Fertil 2000; 56 (Suppl.): 341-349. [ Links ]
19. Fuller SJ & Whittingham DG. Capacitation-like changes occur in mouse spermatozoa cooled to low temperatures. Mol Reprod Dev 1997; 46: 318-324. [ Links ]
20. Maxwell WMC & Johnson LA. Clortetracycline analysis of boar spermatozoa after incubation, flow cytometric sorting, cooling, or cryopreservation. Mol Reprod Dev 1997; 46: 408-418. [ Links ]
21. Gillan L, Evans G, Mawwell, WM. Capacitation status and fertility of fresh and frozen-thawed ram spermatozoa. Reprod Fertil Dev 1997; 9(5): 481-487. [ Links ]
22. Schembri MA, Major DA, Suttie JJ, Maxwell WMC & Evans G. Capacitation-like changes in equine spermatozoa throughout the cryopreservation process. Reprod Fertil Dev 2002; 14: 225-233. [ Links ]
23. Maxwell WMC, Evans G, Mortimer ST, Gillan L, Gellatly ES & McPhie CA. Normal fertility in ewes after cervical insemination with frozen-thawed spermatozoa supplemented with seminal plasma. Reprod Fertil Dev 1999; 11: 123-126. [ Links ]
24. Hancock JL. A staining technique for the study of temperature shock in semen. Nature 1951; 167 323. [ Links ]
25. Didion BA, Dobrinsky JR, Giles JR & Graves CN. Staining procedure to detect viability and the true acrosome reaction in spermatozoa of various species. Gamete Res 1989; 22: 51-57. [ Links ]
26. Pursel VG & Johnson LA. Glutaraldehyde fixation of boar spermatozoa for acrosome evaluation. Theriogenology 1974; 1: 63-68. [ Links ]
27. Jeyendran R, Van der V en H, Pérez-Peláez M, Grabo B & Zaneveld L. Development of an essay to asses the functional integrity of the human sperm membrane and its relationship to other semen characteristics. J Reprod Fertil 1984; 70: 219-228. [ Links ]
28. Loomis PR, Amann RP, Squires EL & Pickett BW. Fertility of unfrozen and frozen stallion spermatozoa extended in EDTA-lactosa-egg yolk and packaged in straws. J Anim Sci 1983; 56: 687-693. [ Links ]
29. Cochran J, Amann RP, Froman DP & Pickett BW. Fertility of frozen-thawed stallion semen extended in lactose-EDTA egg yolk extender and packaged in 1.0 ml straws. Theriogenology 1983; 20: 735-741. [ Links ]
30. Samper JC. Stallion semen cryopreservation: male factors affecting pregnancy rates. Proc Soc Theriogenology 1995; pp 160-165. [ Links ]
31. Palmer E. Factors affecting stallion semen survival and fertility. Proc 10th Int Congr Anim Reprod and Artif Insem, Illinois 1994; 3 337. [ Links ]
32. Braun J, Hochi S, Oguri N & Torres-Boggino F. Effect of different protein supplements on motility and plasma membrane integrity of frozen-thawed stallion spermatozoa. Cryobiology 1995; 32(5): 487-492. [ Links ]
33. Torres-Boggino F, Sato K, Oka A, Kanno Y, Hochi S, Oguri N, Braun J. Suitability relationship among seminal characteristics, fertility and for semen preservation in draft stallions. J Vet Med Sci 1995; 57(2): 225-229. [ Links ]
34. Kareskoski AM, Reilas T, Andersson M, Katila T. Motility and plasma membrane integrity of spermatozoa in fractionated stallion ejaculates after storage. Reprod Dom Anim 2006; 41(1): 33-38. [ Links ]
35. Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reprod Fertil Dev 1995; 7: 871-891. [ Links ]
36. Begley AJ & Quinn P. Decapacitation factors in semen. Clin Reprod Fertil 1982; 1: 167-175. [ Links ]
37. Mortimer ST, Swan MA & Mortimer D. Effect of seminal plasma on capacitation and hyperactivation in human spermatozoa. Human Reprod 1998; 13: 2139-2146. [ Links ]
38. Brinsko SP & Varner DD. Artificial insemination and preservation of semen. Stallion management. Vet Clin North Am 1992; 8:205-218. [ Links ]
39. Kloppe LH, Varner DD, Elmore RG, Bretzlaff KN & Shull JW. Effect of insemination timing on fertilizing capacity of frozen/thawed equine spermatozoa. Theriogenology 1988; 29: 429-439. [ Links ]
40. Alghamdi A, Troedsson MHT, Laschkewitsch T & Xue JL. Uterine secretion from mares with post-breeding endometritis alters sperm motion characteristics in vitro. Theriogenology 2001; 55: 1019-1028. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Diego Lozano Benito.
Base Militar USBA Jaime I (Servicio Veterinario).
Ctra. Porta-Coeli s/n. 46117 Bétera (Valencia).
Tfn: 961606136.
E-mail: dlozben@et.mde.es
Recibido: 28 de junio de 2011
Aceptado: 7 de julio de 2011














