My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Sanidad Militar
Print version ISSN 1887-8571
Sanid. Mil. vol.69 n.2 Madrid Apr./Jun. 2013
https://dx.doi.org/10.4321/S1887-85712013000200011
Lesiones nodulares y placas no pruriginosas
Nodular lesions and non-pruriginous plaques
Bodega Quiroga I.1, Sáenz Casco L.2, Peraza Casajús J.3, García-Oria M.4, Tejedor Togores P.5, Fe Marqués A.6, Serrano Muñoz Á7
1 Cte. Médico. Servicio de Cirugía General y Aparato Digestivo.
2 Cte. Médico. Servicio de Medicina Intensiva.
3 Cap. Médico. Servicio de Cirugía General y Aparato Digestivo.
4 Médico Civil. Servicio de Cirugía General y Aparato Digestivo.
5 Estudiante de Medicina. Universidad de Alcalá de Henares.
6 Tte. Col. Médico. Servicio de Medicina Interna.
7 Col. Médico. Servicio de Cirugía General y Aparato Digestivo.
Hospital Central de la Defensa Gómez Ulla. Madrid. España.
Dirección para correspondencia
Paciente mujer de aproximadamente 10 años de edad, natural de Herat (Afganistán). Vista en el ROLE 2E en varias ocasiones por cuadro de deformación facial con lesiones nodulares de consistencia dura, de diferentes tamaños y formas, formando placas. En algunos lugares como cara y dorso de la mano son ulceradas, con bordes elevados y un fondo lesional cubierto por costra con exudado de aspecto seroso. Las lesiones son múltiples, indoloras, no pruriginosas, con mayor predominio por la cara y el dorso de las manos. Existen también nódulos en espalda, tórax y ambas extremidades inferiores, y se respeta el cuero cabelludo, la planta de los pies y las palmas de las manos.
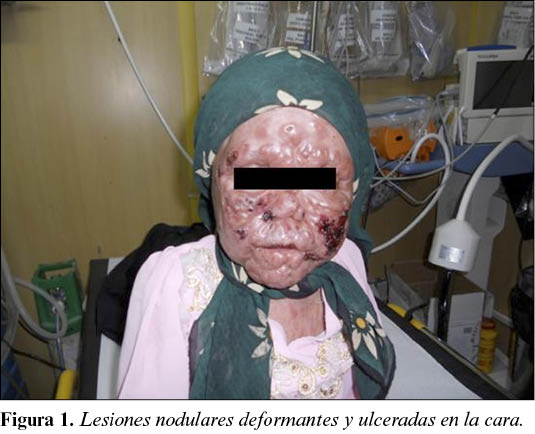
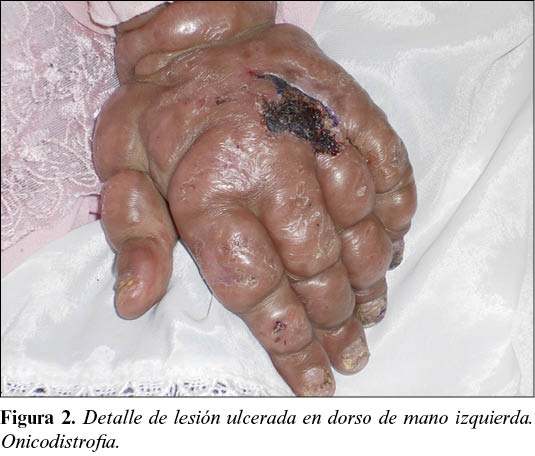
Diagnóstico: Leishmaniasis cutánea
La leishmaniasis humana es una enfermedad causada por un protozoo intracelular del género Leishmania, del cual existen distintas especies que provocan las diferentes formas clínicas de la enfermedad: visceral (conocida como kala-azar), mucocutánea y cutánea. El parásito, en forma promastigota (flagelado, móvil) interacciona con la membrana celular, es fagocitado por los macrófagos de la piel del huésped, se diferencia a amastigote (ovoide, inmóvil) y prolifera1,2.
Se estima que la incidencia a nivel mundial es de 2 millones de casos anuales, correspondiendo un millón y medio de casos a Leishmaniasis cutánea3,4. Esta forma es la más frecuente, afecta aproximadamente a 12 millones de personas y se divide en Leishmaniasis del Viejo Mundo (aparece en el Sur y el Este de Europa, en Asia y en África) y Leishmaniasis del Nuevo Mundo (Estados Unidos y América Latina)3,5. Más del 90 % de los casos de Leishmaniasis cutánea se dan en los siguientes 8 países: Afganistán, Pakistán, Siria, Arabia Saudí, Nigeria, Irán, Brasil y Perú6,7.
Los dos subtipos de leishmaniasis cutánea están causados por dos especies diferentes de Leishmania y son transmitidos por distintas especies del vector (Phlebotomus y Lutsomya), pero ambos se caracterizan por pápulas eritematosas y no dolorosas en la piel, que comienzan en el lugar de inoculación tras un periodo de incubación que puede durar de semanas a meses. Curan dejando cicatrices despigmentadas5.
Para el diagnóstico de Leishmaniasis se pueden emplear múltiples métodos, incluyendo el Test de Montenegro (intradermorreacción de Montenegro), Polymerase Chain Reaction (PCR), métodos moleculares, inoculación en animales o citología de biopsias (éste último, a pesar de ser el más sencillo y económico, tiene hallazgos histopatológicos demasiado inespecíficos). Según estudios realizados, parece que el método más sensible y específico para la detección del parásito es la PCR (detección del ADN parasitario); no obstante, no existe una prueba considerada "gold standard" para el diagnóstico de leishmaniasis8.
El fármaco de primera línea, empleado desde hace más de 50 años, consiste en antimoniales pentavalentes, con dosis de 10-20 mg/kg/día de administración parenteral durante al menos 20 días; en caso de intolerancia o resistencia a este medicamento se recurre al tratamiento de segunda línea, que incluye fármacos como anfotericina B o pentamidina3,4,6. No obstante, todos ellos obtienen pobres resultados y mala tolerancia3 y pueden generar efectos secundarios tales como dolores musculoesqueléticos, náuseas, diarrea, dolor abdominal, astenia, elevación de enzimas hepáticas y pancreáticas, alteraciones en el electrocardiograma y disfunción renal6,7,9. A pesar de conseguir la resolución de la clínica de la enfermedad, se ha demostrado la posterior persistencia de parásitos en el lugar inicial de la infección y en los nódulos linfáticos circundantes. Por este motivo es tan importante continuar con la investigación para el descubrimiento de fármacos con resultados verdaderamente satisfactorios o de una vacuna que prevenga dicha enfermedad9,10.
Bibliografía
1. De Carvalho Vivarini A, Pereira RD, Dias Teixeira KL, Calegari-Silva TC, Bellio M, Laurenti MD, Corbett CE, de Castro Gomes CM, Soares RP, Mendes Silva A, Silveira FT, Lopes UG. Human cutaneous leishmaniasis: interferon-dependent expression of double-stranded RNA-dependent protein kinase (PKR) via TLR2. FASEB J. 2011 Dec;25(12):4162-73. Epub 2011 Aug 16. [ Links ]
2. Birnbaum R, Craft N. Innate immunity and Leishmania vaccination strategies. Dermatol Clin. 2011 Jan; 29(1): 89-102. [ Links ]
3. Tiuman TS, Santos AO, Ueda-Nakamura T, Filho BP, Nakamura CV. Recent advances in leishmaniasis treatment. Int J Infect Dis. 2011 Aug; 15(8): e525-32. [ Links ]
4. Almeida OL, Santos JB. Advances in the treatment of cutaneous leishmaniasis in the new world in the last ten years: a systematic literature review. An Bras Dermatol. 2011 Jun; 86(3): 497-506. [ Links ]
5. Paz C, Doumbia S, Keita S, Sethi A. Cutaneous leishmaniasis in Mali. Dermatol Clin. 2011 Jan; 29(1): 75-8. [ Links ]
6. Oliveira LF, Schubach AO, Martins MM, Passos SL, Oliveira RV, Marzochi MC, Andrade CA. Systematic review of the adverse effects of cutaneous leishmaniasis treatment in the New World. Acta Trop. 2011 May; 118(2): 87-96. [ Links ]
7. Oliveira RA, Diniz LF, Teotônio LO, Lima CG, Mota RM, Martins A, Sanches TR, Seguro AC, Andrade L, Silva GB Jr, Libório AB, Daher EF. Renal tubular dysfunction in patients with American cutaneous leishmaniasis. Kidney Int. 2011 Nov;80(10):1099-106. doi: 10.1038/ki.2011.251. Epub 2011 Aug 3. [ Links ]
8. Azmi K, Nasereddin A, Ereqat S, Schnur L, Schonian G, Abdeen Z. Methods incorporating a polymerase chain reaction and restriction fragment lengthpolymorphism and their use as a "gold standard" in diagnosing Old World cutaneous leishmaniasis. Diagn Microbiol Infect Dis. 2011 Oct; 71(2): 151-5. [ Links ]
9. Chadbourne FL, Raleigh C, Ali HZ, Denny PW, Cobb SL. Studies on the antileishmanial properties of the antimicrobial peptides temporin A, B and 1Sa. J Pept Sci. 2011 Nov;17(11):751-5. doi: 10.1002/psc.1398. Epub 2011 Aug 1. [ Links ]
10. Saha P, Mukhopadhyay D, Chatterjee M. Immunomodulation by chemotherapeutic agents against Leishmaniasis. Int Immunopharmacol. 2011 Nov;11(11):1668-79. Epub 2011 Aug 27. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ignacio Bodega Quiroga
Servicio de Cirugía General
Hospital Central de la Defensa
Glorieta del Ejército 1
28047 Madrid.
ibodqui@oc.mde.es
Recibido: 20 de febrero de 2012
Aceptado: 22 de noviembre de 2012














