INTRODUCCIÓN
El concepto de contaminación cruzada se define como la transferencia de microorganismos, ya sean virus, bacterias, hongos, priones, etc., desde los productos contaminados a los no contaminados, de forma directa o indirecta1-4. Según el último informe “One Health” sobre zoonosis publicado por la Autoridad Europea de Seguridad Alimentaria (EFSA) en febrero de 2021, los factores de riesgo asociados a las contaminaciones cruzadas y a las malas prácticas de los manipuladores representan una parte importante en los brotes de origen alimentario en restaurantes y cantinas (figura 1)5.
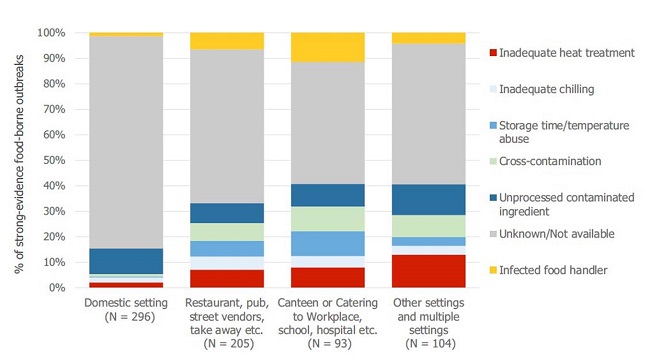
Figura 1. Factores de riesgo relacionados con los brotes de origen hídrico y alimentario en base al lugar de exposición notificados por los países miembros de la UE5.
Los biofilms son agrupaciones microbianas complejas capaces de adherirse y colonizar superficies, formando películas que facilitan el crecimiento y supervivencia de las propias bacterias ante determinadas condiciones adversas del entorno, como la desecación o el uso de algunos desinfectantes, pudiendo suponer una fuente recurrente de contaminación cruzada para las materias primas y, en general, productos alimentarios que se acrecienta cuando las operaciones de limpieza y desinfección (LD) no se llevan a cabo con la frecuencia adecuada3,6,7. El 85-97% del biofilm está constituido por agua, junto con otros elementos minoritarios como los exopolisacáridos (EPS, Extracellular Polymeric Substances), las proteínas, el ADN, los elementos de la lisis bacteriana y las bacterias8.
Los brotes de toxiinfecciones ocasionados en la industria alimentaria se asocian, en la mayor parte de los casos, a los siguientes microorganismos patógenos con capacidad para formar biofilms: Listeria spp., Yersinia enterocolitica, Campylobacter jejuni, Salmonella spp., Staphylococcus spp. y E. coli O157:H76,9,10. Además, una vez formados, son muy difíciles de eliminar y suponen una población bacteriana constante10, por lo que se deben replantear las estrategias encaminadas a su control.
Así pues, el objetivo principal de este estudio ha sido demostrar la presencia de biofilms bacterianos en las superficies de trabajo de las IAM ubicadas en la Comunidad Autónoma de Madrid (CAM) mediante distintas técnicas rápidas de control higiénico. Asimismo, como objetivos secundarios se han marcado los siguientes: relacionar los valores de ATP con los biofilms; medir los residuos proteicos y correlacionar estos valores con los de ATP; cuantificar microorganismos indicadores y detectar microorganismos patógenos; comparar los sistemas TEMPO® (Biomerieux) y Petrifilm® (3M) para establecer recuentos de AC en superficies; correlacionar el recuento de AC por TEMPO® con los valores de ATP; valorar la importancia de la LD mediante la reducción de ATP, residuos proteicos y carga microbiana tras la aplicación de un tratamiento de LD con hipoclorito sódico al 2% durante 10 segundos y aclarado posterior con agua; comprobar el grado de LD de las superficies de trabajo al comparar nuestras lecturas de ATP y carga microbiana con los criterios de aceptación empleados; y proponer soluciones de mejora para los sistemas de APPCC de las IAM.
MATERIALES Y MÉTODOS
Hemos realizado un estudio observacional descriptivo transversal relacionado con la presencia de biofilms. Para ello seleccionamos intencionalmente 10 IAM (5 cocinas y 5 cafeterías) localizadas en la CAM siguiendo criterios de proximidad y de representatividad, considerándose cada una de ellas como una instalación de muestreo (IM). Cada IAM contó con 5 puntos de muestreo (PM), que consistieron en una superficie de trabajo o de contacto con los alimentos de no más de 0,2 m2 (40 cm de longitud x 50 de anchura). En total se obtuvieron 550 muestras, 11 por cada uno de los 50 PM, cada una sobre una superficie de 100 cm2 (tabla 1). El muestreo en cada emplazamiento se efectuó en un solo día, haciéndolo coincidir con la inspección sanitaria periódica realizada por el oficial veterinario designado. Según indicaron los operarios de cada IAM, las superficies seleccionadas se encontraban limpias y desinfectadas y se seleccionaron preferentemente tablas de corte, mesas de trabajo, zonas de preparación y presentación de alimentos, y vajilla; de diversos materiales como acero inoxidable, plástico y porcelana.
Tabla 1. Relación de muestras obtenidas en cada PM (n = 50) y parámetros analizados sobre cada muestra.
| Nº de muestras | Parámetro analizado | Muestreo | Técnica analítica |
|---|---|---|---|
| 2 | ATP | Hisopado con hisopos Clean-Trace™ Surface ATP Test UXL100 (3M). | Lectura inmediata de resultados con Luminómetro 3M Clean-Trace™ NG3. |
| 2 | Residuos proteicos | Hisopado con hisopos Clean-Trace™ Surface Protein Plus PRO100 (3M). | Lectura directa de resultados transcurridos 10 minutos desde la toma de muestras. |
| 1 | Biofilms | Reacción enzimática con spray Biofinder® (Itram Higiene). | Pulverización a 10-15 cm de la superficie e interpretación del resultado transcurridos 30 segundos desde la aplicación. |
| 2 | Detección de Salmonella spp. y recuento de Listeria monocytogenes, AC, STA, BC, EC, EB y TC | Hisopado con hisopos estériles tamponados Deltalab® (DeltaSwab Amies, 304281). | Detección por VIDAS®. Recuentos por TEMPO® e ISO 11290-2:2017 Parte 2 (L. monocytogenes). |
| 2 | Detección de Campylobacter spp. | Hisopado con hisopos estériles tamponados Deltalab® (DeltaSwab Amies, 304281). | Detección por ISO 11272-1:2017 Parte 1. |
| 2 | Recuento de AC | Láminas Petrifilm™ (3M) | Preparación de las láminas con al menos una de antelación siguiendo las instrucciones del fabricante, aplicación sobre la superficie e incubación a 30 ºC ± 1ºC / 72 h ± 2 h. |
AC: aerobios mesófilos totales; STA: Staphylococcus aureus; BC: Bacillus cereus; EC: E. coli; EB: enterobacterias; TC: coliformes totales.
Del total de muestras (n = 550), excluyendo las obtenidas con Biofinder® (n = 50), la mitad se tomaron antes de un tratamiento de LD adicional (n = 250) y la otra mitad después (n = 250) para evaluar la reducción de los valores de ATP, residuos proteicos y carga microbiana. En primer lugar, en cada PM se tomaron las 5 primeras muestras que se identificaron con la letra A (medición A). Seguidamente se pulverizó el visualizador de biofilms (Biofinder®) mediante spray sobre la superficie de muestreo de 100 cm2 y, finalmente, se aplicó in situ un tratamiento de LD con hipoclorito sódico al 2% durante 10 segundos y aclarado posterior con agua y se tomaron las 5 muestras restantes, que fueron identificadas con la letra B (medición B). En todos los PM la toma de muestras para el recuento de L. monocytogenes (ISO 11290-2:2017 Parte 2); los recuentos de aerobios mesófilos totales, E. coli, coliformes totales, enterobacterias, B. cereus y S. aureus (TEMPO®); y la detección de Salmonella spp. (VIDAS® SLM) se llevaron a cabo con el mismo hisopo en cada medición; mientras que para la detección de Campylobacter spp. se empleó un hisopo distinto.
Los resultados se han expresado en las unidades correspondientes por cada 100 cm2, por lo que en el caso de los recuentos obtenidos por Petrifilm™ se ha multiplicado por un factor de 5 ya que cada uno posee una superficie de 20 cm2. Las respuestas al Biofinder® se han computado como positivas o negativas siguiendo las instrucciones del fabricante. La cantidad de residuos proteicos se agrupó en 4 niveles de concentración en función de la reacción colorimétrica evidenciada en el medio del hisopo (reacción de biuret): ausencia (verde), baja (mezcla de tonalidades moradas y verdes), moderada (morado claro) y alta (morado oscuro). Para la interpretación de los recuentos de ATP se han seguido las especificaciones del fabricante para el luminómetro utilizado. Las muestras se han analizado en el laboratorio de Seguridad Alimentaria y Salud Pública del Centro Militar de Veterinaria de la Defensa.
Para el análisis estadístico de los datos se ha empleado la versión 25 del Statistical Package for the Social Sciences (SPSS) de IBM. Los estudios realizados en función del tipo de variable consistieron en análisis descriptivos univariantes y bivariantes de variables categóricas, estudios de correlación (Pearson, Spearman y coeficiente de correlación intraclase), estudios de regresión lineal y estudios de regresión logística. Como grado de significación estadística se empleó un valor de p < 0,05 (intervalo de confianza, IC = 95%).
RESULTADOS Y DISCUSIÓN
La identificación de biofilms mediante la prueba enzimática Biofinder® fue positiva en el 26% de los PM (el 20% se correspondió con las superficies de acero inoxidable y el 6% con las de plástico), evidenciándose la formación peróxido de hidrógeno y burbujas de oxígeno mediante distintos grados de intensidad, tal y como se observa en la figura 2. Este porcentaje se incrementa al 60% si se considera por IM en vez de por PM.
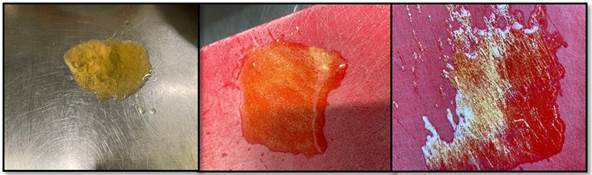
Figura 2. Reacción positiva del Biofinder®. La reacción más intensa se aprecia en la imagen de la derecha con la formación de una espuma blanca más densa.
Según el modelo de regresión logística binaria entre las variables ATP y biofilms, el incremento de los valores de ATP supone una Odds Ratio de 3,6 para la aparición de biofilms, es decir, con valores altos de ATP la probabilidad de presencia de biofilms es 3,6 veces superior en nuestro estudio (p < 0,05).
En lo referente a los residuos proteicos en superficie, el tratamiento de LD aplicado in situ (medición B) se ha mostrado eficaz para reducir los niveles de proteínas con respecto a las muestras tomadas previas al mismo (medición A). En el 80% de los casos el nivel de proteínas se redujo mientras que en el 20% restante se mantuvo igual. En ningún punto de muestreo el nivel de proteínas se incrementó después de la LD con hipoclorito al 2%, lo que sugiere que a esta concentración la lejía no actuó como factor de confusión. Asimismo, la ausencia de proteínas se presentó en un porcentaje bajo (12%) de los PM de la medición A, sin embargo este porcentaje se incrementó hasta el 54% en la medición B. Por otro lado, la presencia de alto nivel de proteínas solo se encontró en el 12% de los PM de la medición A mientras que en la B no hubo ningún caso.
Moore et al.11 compararon tres métodos de medición de proteínas en superficie y todos fueron capaces de detectar concentraciones de hasta 625 µg /100 cm2, aunque el más sensible fue capaz de detectar concentraciones tan bajas como 19,5 µg /100 cm2 en superficies secas. La mayor eficacia para detectar altas cantidades de proteínas sugiere que esta metodología debería emplearse en industrias que produzcan o manipulen alimentos con alto contenido en proteínas.
Tras analizar los datos recabados, se puso de manifiesto la correlación entre los recuentos de ATP y la lectura de proteínas en superficie en la medición A (p < 0,05). El coeficiente de correlación igual a 0,29 indica que la correlación es positiva, por lo que el incremento en una variable se asocia al incremento de la otra, tal y como puede apreciarse en la figura 3.
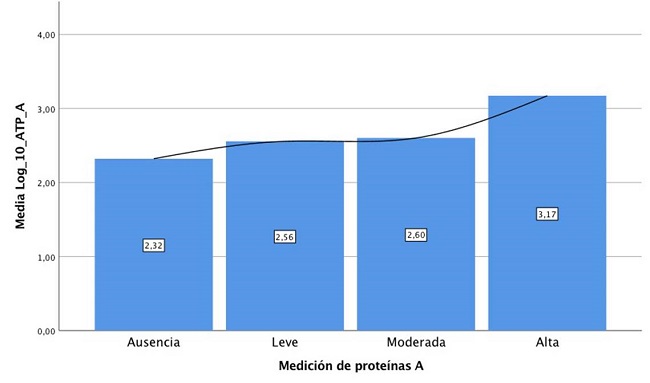
Figura 3. Relación entre los recuentos estimados por la medida de ATP y la lectura de proteínas en superficie en la medición A. En cada barra viene expresado el valor promedio del log10 ATP en URL/100 cm2.
Los recuentos de microorganismos de la medición A mediante TEMPO® se resumen en la tabla 2. En la medición B no se encontraron recuentos de Staphylococcus aureus (STA), Bacillus cereus (BC) ni Escherichia coli (EC), además el número de PM con recuentos de enterobacterias (EB) y coliformes totales (TC) se redujo de 9 (18%) y 10 (20%) en la medición A, a 1 (2%) y 2 (4%) en la medición B, respectivamente. Para AC los PM con recuentos pasaron de 22 en la medición A (44%) a 6 en la medición B (12%). Tanto en la medición A como en la B los recuentos por método automatizado han evidenciado valores superiores de 1 a 2 órdenes exponenciales con respecto a los Petrifilm™, coincidiendo con otros trabajos como el de Salas Vázquez en 200712. En ningún PM se detectaron las bacterias patógenas Salmonella spp., Listeria monocytogenes y Campylobacter spp.
Tabla 2. Recuentos obtenidos en los PM en la medición A mediante TEMPO®. Los promedios no incluyen los PM con ausencia de estos microorganismos. (n = 50).
| Microorganismo en medición A | Nº PM con recuentos | Porcentaje (%) | Promedio (log10 UFC/100 cm2) |
|---|---|---|---|
| EB | 9 | 18 | 2,37 |
| EC | 0 | 0 | NA |
| TC | 10 | 20 | 1,98 |
| STA | 3 | 6 | 1,1 |
| BC | 1 | 2 | 1,72 |
| AC | 22 | 44 | 3,82 |
NA: No aplica; EB: enterobacterias; EC: Escherichia coli; TC: coliformes totales; STA: Staphylococcus aureus; BC: Bacillus cereus; AC: aerobios mesófilos totales. UFC: Unidades Formadoras de Colonias
En la medición A existe una correlación positiva entre los recuentos de AC por TEMPO® y Petrifilm™, con un coeficiente de correlación de 0,56 (p < 0,05). De igual manera, la concordancia entre ambas técnicas es suficiente y significativa según el coeficiente de correlación intraclase (0,463; IC 95%: 0,179-0,673; p < 0,05).
El estudio de regresión lineal entre la variable independiente AC (TEMPO®) y la dependiente ATP en la medición A (figura 4), puso de manifiesto la linealidad entre ambas tanto para la constante como para la variable independiente (p < 0,05). Asimismo, el coeficiente de determinación (R2) de 0,422 indica que los recuentos de AC explican el 42,2% de la variabilidad observada en las determinaciones de ATP. Estos datos concuerdan con los obtenidos en muestreos de varias cocinas de hospital por Aycicek et al.13, en los que también existió concordancia estadísticamente significativa entre las dos técnicas (kappa = 0,249, p < 0,05). Por su parte, el recuento en Petrifilm® también mostró asociación lineal con la variable ATP a pesar de ser más débil (R2 = 0,240, p < 0,05). El hecho de que el 57,8% de la variabilidad de los recuentos de ATP no pueda ser explicado con el estudio de regresión lineal basado en nuestros recuentos de AC por TEMPO® en la medición A, sugiere que existen otros elementos que influyen en las determinaciones de ATP, como los restos celulares de distinta índole, las levaduras y otras especies bacterianas. Para Larson et al.14 la dificultad a la hora de relacionar las unidades formadoras de colonias (UFC) con las unidades relativas de luz (URL) radica en que la bioluminiscencia no puede identificar el origen del ATP. Por su parte, según Davidson et al.15 las lecturas altas de ATP pueden tener un origen tanto alimentario como microbiano, además son necesarios recuentos mínimos de 104 UFC/100 cm2 para medir ATP, situación que también indican Maukonen et al.16. Y Jasson et al.17 coinciden al afirmar que la bioluminiscencia del ATP solo puede emplearse ante recuentos bacterianos altos (>104 UFC/g).
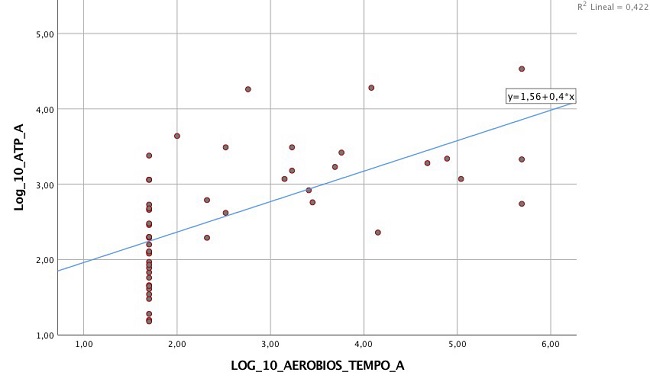
Figura 4. Dispersión simple. Correlación entre el recuento de AC mediante TEMPO® y la determinación de ATP.
Teniendo en cuenta los criterios de aceptabilidad propuestos por Houhala et al.18 en 1996 y citados por Miettinen et al. unos años después19, que clasifican el estado de las superficies en función del nivel de determinados microorganismos (tabla 3), en la medición A, 17 PM tendrían un estado inaceptable si se tuviera en cuenta el recuento de AC (34% del total de PM y 77,3% del total de PM con recuentos viables de AC) y 5 en relación al recuento de EB (10% del total y 55,5% del total de PM con recuentos viables de EB, todos coincidentes con recuentos de AC). En la medición B solo 2 PM (4%) serían inaceptables según los AC y 1 (2%) según las EB. Para otros autores como Sneed et al.20 o Marzano y Balzaretti21 el punto de corte que marca la aceptabilidad de una superficie de trabajo en instalaciones de catering está en < 1,3 Log10 UFC/cm2 aerobios totales en tablas de corte o < 1,3 Log10 UFC/unidad en cuchillos, cuencos y otro tipo de equipamiento.
Tabla 3. Criterios de aceptabilidad de la contaminación de microorganismos en superficies (UFC/100 cm2).
| Agente microbiano | Bueno | Moderado | Inaceptable |
|---|---|---|---|
| Bacterias aerobias totales | 180 | 180-500 | >500 |
| Levaduras | <100 | 100-500 | >500 |
| Mohos | <60 | 60-160 | >160 |
Adaptado de Miettinen et al.20 de un trabajo previo de Houhala et al.19
Los criterios de aceptación para los residuos de ATP en superficies que se han empleado en nuestro estudio han sido los de la guía rápida de interpretación de resultados publicada por la empresa I.C.T. S.L. (representante de Biotrace Ltd.) para superficies de acero inoxidable (tabla 4). Además, el umbral de aceptación de 500 URL/100 cm2 coincide con el propuesto por Ríos-Castillo et al.22 en una publicación en la que se estudiaron superficies en contacto con alimentos de varios supermercados españoles. Tras considerar todos los PM como de riesgo bajo, el 36 % no fueron aceptables, aunque el tratamiento de LD con hipoclorito sódico al 2% durante 10 segundos fue capaz de reducirlos al 12%.
Tabla 4. Interpretación de resultados de ATP (URL) en superficies de trabajo en empresas de catering (I.C.T. S.L.).
| Pasa | Precaución | Falla | |
|---|---|---|---|
| Superficie de alto riesgo | <300 | 301-599 | >500 |
| Superficie de bajo riesgo | <500 | 501-999 | >1000 |
Todos los PM en los que se han detectado biofilms con Biofinder® han resultado inaceptables siguiendo los criterios de aceptación empleados para los residuos de ATP y para los recuentos de AC. Existió una coincidencia del 94,5% de los PM inaceptables según los criterios de aceptación de residuos de ATP y de recuento de AC.
CONCLUSIÓN
Se detectaron biofilms en una tercera parte de los PM inspeccionados. Las IAM analizadas presentaron un estado aceptable de LD y se pueden considerar seguras al no detectarse microorganismos patógenos en ningún PM. Asimismo, el hipoclorito sódico al 2% durante 10 segundos se ha mostrado eficaz en la reducción de ATP, de residuos proteicos y de la carga bacteriana en las superficies analizadas. Sin embargo, sería recomendable que los operadores de las IAM incluyeran el control de biofilms en los sistemas de vigilancia del APPCC, y sopesaran un tratamiento de LD adicional previo al uso en superficies y útiles de trabajo cuya LD se haya efectuado con cierta antelación o sean considerados de mayor riesgo; aspectos que podrían ser un elemento más a controlar por los veterinarios inspectores. A la vista de los resultados obtenidos y teniendo en cuenta su rapidez y facilidad de interpretación, es recomendable el uso de visualizadores de biofilms como herramienta de control en las IAM. Además, las tablas de corte, los utensilios, las zonas de preparación, las bandejas y otros elementos en los que se preparen o manipulen productos cárnicos, deberían ser monitorizados de forma rutinaria mediante sistemas de medición de residuos proteicos. La determinación de ATP no puede emplearse por sí sola para estimar la carga microbiana ya que depende de más variables.













