INTRODUCCIÓN
El voriconazol, con PM 349.3 g/mol y fórmula C16H14F3N5O, es un antifúngico de la familia de los triazoles con una actividad antifúngica de amplio espectro. Ha sido probada su elevada eficacia frente a aspergilosis invasiva, infecciones invasivas graves por Candida spp. resistentes a fluconazol, candidemia en pacientes no neutropénicos y en infecciones fúngicas por Scedosporium spp. y Fusarium spp1,2. También está indicado como profiláctico frente a infecciones fúngicas en los casos de pacientes trasplantados.
El mecanismo de acción de este fármaco actúa a nivel de la síntesis de la pared celular, inhibiendo la síntesis del ergosterol, mediante la unión del fármaco a la enzima 14α-desmetilasa, de igual forma que el resto de antifúngicos triazolados, posaconazol e itraconazol.
Las características farmacocinéticas de absorción lo posiciona como uno de los fármacos de elección, con una absorción rápida y casi completa, alcanzando una Cmax (concentración máxima) en 1-2 horas y una biodisponibilidad vía oral del 96 %. Presenta un volumen de distribución de 4,6 l/kg y una unión a proteínas plasmáticas del 58 %.
El voriconazol presenta una elevada variabilidad inter e intraindividual en su metabolismo, metabolizándose en metabolitos inactivos por isoenzimas del citocromo P450, principalmente por el CYP2C19 en la cual se encuentran metabolizadores rápidos, ultrarrápidos, normales o lentos. El 35-50 % de la población caucásica son metabolizadores normales pero un 20-30 % son metabolizadores rápidos y un 2-5 % ultrarrápidos. De este modo el voriconazol es eliminado del organismo en forma de metabolitos inactivos, siendo menos del 2 % eliminado de forma inalterada por orina.
El intervalo terapéutico deseable, en estado valle, es de 0,5-1 µg/ml para profilaxis y de 1-5 µg/ml para tratamiento, alcanzándose el estado estacionario a las 48 horas con dosis de carga (6 mg/kg/12 h IV o 400 mg/12 h VO) y de 6 días sin dicha dosis.
En los últimos años el elevado incremento de casos de infecciones fúngicas invasivas (IFI), provocadas tanto por levaduras como hongos filamentosos, ha desencadenado el mayor uso y desarrollo de antifúngicos. Dicho incremento se ha visto fomentado en el creciente número de pacientes inmunocomprometidos. Esta inmunosupresión es fuente del tratamiento en pacientes trasplantados, tratamiento quimioterápico o con terapia inmunosupresora y pacientes afectados por el virus de la inmunodeficiencia humana3,4.
El incremento en el uso de voriconazol, su elevada variabilidad inter e intraindividual, su estrecho margen terapéutico y su farmacocinética no lineal, hacen que sea necesaria su monitorización para un ajuste posológico individualizado5. La necesidad es de suma importancia por las reacciones adversas que presenta: hepatotoxicidad, toxicidad neurológica, toxicidad visual y toxicidad dermatológica.
Para la monitorización de niveles de voriconazol es habitual el uso de métodos automatizados de inmunoensayos, por su rapidez en la obtención de resultados y facilidad en la manipulación de muestras6, aunque aportan menor exactitud y sensibilidad que las realizadas mediante HPLC7,8.
Por todo ello en el área de farmacocinética del Servicio de Farmacia del HCD Gómez Ulla, se ha puesto a punto y validado un método analítico para la determinación de voriconazol en muestras séricas por cromatografía líquida de alta resolución acoplada a un detector espectrofotométrico ultravioleta-visible diodo-array, cuyo objetivo es medir de forma fiable y precisa concentraciones séricas de dicho fármaco.
MATERIAL Y MÉTODOS
Estándares y reactivos
Como estándar se utilizó voriconazol puro (PHR1892-1G), lote LRAC2092 de Sigma-Aldrich. Este fue disuelto en agua destilada Versylene Fresenius, para la preparación de calibradores y patrones. Estas disoluciones fueron realizadas con jeringas cromatográficas (Hamilton Bonaduz AG, Switzerland). Para el tratamiento de las muestras de suero se utilizó acetonitrilo PanReac Applichem, calidad HPLC.
Preparación de las muestras
En el caso de los calibradores preparados en agua destilada no requirieron un pretratamiento para ser analizados, sin embargo, los calibradores y controles en suero requirieron el empleo de acetonitrilo para realizar la precipitación de las proteínas y conseguir así un suero libre de proteínas que pudieran interferir con el voriconazol. Tras la adición de acetonitrilo al 50 %, las muestras fueron agitadas en un vortex y centrifugadas a 4.000 rpm durante 10 minutos. Del sobrenadante, se inyectaron 20 µl en el cromatógrafo para su determinación.
Equipo HPLC y condiciones cromatográficas
Se utilizó un equipo cromatográfico HPLC Shimadzhu, equipado con bomba de doble pistón, detector ultravioleta diodo-array, de longitud de onda variable y programable, con horno, desgasificador y estación de control sobre IBM PC 300. La columna analítica empleada fue Brisa LC2 C18 con un tamaño de partícula de 5 µm y con unas dimensiones de 15 x 0,46 cm. Tras la puesta a punto del método analítico, realizando estudios con diferentes condiciones cromatográficas, se fijaron las siguientes condiciones analíticas para la validación del método: fase móvil compuesta por agua destilada (ácido fórmico 0,5 %) / acetonitrilo 65/35, flujo de 1,5 ml/min, temperatura columna de 35 grados, tiempo de análisis de 9 minutos y longitud de onda de 256 nm.
Ensayos de validación del método analítico
Todos los ensayos de validación se realizaron conforme a los requisitos establecidos en las International Conference on Harmonization (ICH) Guidelines for Validation of Analytical Methods (Q2 R1)9.
Selectividad
Se comprobaron posibles interferencias de compuestos endógenos, metabolitos del propio fármaco, u otros fármacos de uso común (ibuprofeno, paracetamol, ácido ascórbico, nicotina u omeprazol) con las condiciones cromatográficas descritas anteriormente.
Linealidad
Se pesaron 10 mg de voriconazol con una balanza de precisión Sartorius 2842 (desviación estándar 0,05 mg) utilizando 100 ml de agua destilada para obtener una solución madre de 100 µg/ml. Se hicieron diluciones seriadas de 20 - 10 - 5 - 2 - 1 - 0,1 µg/ml, estas soluciones estándar se analizaron 5 veces cada una en 5 días distintos realizándose una curva de calibración de voriconazol en agua.
Posteriormente, y siempre a partir de la solución madre de 100 µg/ml, fueron cargadas muestras de sueros, procedentes de un pool de sueros, con las cantidades de voriconazol necesarias para cubrir el rango del ensayo, 10 - 5 - 0,8 - 0,4 - 0,2 - 0,1 µg/ml
Con estas concentraciones de sueros cargados con voriconazol, se realizaron 5 repeticiones de cada una en 5 días diferentes. Se analizaron con la curva de voriconazol en agua y con los resultados se realizó una curva de calibración de voriconazol en suero.
En ambas curvas se comprobó la linealidad según los requerimientos de la ICH9.
Límites de cuantificación
Usando la curva de calibración construida el límite de cuantificación (LOQ) será la mínima concentración que pueda ser detectada con aceptable exactitud y precisión.
Exactitud y precisión
Se elaboraron tres controles de voriconazol en suero (QC) de tres concentraciones, 0,4-2-10 µg/ml, con estos controles sobre la curva de calibración de voriconazol en suero se realizó la validación del método.
Para la precisión se estudiaron los coeficientes de variación (CV), desviación estándar (SD) e IC95 %, determinados a partir de 5 medidas consecutivas (inter día) y a partir de 10 medidas realizadas en un mismo día (intra día).
El estudio de exactitud se fundamentó en la recuperación media obtenida en las diferentes medidas. Criterios de aceptación: recuperación media 95 %-105 %, CV≤5 %.
RESULTADOS
Selectividad
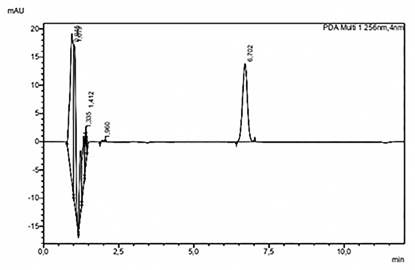
Ninguno de los fármacos utilizados parece causar interferencias con la medida de voriconazol, demostrando la selectividad del método desarrollado y consecuentemente, no se esperarán resultados falsos positivos. En la figura 1, se observa en el cromatograma la presencia única de un pico perteneciente al voriconazol.
Linealidad
Se realizaron distintas rectas de calibración, determinándose: r (coeficiente de correlación lineal), r2 (coeficiente de determinación), ordenada en el origen y pendiente) para el 99 % de confianza. Criterios de aceptación. r≥0,999 y r2≥0,999.
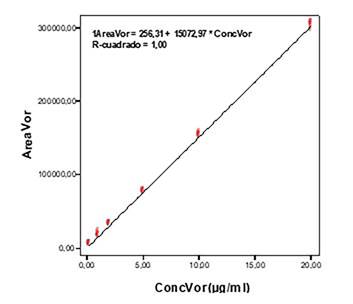
Recta de calibrado para las diluciones en agua representando el área frente a la concentración (figura 2), obteniéndose:
El método es lineal para el rango de concentraciones estudiado, 20-0,1 µg/ml, con una r2=1.
Recta de calibrado para las diluciones en suero representando el área frente a las concentraciones, figura 3, es: A= 360,92 + 8871,89 x C.
El método en suero también es lineal para el rango de concentraciones estudiado, 10-0,1 µg/ml, con una r2=1.
Prueba de la hipótesis nula de la pendiente: b=0. Se determinó a partir de una ANOVA de la regresión, si p<0,05, el valor de b difiere significativamente de 0. La ANOVA de la regresión es F=47905,67 (p<0,001) demostrando buena linealidad del método.
Con estos resultados se determinó el valor medio de la respuesta y la desviación estándar de los factores de respuesta. El CV de los factores de respuesta debe ser ≤5 %, obteniéndose los resultados recogidos en la tabla 1.
Límite de cuantificación
El límite de cuantificación se estableció en 0,1 µg/ml, para el cual se tiene un CV de 4,6 %, próximo al criterio máximo de aceptación (≤5 %).
Exactitud y precisión
Los resultados se muestran en la tabla 2. El criterio de aceptación fue un valor de CV≤5 %. Se realizó un análisis t de Student y se comprobó que no había diferencias significativas entre los distintos días (p<0,05).
Así mismo, para el estudio de exactitud se fijaron los siguientes criterios de aceptación: recuperación media 95 %-105 % y CV≤5 %. Igualmente se realizó un t de Student comprobando que no existen diferencias significativas entre la recuperación media y el 100 %, p<0,05.
Estabilidad de las soluciones analíticas
Tanto las soluciones en agua, como los sueros cargados con voriconazol, fueron estables al menos 30 días a temperatura ambiente, refrigerados y 3 meses tras congelación. Se comprobó mediante la realización de series de determinaciones en las condiciones de conservación descritas anteriormente.
DISCUSIÓN
Con el presente trabajo se ha podido estandarizar y validar una técnica analítica para la identificación y cuantificación de concentración sérica de voriconazol. Estas determinaciones se realizan con un rango amplio y confiable que va desde los 0,1 µg/ml hasta los 10 µg/ml. La exactitud y precisión del método, como la pureza y sensibilidad de la señal cromatográfica, hacen esta metodología realmente útil para el seguimiento terapéutico de los pacientes con voriconazol pautado.
Los coeficientes de variación en concentraciones próximas a 0,5 µg/ml, inferiores al 5 %, indican que nuestro modelo tiene una buena precisión en ese rango de concentraciones crítico en tratamiento profiláctico. Además, se realizó una t de Student, resultando una p > 0,05, indicando la no existencia de diferencias estadísticamente significativas, confirmando la buena exactitud del método.
El proceso por el que se tratan las muestras mediante la precipitación de proteínas con el uso de acetonitrilo, es un método eficaz, rápido y sencillo, al contrario que el utilizado por otros autores10,11, obteniendo un sobrenadante libre de proteínas que pudieran ser objeto de interferencias en el cromatograma y obstrucción de la columna. Este tratamiento de la muestra ha demostrado gran reproducibilidad y firmeza, evitando largos procesos de extracción del analito, con una mayor pérdida de sensibilidad.
Es importante destacar que se trata de un análisis de coste relativamente bajo, respecto a otras determinaciones que se realizan mediante métodos de inmunoensayo, por lo que en términos económicos supone un caso coste-efectividad favorable y accesible. Además este método por HPLC/UV-Vis ofrece una mayor sensibilidad con límite de cuantificación (0,1 µg/ml) en comparación con el límite de cuantificación que ofrecen otros métodos por inmunoensayo, con límites de cuantificación de 0,5 µg/ml, y siendo este el límite para los valores de voriconazol empleados a modo profiláctico.
CONCLUSIÓN
La selectividad y la sencillez del tratamiento de muestra hacen de él un método eficaz, rápido y sencillo para la determinación de voriconazol en suero y con sensibilidad mayor al de los inmunoensayos utilizados. Además el coste del análisis es inferior al de los métodos de inmunoensayo utilizados.