INTRODUCCIÓN
Desde el inicio de la pandemia por Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2), (covid-19), en el mundo se ha producido un cambio en los paradigmas de la sociedad. Este cambio ha afectado también al ámbito de las Fuerzas Armadas. El efecto ha sido especialmente notorio en las operaciones internacionales, donde el correcto desempeño de la misión se ha visto comprometido en numerosas ocasiones.
En la misión EUTM MALI (European Training Mission) hay desplegados 595 soldados españoles, repartidos en distintas localizaciones. La mayoría se encuentran en el Koulikoro Trainig Camp (KTC), junto con un número variable de holandeses, finlandeses, alemanes, lituanos, húngaros, austriacos, suecos y checos. Esta situación añade complejidad a la tarea de establecer una normativa común a todas las nacionalidades, debido a las diferencias culturales que existen entre ellas.
En este estudio se añaden al KTC los casos confirmados en Segou, Sevare y Gao (tres bases descentralizadas), así como los positivos de Bamako (dos localizaciones) y la ITAT (base de helicópteros).
Es importante tener en cuenta la situación y las capacidades de limitar el contacto social en este ambiente: camaretas de cuatro a diez personas, comedor común de todas las nacionalidades, actividad física habitualmente en grupo, lugares de trabajo cerrados y con espacio muy reducido (generalmente contendores de 20 pies), etc.
El brote comenzó el día 25 de noviembre de 2021, con una duración de 63 días (último positivo el 26 de enero de 2022). De forma paralela se desarrollaron diversos brotes en el resto de contingentes de otras nacionalidades, pero el español, al ser el contingente con más unidades, fue el más importante.
La adaptación de las medidas de prevención y control establecidas por las autoridades sanitarias españolas se deben aplicar en zona de operaciones, debiendo conjugarse por las impuestas por la propia misión. En este caso y con carácter general, eran más estrictas las determinadas por la misión, aunque fueron adaptándose progresivamente.
Las decisiones sobre las medidas de prevención y control implementadas fueron tomadas por la figura del JMED (durante el periodo estudiado, un teniente coronel médico alemán), tras reunirse con la JMED Deputy en KTC (capitán médico holandesa) y el oficial médico del ROLE 1 alemán (capitán) y el oficial médico de ASAN NSE español (teniente).
Durante el brote se implementaron las siguientes medidas de prevención y control: uso de mascarilla quirúrgica obligatoria en todos los espacios (salvo camareta), disminución de aforo de los bares a cuatro personas por mesa, higiene de manos estricta y prohibición de contacto con personal maliense.
En el caso de los positivos, fueron aislados en un edificio para tal uso, con aseos propios. Cuando un positivo era detectado por Test Rápido de Detección de Antígenos (TRDA), se confirmaba mediante Reacción en Cadena de la Polimerasa (PCR) frente a SARS-CoV-2 en un laboratorio de Bamako. Posteriormente, permanecían aislados durante siete días. A pesar de que en la mayoría de las publicaciones (siguiendo las recomendaciones sanitarias de cada país) mantenían a los positivos aislados durante 14 días1-5, se decidió, pasado el plazo de siete días, comenzar a hacer PCR cada dos días hasta que una resultaba negativa, momento en el cual terminaba su aislamiento. Esta medida se justifica por la necesidad de personal en las distintas funciones dentro de la base.
En el caso de los contactos estrechos (más de 15 minutos a menos de dos metros de distancia sin mascarilla en las últimas 48 horas), realizaban cuarentena en sus camaretas, y se les hacía TRDA en los días +0, +3, +5 y +7. Si en el día +5 eran negativos, se les permitía salir de la camareta a realizar sus funciones, siempre con mascarilla en todo momento.
Posteriormente, dado el elevado número de contactos estrechos y las necesidades operativas de la misión, este protocolo cambió tras una nueva reunión de los arriba mencionados. Siguiendo las recomendaciones de España y la OMS del momento frente a la COVID-19, los contactos estrechos no realizaron cuarentena, siguieron con sus actividades diarias, con mascarilla obligatoria en todo momento, realizando los mismos test de seguimiento y no permitiéndoles utilizar ningún local de uso común (comedor, gimnasio, bar, etc.).
Además de estas medidas, la introducción de la dosis de recuerdo frente a SARS-CoV-2 se ha convertido en un objetivo y una necesidad operacional.5 Desde España se propuso la vacunación del contingente con Spikevax (Moderna)®, y el 22 de enero de 2021 se inició la campaña.
Si bien es cierto que cada Zona de Operaciones (ZO) tiene sus peculiaridades, en la mayor parte de los casos presentan una serie de elementos en común que son importantes a la hora de manejar un brote de cualquier enfermedad: hacinamiento, trabajo en espacios cerrados, dificultad en el acceso a atención sanitaria, otras enfermedades endémicas, etc. Considerando que todos pueden beneficiarse de las experiencias previas, aunque la misión no sea exactamente la misma, se realizó un estudio para describir nuestros procedimientos y resultados manejando un brote de covid-19 y una vacunación en ZO.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional descriptivo prospectivo desde el 23 de noviembre de 2021 hasta el 22 de febrero de 2022 sobre el contingente español desplegado en EUTM MALI XIX.
Se realizó TRDA (Boson BioTech®) en muestra nasofaríngea como método diagnóstico de infección en aquellos pacientes sintomáticos y como método de cribado en sus contactos estrechos:
— Pacientes positivos (TRDA): realización de PCR de confirmación (excepto en Sevare, Segou y Gao, donde no era posible su realización). Aislamiento en tiendas habilitadas a tal efecto. Posteriormente PCR en el día +10 para comprobar negativización. En caso de obtener de nuevo resultado positivo se repitió el día +12. El día +14 fin de aislamiento sin prueba complementaria.
— Contactos estrechos: se consideraron a aquellos que estuvieron más de 15 minutos a menos de dos metros de distancia sin mascarilla en las últimas 48 horas6. TRDA los días +0, +3, +5 y +7. Inicialmente cuarentena en sus camaretas hasta el día +5. Posteriormente, cambio de protocolo, pudiendo realizar sus funciones con mascarilla obligatoria en todo momento hasta el día +7.
Las variables estudiadas fueron: sexo, edad, días desde la última dosis de vacuna, tipo de vacuna en primera y segunda dosis (Moderna, Pfizer o Astrazeneca), despliegue a ZO con una dosis o dos dosis, covid-19 previo a despliegue, covid-19 en despliegue, sintomatología (asintomático, anosmia, tos, fiebre, malestar general, cefalea, mucosidad) y voluntariedad para la vacunación en ZO.
La descripción de la variable días desde la última dosis de vacuna, que es numérica, se realizó con medidas de tendencia central (media y mediana). La comparación entre los grupos (covid-19 en ZO o no) se realizó mediante test paramétricos en aquellas variables con distribución normal; sexo, tipo de vacuna en primera y segunda dosis, despliegue a ZO con una dosis o dos dosis y covid-19 previo a despliegue se analizaron mediante test exacto de Fisher. Se utilizó la prueba T de Student para el análisis de la variable días desde la última dosis de vacuna y edad.
Se seleccionaron a los candidatos para vacunación según las recomendaciones del Instituto de Medicina Preventiva de la Defensa (IMPDEF). La vacuna administrada fue Spikevax (Moderna)® Lote 214013, fecha de caducidad 13 de marzo de 2022.
La gestión de datos se realizó mediante una base de datos anonimizada e informatizada con el programa MS Excel. El análisis de los datos se realizó con el programa SPSS v.26 (SPSS Inc., Chicago, IL). Las diferencias se consideraron estadísticamente significativas si el grado de significación p fue inferior a 0,05.
RESULTADOS
Desarrollo del brote
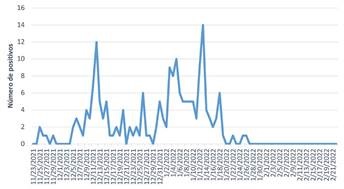
De un contingente de 595 personas, 188 (31,6%) fueron positivos, siendo el último caso el día 26 de enero de 2022. El número de positivos por día está reflejado en la figura 1.
Los casos positivos generaron un total de 183 contactos estrechos. De los 183 contactos estrechos, 45 (25%) resultaron positivo. De ellos, 34 (75%) fueron positivos el día +3, 10 (22%) en el día+5 y 1 (3%) en el día +7.
Características de los pacientes
La distribución por sexos fue de 23 (3,9%) mujeres y 572 (96,1%) varones. La media de edad fue de 32 años. Todo el contingente se realizó una PCR como máximo 72 horas antes del despliegue. El 70% del contingente fue vacunado con dos dosis de Oxford/Astrazeneca®, 23,3% con Comirnaty (Pfizer)®, y 6,7% con Spikevax (Moderna)®. El 92,1% había recibido 2 dosis de la vacuna, frente al 7,9% que solo había recibido una única dosis (por infección previa por COVID-19). La media de días desde la última dosis de vacuna hasta el resultado positivo fue de 231 días (casi 8 meses).
De los que dieron positivo, el 64,4% fueron asintomáticos. Del 35,6% restante que sí padecieron síntomas, la duración media de los mismos hasta el diagnóstico fue de dos días. La distribución de síntomas fue: 10,9% anosmia, 35,9% tos, 9,4% mucosidad, 32,8% cefalea, 57,8% malestar general y 20,3% fiebre. Todos los síntomas fueron leves y ninguno requirió hospitalización. No encontramos diferencias en la presentación como sintomático o no en función del sexo.
De los casos positivos, el 90% de aquellos que habían sido vacunados con una sola dosis fueron asintomáticos al diagnóstico versus un 64% de los vacunados con dos dosis (p = 0,01).
No se encontraron diferencias estadísticamente significativas en los días desde la última vacunación y la adquisición del virus.
Tampoco se encontraron diferencias estadísticamente significativas en función del sexo, ni edad, ni en función del tipo de vacuna, ni por estar vacunado con dos dosis o una dosis (por infección previa), ni por infección previa por SARS-CoV-2.
Vacunación
El 10 de diciembre de 2021 se estableció la dosis de recuerdo como requisito para los despliegues, siendo la vacuna suministrada Spikevax Moderna®. De un total de 440 personas potencialmente vacunables, se vacunó a 403 (91%).
De las 45 personas que rechazaron la vacunación inicialmente, ocho lo reconsideraron tras una charla informativa, quedando finalmente un total de 37 (9%) personas que rechazaron la vacunación.
DISCUSIÓN
Desarrollo del brote
Para minimizar el riesgo de desplegar personal infectado por SARS-CoV-2, se siguió la normativa aprobada por la IGESAN y el protocolo de despliegue establecido por el Mando de Operaciones, que incluía limitar actos sociales en los ocho días previos al despliegue y se realizó al contingente una PCR como máximo 72 horas antes de la partida.
El primer caso se detectó el día 25 de noviembre de 2021, dos días después de nuestra llegada, sin embargo, correspondían a parte del contingente que había desplegado 10 días antes. No se puede saber si alguno de los positivos ya desplegó infectado desde España, sin embargo, la situación en cuanto a transmisión comunitaria en España en esos momentos no era elevada, por lo que se puede asumir que la infección ocurrió en ZO.
El brote duró un total de 63 días (último positivo el 26 de enero de 2022), con un primer pico a los 17 días de 12 positivos en un solo día, y un segundo rebrote a los 51 días (15 días después de Navidad y Año Nuevo), con el máximo de 14 positivos en un día.
Medidas de prevención y control al inicio del brote
Se propuso: uso de mascarilla quirúrgica obligatoria en todos los espacios (salvo camareta), disminución de aforo de los bares a cuatro personas por mesa, higiene de manos estricta y prohibición de contacto con personal maliense (no así con otros contingentes por las necesidades de interacción derivadas de los cometidos en KTC), medidas que otros autores también tomaron3,4,7.
No se disminuyó el aforo de otras dependencias por diversos motivos logísticos. En el caso del comedor, como se indicó previamente, era compartido por todos los contingentes de todas las nacionalidades, con un horario de comidas muy restringido (dadas las exigencias de limpieza y la limitación de aforo ya existente). En el caso de los alojamientos, el KTC se encontraba en dicho periodo al límite de su capacidad, por lo que tampoco fue posible.
Estas medidas se han demostrado efectivas, en especial el uso de mascarilla en todos los ámbitos7.
De los 183 contactos estrechos, 138 (75%) fueron negativos durante todo el periodo de cuarentena. Teniendo en cuenta la autorización para realizar actividades que se implementó en el curso del brote para los contactos, se generaron un total de 690 días laborables perdidos. Si a esto le sumamos los 1.316 días laborables perdidos por los 188 positivos, se puede apreciar el verdadero impacto en el desarrollo de la misión.
La implementación de mascarilla quirúrgica en interior y exterior supuso un descenso importante en el número de contactos estrechos y, por lo tanto, de gente incapacitada para realizar sus funciones.
Fuentes de infección en ZO
Debido a la situación de la base de Koulikoro, compartida con las Fuerzas Armadas Malienses, resultaba imposible cerrar y aislar a la base, por lo que el riesgo de personal externo infectado accediendo a la base era elevado, situación común en otras ZO3. En Mali no existe una red sanitaria con los estándares europeos y, por lo tanto, la incidencia real de covid-19 en el país en el momento del brote es desconocida.
Por otra parte, el alojamiento en Koulikoro implica necesariamente alojar en la misma camareta a varias personas. Estudios realizados, en este sentido, sugieren que ser compañero de habitación de un paciente positivo es otro de los factores de riesgo a la hora de propagar el SARS-CoV-2.8
Se tomó la decisión de realizar la cuarentena de los contactos estrechos en sus camaretas para limitar el contacto con otras personas. Además, se reservaron ciertos baños para su uso exclusivo y así limitar aún más el contacto, medida que, sin embargo, no se ha visto que tenga un impacto importante en la transmisión del virus8.
Uso del TDRA como cribado
La PCR sigue siendo el gold estándar en el diagnóstico de infección por SARS-CoV-2, pero presenta la problemática de que pueden persistir con resultado positivo hasta tres meses tras la infección, lo cual puede tener un gran impacto en la operatividad de la misión9.
La solución a este problema fue el contaje del número de ciclos de PCR, pero en muchos países en los que España despliega no hay acceso a realizar el número de ciclos de PCR, ni está estandarizado10.
La realización de TRDA presenta varias ventajas: es rápido, barato, fácil de realizar, elimina la necesidad de laboratorio y brinda la posibilidad de hacer test seriados. Sin embargo, hay que tener en cuenta que la sensibilidad del TDRA en individuos asintomáticos es de media un 58,1%11.
Por otra parte, varios estudios sugieren que la mayor parte de las personas asintomáticas con TRDA positivo tienen un número mayor de ciclos en la PCR, lo que sugiere menor carga viral y por lo tanto menor capacidad infectiva12. De este modo, puede ser de utilidad tanto para el cribado como para la posterior comprobación de negativización a la hora de finalizar el aislamiento12.
De los contactos estrechos asintomáticos que resultaron positivo durante su seguimiento, el 75% fueron positivos el día +3, el 22% en el día+5 y el 3% en el día +7. Parece razonable, por ahorro de recursos, limitar los TDRA a los días +3 y +5.
EL TDRA puede resultar un método útil en ZO para el manejo de los brotes de COVID-19, especialmente para el cribado de contactos asintomáticos.
Características del grupo de positivos
En la muestra no hemos encontrado diferencias en cuanto a infección ni a la presentación como sintomático respecto al sexo. Tampoco en relación con la edad.
Un aspecto importante, en relación con el estado de inmunidad, es el tiempo desde la administración de la última vacuna.13 En la muestra no se han encontrado diferencias a este respecto. Si bien es importante destacar que el papel de la vacunación no es tanto prevenir la infección por el virus como disminuir la sintomatología y la mortalidad, especialmente en ZO donde el acceso a atención sanitaria es limitado14.
La mayor parte del contingente español había sido vacunado con Oxford/Astrazeneca®, y algunos estudios sugieren que los títulos de anticuerpos son menores en comparación con Moderna y Pfizer15. Sin embargo, no se han encontrado diferencias en cuanto al número de infectados en función del tipo de vacuna recibida.
La proporción de individuos asintomáticos fue muy similar a estudios previos (77,83, 76,9%2), siendo esta proporción mayor en aquellos con una sola dosis de vacunación a causa de infección previa por el SARS-CoV-2.
La distribución de síntomas en la muestra fue atípica respecto a otros estudios, con una baja proporción de pacientes con anosmia y más alta en mucosidad y fiebre2. En la muestra se confirma que en una población joven, adecuadamente inmunizada, los casos son leves, sin necesidad de hospitalización ni muertes por esta causa, como ya se ha comprobado en estudios previos7.
Vacunación frente a SARS-CoV-2 en ZO
Las razones para que un individuo decida rechazar la vacunación son diversas y han sido ampliamente estudiadas en la literatura: miedo a los efectos secundarios, inseguridad respecto a la efectividad de la misma, creencia de que es una infección leve, teorías de conspiración y creencia en la superioridad de la infección natural a la hora de desarrollar inmunidad16.
Existe una dificultad añadida en ZO a estas razones, pues una buena parte del personal se encuentra descentralizado y, en ocasiones, en zonas de difícil acceso o con un nivel de inseguridad elevado.
En un estudio llevado a cabo en Estados Unidos, Higginson y colaboradores obtuvieron un 38,6% de rechazo a la vacunación5. En nuestra muestra hemos obtenido una tasa de rechazo a la vacunación significativamente inferior.
Se realizó una charla informativa al personal que rechazó la vacunación, con buenos resultados, un 18% cambiaron su decisión. Este tipo de estrategias ya se han utilizado en otros contingentes, con resultados positivos17.
Si bien se entiende que la importancia de vacunación en ZO obedece, además de a la protección individual y colectiva, a una necesidad operativa para el correcto desarrollo de la misión, la decisión de aceptar o rechazar la vacuna fue individual.
Desde el 10 de diciembre de 2021 se estableció como requisito predespliegue para todos aquellos que desplegasen a partir de esa fecha, pero no para los que ya estaban desplegados.
Este mismo dilema ha ocurrido en contingentes de todas las nacionalidades, en concreto, Krick y Reese hacen un análisis de la imposición de la vacunación en las Fuerzas Armadas estadounidenses18. En este estudio, analizan diversos factores a tener en cuenta, como es el principio de autonomía del paciente, el principio legal-moral, el beneficio para la sociedad en su conjunto desde el punto de vista de la amenaza sanitaria, etc. Concluyen que desde un punto de vista ético, sí estaría justificada la decisión de imponer como obligatoria la vacunación en las Fuerzas Armadas18.
Limitaciones
En primer lugar, se trata de un estudio observacional, con las limitaciones intrínsecas al propio diseño: no existe control en la clasificación de grupos de estudio, pueden existir sesgos no detectados que influyan en los resultados, no se puede demostrar causalidad, solo asociación, etc.
En segundo lugar, solo realizamos TRDA a aquellos sintomáticos y sus contactos estrechos, no masivamente, por lo que se pudieron dejar muchos infectados asintomáticos sin detectar. El realizar TRDA masivamente no era una opción, dada la descentralización del contingente y el riesgo para la seguridad de la misión que implicaba.
En tercer lugar, el tamaño muestral es pequeño en relación a otros estudios y la proporción de mujeres es muy reducida, por lo que resulta difícil extrapolar los resultados a la población general.
CONCLUSIONES
Nuestra experiencia con un brote de covid-19 en ZO refleja la importancia de tomar medidas de prevención y control para el correcto desarrollo de la misión. El resultado de no hacerlo es un número importante de horas de trabajo perdidas, así como una disminución en las capacidades operativas que pueden traer consecuencias no deseadas.
En nuestra muestra, reafirmamos la baja morbimortalidad en población joven, sana y adecuadamente inmunizada.
Además de las recomendaciones generales, creemos que es importante el uso de mascarillas en todos los ámbitos, asegurando a los distintos contingentes un adecuado suministro de las mismas. Por otro lado, se debe intentar evitar el hacinamiento en la medida de lo posible dentro de las bases.
En nuestra experiencia, el uso de TRDA como diagnóstico para aquellos que presentaron síntomas y como cribado para los contactos estrechos asintomáticos es una medida adecuada y proporcional en ZO, teniendo en cuenta y asumiendo las limitaciones de la misma.
Del mismo modo, un protocolo de cuarentena laxo con los contactos estrechos asintomáticos, asegurando el seguimiento mediante TRDA, permite continuar con las operaciones sin aumentar en exceso el riesgo de infección.
La vacunación resulta fundamental para minimizar al máximo la posibilidad de padecer un cuadro de covid-19 grave que implique la necesidad de evacuación a territorio nacional.
Creemos que este estudio puede servir a otros contingentes desplegados en las diferentes misiones en las que España participa, así como para el planeamiento de las futuras misiones desde el punto de vista sanitario, para mantener la misión en funcionamiento y a la fuerza sana.