Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Osteoporosis y Metabolismo Mineral
versión On-line ISSN 2173-2345versión impresa ISSN 1889-836X
Rev Osteoporos Metab Miner vol.5 no.2 Madrid abr./jun. 2013
https://dx.doi.org/10.4321/S1889-836X2013000200004
Efectos divergentes de la inhibición de TGF-β en metástasis óseas de cáncer de mama y pulmón
Divergent effects of TGF-β inhibition in bone metastases in breast and lung cancer
Luis-Ravelo D., Antón I., Vicent S., Zandueta C., Martínez S., Valencia K., Ormazábal C., Lecanda F.
Laboratorio de Adhesión y Metástasis - División de Oncología - Centro de Investigación Médica Aplicada (CIMA)-Universidad de Navarra-Pamplona
Trabajo becado por la SEIOMM para asistir al 33 Congreso de la ASBMR (Toronto, Canadá. 2010).
Este trabajo fue financiado por el acuerdo "proyecto FIMA UTE", RTICC RD06/0020/0066, PI042282, FIT-090100-2005-46, SAF-2009-11280 y los Premio "Ortiz de Landázuri" (67/2005, Gobierno de Navarra) y "Fundación La Caixa" obtenidos por F.L. D. L-R por FIMA y Programa Nacional FPU e I.A. por FIMA y Gobierno del País Vasco. F.L. es investigador del Programa I3.
Dirección para correspondencia
RESUMEN
Fundamento: El objetivo de este estudio radica en la determinación de la validez del factor de crecimiento transformante β (TGF-β) como diana terapéutica en modelos de metástasis óseas derivadas de distintos tipos histopatológicos del cáncer de pulmón.
Material y métodos: Ratones inmunodeprimidos de 4 semanas de edad inoculados con líneas de cáncer de pulmón y de mama fueron tratados con péptido inhibidor de la citoquina, péptido control o placebo. Se tomaron semanalmente medidas de bioluminiscencia y microrradiografías para determinar el efecto del tratamiento sobre la carga tumoral presente en los huesos largos y las lesiones metastásicas en los mismos.
Resultados: El tratamiento con el péptido específico frente a TGF-β tiene un efecto protector en el hueso en los animales inoculados con la línea de cáncer de mama, a diferencia de lo ocurrido en los grupos de péptido control y placebo. Sin embargo, el tratamiento anti-TGF-β carece de efectos terapéuticos significativos sobre las metástasis óseas que se desarrollan en los animales inoculados con las líneas de cáncer de pulmón empleadas.
Conclusiones: El carácter de TGF-β como posible diana terapéutica en metástasis en hueso es altamente dependiente del tipo y subtipos histopatológicos de tumor.
Palabras clave: TGF-β, hueso, metástasis, modelos animales.
SUMMARY
Background: The objective of this study lies in the determination of the validity of transforming growth factor β (TGF-β) as a therapeutic target in models of metastasis deriving from different histological types of lung cancer.
Material and methods: 4-week-old immunodeficient mice inoculated with lung and breast cancer lines were treated with cytokine inhibitor peptide, control peptide or placebo. Weekly bioluminescence and microradiographic measurements were taken to determine the effects of the treatment on tumor burden and metastatic lesions in the long bones.
Results: Treatment with the specific peptide against TGF-β has a protector effect in the bone of animals inoculated with the breast cancer lines, unlike what happens in the control peptide and placebo groups. However, the anti-TGF-β treatment lacks the significant therapeutic effects on the bone metastases which develop in lung cancer bearing animals.
Conclusions: The role of TGF-β as a potential therapeutic target in bone metastasis is highly dependent on the histopathological type and subtype of tumor.
Key words: TGF-β, bone, metastasis, animal models.
Introducción
El esqueleto constituye uno de los órganos diana preferentes de las células tumorales. Las neoplasias de mama, próstata, pulmón y mieloma originan metástasis óseas con alta frecuencia [1]. El pronóstico de supervivencia desde el diagnóstico de la metástasis ósea varía dependiendo del tipo de tumor. En los pacientes de cáncer de pulmón con este tipo de metástasis, la mediana de supervivencia se mide frecuentemente en meses, siendo la menor de todos los tipos de tumor con tropismo óseo [2]. Además, en muchas ocasiones este fenómeno se detecta en el momento del diagnóstico de la enfermedad, lo que contribuye a que esta neoplasia sea la primera causa de muerte por cáncer [3].
La alta frecuencia de metástasis óseas puede explicarse por la fenestración del endotelio del compartimento medular, que podría facilitar el asentamiento de las células metastásicas [4]. También el hueso constituye un entorno propicio para el desarrollo de las células, ya que es un medio rico en factores de crecimiento, como el factor de crecimiento transformante β (TGF-β) [5]. La ruta de señalización intracelular de esta citoquina implica la fosforilación de proteínas Smads, que en última instancia permiten la expresión de genes diana en el núcleo. El TGF-β presenta funciones opuestas en carcinogénesis. Por un lado, la señalización a través de su receptor desencadena una respuesta antiproliferativa en condiciones de estrés oncogénico. Esto tiene lugar a través de la inducción de la expresión de genes supresores de tumor como inhibidores de las quinasas dependientes de ciclina (CDKI) o la represión de oncogenes como c-Myc y miembros de la familia ID [6]. Por otro lado, existen neoplasias que retienen intacta esta vía evadiendo esta respuesta citostática y favoreciendo simultáneamente la progresión tumoral. Entre otros mecanismos, destaca su contribución a la evasión de la inmunidad mediada por linfocitos T CD8+ [7] y a la angiogénesis por inducción del factor de crecimiento de endotelio vascular (VEGF) y MMPs (metaloproteasas de matriz) en tumor y endotelio [8]. La célula tumoral también puede utilizar la señalización del TGF-β para la progresión metastásica en el microentorno óseo, puesto que esta citoquina favorece la expresión de proteína relacionada con la hormona paratiroidea (PTHrP) o IL11 [9,10]. Estos factores inducen la expresión de RANKL (ligando del receptor activador para el factor nuclear κB) en la membrana de los osteoblastos. El reconocimiento de este ligando por el receptor correspondiente en los precursores mononucleares conlleva la activación de éstos y formación de osteoclastos maduros. La acción de estas células promueve la liberación de la matriz ósea de citoquinas que ceban la colonización metastásica. Se genera así un proceso de retroalimentación positiva o "ciclo vicioso" que magnifica los efectos osteolíticos.
La inhibición genética o farmacológica de la vía de señalización del TGF-β ha demostrado un beneficio terapéutico en modelos preclínicos. La expresión de la forma dominante negativa del receptor TGFBR2 en células tumorales de mama o el uso del inhibidor SD-208 de TGFRI en animales inoculados con células de melanoma con tropismo óseo han demostrado una reducción de las lesiones metastásicas en el hueso que ocasionan estas líneas celulares [11,12]. En la misma línea, nuestro grupo demostró este efecto en un modelo de metástasis óseas derivadas de una línea de carcinoma pulmonar de células grandes [13].
El objetivo principal de este estudio es valorar la contribución del TGF-β a la metástasis en hueso en modelos derivados de otros tipos histopatológicos del cáncer de pulmón como adenocarcinoma o carcinoide. Como control se empleó un modelo de metástasis ósea derivado de cáncer de mama.
Material y métodos
Cultivo celular
Se utilizaron las líneas tumorales A549, H727 y MDA-MB-231, procedentes de adenocarcinoma pulmonar, carcinoide de pulmón y cáncer de mama, respectivamente. Las líneas A549 y H727 fueron transfectadas con el vector retroviral SFG-NES-TGL (donado gentilmente por Dr. Ponomarev), que contiene el gen reportero de la luciferasa. Las células se cultivaron a 37oC y 5% CO2 bajo condiciones de esterilidad en medio RPMI (A549 y H727) o DMEM (MDA-MB-231) suplementados con 10% de FBS, 100 unidades/ml de penicilina y 100 µg/ml de estreptomicina (Invitrogen®).
Animales e inoculación intracardiaca (I.C.)
Se realizó la inyección de las células tumorales en el ventrículo izquierdo de 24 ratones inmunodeprimidos de 4 semanas de edad (Laboratorios Harlan) de acuerdo a descripciones previas [14,15]. Las células se resuspendieron en PBS a una concentración de 2 x 106 células/ml. Los animales se anestesiaron previamente a la inoculación con ketamina (65 mg/kg) y xilacina (2,5 mg/kg) por vía intraperitoneal. Se inyectaron 2 x 105 células (100 µl) usando una aguja de calibre 29G.
Todos los protocolos de trabajo con animales de laboratorio fueron aprobados por el Comité de Ética para la Experimentación Animal de la Universidad de Navarra (CEEA).
Régimen terapéutico
Se utilizaron los péptidos control p41 o los anti-TGF-ββp17 o p144 (donados gentilmente por Digna Biotech según disponibilidad) para valorar esta citoquina como diana terapéutica. Ambos presentan similar actividad in vivo [13,16]. Cinco días después de la inoculación de las líneas tumorales, los animales se dividieron en 3 grupos de 8 ratones cada uno para recibir una dosis diaria por vía intraperitoneal de 3,75 mg/kg de p144, péptido control (p41) o vehículo (suero fisiológico). Los ratones inoculados con la línea MDA-MB-231 se dividieron igualmente y fueron tratados a partir del día 7 en jornadas alternas con 2,5 mg/kg de p17 (actividad similar a p144), péptido control p41 o vehículo.
La dosis de p17 fue elegida en base a su actividad en estudios previos [13,17], mientras que la de p144 fue superior para asegurar que los resultados observados in vivo con las líneas celulares de cáncer de pulmón no fueran atribuibles a una baja concentración del péptido. El tiempo trascurrido desde la inoculación intracardiaca hasta el inicio de tratamiento se estableció en experimentos previos, en los que se determinó el tiempo necesario para que las células se detecteran en hueso, mediante bioluminiscencia o aislamiento de las células metastásicas.
Se determinó semanalmente el efecto sobre la carga tumoral mediante bioluminiscencia y/u osteolisis por análisis radiológico en busca de posibles diferencias.
La duración de cada experimento dependió del desarrollo de las metástasis por cada línea celular.
Bioluminiscencia
Se administró D-luciferina (PROMEGA) a una concentración de 150 mg/kg por vía intraperitoneal a los animales previamente anestesiados. Transcurridos 5 minutos se tomaron diferentes imágenes en cámara CCD de bioluminiscencia con el programa Living Image (IVIS® system, Xenogen). Para cuantificar la señal bioluminométrica se utilizó el mismo programa delimitando las extremidades inferiores. A los datos obtenidos se les sustrajo el valor luminométrico de un ratón no inyectado con células (control). Los valores obtenidos se dividieron por el valor luminométrico de cada extremidad obtenido antes del inicio del tratamiento. La señal lumninométrica obtenida aparece superpuesta en el roedor.
Las células transfectadas con el vector SFG-NES-TGL, A549 y H727, presentan señal detectable. No se obtuvieron datos luminométricos de la carga tumoral de los animales inoculados con la línea MDA-MB-231 puesto que el vector con el gen de luciferasa con el que se transfectó no generó señal, probablemente por metilación del promotor [13].
Análisis radiográfico
Las radiografías se realizaron bajo anestesia usando un modelo de rayos X de Faxitron® (MX-20). Se utilizaron películas sensibles a esta radiación (MIN-R, Kodak®) a 20 kV durante 20 segundos a un aumento 2x. Las radiografías se digitalizaron a una resolución de 1200 ppi (Epson® Expression 1680 Pro). El área de las lesiones osteolíticas fue evaluado con el programa de análisis de imagen computarizada AnalySIS® (GmbH). La cuantificación relativa de las áreas metástasica se expresa como el porcentaje de la suma de las áreas lesionadas presentes en fémur y tibia con respecto al total de la superficie de estos huesos largos en las películas.
Microtomografía computarizada (µCT)
Las articulaciones de fémures y tibias representativos de cada grupo de experimentación fueron analizadas en un dispositivo de microCT (micro CAT II, Siemens® Preclinical Solutions) a 75,0 kVp y 250 uA. Cada escaneo se realizó a 10 µm de resolución. Las imágenes bidimensionales se reconstruyeron usando un procedimiento estándar de deconvolución con un filtro Shepp-Logan. Para la reconstrucción de las imágenes se utilizó el programa COBRA®_Exxim. Las imágenes se almacenaron en tramas tridimensionales con un tamaño de voxel de 19*19*23 µm.
Análisis estadístico
El programa informático SPSS 15.0 fue utilizado para determinar el valor estadístico de los resultados. Se utilizó un nivel de significación α=0,05. Los valores p inferiores a este límite se consideraron significativos (*). Se realizó ANOVA de un factor para estudiar el área metastásica de las radiografías con comparaciones múltiples Tukey y la prueba de Kruskal-Wallis seguido de comparaciones múltiples con Mann-Whithney para bioluminiscencia. Los valores p obtenidos se ajustaron con el método de Bonferroni.
Resultados
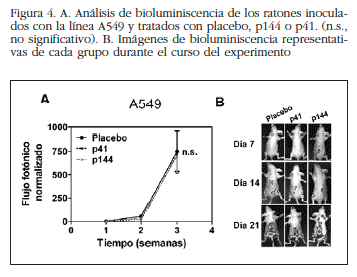
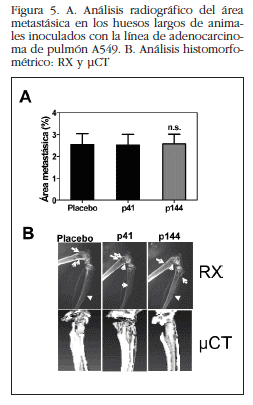
El análisis radiológico de fémures y tibias en los animales inoculados con la línea MDA-MB-231 demostró una drástica reducción de las metástasis en los animales tratados con p17 en comparación con los tratados con péptido control o placebo a las 3 semanas desde el inicio del experimento (Figura 1). En los animales inoculados con la línea H727, las imágenes de bioluminiscencia a día 22 mostraron un ligero efecto de p144 sobre la carga tumoral en las extremidades inferiores de los animales tratados con este péptido (*p< 0,05, Figura 2A). Este efecto perdió carácter significativo en los siguientes días de experimentación (Figura 2B). De forma similar, el análisis radiográfico de los huesos largos reveló una leve disminución de las lesiones metastásicas en estos ratones que no alcanzó significación (Figuras 3A y 3B). Por el contrario, en los animales inoculados con la línea A549 el p144 no mostró efecto protector alguno sobre la carga tumoral determinada por bioluminiscencia (Figuras 4A y 4B) o sobre el desarrollo de las lesiones osteolíticas (Figuras 5A y 5B). Estos resultados indican que la actividad prometastásica de TGF-β es altamente dependiente de cada línea celular.
Discusión
La metástasis implica la adquisición de nuevas funciones por parte de la célula en el tumor primario. Éstas incluyen motilidad e invasión, intravasación, supervivencia en circulación, adhesión a endotelio, extravasación y crecimiento o colonización de órganos diana [18]. Para ello es necesario un programa genético y/o epigenético -hoy por hoy poco conocido- influenciado por la presión selectiva establecida en el propio tumor y su microambiente. Por tanto, resulta crítica la identificación de estas dianas implicadas en metástasis. El conocimiento de los efectores de este proceso podría permitir el desarrollo de nuevas terapias antimetastásicas que repercutan en una mejora de la calidad de vida del paciente oncológico. Este hecho justifica el desarrollo de modelos de metástasis que reproduzcan la realidad clínica. El modelo basado en la inoculación intracardiaca recapitula las últimas etapas de la metástasis: extravasación, anidación ("homing") y colonización de los órganos diana. Con esta técnica se obtuvo una alta y rápida incidencia de metástasis con resultados reproducibles. Esta aproximación se ha utilizado anteriormente con líneas tumorales de melanoma, próstata y mama [10,19]. La principal limitación es la exclusión de los eventos iniciales de la cascada metastásica como la invasión, motilidad e intravasación desde el parénquima pulmonar. Los modelos que recapitulan estas etapas iniciales de la metástasis como los de inyección ortotópica han resultado exitosos para el cáncer de mama. En ellos se realiza una extirpación del tumor primario tras su crecimiento para facilitar la aparición posterior de metástasis a distancia [20]. Sin embargo, esta aproximación resulta inviable en cáncer de pulmón, ya que la muerte de los animales sobreviene con frecuencia antes del desarrollo de metástasis debido al crecimiento rápido del tumor. Además, la frecuencia de metástasis óseas en los modelos ortotópicos es baja.
Pese a la importancia del TGF-β en microentorno óseo y metástasis, su potencial terapéutico debe ser considerado con precaución. En primer lugar, la inhibición sistémica de esta vía puede generar efectos colaterales, ya que la señalización por esta vía es de vital importancia en los procesos homeostáticos en los tejidos. En segundo lugar, los resultados obtenidos demuestran que el efecto de esta vía depende del contexto celular. Las células tumorales de mama evaden las señales de inhibición del TGF-β conservando intactos a los miembros de la ruta favoreciendo la función prometastásica de la citoquina. La mayor abundancia de inhibidores transcripcionales de los genes involucrados en la respuesta citostática en estas células puede explicar este fenómeno [21]. Esto puede explicar la mejora terapéutica obtenida en el modelo de metástasis ósea de la línea celular MDA-MB-231. Al igual que ocurre en cáncer de mama, la oncogénesis pulmonar puede implicar la pérdida de los efectos supresores de tumor de TGF-β [22]. Por tanto, esta citoquina puede ser de interés terapéutico para el tratamiento de metástasis óseas del cáncer de pulmón. En concordancia con estos resultados, el uso de un péptido inhibidor de TGF-β en un modelo de carcinoma de células grandes demostró una reducción de las metástasis óseas [13]. Sin embargo, los resultados mostrados en este trabajo demuestran que este efecto sobre los modelos de adenocarcinoma y carcinoide de pulmón es poco o nada significativo. Estos experimentos sustancian por tanto el contexto célula dependiente en la vía de TGF-β. Además, es posible que otras citoquinas presentes en abundancia en el hueso puedan constituir elementos claves para la progresión del "ciclo vicioso" y consiguiente colonización metastásica del hueso, como IGF-1 [23]. Futuros estudios pueden determinar la idoneidad de otras dianas para el desarrollo de terapias antimetastásicas.
Bibliografía
1. Vicent S, Luis-Ravelo D, Antón I, Hernández I, Martínez S, de las Rivas J, et al. Bone metastases. An Sist Sanit Navar 2006;29:177-88. [ Links ]
2. Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity. Clin Cancer Res 2006;12(20 Pt 2):6243s-9s [ Links ]
3. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin 2011;61:69-90. [ Links ]
4. Nguyen DX, Bos PD, Massagué J. Metastasis: from dissemination to organ-specific colonization. Nat Rev Cancer 2009;9:274-84. [ Links ]
5. Baylink DJ, Finkelman RD, Mohan S. Growth factors to stimulate bone formation. J Bone Miner Res 1993;8 Suppl 2:S565-72. [ Links ]
6. Padua D, Massagué J. Roles of TGFbeta in metastasis. Cell Res 2009;19:89-102. [ Links ]
7. Thomas DA, Massagué J. TGF-beta directly targets cytotoxic T cell functions during tumor evasion of immune surveillance. Cancer Cell 2005;8:369-80. [ Links ]
8. Sánchez-Elsner T, Botella LM, Velasco B, Corbí A, Attisano L, Bernabéu C. Synergistic cooperation between hypoxia and transforming growth factor-beta pathways on human vascular endothelial growth factor gene expression. J Biol Chem 2001;276:38527-35. [ Links ]
9. Mundy GR. Metastasis to bone: causes, consequences and therapeutic opportunities. Nat Rev Cancer 2002;2:584-93. [ Links ]
10. Kang Y, Siegel PM, Shu W, Drobnjak M, Kakonen SM, Cordón-Cardo C, et al. A multigenic program mediating breast cancer metastasis to bone. Cancer Cell 2003;3:537-49. [ Links ]
11. Yin JJ, Selander K, Chirgwin JM, Dallas M, Grubbs BG, Wieser R, et al. TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. J Clin Invest 1999;103:197-206. [ Links ]
12. Mohammad KS, Javelaud D, Fournier PG, Niewolna M, McKenna CR, Peng XH, et al. TGF-beta-RI kinase inhibitor SD-208 reduces the development and progression of melanoma bone metastases. Cancer Res 2011;71:175-84. [ Links ]
13. Vicent S, Luis-Ravelo D, Antón I, García-Tuñón I, Borrás-Cuesta F, Dotor J, et al. A novel lung cancer signature mediates metastatic bone colonization by a dual mechanism. Cancer Res 2008;68:2275-85. [ Links ]
14. Catena R, Luis-Ravelo D, Antón I, Zandueta C, Salazar-Colocho P, Larzábal L, et al. PDGFR signaling blockade in marrow stroma impairs lung cancer bone metastasis. Cancer Res 2011;71:164-74. [ Links ]
15. Luis-Ravelo D, Antón I, Vicent S, Hernández I, Valencia K, Zandueta C, et al. Tumor-stromal interactions of the bone microenvironment: in vitro findings and potential in vivo relevance in metastatic lung cancer models. Clin Exp Metastasis 2011;28:779-91. [ Links ]
16. Dotor J, López-Vázquez AB, Lasarte JJ Sarobe P, García-Granero M, Riezu-Boj JI, et al. Identification of peptide inhibitors of transforming growth factor beta 1 using a phage-displayed peptide library. Cytokine 2007;39:106-15. [ Links ]
17. Ezquerro I, Lasarte JJ, Dotor J, Castilla-Cortázar I, Bustos M, Penuelas I, et al. A synthetic peptide from transforming growth factor beta type III receptor inhibits liver fibrogenesis in rats with carbon tetrachloride liver injury. Cytokine 2003;22:12-20. [ Links ]
18. Bogenrieder T, Herlyn M. Axis of evil: molecular mechanisms of cancer metastasis. Oncogene 2003;22:6524-36. [ Links ]
19. Wu TT, Sikes RA, Cui Q, Thalmann GN, Kao C, Murphy CF, et al. Establishing human prostate cancer cell xenografts in bone: induction of osteoblastic reaction by prostate-specific antigen-producing tumors in athymic and SCID/bg mice using LNCaP and lineage-derived metastatic sublines. Int J Cancer 1998;77:887-94. [ Links ]
20. Hoffman RM. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs 1999;17:343-59. [ Links ]
21. Gomis RR, Alarcón C, Nadal C, Van Poznak C, Massagué J. C/EBPbeta at the core of the TGFbeta cytostatic response and its evasion in metastatic breast cancer cells. Cancer Cell 2006;10:203-14. [ Links ]
22. Jeon HS, Jen J. TGF-beta signaling and the role of inhibitory Smads in non-small cell lung cancer. J Thorac Oncol 2010;5:417-9. [ Links ]
23. Yoneda T, Williams PJ, Hiraga T, Niewolna M, Nishimura R. A bone-seeking clone exhibits different biological properties from the MDA-MB-231 parental human breast cancer cells and a brain-seeking clone in vivo and in vitro. J Bone Miner Res 2001;16:1486-95. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Fernando Lecanda
Centro de Investigación Médica Aplicada (CIMA)
Universidad de Navarra
Avda. Pío XII, 55
31008 Pamplona (España)
Correo electrónico:
flecanda@unav.es
Fecha de recepción: 27/02/2013
Fecha de aceptación: 29/04/2013











 texto en
texto en