Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Osteoporosis y Metabolismo Mineral
versión On-line ISSN 2173-2345versión impresa ISSN 1889-836X
Rev Osteoporos Metab Miner vol.6 no.4 Madrid nov./dic. 2014
https://dx.doi.org/10.4321/S1889-836X2014000400005
Efecto de la lesión medular motora completa reciente en el recambio óseo y en la evolución de la masa ósea. Resultados preliminares
Effect of spinal cord injury recently in bone turnover and in bone mass evolution of complete motor. Preliminary findings
Gifre L.1, Vidal J.2, Ruiz-Gaspà S.3, Portell E.2, Monegal A.1, Muxi A.4, Guañabens N.1,3 y Peris P.1,3
1 Servicio de Reumatología - Unidad de Patología Metabólica Ósea - Hospital Clínico de Barcelona
2 Unidad de Lesionados Medulares - Instituto de Neurorrehabilitación Guttmann - Universidad Autónoma de Barcelona - Badalona
3 CIBERehd
4 Servicio de Medicina Nuclear - Hospital Clínico de Barcelona
Trabajo becado por la SEIOMM para asistir al 35 Congreso de la ASBMR (Baltimore, 2013).
Trabajo financiado por becas del Hospital Clínic Barcelona y Fundació La Marató de TV3.
Dirección para correspondencia
RESUMEN
Fundamento y objetivos: La lesión medular (LM) se asocia con una marcada pérdida de masa ósea y un aumento de la incidencia de fracturas; sin embargo, la etiopatogenia y el manejo clínico de estos pacientes es incierto. El objetivo de este estudio ha sido valorar la evolución de la densidad mineral ósea (DMO) en pacientes con LM reciente, y su relación los parámetros del metabolismo fosfocálcico y los marcadores de recambio óseo.
Métodos: Estudio prospectivo en pacientes con LM motora completa (ASIA A) reciente (<6 meses). En todos ellos se valoró: parámetros del metabolismo fosfocálcico (calcio, fosfato, PTH y 25-hidroxivitamina D), marcadores de recambio óseo (formación: propéptido aminoterminal del procolágeno tipo I -P1NP-, fosfatasa alcalina ósea -FA ósea-, osteocalcina -OC-; resorción: telopéptido carboxiterminal del colágeno tipo I -CTx-) y DMO, basal y a los 6 meses de seguimiento. Los resultados se compararon con un grupo control.
Resultados: Se incluyeron 23 varones con una LM severa (ASIA A), con una edad media de 38±15 años a los 102±33 días de la LM. El 52% tenía una paraplejia. 12 pacientes fueron valorados a los 6 meses de seguimiento. Tras la LM se observó un aumento significativo de los marcadores de recambio óseo, especialmente P1NP y CTx, comparado con el grupo control (P1NP: 191±90 vs. 51±19 ng/ml, p<0,001; CTx: 1,37±0,49 vs. 0,51±0,23 ng/ml, p<0,001). Los marcadores de recambio óseo disminuyeron a los 6 meses de seguimiento (P1NP: -34%, p=0,005 y CTx: -26%, p=0,002). Asimismo, a los 6 meses se observó una marcada disminución de la DMO en fémur proximal (-12% en fémur total, p=0,02) comparada con los valores basales, y el desarrollo de osteoporosis en el 50% de los pacientes. Se observó, además, una correlación negativa entre los valores de DMO en fémur total y los marcadores de recambio óseo (Fosfatasa alcalina ósea, P1NP y osteocalcina).
Conclusión: Tras la LM se produce un marcado aumento del recambio óseo y de la pérdida de masa ósea, especialmente en fémur proximal, que conduce al desarrollo de osteoporosis en el 50% de los pacientes, una complicación que ya se observa a los 6 meses de seguimiento, y que indica la necesidad de adoptar medidas preventivas en el abordaje terapéutico de estos pacientes.
Palabras clave: osteoporosis, lesión medular, metabolismo óseo, marcadores recambio óseo.
SUMARY
Background and aim: Spinal cord injury (SCI) has been associated with a marked increase in bone loss and a higher incidence of skeletal fractures, however the pathogenesis and clinical management of this condition remains unclear. The aim of this study was to analyze the bone mineral density (BMD) evolution in patients with complete SCI and its relationship with parameters of bone metabolism and bone turnover markers.
Methods: Patients with a recent complete motor SCI (ASIA A)(<6 months) were prospectively included. Bone metabolism parameters (calcium, phosphate, PTH and 25-OHD), bone turnover markers (bone formation: procollagen type 1 aminoterminal propeptide -P1NP-, bone alkaline phosphatase -bone AP-, osteocalcin -OC-; bone resorption: C-telopeptides of type I collagen -CTx-) and BMD were assessed in all patients at baseline and at 6 months. The results were compared with a control group.
Results: 23 men with complete SCI (ASIA A) and a mean age of 38±15 years were included at 102±33 days of SCI onset. 52% had paraplegia. 12 patients were assessed at 6 months of follow-up. Patients with SCI showed a significant increase in bone turnover markers, especially P1NP and CTx, compared to controls (P1NP: 191±90 vs 51±19 ng/ml, p<0.001; CTx: 1.37±0.49 vs 0.51±0.23 ng/ml, p<0.001). At 6 months, bone turnover markers decreased (P1NP: -34%, p=0.005 and CTx: -26%, p=0.002) and BMD had a mean decrease of 12% at total femur (p=0.002) compared to baseline, with osteoporosis development in 50% of patients. Bone markers (bone AP, P1NP and OC) were negatively correlated with total femur BMD values.
Conclusions: Patients with complete SCI show a marked increase in bone turnover and bone loss, especially at the proximal femur, with the development of osteoporosis being observed in 50% of these patients at 6 months of follow-up. These findings indicate the need to implement preventive measures within the therapeutic approach in these patients.
Key words: osteoporosis, spinal cord injury, bone metabolism, bone turnover markers.
Introducción
La ausencia de carga mecánica en el esqueleto se asocia a una marcada pérdida de masa ósea que puede conducir al desarrollo de osteoporosis y fracturas. La lesión medular (LM), especialmente cuando es completa, es una causa frecuente y el máximo exponente de ausencia de carga en el esqueleto. Así, tras la LM se ha descrito una marcada pérdida de la densidad mineral ósea (DMO), del orden del 35% a los dos años de sufrirla, y el desarrollo de osteoporosis y fracturas en más del 50% de los pacientes1-5. Aunque la fisiopatología de este proceso no es bien conocida, tras la LM se también se ha observado un marcado aumento del recambio óseo, especialmente durante el primer año de la LM6-10. Si bien la ausencia de carga constituye el principal factor relacionado con este hallazgo, el mecanismo regulador de este proceso no está aclarado. Este hecho, unido a la ausencia de pautas orientadas a la prevención y tratamiento de la osteoporosis tras la LM, podría ser la causa del tratamiento deficiente de estos pacientes. En este sentido, un estudio reciente realizado en nuestra unidad evidenció que tras una LM completa menos del 10% de los pacientes había seguido tratamiento antiosteoporótico, incluso tras haber presentado fracturas por fragilidad2, un hecho que también se ha observado en otros estudios11. Es importante recordar que los individuos que presentan una LM completa suelen ser jóvenes, por lo que el riesgo de desarrollar fracturas a lo largo de su vida es muy alto, aumentando claramente a partir de los 3-5 años de la LM2, lo que indica la necesidad de adoptar medidas preventivas en estos pacientes.
El objetivo de este estudio es analizar la evolución de la DMO y del recambio óseo en pacientes con LM reciente, y los factores relacionados con la pérdida de masa ósea en este proceso. En este análisis preliminar se muestra la evolución de la DMO y de los marcadores de recambio óseo a corto plazo, en los primeros 6 meses de seguimiento.
Pacientes y métodos
Población del estudio
Estudio prospectivo en el que se han incluido pacientes con LM de origen traumático de instauración reciente (<6 meses) y de carácter severo (LM motora completaescala de ASIA: A o B). Los pacientes fueron reclutados de forma consecutiva (de agosto de 2010 a enero de 2012) en el Instituto de Neurorrehabilitación Guttmann, y remitidos posteriormente a la Unidad de Patología Metabólica Ósea del Servicio de Reumatología del Hospital Clínico de Barcelona.
Se incluyeron pacientes con edad superior a 18 años, y se excluyeron aquéllos con enfermedades o procesos que afectaran el metabolismo óseo (enfermedad ósea de Paget, artritis reumatoide, hiperparatiroidismo, hipercortisolismo, síndrome malabsortivo, tumores malignos, trasplante, embarazo o lactancia reciente) y/o que siguieran tratamiento con fármacos que interfirieran en el metabolismo óseo (bisfosfonatos, ranelato de estroncio, moduladores selectivos del receptor estrogénico, calcitonina, terapia hormonal, denosumab y teriparatida, entre otros).
En todos los pacientes se valoraron los factores de riesgo de osteoporosis, incluyendo: antecedentes familiares de fractura de fémur, historia personal de fracturas, consumo de tabaco y alcohol, ingesta de calcio por dieta (mg/día) y antecedentes de litiasis renal. Asimismo, se analizó la causa, nivel (tetraplejia/paraplejia), severidad y tipo (espástica/flácida) de LM y las complicaciones asociadas.
La severidad de la LM se valoró mediante la escala de ASIA (American Spinal Injury Association) que, según la función motora y sensitiva residual, clasifica la LM 5 categorías: A: LM motora y sensitiva completa; B: LM motora completa y sensitiva parcial; C y D: motora y sensitiva parcial; E: sin lesión motora ni sensitiva12.
Los resultados se compararon con un grupo control sano de edad y sexo similar.
El estudio se realizó con la aprobación del Comité de Ética del hospital y se ajustó a las directrices pertinentes para la investigación en humanos. Todos los pacientes firmaron el consentimiento informado para su inclusión.
Determinaciones analíticas
En todos los pacientes se realizó una extracción sanguínea entre las 8 y 10 horas de la mañana, tras ayuno nocturno. Se realizó un perfil de bioquímica que incluía calcio, fosfato y creatinina, determinados por técnicas estándar, y se valoraron los niveles de 25-hidroxivitamina D (25-OHD) y hormona paratiroidea (PTH), analizados mediante quimioluminiscencia automatizada (Liaison, Diasorin y Advia Centaur XP, Siemens, respectivamente). Además, se determinaron los siguientes marcadores bioquímicos de formación: fosfatasa alcalina ósea (FA ósea, IDS, Vitro); osteocalcina (OC, radioinmunoensayo, Elsa-Osteo-Cis, Gif-sur-Yvette, Francia) y propéptido aminoterminal del procolágeno tipo I (P1NP, método automatizado Cobas e411, Roche), y de resorción ósea: telopéptido carboxiterminal del colágeno tipo I (CTx, método automatizado Cobas e411, Roche).
Densidad mineral ósea
La DMO de columna lumbar, fémur proximal (cuello de fémur y fémur total) y de extremidades inferiores (EEII) fue determinada en todos los pacientes mediante absorciometría dual de rayos X (DXA; Lunar Prodigy, Radiation Corporation Madison, WI). Las categorías densitométricas de riesgo (DMO normal, osteopenia y osteoporosis) fueron definidas según los criterios de la O.M.S.13.
Análisis estadístico
Los resultados se han expresado mediante la media ± desviación estándar de la media (DE). Las diferencias entre medias de las variables continuas se analizaron mediante la prueba no paramétrica de la U de Mann-Whitney, y las diferencias entre proporciones mediante la prueba de Fisher. Para la comparación entre variables apareadas se utilizó el Test de Wilcoxon. Para valorar asociación entre variables se utilizó el coeficiente de correlación de Pearson. El valor p<0,05 fue considerado estadísticamente significativo. El análisis estadístico de los datos se realizó mediante el programa SPSS (versión 18.0, Chicago, EE.UU.).
Resultados
Las características clínicas de los pacientes incluidos en el estudio se muestran la tabla 1.
Se incluyeron 23 varones, con una edad media de 38±15 años (rango: 18-64 años) a los 102±33 días de sufrir la LM. Todos los pacientes tenían una LM severa (ASIA A); el 48% tenía una tetraplejia y el 52% una paraplejia. La mayoría de pacientes presentaba una LM de tipo espástico (83%). Todos los pacientes presentaban una afectación funcional residual severa: 3 pacientes (13%) permanecían con inmovilización total en cama, el resto (87%) requerían silla de ruedas para desplazarse. La causa de la LM fue mayoritariamente por accidente de tráfico (57%). El resto de pacientes presentaron una LM por: precipitación (17%), zambullida en aguas poco profundas (13%), accidente deportivo (9%) y accidente doméstico (4%). 12 de los 23 pacientes (7 pacientes con tetraplejia, 5 con paraplejia) fueron valorados nuevamente a los 6 meses de seguimiento.
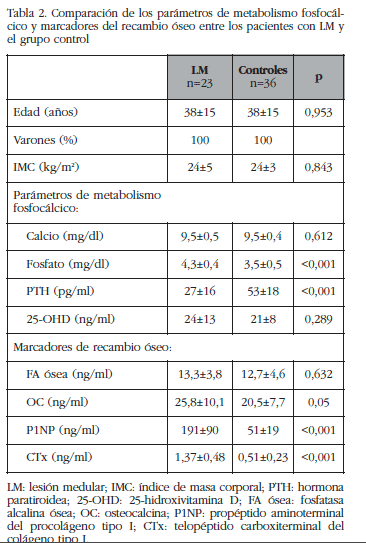
Tras la LM se observó un marcado aumento de los marcadores de recambio óseo (OC, P1NP y CTx) respecto al grupo control (Tabla 2); no se observaron diferencias significativas en el valor de marcadores óseos en función del nivel de la lesión (pacientes con tetraplejia vs. paraplejia). Asimismo, los pacientes con LM presentaron un aumento significativo de los valores de fosfato sérico y una disminución de los valores de PTH respecto al grupo control (Tabla 2). El 39% de los pacientes presentaban un déficit de vitamina D (<20 ng/ml); sin embargo, no se observaron diferencias en los niveles de 25-OHD ni en los valores de calcio sérico comparado con el grupo control.
A los 6 meses de seguimiento se observó una disminución significativa de los marcadores de recambio óseo (P1NP: -34%, p=0,005 y CTx: -26%, p=0,002), aunque persistían aumentados respecto al grupo control, y una normalización de los parámetros de metabolismo fosfocálcico (fosfato basal: 4,4±0,4 mg/dl vs. 3,9±0,4 mg/dl en seguimiento, p=0,011; PTH basal: 32±20 pg/ml vs. 40,8±22,9 pg/ml en seguimiento, p=0,09).
La DMO en fémur proximal y en EEII disminuyó de forma significativa a los 6 meses de seguimiento (fémur total: -12,3±4,9%, p=0,002; cuello de fémur: -12,8±6,7%, p=0,002; EEII: -7,7±3,7%, p=0,003) comparada con los valores basales (Figura 1). No se observaron cambios significativos en la evolución de la DMO lumbar (1,214±0,2 g/cm2 basal vs. 1,224±0,2 g/cm2 a los 6 meses, p=n.s). El 50% de los pacientes tenía criterios de osteoporosis densitométrica a los 6 meses de seguimiento. No se observaron diferencias en la evolución de la DMO en función del nivel de la LM (tetraplejia vs. paraplejia) o del tipo de lesión (espástica vs. flácida). Ningún paciente presentó fracturas esqueléticas durante los primeros 6 meses de seguimiento.
Se observó una correlación negativa entre los valores de DMO en fémur total y los marcadores de recambio óseo (FA ósea: r=-0,63, p=0,001; P1NP: r=-0,459, p=0,028; OC: r=-0,454, p=0,051). Los valores de CTx no se relacionaron con los valores de DMO. El cambio de DMO a los 6 meses no se relacionó con el cambio de los marcadores de recambio óseo.
Discusión
Los resultados de este estudio muestran que tras una LM motora completa se produce un marcado aumento del recambio óseo y de la pérdida de masa ósea, especialmente en fémur proximal, que conduce al desarrollo de osteoporosis en la mitad de los pacientes, una complicación que ya se observa a los 6 meses de seguimiento y que indica la necesidad de adoptar medidas preventivas en el abordaje terapéutico de estos pacientes.
Así, durante un periodo de tan solo 6 meses, los pacientes incluidos en este estudio presentaron una pérdida de la DMO en fémur proximal del 12% tras la LM y el 50% desarrollaron una osteoporosis densitométrica. La DMO en la columna lumbar, sin embargo, se mantuvo estable durante el seguimiento. Estos resultados coinciden con estudios previos en los que se indica que la pérdida ósea tras la LM se produce de forma precoz, siendo ya evidente a las 6 semanas de la lesión1,14 y de mayor magnitud durante los dos primeros años tras la LM, con pérdidas de DMO que oscilan entre el 8 y 35%, dependiendo de la localización y el tiempo de evolución1,4,6,15,16, lo que conduce al desarrollo de osteoporosis y fracturas en más del 50% de los pacientes4. Una de las principales características de la pérdida ósea asociada a la LM es su localización, ya que al igual que ocurre en nuestro estudio, ésta se produce por debajo del nivel de la lesión, afectando sobretodo a las extremidades inferiores1,17,18, un hecho que parece estar asociado a la ausencia de carga mecánica en dicha localización y que explica, además, la alta incidencia de fracturas en extremidades inferiores que se observa en estos pacientes, especialmente en fémur y tibia2,19,20. Asimismo, si bien se ha sugerido una mayor pérdida de hueso trabecular tras la LM15, otros estudios muestran que la pérdida ósea que se produce en este proceso tiene lugar en varios compartimentos; en este sentido, un estudio que analiza la evolución de la masa ósea mediante tomografía computarizada cuantitativa periférica (pQCT) en fémur proximal de pacientes con LM reciente, describe una pérdida ósea cortical y una alteración de la microarquitectura y de la resistencia ósea tras la LM, que estarían mediadas por un aumento en la resorción ósea trabecular y endostal14. Los resultados de nuestro estudio también sugieren una afectación precoz en ambos compartimentos óseos; así, la magnitud de la pérdida ósea en los distintos compartimentos del fémur proximal, cuello de fémur y fémur total, fue similar a los 6 meses de seguimiento, del orden del 12% en ambas localizaciones. Sin embargo, no se observaron cambios significativos en la DMO lumbar a los 6 meses de seguimiento, un hallazgo que también ha sido descrito en otros estudios1,4, y que confirma el efecto determinante que tiene la ausencia de carga en las extremidades inferiores en la pérdida ósea asociada a este proceso.
La mayoría de estudios, tanto en modelos experimentales como en humanos, describen un marcado aumento del recambio óseo tras la LM1,6,8-10, especialmente durante el primer año de la lesión, un hallazgo que también hemos observado en nuestros pacientes. De hecho, los pacientes incluidos en este estudio presentaron un aumento de los marcadores de recambio óseo, especialmente de P1NP y el CTx séricos, tras la LM del orden de 2 a 3 veces más altos que el grupo control, que, además, de forma similar a lo observado en el estudio de Sabour et al.21, se correlacionaron de forma negativa con los valores de DMO en fémur proximal. Este aumento en los marcadores de recambio disminuyó de forma progresiva, de tal forma que, a los 6 meses, si bien persistían discretamente aumentados, sus valores habían disminuido de forma significativa. Además, en estos pacientes también se observó una disminución de los valores de PTH y un aumento secundario del fosfato, dos hallazgos previamente descritos en pacientes con LM reciente y que se han atribuido al marcado aumento del recambio óseo que se produce tras la lesión6,8,9,22. Ambos parámetros, PTH y fosfato, se normalizaron a los 6 meses de seguimiento. Si bien se ha descrito una elevada prevalencia de hipovitaminosis D en pacientes afectos de LM23, ésta se ha observado mayoritariamente en pacientes con LM de larga evolución. Nuestros pacientes presentaban una LM reciente, de menos de 6 meses de evolución, un hecho que podría justificar la ausencia de diferencias en los valores de vitamina D respecto el grupo control. Además, aunque el incremento del recambio óseo que se observa tras la LM reciente es un hallazgo descrito en la mayoría de estudios, la magnitud de dicho incremento y, sobretodo, su evolución a largo plazo son aspectos menos documentados. En este sentido, aunque el aumento del recambio es especialmente evidente durante los primeros meses tras la LM, algunos autores indican la persistencia de este incremento años después de la LM. Así, Zehnder et al.6 observaron que alrededor del 30% de los pacientes presentaban un aumento de la resorción ósea, valorada mediante la determinación de la deoxipiridinolina libre, a los 10 años de la LM; un hecho que coincide con la persistencia de la pérdida de DMO, aunque de menor magnitud, que presentan estos pacientes tras varios años de la LM6,24 y que confirma la necesidad de adoptar medidas preventivas en la monitorización y tratamiento de este proceso.
La fisiopatología de la alteración del recambio óseo y de la pérdida de masa ósea asociada a la LM es incierta, no obstante la ausencia de carga mecánica parece ser el factor determinante de la pérdida de masa ósea asociada a este proceso1. Otros factores, como la denervación que se produce tras LM, también podrían colaborar de forma adicional en dicha pérdida. En este sentido, estudios experimentales indican una mayor pérdida ósea en ratones con LM que en ratones sometidos a descarga de las extremidades16,25.
Una de las principales limitaciones de este estudio es la pérdida en el seguimiento de los pacientes. No obstante, se trata de un análisis preliminar que incluye una muestra muy homogénea de pacientes, pues todos presentan una LM motora completa de menos de 6 meses de evolución, y que, por lo tanto, permite aplicar los resultados a otros pacientes de características similares. Además, es remarcable que se trata de una de las cohortes prospectivas de pacientes con LM con mayor número de pacientes incluídos.
En resumen, los resultados de este estudio preliminar muestran que tras una LM motora completa se produce un marcado aumento del recambio óseo y de la pérdida de masa ósea por debajo del nivel de la lesión, que conduce al desarrollo de osteoporosis en la mitad de los pacientes durante el primer año de seguimiento. Estos resultados confirman la necesidad de establecer medidas preventivas para el desarrollo de osteoporosis en el abordaje terapéutico de estos pacientes.
Conflicto de intereses: No existe conflicto de intereses por parte de los autores.
Bliografía
1. Jiang SD, Dai LY, Jiang LS. Osteoporosis after spinal cord injury. Osteoporos Int 2006;17:180-92. [ Links ]
2. Gifre L, Vidal J, Carrasco J, Portell E, Puig J, Monegal A, et al. Incidence of skeletal fractures after traumatic spinal cord injury: a 10-year follow-up study. Clin Rehabil 2014;28:361-9. [ Links ]
3. Lazo MG, Shirazi P, Sam M, Giobbie-Hurder A, Blacconiere MJ, Muppidi M. Osteoporosis and risk of fracture in men with spinal cord injury. Spinal Cord 2001;39:208-14. [ Links ]
4. Giangregorio L, McCartney N. Bone loss and muscle atrophy in spinal cord injury: epidemiology, fracture prediction, and rehabilitation strategies. J Spinal Cord Med 2006;29:489-500. [ Links ]
5. Bauman WA, Spungen AM, Wang J, Pierson RN Jr, Schwartz E. Continuous loss of bone during chronic immobilization: a monozygotic twin study. Osteoporos Int 1999;10:123-7. [ Links ]
6. Zehnder Y, Lüthi M, Michel D, Knecht H, Perrelet R, Neto I, et al. Long-term changes in bone metabolism, bone mineral density, quantitative ultrasound parameters, and fracture incidence after spinal cord injury: a cross-sectional observational study in 100 paraplegic men. Osteoporos Int 2004;15:180-9. [ Links ]
7. Jiang SD, Jiang LS, Dai LY. Changes in bone mass, bone structure, bone biochemical properties, and bone metabolism after spinal cord injury: a 6-month longitudinal study in growing rats. Calcif Tissue Int 2007;80:167-75. [ Links ]
8. Roberts D, Lee W, Cuneo RC, Wittamann J, Weard G, Flatman R, et al. Longitudinal study of bone turnover after acute spinal cord injury. J Clin Endocrinol Metab 1998;83:415-22. [ Links ]
9. Maïmoun L, Couret I, Mariano-Goulart D, Dupuy AM, Micallef JP, Peruchon E, et al. Changes in osteoprotegerin/RANKL system, bone mineral density, and bone biochemicals markers in patients with recent spinal cord injury. Calcif Tissue Int 2005;76:404-11. [ Links ]
10. Bubbear JS, Gall A, Middleton FRI, Ferguson-Pell M, Swaminathan R, Keen RW. Early treatment with zoledronic acid prevents bone loss at the hip following acute spinal cord injury. Osteoporos Int 2011;22:271-9. [ Links ]
11. Morse LR, Battaglino RA, Stolzmann KL, Hallett LD, Waddimba A, Gagnon D, et al. Osteoporotic fractures and hospitalization risk in chronic spinal cord injury. Osteoporos Int 2009;20:385-92. [ Links ]
12. Waring WP 3rd, Biering-Sorensen F, Burns S, Donovan W, Graves D, Jha A, et al. 2009 review and revisions of the international standards for the neurological classification of spinal cord injury. J Spinal Cord Med 2009;33:346-52. [ Links ]
13. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group, 843. World Health Organ Tech Rep Ser 1994;1-129. [ Links ]
14. Edwards WB, Schnitzer TJ, Troy KL. The mechanical consequence of actual bone loss and simulated bone recovery in acute spinal cord injury. Bone 2014;60:141-7. [ Links ]
15. Frey-Rindova P, de Bruin ED, Stüssi E, Dambacher MA, Dietz V. Bone mineral density in upper and lower extremities during 12 months after spinal cord injury measured by peripheral quantitative computed tomography. Spinal Cord 2000;38:26-32. [ Links ]
16. de Bruin ED, Dietz V, Dambacher MA, Stüssi E. Longitudinal changes in bone in men with spinal cord injury. Clin Rehabil 2000;14:145-52. [ Links ]
17. Liu D, Zhao CQ, Li H, Jiang SD, Jiang LS, Dai LY. Effects of spinal cord injury and hindlimb immobilization on sublesional and supralesional bones in young growing rats. Bone 2008;43:119-25. [ Links ]
18. Goemaere S, Van Laere M, De Neve P, Kaufman JM. Bone mineral status in paraplegic patients who do or do not perform standing. Osteoporos Int 1994;4:138-43. [ Links ]
19. Lala D, Craven BC, Thabane L, Papaioannou A, Adachi JD, Popovic MR, et al. Exploring the determinants of fracture risk among individuals with spinal cord injury. Osteoporos Int 2014;25:177-85. [ Links ]
20. Craven BC, Robertson CF, McGillivray CF, Adachi J.D. Detection and treatment of sublesional osteoporosis among patients with chronic spinal cord injury: proposed paradigms. Top Spinal Cord Inj Rehabil 2009;14:1-22. [ Links ]
21. Sabour H, Javidan AN, Latifi S, Larijani B, Shidfar F, Vafa MR, et al. Bone biomarkers in patients with chronic traumatic spinal cord injury. Spine J 2014;14:1132-8. [ Links ]
22. Maïmoun L, Fattal C, Micallef JP, Peruchon E, Rabischong P. Bone loss in spinal cord-injured patients: from physiopathology to therapy. Spinal Cord 2006;44:203-10. [ Links ]
23. Rivero González L, Méndez Suárez JL, Miranda Calderín G, Bárbara Bataller E, Sánchez Enríquez J, Sosa Henríquez M. Prevalencia de la hipovitaminosis D e hiperparatiroidismo secundario en la Unidad de Lesionados Medulares de Gran Canaria. Estudio preliminar. Rev Osteoporos Metab Miner 2013;5:67-72. [ Links ]
24. Garland DE, Adkins RH, Stewart CA. Five-year longitudinal bone evaluations in individuals with chronic complete spinal cord injury. J Spinal Cord Med 2008;31:543-50. [ Links ]
25. He JY .Jiang LS, Dai LY. The roles of the sympathetic nervous system in osteoporotic diseases: A review of experimental and clinical studies. Ageing Res Rev 2011;10:253-63. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Laia Gifre
Servicio de Reumatología
Hospital Clínic
Carrer Villarroel, 170
08036 Barcelona (España)
Correo electrónico: lgifre@clinic.ub.es
Fecha de recepción: 11/07/2014
Fecha de aceptación: 24/10/2014











 texto en
texto en