Introducción
La enfermedad cardiovascular representa en la actualidad la principal causa de mortalidad en el mundo desarrollado. Se prevé que siga en aumento en las próximas décadas como consecuencia del envejecimiento poblacional. Uno de los factores que contribuye al riesgo cardiovascular es el estrés oxidativo [1]. Diferentes estímulos implicados en el desarrollo de enfermedad cardiovascular como activación de macrófagos, hiperglicemia, la oxidación de LDL colesterol e incluso la angiotensina II ejercen sus efectos nocivos, al menos parcialmente, a través de la síntesis local de especies reactivas de oxígeno [2,3,4,5].
Por otro lado, existen evidencias de una relación positiva entre estrés oxidativo y calcificaciones vasculares [6]. Las células de músculo liso vascular (CMLV) sometidas a estrés oxidativo incrementan la actividad de la fosfatasa alcalina y la deposición de calcio, indicando su transdiferenciación hacia células capaces de mineralizar (tipo osteoblasto/condrocito) [7]. En cultivo primario de CMLV de aorta de ratón, el estrés oxidativo inducido por peróxido de hidrógeno o glucosa oxidasa promueve la calcificación y la sobreexpresión de Runx2 (Cbfa1), factor de transcripción óseo relacionado con la diferenciación osteogénica, mediada por AKT [8]. Curiosamente, estos mismos estímulos producen el efecto contrario en células precursoras de osteoblastos, demostrando la importancia del peróxido de hidrógeno o agua oxigenada (H2O2) en el proceso de diferenciación de las células de estirpe mesenquimal [9].
Las principales enzimas antioxidantes implicadas en la eliminación catalítica de peróxido de hidrógeno son la catalasa, las glutation peroxidasas y la tioredoxina peroxidasa. De todas ellas, la catalasa es la enzima más eficiente en la eliminación de peróxido de hidrógeno.
Uno de los factores que inciden en el envejecimiento es la acumulación progresiva de daño oxidativo. Este daño puede estar debido a la exposición al estrés oxidativo intracelular normal o, en situaciones patológicas, a un aumento de dicho estrés debido a inflamación u otras causas que puede, de hecho, provocar un envejecimiento acelerado. Por todo ello, nuestro objetivo ha sido evaluar el papel que ejerce la sobreexpresión de catalasa sobre el proceso de calcificación vascular asociada a enfermedad renal moderada y su efecto sobre la masa ósea [10]. Para ello se utilizó un modelo murino transgénico, que sobreexpresa la enzima catalasa, sometido a una insuficiencia renal crónica.
Material y métodos
Modelo experimental in vivo
Establecimiento de insuficiencia renal crónica (IRC)
Se utilizaron cepas de ratones C57/BL6J salvajes (WT) y cepas de ratones C57/BL6J transgénicos (TG) que sobreexpresan la enzima antioxidante catalasa. Para inducir IRC, se sometieron a ratones de 3 meses de edad a una primera intervención, que consistió en la apertura lateral del animal en el lado derecho donde se cauterizaron los dos polos del riñón. La anestesia utilizada fue isoflurano (1-2%) por vía inhalatoria. Trascurrida una semana de la primera operación, se sometió al animal a una segunda intervención, que consistió en la apertura del lado izquierdo y extirpación total del riñón. Transcurridas 16 semanas de la última operación, los animales se sacrificaron por exanguinación, previa anestesia con CO2. En el momento del sacrificio se obtuvo el suero de los animales para analizar marcadores bioquímicos generales y del metabolismo óseo: urea, calcio, fósforo, producto Ca-P, PTHi y FGF23. Se extrajo igualmente el trozo de riñón sobrante, la aorta y las tibias.
La tibia izquierda, que se conservó en etanol de 70º, se analizó mediante microtomografía computerizada (µCT) con un equipo SkyScan 1174, Bruker µCT (Kontich, Bélgica). El análisis morfométrico 2D y 3D fue realizado mediante el software CTAn. La región de interés (ROI) fue delimitada manualmente en cada muestra. Para la región trabecular se seleccionaron 150 cortes y se usaron niveles de umbral en la escala de grises entre 78 y 250. Los análisis morfométricos se basaron en los plung-ins internos de CTAn en 2D y 3D. Los parámetros morfométricos medidos fueron el volumen óseo trabecular (BV/TV, %), la separación entre trabéculas (Tb.Sp, µm), número de trabéculas (Tb.N, mm-1) y la porosidad trabecular (Tb.Po, µm).
Todos los estudios fueron aprobados y autorizados por el Comité de Experimentación Animal de la Universidad de Oviedo.
Modelo experimental in vitro
Se emplearon cultivos primarios de CMLV procedentes de aorta de ratón C57/BLJ6 WT y TG. Para ello, las aortas de los animales se trocearon y se pusieron a crecer los explantes en placas de cultivo recubiertas con fibronectina para favorecer la adhesión.
Las células se cultivaron en medio DMEM suplementado con suero bovino fetal al 10%. Cuando las células alcanzaron una confluencia del 60-70% se sustituyó por medio DMEM-F12 suplementado con albúmina bovina al 0,1% (medio control) y por medio calcificante constituido por medio control suplementado con fósforo y calcio a concentraciones de 3 mM y 2 mM, respectivamente. Las células fueron incubadas en estas condiciones durante 8 días.
La actividad basal de catalasa se midió en CMLV procedentes de ratones WT y TG mediante la utilización del kit comercial “catalase assay kit” (Cayman Chemical, 707002), siguiendo el protocolo establecido por la casa comercial.
Los niveles de especies reactivas de oxígeno en las CMLV de ratones WT y TG cultivadas con medio control y calcificante se midieron con un fluorocromo específico de mitocondrias, dihidrorodamina 123 (DHR 123).
Las proteínas de los cultivos celulares se extrajeron con un tampón con composición Tris-HCl 50 mM, NaCl 150 mM, NP-40 1%, deoxicolato sódico 0,5%, EDTA 1,0 mM y SDS 0,1% con inhibidor de proteasas. Se sonicó la muestra en frío 10 minutos para evitar la disgregación de las proteínas y se centrifugaron a 10.000 rpm durante 5 minutos a 4ºC. Se recogieron las proteínas del sobrenadante, se cuantificaron mediante el método Bio-Rad DC. y se conservaron a -80ºC.
Se utilizaron 20 µg de proteínas que se sometieron a electroforesis en geles de acrilamida de 0,75 mm de grosor en condiciones desnaturalizantes (SDS-PAGE), empleando para su identificación marcadores de peso molecular conocido (RainbowTM Molecular Weight Markers, GE Healthcare, Reino Unido). Las proteínas se transfirieron a una membrana de nitrocelulosa (AmershamTM HybondTM 0,45 µm PVDF, GE Healthcare, Reino Unido). La transferencia se realizó en frío durante una hora a 100 v. Una vez finalizada la misma, se bloqueó la membrana durante una hora con leche al 5% en un tampón fosfato salino (PBS). Posteriormente, las membranas se mantuvieron toda la noche con el anticuerpo primario (anticuerpo monoclonal de catalasa en dilución 1:5.000 en BSA, Runx2 1:500 en BSA frente a gliceraldehído 3-fosfato deshidrogenasa (GAPDH) en dilución 1:5.000 en BSA, todos de Santa Cruz Biotechnology, Inc., Santa Cruz, California, EE.UU.). Al día siguiente, la membrana se lavó tres veces en intervalos de 10 minutos cada uno con una solución de lavado compuesta de PBS y Tween-20 (Sigma-Aldrich), y posteriormente se incubó con el anticuerpo frente a cabra o frente a conejo. La membrana se lavó con la solución de lavado descrita anteriormente y se detectó la proteína mediante el kit comercial ClarityTM Western ECL Substrate (BIO-RAD, EE.UU.). La cuantificación relativa de la intensidad de las bandas obtenidas en el Western Blot se realizó con el programa informático Image LabTM Software y el escáner Molecular Imager ChemiDocTM XRS+ (ambos de BIO-RAD, EE.UU.).
Técnicas comunes a emplear
qRT-PCR
El análisis mediante qRT-PCR se realizó con el ADNc obtenido de las diferentes condiciones experimentales usando el kit High Capacity Reverse Transcription Kit (Applied Biosystems) y la extracción fenólica de ARN. Para la normalización de los resultados se utilizó la expresión de genes constitutivos (ARNr Runx2 y GAPDH) y el método de cuantificación relativa utilizado fue el ΔΔCT.
Análisis estadístico
Para el análisis estadístico de los resultados se empleó el programa SPSS 17.0. La comparación de los grupos de tratamiento se realizó por medio de chi-cuadrado en el caso de variables categóricas y por medio de la t de Student para las variables numéricas.
Resultados
a) Estudios in vivo:
Marcadores bioquímicos
La IRC en los ratones WT y TG mostró aumentos en los niveles de urea, producto Ca-P, PTHi y FGF23. En el caso del FGF23 el aumento fue muy superior (10 veces) en los ratones WT con IRC con respecto a su control Sham. El incremento de FGF23 en los ratones TG con IRC fue de 2 veces respecto a su control Sham (Tabla 1).
Efecto de la IRC moderada sobre la calcificación vascular y los cambios a nivel óseo
A pesar de que la cepa de ratones C57/BL6J empleada para los estudios de calcificación no permitió la obtención de calcificaciones vasculares en las aortas (Tabla 1), se observó un incremento significativo en la expresión génica de Runx2, marcador de diferenciación osteoblástica, solo en el grupo de animales WT con IRC (Figura 1). Este aumento no se observó en los animales TG con IRC. El efecto de la IRC sobre el proceso de calcificación se estudió en otro tejido blando como es el riñón, observándose un aumento del contenido en calcio en los ratones con IRC mayor en los ratones WT que en los ratones TG (Tabla 1).

Figura 1 Niveles de expresión génica de Runx2 (unidades relativas) en aorta en los distintos grupos. WT: ratón salvaje; TG: ratón transgénico; IRC: insuficiencia renal crónica*p<0,05 respecto a su respectivo Sham.
Los cambios a nivel vascular también se observaron a nivel óseo. En los animales WT con IRC se vio un deterioro de la estructura ósea con respecto a su grupo control Sham, con una disminución estadísticamente significativa del volumen óseo trabecular (Figura 2A) y del número de trabéculas (Figura 2C), y un aumento de la separación trabecular (Figura 2B) y de la porosidad trabecular (Figura 2D). El grupo de ratones TG con IRC no presentó diferencias con respecto a su grupo control Sham a nivel trabecular.
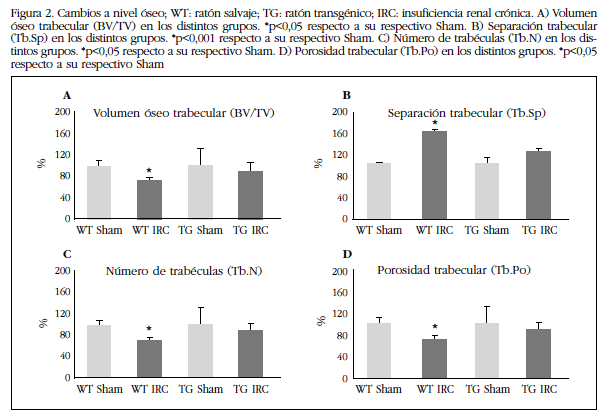
Figura 2 Cambios a nivel óseo; WT: ratón salvaje; TG: ratón transgénico; IRC: insuficiencia renal crónica. A) Volumen óseo trabecular (BV/TV) en los distintos grupos. *p<0,05 respecto a su respectivo Sham. B) Separación trabecular (Tb.Sp) en los distintos grupos. *p<0,001 respecto a su respectivo Sham. C) Número de trabéculas (Tb.N) en los distintos grupos. *p<0,05 respecto a su respectivo Sham. D) Porosidad trabecular (Tb.Po) en los distintos grupos. *p<0,05 respecto a su respectivo Sham
b) Estudios in vitro:
Efecto de la sobreexpresión de catalasa en la depuración de peróxido de hidrógeno y en la expresión de Runx2 en CMLV
Las CMLV procedentes de los ratones TG presentaron una mayor actividad y expresión proteica de la enzima catalasa a nivel basal que las de los ratones WT (Figura 3 A y B).

Figura 3 A) Actividad basal de la enzima catalasa en CMLV de ratones WT y TGB) Expresión proteica en unidades relativas de la enzima catalasa en CMLV de ratones WT y TG mediante Western Blot; WT: ratón salvaje; TG: ratón transgénico. *p<0,001 respecto al grupo WT
Cuando se le añadió medio calcificante a las CMLV de ratones WT se produjo un aumento del contenido en calcio. Este efecto no se observó en las CMLV de los ratones TG (Figura 4A). De forma paralela, se estudió la expresión proteica de Runx2 en CMLV de ratones WT y TG con medio calcificante durante 8 días y se observó un aumento en la expresión de Runx2 en las CMLV de ratones WT que no se observó en las CMLV de los ratones TG (Figura 4B).

Figura 4 Efecto de la adición de medio calcificante (Ca y P) en CMLV de ratones WT y TG sobre: A) El contenido en calcio durante 8 días. B) La expresión proteica de Runx2 durante 8 días (se muestran los valores de la cuantificación deansitométrica vs. GAPDH) mediante Western Blot. WT: ratón salvaje; TG: ratón transgénico. *p<0,05 vs. control
Estudio de los niveles de marcadores de estrés oxidativo y los niveles proteicos de catalasa
Se observó un aumento de los niveles de fluorescencia de la sonda DHR123 en las CMLV de ratones WT cultivadas con medio calcificante, lo que indica un aumento de las especies reactivas de oxígeno mitocondriales. No se observó este efecto en las CMLV de ratones TG, sino que se produjo una disminución de las especies reactivas de oxigeno (Figura 5). También se observó una menor expresión proteica de la enzima catalasa al cultivar las CMLV de ratones WT durante 8 días con medio calcificante con respecto a las procedentes de ratones TG (Figura 6).
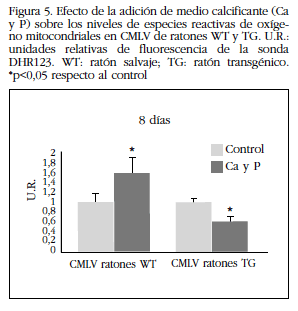
Figura 5 Efecto de la adición de medio calcificante (Ca y P) sobre los niveles de especies reactivas de oxígeno mitocondriales en CMLV de ratones WT y TG. U.R.:unidades relativas de fluorescencia de la sonda DHR123. WT: ratón salvaje; TG: ratón transgénico. *p<0,05 respecto al control
Discusión
En este trabajo hemos podido confirmar que la sobreexpresión de la enzima antioxidante catalasa en un modelo murino protege del proceso de calcificación vascular y del deterioro óseo. En las CMLV de estos mismos ratones se observó un descenso en los niveles de especies reactivas de oxígeno, pero también de proteínas osteogénicas como Runx2.
A nivel bioquímico, resultó particularmente notorio el aumento de FGF23 en los animales WT con IRC respecto al grupo Sham (10 veces), efecto menos marcado en los TG con IRC cuyo aumento fue de 2 veces respecto a su grupo control (Sham). Algunos autores han postulado el papel de FGF23 como inductor del proceso de calcificación [11,12], e incluso se ha asociado sus altos niveles con mortalidad en enfermos renales [13]. Por otro lado, FGF23 inhibe la expresión génica de Cyp27b1 que codifica la 1-alfa hidroxilasa renal suprimiendo la síntesis de calcitriol a partir de su precursor 25 hidroxivitamina D3 [14]. Pero, además, FGF23 activa la expresión génica de Cyp24 que codifica la 24 hidroxilasa la enzima que hidroliza e inactiva el calcitriol [15]. Todo ello contribuye al descenso de la síntesis de calcitriol, pero también a su degradación con el resultado de un descenso de los niveles de vitamina D, factor que podría inducir la calcificación vascular como ha sido demostrado en estudios epidemiológicos [16,17].
El contenido en calcio en aorta en los ratones TG con IRC fue similar al de los ratones WT con IRC. Si bien este hecho puede parecer paradójico y contradictorio al resto de resultados observados, el grupo de Giachelli y cols. ha confirmado la ausencia de calcificación en la aorta en la misma cepa de ratones utilizada para la generación del transgénico [18]. No obstante, el efecto protector de la sobrexpresión de catalasa evitando el acúmulo de calcio se observó en otro tejido blando como el riñón.
Por otro lado, los niveles elevados de FGF23 se han asociado con supresión de la diferenciación osteoblástica y de la mineralización de la matriz ósea in vitro [19]. Esto tal vez podría explicar el efecto negativo de la IRC sobre el deterioro óseo en los ratones WT y en mucho menor grado en los ratones TG. Recientes estudios de nuestro grupo, han demostrado un deterioro óseo en un modelo de ratas con IRC y niveles elevados de fósforo, FGF23 y PTH. En este mismo trabajo, estudios de silenciamiento del gen han confirmado que solo FGF23 tiene un efecto directo activando Dkk1 [20], inhibidor de la vía de Wnt que participa en la inactivación de la vía. De este modo, niveles elevados de FGF23, como los observados en nuestro modelo experimental en ratones WT con IRC, podrían haber contribuido al descenso en la densidad mineral ósea a través de una inactivación de la vía de Wnt.
El incremento de las especies reactivas de oxígeno contribuye al aumento de proteínas osteogénicas, siendo un estímulo para el inicio del proceso de calcificación [7,8]. Este efecto ha sido observado en las CMLV de ratones WT sometidas a estímulos calcificantes. Sin embargo, en las CMLV de ratones TG, sometidas a un estímulo calcificante, no solo no aumentó la expresión de especies reactivas de oxígeno sino que disminuyó, al igual que ocurrió con la expresión proteica de Runx2, proteína osteogénica y marcador temprano del proceso de calcificación. De hecho, se ha señalado la importancia del peróxido de hidrógeno como un segundo mensajero implicado en la señalización intracelular regulada por estrés oxidativo [21]. Un descenso del peróxido de hidrógeno por la sobreexpresión de catalasa contribuiría a un menor estrés oxidativo y un descenso del proceso de calcificación vascular a través de una inhibición de Runx2.
A la vista de los resultados obtenidos, se hace necesario conocer los mecanismos por los que la disminución del estrés oxidativo confiere una ventaja tanto a nivel vascular como óseo. La disminución del proceso inflamatorio, el mantenimiento de los niveles proteicos de klotho renal, principal molécula implicada en el envejecimiento, o la regulación de la vía de Wnt podrían ayudar a explicar este diferente comportamiento, por lo que se hace necesario seguir profundizando en este campo.
En resumen, la sobreexpresión de la enzima catalasa redujo el proceso de calcificación tanto in vivo como in vitro, mostrando in vivo que ese descenso se acompañó de una mejora en los parámetros óseos estudiados.











 texto en
texto en 




