INTRODUCCIÓN
Las alteraciónes del metabolismo óseo y mineral asociadas a la enfermedad renal crónica (ERC), conocidas por sus siglas sajonas CKD-MBD (Chronic Kidney Disease – Mineral and Bone Disorders), se definieron ya en el año 2009 como un conjunto de trastornos sistémicos del metabolismo óseo y mineral debidos a la enfermedad renal crónica, que se traducen en una combinación de las siguientes manifestaciónes1,2:
Anomalías del metabolismo del calcio, fósforo, paratohormona o vitamina D.
Anomalías del remodelado óseo, mineralización, volumen, crecimiento lineal o resistencia.
Calcificaciónes vasculares y de otros tejidos blandos.
Esta definición, actualizada recientemente3, y los documentos de consenso de diversas sociedades científicas4, han destacado la importancia del papel de la calcificación vascular en la morbimortalidad del paciente con enfermedad renal crónica.
El trasplante renal constituye el tratamiento de elección en la terapia renal sustitutiva de los pacientes con ERC, dado que mejora la esperanza de vida y la calidad de la misma. Sin embargo, el impacto de la recuperación de la función renal tras la cirugía sobre las alteraciónes del metabolismo óseo mineral es controvertido5. Las calcificaciónes vasculares no revierten tras el trasplante, y coexisten con otras alteraciónes del metabolismo óseo-mineral en el marco del tratamiento inmunosupresor. La variedad de métodos empleados en la detección de las calcificaciónes vasculares en los estudios previos al trasplante renal, así como la heterogeneidad de los estudios disponibles hasta ahora, no permiten analizar con precisión la magnitud del impacto de la calcificación en la evolución del injerto renal6.
La pérdida de masa ósea después del trasplante renal ocurre principalmente en los primeros 6 meses tras el trasplante y se reduce a medida que disminuye la dosis de corticoides7. El descenso es del 5,5-19,5% durante los primeros 6 meses, del 2-8% entre los 6 y los 12 meses, y de 1-2% a partir de entonces. La rápida pérdida ósea que ocurre después del trasplante condicióna unas altas prevalencias (7-20%) e incidencias (3-4%/año) de fracturas, muy superiores tanto a las de la población general como a las de la población en hemodiálisis8.
El objetivo primario de este estudio fue evaluar la prevalencia de calcificación vascular y fracturas vertebrales en una cohorte de pacientes sometidos a trasplante renal, y su asociación con disfunción del injerto y con mortalidad cardiovascular y por todas las causas, así como el papel de la pérdida de masa ósea y de otras alteraciónes del metabolismo óseo y mineral en la evolución postrasplante.
MATERIAL Y MÉTODOS
Se diseñó un estudio prospectivo, observaciónal, unicéntrico, en el que se incluyeron los 405 pacientes sometidos a trasplante renal entre los años 2008 y 2017, previa firma de consentimiento informado. Se excluyeron del estudio aquellos receptores que no dieron su consentimiento para participar en el mismo y aquellos cuyo seguimiento fue inferior a dos años o se realizó en otra región, así como los pacientes con complicaciónes quirúrgicas intraoperatorias que obligaron a la exéresis inmediata del injerto o que fallecieron en el postoperatorio inmediato (n=95). El estudio fue aprobado por el Comité de Ética de la Investigación del Principado de Asturias.
Se realizó una recogida sistemática de parámetros clínicos, bioquímicos, epidemiológicos en el momento del trasplante y un seguimiento tras la intervención mínimo de dos años en todos los pacientes incluidos. Así, se recogieron:
Datos generales y antropométricos: edad en el momento del trasplante, sexo, estatura, peso, índice de masa corporal.
Datos sobre enfermedad renal y terapia renal sustitutiva (TRS) previa al trasplante: causa de la ERC, diuresis residual, tiempo en diálisis, modalidad de TRS.
Factores de riesgo cardiovascular y antecedentes clínicos: hipertensión arterial (HTA), diabetes mellitus (DM), dislipemia (DL), consumo de tabaco.
Datos bioquímicos promedio de los 6 meses previos al trasplante: calcio sérico (Ca), fósforo sérico (P), hemoglobina sérica (Hb), paratohormona (PTH) y albúmina (Alb).
Datos sobre el trasplante renal: se recogieron datos sobre la edad de los donantes, la tasa de injerto renal no funciónante, la tasa de disfunción inicial del injerto (aquellos pacientes que precisaron continuar con diálisis durante los primeros días tras la cirugía), la tasa de rechazo agudo inmune, y la compatibilidad HLA (human leukocyte antigen).
-
Evaluación radiológica de las calcificaciónes vasculares y de las fracturas vertebrales en los estudios pretrasplante: el estudio radiológico consistió en la realización de radiografías de pelvis anteroposterior, columna dorsal y lumbosacra en proyecciónes anteroposterior y lateral.
Los estudios radiológicos fueron evaluados de forma ciega, por parte de dos expertos de forma independiente. Se evaluó la concordancia entre un mismo observador e interobservador9, con un índice kappa de 0,74, en ambos casos (para la presencia de calcificación vascular aórtica, y presencia o no de fracturas vertebrales, sin considerar la gravedad de las calcificaciónes o el tipo/grado de las fracturas).
Se definió como presencia de calcificaciónes vasculares a cualquier calcificación del territorio de la aorta abdominal, las arterias ilíacas, femorales, uterinas/espermáticas (más de dos calcificaciónes parcheadas aisladas o una calcificación lineal visible en una sección del vaso)10. Para el análisis de mortalidad y eventos cardiovasculares se ha empleado la calcificación de aorta abdominal por ser la más prevalente en la cohorte a estudio.
Se ha empleado la clasificación semicuantitativa de Genant11 para establecer la existencia de fractura vertebral osteoporótica en las imágenes radiológicas dorsales y lumbosacras anteroposterior y laterales, siempre y cuando presentasen un acuñamiento, biconcavidad y/o aplastamiento grado 1 de Genant o superior.
Evaluación mediante densitometría de la CKD-MBD: la densidad mineral ósea (DMO) se midió en columna lumbar posteroanterior (L2-L4) y en cuello femoral derecho, mediante densitómetro DXA Hologic® QDR-1000 (Hologic Inc., Waltham, Massachusetts. EE.UU.). Se disponía de 39 estudios realizados en los dos años pretrasplante.
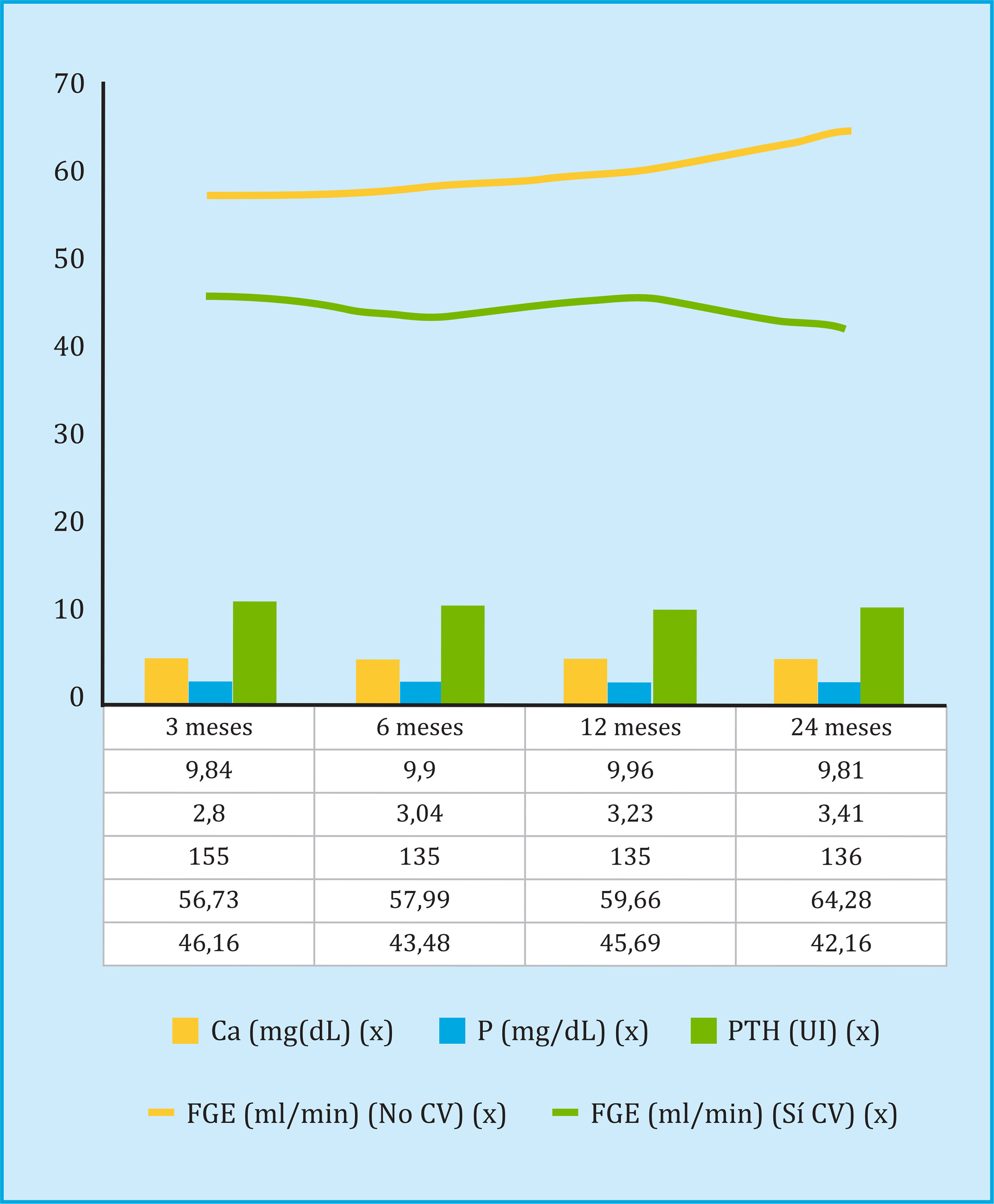
Evaluación de la función renal y metabolismo óseo del paciente con trasplante: creatinina, filtrado glomerular estimado (FGE) según la fórmula CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration), Ca, P, PTH en intervalos de 3, 6, 12 y 24 meses. Se evaluó la mortalidad por todas las causas, con un tiempo de seguimiento medio de 7,2±2,4 años (mínimo de 2 años, máximo de once años), así como la mortalidad por evento cardiovascular (infarto agudo de miocardio –IAM- y/o accidente cerebrovascular –ACV-), y la disfunción del injerto no justificado por causa inmunológica12, entendido este como un descenso marcado del filtrado glomerular en el seguimiento postrasplante.
Análisis estadístico
El análisis descriptivo se muestra en forma de porcentajes (%), medias (X) y desviaciónes estándar (DE), o medianas (Mn) y rango intercuartílico en las variables que no tenían una distribución normal.
Para el análisis de las diferencias entre los parámetros clínicos y bioquímicos, y la asociación de los mismos con la calcificación vascular, se utilizaron las pruebas estadísticas de T-Student, test de Chi-cuadrado, análisis de regresión logística múltiple y pruebas no parámetricas (U-Mann Whitney) cuando fueron necesarias, con un intervalo de confianza (IC) de 95%, y considerando un valor de p<0,05 como estadísticamente significativo.
Para el análisis de la supervivencia, se calcularon las curvas de Kaplan Meier, junto con el análisis multivariante de regresión logística y de regresión de Cox.
El análisis estadístico se realizó mediante el software IBM® SPSS® Statistics v.20.00 para Windows.
RESULTADOS
Las características generales de los pacientes incluidos en el estudio se muestran en la tabla 1. En lo referente a los parámetros bioquímicos relaciónados con el metabolismo óseo mineral en los seis meses previos al trasplante, el valor medio de calcio sérico fue 9,17±0,85 mg/dl, de fósforo sérico 4,4 5±1,31 mg/dl, de albúmina 38,3±4,4 mg/dl, de hemoglobina del 11,3±1,9 g/dl y la mediana de PTH de 244 pg/ml, con un rango intercuartílico comprendido entre 150 y 360.
Tabla 1. Características generales de los pacientes incluidos en el estudio

N: población de estudio; X: media; DE: desviación estándar; IMC: índice de masa corporal; ECR: enfermedad renal crónica; PQHR: poliquistosis hepatorrenal; HD: hemodiálisis; DP: diálisis peritoneal; ERCA: enfermedad renal avanzada; T: tiempo; Mn: mediana; Rn: rango; HTA: hipertensión arterial; DM: diabetes mellitus; DL: dislipemia.
La edad media de los donantes fue de 54±12 años, con una correlación con la edad de los receptores de R=0,645 (p<0,001), la tasa de injerto nunca funciónante fue del 3,5%, el porcentaje de disfunción inicial del injerto con posterior recuperación fue del 35,5%, la tasade rechazo agudo del 11%, y la media de compatibilidades HLA fue de 2±1.
El 66,4% de los pacientes incluidos en el estudio presentaban algún tipo de calcificación vascular radiológica en los territorios analizados, no encontrando diferencias entre las distintas modalidades de diálisis. Así, el 64,2% presentaban calcificación a nivel de aorta abdominal, el 53% presentaban calcificación a nivel de ilíacas, el 40,6% presentaban calcificación en el territorio femoral y el 23,9% presentaban calcificación en las arterias uterinas o espermáticas, aunque en el trabajo actual se hará referencia únicamente a la calcificación en aorta abdominal. Las características basales de los pacientes y los parámetros de la CKD-MBD, según la existencia o no de calcificación vascular radiológica previa, se muestran en la tabla 2
Tabla 2. Características basales, existencia de fracturas vertebrales y datos del trasplante de los pacientes en función de la existencia de calcificación vascular radiológica en cualquier territorio previa al trasplante
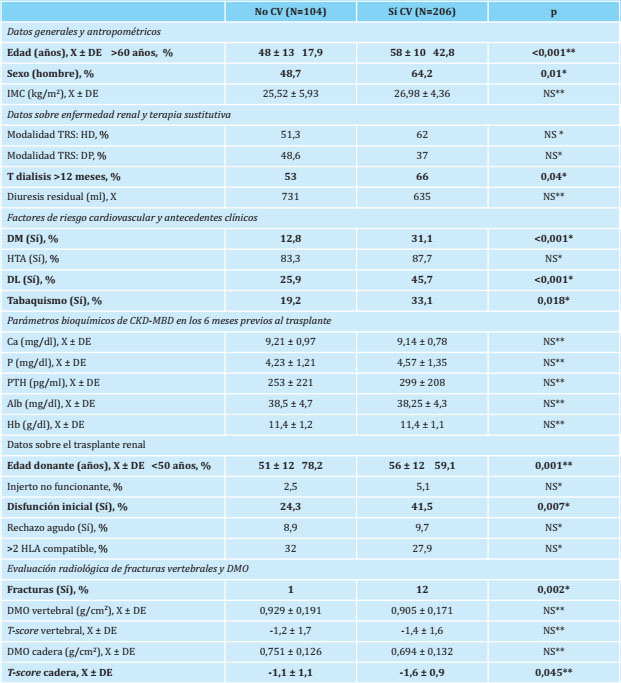
N: número de pacientes; X: media; DE: desviación estándar; IMC: índice de masa corporal; TRS: terapia renal sustitutiva; HD: hemodiálisis; DP: diálisis peritoneal; T: tiempo; DM: diabetes mellitus; HTA: hipertensión arterial; DL: dislipemia; Hb Ca: calcio; P: fósforo sérico; PTH: paratohormona; Alb: albúmina; Hb: hemoglobina; DMO: densitometría ósea; NS: no significativo;
*:Chi-Cuadrado;
**:T Student.
La prevalencia global de fracturas vertebrales en los estudios pretrasplante fue del 8,4%; en lo referente a los estudios de densitometría ósea (n=39), los valores de masa ósea en columna vertebral fueron de 0,915±0,176 g/cm2, con un promedio de T-score de -1,3±1,6, y de 0,717±0,131 g/cm2 en cadera, con un promedio de T-score de -1,3±1,1, significativamente menor en pacientes con calcificación vascular radiológica (1,1±1,1 vs. -0,6±0,9; p=0,045). Los resultados y las características de los pacientes, en base a la detección previa o no de fracturas vertebrales, así como el resultado de las densitometrías óseas disponibles (n=39), se muestran en la tabla 3.
Tabla 3. Fracturas vertebrales y características clínicas de los pacientes
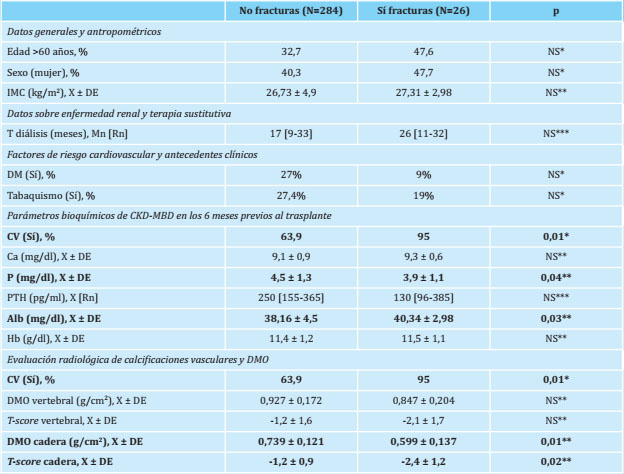
N: número de pacientes; X: media; DE: desviación estándar; IMC: índice de masa corporal; T: tiempo; Mn: mediana; Rn: rango intercuartílico; DM: diabetes mellitus; CV: calcificación vascular; Ca: calcio; P: fósforo sérico; PTH: paratohormona; Alb: albúmina; Hb: hemoglobina; DMO: densitometría ósea; NS: no significativo;
*:Chi-Cuadrado;
**:T Student.
***:U Mann-Whitney.
Se ha encontrado una fuerte asociación entre calcificación vascular y fracturas vertebrales (estando estas presentes en el 95% de los pacientes con calcificación vascular), y a su vez con los valores de densitometría ósea, como se muestra en la figura 1. Los resultados del análisis de regresión logística de los factores de riesgo de calcificación vascular se muestran en la tabla 4.

(a): se muestran en las figuras los valores medios de masa ósea a nivel de cadera para distintas categorías de calcificación vascular (barras) y la desviación estándar de dichos valores; cm2: centímetro cuadarado; DMO: densitometría ósea; g: gramo.
Figura 1. Calcificación vascular, fracturas vertebrales y densitometría ósea de cadera en pacientes sometidos a trasplante renal
Tabla 4. Factores de riesgo evaluados

IC: intervalo de confianza; T: tiempo; NS: no significativo;
(a):ajustado para todos los factores de riesgo incluidos en la tabla. Se muestra entre paréntesis el porcentaje de pacientes en la cohorte de estudio que presentaba dicho factor de riesgo
La evolución de los parámetros bioquímicos del metabolismo óseo mineral y de la función del injerto renal en el seguimiento postrasplante se muestra en la figura 2. Se observó un menor FGE en todos los pacientes que presentaban calcificación, y analizando el descenso del filtrado glomerular entre los 3 y los 24 meses de seguimiento, una reducción media de 3,36 ml/min en los pacientes con calcificación vascular en algún territorio, frente a un aumento de 7,31 ml/min en los pacientes sin calcificación vascular. Los resultados del análisis multivariante de regresión de Cox, para evaluar los factores de riesgo para el descenso del FGE en el seguimiento postrasplante, se muestran en la tabla 4.
La tasa de mortalidad global por todas las causas fue del 13,8%, de las que el 35% fueron de etiología cardiovascular, el 25,8% por complicaciónes infecciosas, el 16,1% de etiología neoplásica y el resto por otras causas. La supervivencia de los pacientes fue significativamente menor en el grupo de pacientes con calcificación vascular (131±1,5 meses sin calcificación frente a 110±3,5 meses con calcificación vascular, p<0,001), como se muestra en el análisis de Kaplan-Meier en la figura 3. Analizando exclusivamente la mortalidad de etiología cardiovascular (accidente cerebrovascular isquémico o infarto agudo de miocardio), los hallazgos fueron idénticos (Log Rank=7,43, p<0,001), sin presentar ningún paciente sin calcificación vascular previa un evento cardiovascular fatal. Los factores de riesgo independientes de mortalidad, según el análisis multivariante de regresión de Cox, tanto cardiovascular como por todas las causas, se muestran en la tabla 5, donde no se incluyeron los resultados de los estudios de densitometría ósea, dado su reducido número. La DMO vertebral fue de 0,902±0,172 g/cm2 en los pacientes no fallecidos (n=37) frente a 1,114±0,096 g/cm2 en los fallecidos (n=2) (T-score -1,5 vs. 0,6), y la DMO a nivel de cadera fue de 0,721±0,134 g/cm2 en los no fallecidos frente a 0,678±0,044 g/cm2 en los fallecidos (T-score -1,4 vs. -2), sin diferencia estadística entre ambos grupos.
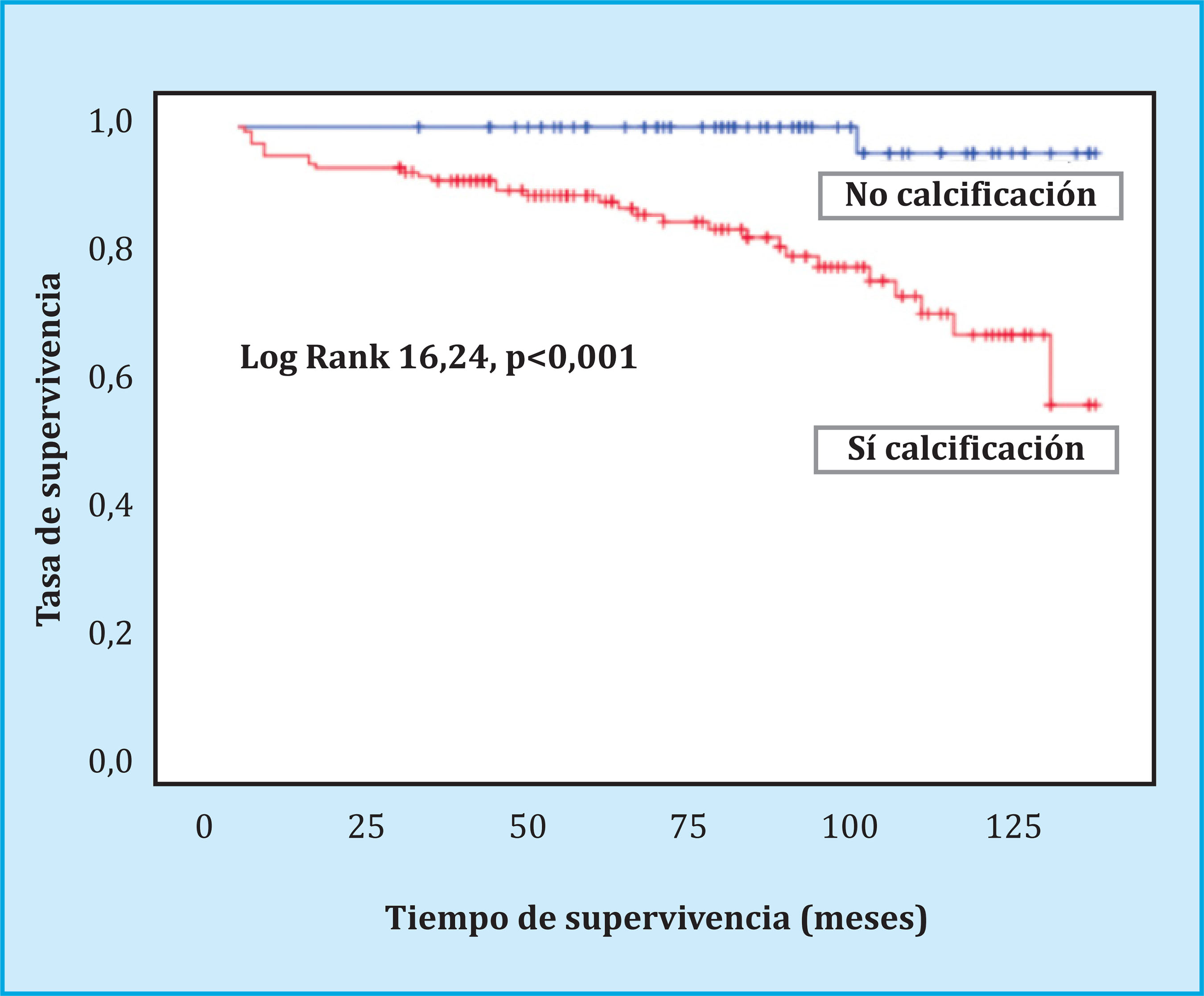
Figura 3. Supervivencia global del paciente trasplantado renal en base a la existencia de calcifación vascular radiológica
Tabla 5. Factores de riesgo de mortalidad por todas las causas y de etiología cardiovascular (Análisis de regresión multivariante de Cox)

N: número de pacientes; HR: hazard ratio; IC: intervalo de confianza; HTA: hipertensión arterial; DM: diabetes mellitus; CV: calcificación vascular; AA: aorta abdominal; ↓ FGE: descenso filtrado glomerular estimado;
(a):ajustado para todos los factores de riesgo incluidos. Se muestra entre paréntesis el porcentaje de pacientes en la cohorte de estudio que presentaba dicho factor de riesgo.
(b):no se incluyó la variable calcificación aorta abdominal ni fracturas vertebrales en el análisis por ser positivas en el 100% de los pacientes fallecidos por mortalidad cardiovascular
DISCUSIÓN
La mortalidad cardiovascular es la principal causa de muerte en el paciente sometido a trasplante renal, con un riesgo anual de eventos letales o no letales del 3 al 5% mayor que en población general. El fallecimiento con injerto renal funciónante supone hasta el 42% de las pérdidas del injerto, siendo la causa más frecuente la cardiovascular, con una prevalencia según las series entre el 36 y el 55%13 (en nuestra serie del 35%).
El papel de las alteraciónes del metabolismo óseo mineral asociadas a la ERC en la morbimortalidad del trasplante renal ya ha sido descrito por otros autores8,14. Una de las manifestaciónes principales de la CKD-MBD es la calcificación vascular; existen múltiples métodos validados para la detección de la calcificación, y múltiples escalas que permiten cuantificarla; Cianciolo et al.6, en su metaanálisis publicado en 2014, incluyeron hasta 13 estudios de calcificación en pacientes receptores de trasplante renal, evaluando distintos territorios y con diferentes técnicas diagnósticas. En la mayoría de estos estudios, se observó una progresión de la calcificación en el postrasplante en todos los territorios, dependiente de la gravedad inicial de las mismas15.
La presencia de fracturas vertebrales también tiene un impacto negativo en el pronóstico de los pacientes con ERC, siendo un factor independiente de mortalidad en pacientes con ERC en estadios 3-5, y se ha asociado con la existencia de calcificaciónes vasculares en pacientes en hemodiálisis10, y en estudios en población general16; estos hallazgos son idénticos a los de nuestra serie, donde la existencia de fracturas vertebrales previas incrementaba en nueve veces el riesgo de existencia de calcificación vascular.
Sin embargo, dada la ausencia de síntomas agudos o la existencia de dolor de espalda de múltiples causas, raramente se investiga la existencia de fracturas en la práctica clínica cotidiana. Se ha demostrado una prevalencia de fractura vertebral entre el 8 y el 45% en pacientes sometidos a trasplante renal cuando se investigaron las deformidades óseas17 (en nuestra serie, del 8,4% en los seis meses previos al trasplante). Hasta la actualización reciente de las guías KDIGO (Kidney Disease: Improving Global Outcomes)3, la DMO no estaba recomendada de forma sistemática, por lo que en nuestra serie disponemos de un número muy reducido de estudios; a pesar de ello, hemos podido encontrar un T-score menor en cuello femoral de los pacientes con calcificación vascular, y a su vez asociado con la existencia de fracturas vertebrales previas. Que la masa ósea en cuello femoral sea mejor marcador de fracturas vertebrales que la masa ósea lumbar entra dentro de lo esperable considerando la posibilidad de artefactos de la imagen radiológica, entre otros, por la propia calcificación aórtica18, unido al hecho de la existencia de valores de PTH elevados en los pacientes antes del trasplante, lo que conlleva una mayor afectación en una localización ósea con predominio cortical, como el cuello femoral, frente a zonas de predominio trabecular, como la columna lumbar. Nuestros resultados concuerdan además con un estudio reciente que determina la importancia de la DMO como predictor de fracturas en pacientes renales19, si bien será necesario realizar estudios con densitometría con un mayor número de pacientes que permitan ratificar nuestros hallazgos
Entre los parámetros bioquímicos llaman la atención unos valores significativamente mayores de la albúmina entre los pacientes fracturados (que indicaría que la fragilidad ósea de estos pacientes no estaría condiciónada por un mayor deterioro nutriciónal)20,21.
La radiología simple aporta la menor dosis de radiación posible, permite evaluar de forma conjunta calcificación vascular y fracturas, y ha demostrado su utilidad como predictor de mortalidad en pacientes en diálisis. Rodríguez et al.10, en un estudio de 193 pacientes en hemodiálisis a los que se realizó una radiografía simple de columna lumbar y pelvis, demostraron un aumento de la prevalencia de la calcificación en aorta de pacientes con enfermedad renal crónica en hemodiálisis, y se asoció la gravedad de la misma con el tiempo en diálisis, con las fracturas vertebrales y con la morbimortalidad
En nuestra serie, la prevalencia global de calcificación vascular en el momento del trasplante fue del 66,4%, coincidente con los hallazgos de series previas10,22. Como era de esperar, se ha asociado la existencia de calcificación vascular radiológica con la diabetes mellitus previa al trasplante, el sexo, el tiempo en diálisis superior a 12 meses, el tabaquismo activo, la existencia de fracturas vertebrales y, sobre todo, a partir de la sexta década. Estos hallazgos son similares a otros ya publicados, incluso en población general6,10,16. No se encontraron diferencias significativas en cuanto a la existencia de calcificación entre las modalidades de terapia renal sustitutiva, y tampoco hubo diferencias con respecto a los valores de calcio, fósforo y PTH sérica en los 6 meses previos al trasplante, de forma similar a algunos estudios publicados23 donde tampoco se encuentran diferencias con respecto a la asociación con la calcificación vascular, si bien hay controversia entre diversos autores24.
En lo referente al injerto renal, la edad de los donantes fue superior en los pacientes con calcificación vascular, y se correlaciónó con la edad de los receptores (R=0,65; p<0,001), con tasas de disfunción inicial del injerto superiores (41,5% frente a 24,3%); este hallazgo tiene relación con la selección de donantes de más edad para pacientes de edad más avanzada, de acuerdo con los protocolos de las distintas sociedades científicas que recomiendan que los órganos extraídos a pacientes de determinada edad, sean trasplantados en pacientes en un rango de ±15 años25. En el seguimiento postrasplante, se objetivó una mayor tasa de descenso del FGE en el grupo de pacientes con calcificación; aunque esto podría achacarse únicamente a la edad de los donantes (menor en pacientes sin calcificación), el análisis de regresión de Cox demostró como factor de riesgo independiente la calcificación vascular en cualquier territorio (OR=2,8; p<0,001). Otros factores, como la disfunción inicial del injerto, que pudiera entenderse como predisponente para una peor evolución a posteriori, no mostraron significación estadística
No se ha encontrado asociación entre el descenso del FGE y el resto de parámetros bioquímicos del metabolismo óseo mineral evaluados en el seguimiento, al igual que en otros estudios recientes, como el de Wolf et al.14, donde solamente el FGF-23 mostró impacto en la evolución del filtrado a largo plazo (no incluido en nuestro análisis). En el postrasplante inmediato, la hipercalcemia se ha descrito como uno de los principales factores de disfunción del injerto a medio plazo, por la aparición de microcalcificaciónes tubulares26; en nuestro análisis, la calcemia no ha mostrado impacto sobre el descenso del filtrado. En futuros trabajos, sería interesante analizar el impacto de otros biomarcadores, como α-klotho, en el seguimiento postrasplante
La supervivencia global del paciente sometido a trasplante fue mayor en los pacientes sin calcificación radiológica previa, como ocurre en otros estudios previos27, incluso en población general28. En el análisis multivariante, la calcificación vascular en aorta abdominal mostró impacto en la mortalidad de los pacientes en el seguimiento postrasplante, junto con el descenso del filtrado glomerular, el tabaquismo y la edad avanzada; no se ha encontrado asociación entre mortalidad por todas las causas y la existencia de fracturas vertebrales, que sí ha sido referida por otros autores10,16. Del mismo modo, la supervivencia libre de eventos cardiovasculares fatales fue mayor en los pacientes sin calcificación vascular. En nuestra cohorte, todos los pacientes fallecidos por eventos cardiovasculares presentaban algún tipo de calcificación vascular en aorta abdominal, al menos moderada, además de haber sufrido una o más fracturas vertebrales, por lo que no hemos podido analizar su impacto en la mortalidad cardiovascular.
La principal limitación de este estudio es que no se han incluido factores de riesgo como la terapia inmunosupresora y las complicaciónes infecciosas durante el seguimiento, así como el reducido número de estudios de densitometría ósea disponibles, dada la baja recomendación para su realización en guías previas2. Es importante señalar la necesidad de incluir este estudio en la práctica clínica diaria, como parte de la evaluación previa al trasplante renal, por su asociación con la calcificación vascular, que a su vez condicióna una importante morbimortalidad. Otra limitación existente es la ausencia de determinaciónes regladas de vitamina D, puesto que valores muy bajos se asocian con un aumento de la progresión de la calcificación aórtica, así como de mortalidad incluso en población general29.
La principal fortaleza del estudio es que incluye la evolución de la función del injerto renal en el tiempo, y su impacto directo en la morbimortalidad del paciente, y que a su vez se va a asociar de forma directa con la calcificación vascular previa.
CONCLUSIÓN
Los resultados de este estudio corroboran que la calcificación vascular previa al trasplante (asociada además con fracturas vertebrales y pérdida de masa ósea) condicióna la morbimortalidad del paciente sometido a trasplante renal y, además, nos permiten ver su impacto sobre la evolución de la función del injerto, independientemente de otros factores de riesgo tradiciónales. La radiografía simple, más barata e inocua que otros procedimientos, e incluida en la mayoría de protocolos de evaluación previos al trasplante renal, nos puede dar, por tanto, información cierta sobre el pronóstico y la evolución de los pacientes, y ayudar a prevenir potenciales complicaciónes futuras. Es relevante promover no sólo la mejor salud vascular posible, sino también el menor impacto en el tejido óseo en la progresión de la ERC antes del momento del trasplante. Por ello, aunque el estudio no dispone de un elevado número de pacientes con densitometría, se aconseja su realización como un estudio previo a la inclusión en lista de espera de trasplante, dada la asociación entre la fragilidad ósea y la calcificación vascular, y, a su vez, con el pronóstico tanto del paciente como del injerto renal.











 texto em
texto em