INTRODUCCIÓN
Los inhibidores de la aromatasa (IA) son la terapia adyuvante recomendada para tratar el cáncer de mama con receptores de estrógenos positivos1,2. Su efectividad para reducir el riesgo de recidiva y mortalidad es bien conocido3. Sin embargo, los IA también están asociados a diversos efectos secundarios que afectan a la calidad de vida de las pacientes, y, por lo tanto, comprometen la adherencia al tratamiento y la mortalidad asociada4.
Se conoce que hasta un 30% de pacientes con IA interrumpen su tratamiento debido a eventos adversos5, principalmente musculoesqueléticos6,7. Entre ellos, los más frecuentes son las artralgias8 y la pérdida acelerada de masa ósea9 asociada a un aumento de la fractura osteoporótica10,11. Para prevenir la pérdida de masa ósea, se recomienda tratar a las pacientes con antirresortivos, donde los más usados son los bifosfonatos (BF)12-14.
El uso de los BF se ha relacionado con una mejora en la mortalidad asociada a la disminución de metástasis óseas13. Así mismo, se publicó un estudio en una población coreana donde se asoció el uso de BF a una mejora de la adherencia15.
El objetivo de nuestro estudio fue evaluar la persistencia a la terapia con IA, la mortalidad asociada a la discontinuidad al tratamiento y la influencia de los BF orales, en una cohorte basada en población con datos obtenidos de la práctica clínica habitual.
MATERIAL Y MÉTODOS
Base de datos
Datos de más de 7 millones de pacientes, provenientes de más de 350 centros de Atención Primaria de Cataluña, son registrados de forma anónima por el Sistema de Información para el Desarrollo de la Investigación en Atención Primaria (SIDIAP), cubriendo >80% del total de la población catalana (http://www.sidiap.org).
Esta base de datos contiene información de variables sociodemográficas, factores de riesgo del estilo de vida (consumo de alcohol, obesidad, tabaquismo, etc.), comorbilidades y dispensaciones farmacológicas. Los datos son recogidos por profesionales del sector sanitario, incluyendo los códigos de la clasificación internacional de enfermedades y problemas de salud relacionados, 10.ª edición (CIE-10), así como formas estructuradas para la reunión de variables clínicas (tabaco, índice de masa corporal, etc.). SIDIAP también tiene registrados los datos de mortalidad, obtenidos del Registro Central de Personas Aseguradas, así como la migración fuera del área de captación16.
Diseño del estudio y participantes
Estudio prospectivo observacional de mujeres diagnosticadas con cáncer de mama con receptores hormonales positivos en tratamiento con IA. Se incluyeron las pacientes tratadas con IA en monoterapia entre enero de 2006 y diciembre de 2015 recogidas en la base de datos SIDIAP. Se identificaron a las usuarias de IA mediante los códigos ATC (sistema europeo de codificación de sustancias farmacéuticas y medicamentos): L02BG03 para anastrozol, L02BG04 para letrozol, y L02BG06 para exemestano. Se excluyeron aquellas con historia previa de cáncer (excepto cáncer local de piel no melanoma).
Periodo de seguimiento de las pacientes
Para el estudio de la persistencia, las pacientes fueron seguidas desde el inicio de la terapia con IA hasta el primero de los siguientes acontecimientos: cese o abandono de la terapia con IA, fallecimiento, migración fuera del área de captación, o fin de la disponibilidad de datos en el SIDIAP (31 de diciembre, 2015). En el caso de la mortalidad, las pacientes fueron seguidas desde su entrada en el estudio hasta el 31 de diciembre de 2015.
Variables de estudio
Las principales variables de estudio fueron la persistencia a los IA, y la supervivencia global. Se estudió el uso continuado de los IA mediante los registros de facturación provenientes de las farmacias. Se consideró el cese o abandono del tratamiento en aquellos registros sin dispensación con intervalos de 6 meses o más. Se reportó la supervivencia global, expresada en mortalidad, durante el periodo de seguimiento.
Se estudió el efecto de los BF en la persistencia y la mortalidad estratificando en usuarias y no usuarias: se clasificó como usuarias de BF a las pacientes con registros de BF orales (M05BA) con los códigos M05BA01 (ácido etidrónico), M05BA02 (ácido clodrónico), M05BA04 (ácido alendrónico), M05BA05 (ácido tiludrónico), M05BA06 (ácido ibandrónico), M05BA07 (ácido risedrónico), y M05BB03 (combinación de ácido alendrónico y colecalciferol).
Análisis estadístico
Se describieron las características de las pacientes utilizando la media ± desviación estándar (DE) en las variables cuantitativas con distribución normal, y el número y porcentaje –n (%)– para las variables categóricas.
Se estudió la persistencia al tratamiento con IA con un análisis de supervivencia: se calculó el estimador de Kaplan-Meier y se representó mediante modelos de probabilidad acumulada; se realizó un modelo de los riesgos proporcionales (regresión de Cox) entre usuarias y no usuarias de BF ajustando por edad, obteniendo el cociente de riesgo (HR, del inglés Hazard Ratio), y se verificó su proporcionalidad. Adicionalmente se llevó a cabo un análisis de sensibilidad teniendo en cuenta la mortalidad como riesgo competitivo (modelos de Fine y Gray), estimando la subdistribución de los cocientes de riesgo (SHR).
Finalmente, se comparó la diferencia de mortalidad entre grupos mediante una prueba Chi cuadrado.
Los análisis se realizaron con R 3.5.3 utilizando los paquetes foreign, compareGroups, splines, survival, y survminer. Estos se definieron como significativos con p<0,05.
RESULTADOS
Se recogieron 18.455 datos de mujeres tratadas con IA. Sus características basales están descritas en la tabla 1. La persistencia [IC 95%] al tratamiento con IA fue del 99,8% [99,7 a 99,9] a 1 año, 98,3% [98,1 a 98,5] a 2 años, 95,8% [95,5 a 96,2] a 3 años, 92,9% [92,4 a 93,4] a 4 años y 87,0% [86,3 a 87,8] a 5 años de tratamiento (Figura 1).
Tabla 1. Características basales de las participantes incluidas en el estudio

BF: bifosfonatos; DE: desviación estándar; IMC: índice de masa corporal; MEDEA: mortalidad en áreas pequeñas españolas y desigualdades socioeconómicas y ambientales.
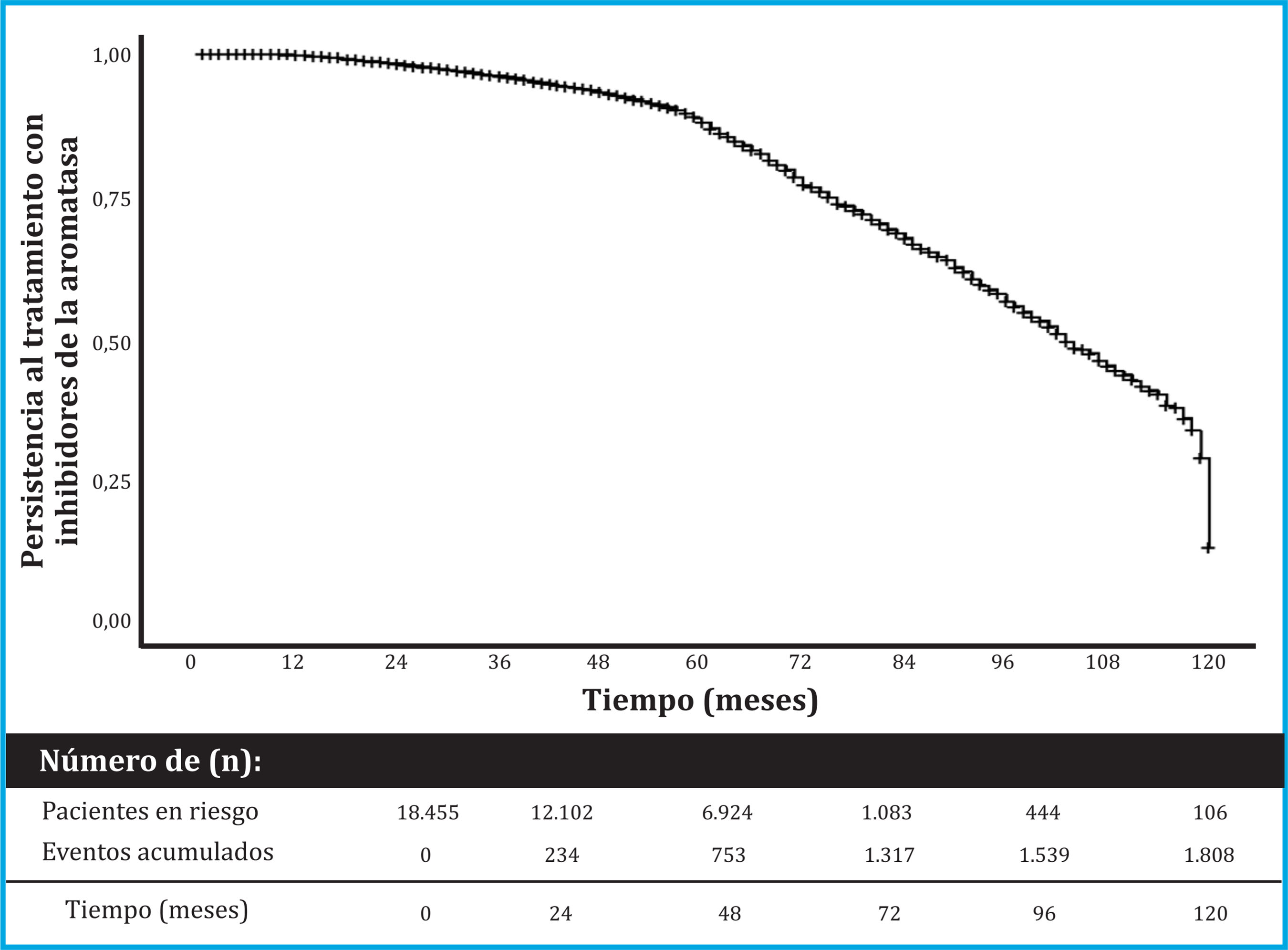
Figura 1. Persistencia al tratamiento con IA. El gráfico presenta una curva de Kaplan-Meyer que muestra el riesgo de abandono de los IA en términos acumulativos. Abreviaturas: IA: inhibidores de la aromatasa
La mortalidad se cuantificó mediante estratificación de las pacientes teniendo en cuenta las que finalizaron los 5 años de tratamiento, y, por otro lado, las que no. Se observó una mortalidad global del 19,75% (3.644/18.455): con un 21,2% (3.165/14.908) en las pacientes que no completaron 5 años de tratamiento con IA, y del 13,5% (479/3.547) en aquellas tratadas durante 5 años o más (p<0,001).
Influencia de los BF
De las 18.455 pacientes incluidas en el estudio, el 21,7% (n=4.009) fueron tratadas con BF orales (Tabla 2). Estas mostraron una mejor persistencia a los IA que aquellas no tratadas con BF: 99,9% [99,8 a 100] vs. 99,7% [99,6 a 99,8] a 1 año; 99,8% [99,6 a 99,9] vs. 97,8% [97,5 a 98,1] a 2 años; 98,5% [98,1 a 98,9] vs. 94,9% [94,4 a 95,3] a 3 años; 97,2% [96,6 a 97,8] vs. 91,2% [90,5 a 91,8] a 4 años; y 93,3% [92,2 a 94,4] vs. 84,5% [83,5 a 85,5] a 5 años de tratamiento, respectivamente (Figura 2). De esta manera, el cociente de riesgo de abandonar los IA en usuarias de BF respecto las no usuarias fue el siguiente: HR ajustado: 0,53 [IC 95%: 0,47 a 0,60], y SHR ajustado: 0,62 [IC 95%: 0,55 - 0,70].
Tabla 2. Características basales de las mujeres tratadas con IA según su uso de BF

BF: bifosfonatos; DE: desviación estándar; IMC: índice de masa corporal; MEDEA: mortalidad en áreas pequeñas españolas y desigualdades socio-económicas y ambientales.

Figura 2. Persistencia al tratamiento con IA entre usuarias y no usuarias de BF. El gráfico presenta una curva de Kaplan-Meyer que muestra el riesgo de abandono de los IA en términos acumulativos entre los grupos de estudio: usuarias y no usuarias de BF. Abreviaturas: IA: inhibidores de la aromatasa; BF: bifosfonatos
Por otro lado, la mortalidad en las pacientes con BF fue de un 14,6% (587/4.009), mientras que en las no usuarias fue de un 21,2% (3.507/14.446) (p<0,001).
DISCUSIÓN
Este estudio se ha centrado en evaluar la persistencia a la terapia con IA en una cohorte de mujeres diagnosticadas con cáncer de mama con receptores hormonales positivos, así como la mortalidad y el efecto de los bifosfonatos, en la práctica clínica habitual. Se observó que la persistencia global a 5 años fue del 87% con una mortalidad global del 19,75%. La mortalidad en aquellas pacientes que completaron 5 años de terapia fue un 7,7% menor que aquellas que no. Por otro lado, las usuarias de BF mostraron una mejor persistencia al tratamiento con IA, con un 47% menos de riesgo de abandono de la terapia, y un 6,6% menos de mortalidad que las no usuarias.
Se ha descrito que los efectos secundarios de los IA influyen negativamente en la adherencia al tratamiento5. Diversos ensayos controlados aleatorios (ECA) han publicado tasas de persistencia que varían entre 76-90%17,18. Sin embargo, la fiabilidad de estos porcentajes puede ser cuestionada por la falta de resultados de discontinuidad de algunos ECA. Varios estudios de adherencia en bases de datos poblacionales muestran valores alrededor de 69-88% en periodos de observación cortos (un año de adherencia)19-21, y de 61-79% en tiempos de seguimiento más largos (3-4,5 años)20,22. Hershman y cols. (2010)22 observaron una tasa de discontinuación del 30% en pacientes con IA a 4,5 años de seguimiento, mientras que Hadji y cols. (2013)23 describieron una discontinuación entre el 44-55% a 3 años. Entre otros factores, la edad de las pacientes (a menor edad, menor adherencia), y el coste de los medicamentos y/o gastos médicos derivados –especialmente en sistemas sanitarios privados–, han sido descritos como variables asociadas a una mayor discontinuidad21. La alta persistencia observada en nuestra población podría ser explicada por una media de edad alta (media ± DE: 67,6 ± 11,6) respecto la reportada en los ECA (media ± DE: 64,1±9,0 en el estudio ATAC24, y 64,3±8,1 en el estudio IES25; mediana [rango]: 61 [38-89] en el estudio BIG 1-9826; y mediana de 63,9 y 64,3 en pacientes con exemestano y anastrozol en el estudio MA.2727) y un sistema sanitario público, donde el coste del tratamiento es prácticamente despreciable.
En el caso de la mortalidad global, existe una cierta diversidad de resultados en función del diseño del ECA. En el estudio BIG 1-98, se observó una mortalidad del 12,3%28. El estudio de seguridad del ATAC, detectó una mortalidad del 23,5% en todas las usuarias de IA en monoterapia, y del 21,5% en la subpoblación de mujeres con el estado tumoral conocido de receptores hormonales positivos29. En contraste, el estudio MA.27, publicado por Goss y cols. (2013), mostró una mortalidad del 5,7% a los 5 años27. A diferencia de los ECA, nuestro estudio utiliza datos de población general visitada en la asistencia primaria, consiguiendo una población más representativa de la clínica habitual. De manera interesante, los valores de mortalidad de nuestra población de estudio se asemejan a los descritos en el estudio ATAC. Este hecho podría deberse a que ambos reportan resultados de mortalidad de hasta 10 años de seguimiento.
Por otro lado, y en concordancia con nuestros resultados, el uso de BF fue reportado por Lee y cols. (2014)15 como un factor que mejora la adherencia al tratamiento con IA. Así mismo, el uso de BF fue asociado a una disminución de la incidencia de metástasis óseas del 34% y una reducción de la mortalidad del 17%13. En general, el uso de BF disminuye la mortalidad global, aumenta la esperanza de vida y previene la aparición de varios canceres en población general30. Esta mejora de la esperanza de vida no solo se atribuye a la disminución de fracturas31, sino a una posible prevención de la fragilidad y una mayor capacidad del individuo de hacer frente a diferentes patologías32.
Teniendo todo eso en cuenta, la mayor adherencia a los IA en pacientes tratadas con BF podría ser explicada por una mejoría en el tratamiento de los eventos adversos que impactaría positivamente en la paciente, mientras que la disminución en la mortalidad global derivada del uso de los BF podría atribuirse tanto a una disminución de las metástasis óseas como a la mayor adherencia a los AI.
Una limitación del estudio es que la base de datos del SIDIAP no dispone de los datos que hacen referencia a la causa de mortalidad ni el motivo de discontinuación del tratamiento. Debido a esto, en este estudio solo tenemos en cuenta la mortalidad global, pero existe un riesgo de sesgo en que la mortalidad antes de los 5 años no sea consecuencia del abandono de la terapia. Se necesitan estudios adicionales para comprobar que la diferencia observada en la mortalidad no es debida a un sesgo en las poblaciones estudiadas (entre aquellas pacientes que completaron 5 años vs. las que no, y entre usuarias y no usuarias de BF). Sin embargo, nuestro estudio corrobora los resultados observados en los estudios previos.
En conclusión, se ha observado una persistencia a los IA del 87% a 5 años en la práctica clínica habitual, la cual mejora con el uso de BF. Por otro lado, completar 5 años de terapia con IA y el uso de BF estarían asociadas a una disminución de la mortalidad.











 texto en
texto en 


