INTRODUCCIÓN
La hipofosfatasia (HPP) es una enfermedad metabólica rara caracterizada por una baja actividad enzimática de la fosfatasa alcalina no específica de tejido (FANET), que provoca un acúmulo de sus sustratos naturales: pirofosfosfato inorgánico (PPi), piridoxal-5'-fosfato (PLP) y fosfoetanolamina (PEA)1. El PPi, actúa como potente inhibidor de la formación de los cristales de hidroxiapatita y sus niveles extracelulares elevados pueden inducir alteraciones esqueléticas, como la disminución de la mineralización ósea2,3. En general, las formas más severas se asocian con síntomas y diagnóstico más tempranos, incluso perinatales, mientras que las formas más leves a menudo se presentan más tarde en la infancia o en la edad adulta4. La importancia de un diagnóstico precoz reside en la potencial gravedad de la enfermedad y la alteración de la calidad de vida, así como en la posible iatrogenia derivada de un diagnóstico y tratamiento erróneos5. Estudios previos han analizado la sintomatología que caracteriza a la HPP del adulto, que habitualmente muestra un rango amplio de manifestaciones clínicas, a veces inespecíficas, como son la presencia de dolor musculoesquelético, debilidad, patología dental o pérdida precoz de piezas dentales, y la presencia de fracturas recurrentes por estrés y pseudofracturas6,7. En una cohorte de edad pediátrica, el análisis de la densidad mineral ósea (DMO) en estos pacientes ha detectado valores bajos en los casos más graves8. Sin embargo, la escasa evidencia disponible en adultos con HPP, ha mostrado una DMO normal o discretamente disminuida7,9-12, de lo que se deduce que la densitometría ósea pudiera no predecir adecuadamente el riesgo de fractura7. Por ello, el objetivo de este estudio consiste en evaluar la DMO en fémur proximal (FP) y realizar un análisis volumétrico del hueso cortical y trabecular de dicha región, así como el grosor cortical mediante 3D-Shaper en sujetos con HPP, y comparar dichos parámetros entre los sujetos con y sin antecedentes de fracturas.
MATERIAL Y MÉTODOS
Población de estudio y diseño
En primer lugar, se realizó una búsqueda en la base de datos bioquímica de nuestro hospital terciario y ambulatorios asociados en la que se localizaron 383.353 pacientes con determinaciones de fosfatasa alcalina (FA), de los cuales 231.805 fueron adultos con al menos dos mediciones. De ellos, 427 mostraron hipofosfatasemia persistente (≥2 determinaciones menores o iguales a 35 UI/L y ninguna superior a 45 UI/L; rango normalidad: 46-116 UI/L). Posteriormente, se revisaron sus historias clínicas, y se excluyó a 31 sujetos por causas secundarias subyacentes de hipofosfatasemia13 y a 13 ante la imposibilidad de contacto telefónico. Un total de 383 sujetos cumplieron los criterios de selección y fueron contactados, de los cuales 85 firmaron el consentimiento informado para la realización de un test genético para detectar variantes en el gen ALPL. Se detectó a 39 (46%) pacientes con mutaciones patogénicas o probablemente patogénicas y se les ofreció realizar seguimiento en nuestras consultas.
En este trabajo se presenta el análisis transversal de los datos basales densitométricos y de arquitectura ósea de 33 adultos incluidos posteriormente en un estudio longitudinal observacional prospectivo realizado en el Hospital La Paz (Madrid). Los detalles relacionados con el proceso de reclutamiento se han reportado en una publicación previa de nuestro grupo14. El estudio ha sido aprobado por el Comité Ético y de Investigación del Hospital La Paz. Se ha obtenido el consentimiento informado de los pacientes.
MÉTODOS
Se recogieron mediante cuestionario protocolizado y se analizaron factores de riesgo de osteoporosis, incluyendo hábito tabáquico, ingesta enólica (≥30 g/día), exposición solar (≥10 minutos/día), práctica de ejercicio, ingesta dietética de calcio por lácteos (1 ración = 1 vaso de leche = 2 yogures = 1 porción de queso (40-50 mg) = 200 mg/calcio), antecedentes personales de fractura y su etiología, así como antecedentes familiares de fractura de cadera.
Se realizó un estudio densitométrico (Lunar Prodigy, General Electric Medical Systems iDXA) en cada uno de los sujetos para el análisis de la DMO en FP (cuello, trocánter, cadera total y diáfisis femoral). Se ha definido la presencia de osteoporosis de acuerdo con los criterios de la OMS15. Por otro lado, se ha empleado el software 3D-Shaper (versión 2,7.Galgo Medical) para evaluar la densidad volumétrica del hueso cortical y trabecular del FP. El software utiliza un modelo estadístico 3D del FP y lo ajusta sobre la imagen densitométrica, para conseguir un modelo personalizado en 3D de la forma y la distribución de la DMO del hueso. Las medidas proporcionadas por el software incluyen la densidad mineral ósea volumétrica (DMOv) de los compartimentos cortical, trabecular e integral, la densidad mineral ósea superficial (DMOs) cortical y el grosor cortical. Información adicional sobre la metodología implementada en el software y su validación se puede encontrar en trabajos previos16.
Análisis estadístico
Para la descripción de la muestra, se ha calculado la media y desviación estándar (DE) o mediana y rango intercuartil (RIQ) para las variables cuantitativas, así como el número absoluto y los porcentajes relativos para las variables cualitativas en cada grupo. Las comparaciones entre grupos se han realizado mediante el test estadístico U-Mann-Whitney. Todos los análisis se han realizado utilizando el paquete estadístico SPSS versión 23.0 para Windows.
RESULTADOS
Datos demográficos, clínicos, densitométricos y de 3D-Shaper de sujetos con HPP
Se incluyeron 33 adultos con HPP de los cuales todos presentaron variantes patogénicas o probablemente patogénicas en heterocigosis. Un 63,6% de los pacientes (21/33) fueron mujeres (42,9% postmenopáusicas), y 8/12 de los varones fueron mayores de 50 años (66,6%). La media de edad fue de 50,56±15,08 años; del IMC, 26,31±4,39 kg/m2, y la media de la fosfatasa alcalina, 25,2±6,53 UI/L. Un 12,1% (4/33) presentaron historia familiar de fractura de cadera. El número total de fracturas fue de 16: el 30,3% (10/33) presentaron antecedentes personales de fracturas de etiología traumática (3 en metatarsianos, 4 en huesos de la mano, 2 en el codo y una en clavícula) y el 15,2% (5/33), fracturas previas de estrés (tres pacientes en un metatarsiano, una paciente en dos metatarsianos y otra paciente, fractura atípica en diáfisis femoral que cumple criterios de la American Society for Bone and Mineral Research (ASBMR)17, sin exposición previa a difosfonatos. Ningún paciente presentó fracturas por fragilidad. Las características demográficas y el resto de factores de riesgo de osteoporosis se describen en la tabla 1. La prevalencia de osteoporosis en cuello femoral fue del 11,8% (2/17), y se detectó osteopenia en un 82,4% (14/17) de pacientes. En mujeres premenopáusicas y varones menores de 50 años, se observó baja masa ósea para el rango etario en 12,5% (2/16) de pacientes. El resto no mostraron alteraciones en el estudio densitométrico de cuello femoral (CF). La media de DMO en cuello femoral de los pacientes con osteoporosis fue de 0,73±0,01 y del T-score de -2,65±0,7. En los pacientes con osteopenia, la media de DMO en dicha región fue de 0,86±0,05 g/cm2 y de T-score, -1,3±0,43. En los sujetos con baja masa ósea para su rango etario, la media de DMO fue de 0,67±0,07 g/cm2 y de Z-score, de -2,4±0,6.
Tabla 1. Características demográficas y factores de riesgo de osteoporosis de los pacientes con HPP

Los datos cuantitativos están expresados como mediana (rango intercuartil, RIQ) y media ± desviación estándar (DE). Los cualitativos como números absolutos y porcentajes. p<0,05 se considera significativo. TG+: pacientes con hipofosfatasemia persistente y test genético positivo que confirma hipofosfatasia; IMC: índice de masa corporal; AP: antecedentes personales; FA: fosfatasa alcalina; PTH: hormona paratiroidea; vit. D: vitamina D; RN: rango normalidad.
En relación con las fracturas de estrés, dos pacientes en postmenopausia cursaron con sendas fracturas de diáfisis femoral y de metatarso, y ambas presentaron densitometría ósea en rango de osteopenia, mientras que las tres pacientes premenopáusicas con fracturas de metatarsianos tuvieron una densitometría normal. Entre los pacientes con fractura traumática, cinco fueron varones (cuatro con edad >50 años). Uno de ellos sufrió una fractura de codo traumática y presentó osteoporosis en CF, mientras que los otros tres cursaron con sendas fracturas en metatarsiano, codo y escafoides, y presentaron osteopenia. El paciente menor de 50 años tuvo una fractura traumática en un metacarpiano y densitometría ósea normal.
La mediana de DMO a nivel de CF fue de 0,876 (0,830,92) g/cm2; a nivel de la diáfisis femoral, de 1,123 (1,031,21) g/cm2; en región trocantérea de 0,759 (0,693-0,82) g/cm2, y de 0,931 (0,89-1) g/cm2 en cadera total. El valor de Z-score a nivel de CF fue de -0,29 (-1,13-0,25) y en cadera total, de -0,06 (-0,79-0,39). En el análisis 3D-Shaper, se objetivó una DMOv cortical total de 813,45 (759,12862,26) mg/cm3, DMOv trabecular de 155,77 (136,73180,08) mg/cm3, una DMOs cortical total de 157,55 (144,8-166,94) mg/cm2 y una DMOv integral total de 309,29 (280,3-324,62) mg/cm3. El grosor cortical (mm) fue de 1,89 (1,85-2,01). La tabla 2 incluye los datos densitométricos y parámetros de 3D-Shaper de los pacientes con HPP.
Tabla 2. Datos de densitometría y 3D-Shaper en pacientes con HPP
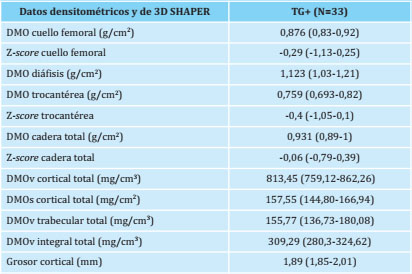
Los datos están expresados como mediana (rango intercuartil, RIQ). TG+: pacientes con hipofosfatasemia persistente y test genético positivo que confirma hipofosfatasia; DMO: densidad mineral ósea; DMOv: densidad mineral ósea volumétrica; DMOs: densidad mineral ósea superficial; p<0,05 se considera estadísticamente significativo.
Datos demográficos, clínicos, densitométricos y de 3D-Shaper de sujetos con HPP con fractura versus sin fractura
En primer lugar, se realizó la comparación de datos demográficos, clínicos, densitométricos y de 3D-Shaper de los cinco sujetos con HPP que presentaron fracturas de estrés frente a los 28 que no las mostraron. Los pacientes con fracturas de estrés fueron mujeres, un 40% postmenopáusicas, con una media de edad de 46,35±10,1 años, mientras que en el grupo de pacientes sin ellas, un 57,14% fueron mujeres (25% postmenopáusicas) con una media de edad de 51,31±15,82 años (p=0,48). Se observaron diferencias en la prevalencia de mujeres, mayor en el primer grupo (p=0,07) y en el IMC, inferior en las pacientes con fracturas de estrés (23,5±2,44 kg/cm2) frente al otro grupo (26,81±4,5 kg/cm2; p=0,07). No hubo diferencias en el resto de factores de riesgo de osteoporosis. Si bien no se observaron diferencias en parámetros de DMO en FP, en el análisis mediante 3D-Shaper se evidenció una diferencia estadísticamente significativa en el grosor cortical (mm), que fue menor en aquellos pacientes con fracturas de estrés [1,8 (1,77-1,89)] frente a los no fracturados [1,94 (1,87-2,03); p=0,03)].
En segundo lugar, se comparó a los 9 pacientes con antecedente de fractura traumática frente a los 19 sin antecedente fracturario, y no se objetivaron diferencias densitométricas ni en parámetros de 3D-Shaper (p>0,05). En tercer lugar, en la comparación entre sujetos con fracturas de estrés y los que presentaron fracturas de etiología traumática, se observó una disminución del grosor cortical (mm), inferior en los pacientes del primer grupo [1,8 (1,77-1,89)] frente al segundo [1,97 (1,88-2,03), p=0,03]. No se observaron diferencias en el resto de parámetros densitométricos ni de DXA-3D.
Desde el punto de vista bioquímico, no hubo diferencias significativas en los niveles de fosfatasa alcalina, PTH y vitamina D entre grupos (p>0,05). La tabla 3 muestra la comparativa intergrupal de los datos demográficos, clínicos, densitométricos y de 3D-Shaper, y la figura 1, los niveles de FA estratificados por grupos.
Tabla 3. Datos demográficos, clínicos, densitométricos y de 3D-Shaper de sujetos con versus sin fractura

Los datos cuantitativos están expresados como media y desviación estándar (DE) y mediana, rango intercuartil (RIQ) y los cualitativos como frecuencias y porcentajes. IMC: índice de masa corporal; AF: antecedentes familiares; FA: fosfatasa alcalina; PTH: hormona paratiroidea; vit. D: vitamina D; DMO: densidad mineral ósea; DMOv: densidad mineral ósea volumétrica; DMOs: densidad mineral ósea superficial; p<0,05 se considera estadísticamente significativo.
DISCUSIÓN
En este trabajo se realizó un análisis descriptivo de las características densitométricas de adultos con HPP y de los parámetros de arquitectura ósea mediante 3D-Shaper, técnica aún poco explorada en estos pacientes, así como una comparativa de dichos parámetros entre los pacientes con y sin antecedentes de fracturas.
En nuestro estudio hemos observado que las alteraciones densitométricas no fueron especialmente relevantes en cuanto a prevalencia de osteoporosis. La repercusión se ha traducido en estos pacientes en cambios más moderados, con una alta prevalencia de osteopenia, más acusada en mujeres postmenopáusicas y varones mayores de 50 años. La discreta disminución de DMO observada en este trabajo parece estar acorde con los resultados encontrados en la literatura existente sobre adultos con HPP, en los que la mayoría de pacientes presentaron parámetros normales o una disminución leve de los valores de Z-score, hallazgos que parecen responder a formas más leves del adulto5,7,9.
Trabajos previos7 no han encontrado diferencias de DMO en sujetos diagnosticados de HPP con y sin fracturas, sugiriendo que esta prueba pudiera no traducir adecuadamente el riesgo de presentarlas. Tampoco en nuestro estudio hemos encontrado diferencias significativas en el análisis densitométrico entre individuos con HPP con y sin antecedentes de fracturas de estrés. Sin embargo, la técnica 3D-Shaper muestra a nivel de FP una disminución estadísticamente significativa del grosor cortical (mm) en los pacientes con fracturas de estrés [1,8 (1,77-1,89)] frente a aquellos sin este antecedente [1,94 (1,87-2,03, p=0,03)] y en comparación con los que presentaron fracturas traumáticas [1,97 (1,88-2,04), p=0,03] que no parece explicarse por un menor nivel de fosfatasa alcalina.
En esta misma patología, aplicando tomografía computarizada cuantitativa periférica de alta resolución (HRpQCT) en tibia distal izquierda y radio distal derecho, Schmidt et al. evidenciaron también una disminución de grosor cortical en pacientes con HPP con fracturas frente a los no fracturados7. Asimismo, otro trabajo ha destacado la presencia de una disminución del grosor cortical en las radiografías de algunos pacientes adultos con HPP18.
Si bien no hemos encontrado evidencia de otros estudios que analicen parámetros de 3D-Shaper en HPP, otras publicaciones han evaluado esta tecnología en pacientes con distintas patologías metabólicas óseas. Gracia-Marco et al.19, han objetivado en sujetos con hiperparatiroidismo primario diferencias en el grosor cortical, inferior en pacientes con esta enfermedad frente a controles sanos (1,85±0,14 mm vs. 1,93±0,17 mm; p=0,023). Estos resultados apuntan a que los estudios de arquitectura ósea pudieran resultar de especial interés en el campo de otras patologías que cursan con alto remodelado óseo. Sin embargo, Humbert et al.20, observaron una disminución no significativa del grosor cortical en pacientes postmenopáusicas con fractura de cadera frente a los controles (1,746±0,127 mm vs. 1,783±0,123 mm; p=0,1). En nuestro estudio los pacientes con HPP y fractura traumática tampoco mostraron una disminución del grosor cortical respecto a los que no se fracturan.
Las fracturas de estrés fueron descritas originalmente en reclutas militares y consideradas “fracturas por fatiga” consecuencia de mínimos o pequeños impactos mecánicos de manera repetida y prolongada sobre un hueso con resistencia elástica normal. Un subtipo de fracturas de estrés son las fracturas por insuficiencia producidas por una carga normal sobre un hueso con resistencia alterada, descritas en pacientes con deficiencia de vitamina D (líneas de Looser-Milkman, características de la osteomalacia)21,22. Una elevada prevalencia de fracturas por insuficiencia o pseudofracturas se ha descrito también en pacientes con HPP1, pero no sabemos con exactitud qué pacientes las van a desarrollar. En cuanto a su localización, son características las fracturas recurrentes de metatarso y las fracturas y pseudofracturas femorales, que son las encontradas en nuestros pacientes.
Con probable patogenia multifactorial, las fracturas de estrés podrían reflejar alteraciones en la DMO y en la calidad ósea23. En nuestro estudio no encontramos diferencias en la DMO a nivel de FP de los pacientes que presentaron fracturas de estrés frente a los que no las presentaron, coincidiendo con lo publicado recientemente por otros autores11. La disminución del grosor cortical objetivada en nuestros pacientes con fracturas de estrés reforzaría la existencia de una alteración cualitativa ósea. López Delgado et al.12 describen un bajo remodelado óseo en pacientes con hipofosfatasemia persistente, aunque esto no parece traducirse en diferencias en la DMO o en el trabecular bone score (TBS) cuando lo comparan con un grupo control. Nuestros pacientes con fracturas de estrés no mostraron diferencias en el nivel de disminución de fosfatasa alcalina respecto a los que no se fracturan, por lo que no parece poder explicarse la presencia de fracturas por una mayor severidad del defecto enzimático.
Como limitaciones de nuestro estudio, cabe mencionar que la mayoría de los sujetos incluidos presentan mutaciones en heterocigosis que condicionan formas más leves de la enfermedad y, desde el punto de vista densitométrico, que, hasta el momento, no disponemos de los valores poblacionales de referencia para las medidas 3D-Shaper ni se han comparado con un grupo control, hecho que puede limitar la interpretación de los resultados. Como fortalezas, sin embargo, cabe destacar el número significativo de pacientes, tratándose de una enfermedad rara y estudiados mediante una técnica novedosa.
Estos datos parecen reflejar una discreta repercusión a nivel densitométrico en las formas más leves del adulto. Se ha identificado una disminución del grosor cortical en pacientes con HPP con fracturas de estrés. Estudios de arquitectura ósea en FP pudieran resultar de interés para determinar sujetos con HPP susceptibles de presentar este tipo de fracturas.











 text in
text in 



