INTRODUCCIÓN
La vitamina D es un micronutriente esencial en el metabolismo óseo y no óseo1. La elevada prevalencia de su déficit ha sido documentada en múltiples estudios2-5. Sin embargo, la definición de sus valores de referencia continúa siendo controvertida y en consecuencia se generan dudas acerca de su diagnóstico y tratamiento6. Aunque a mediados del siglo XX se daba por erradicado el raquitismo con la exposición solar y el enriquecimiento de la leche con vitamina D, en los últimos años hay informes sobre raquitismo en distintos puntos del planeta siendo los afectados principalmente bebés de piel negra y amamantados exclusivamente7-9. Si bien el raquitismo es la consecuencia más grave de deficiencia de la vitamina D, la mera insuficiencia también tiene consecuencias importantes para la salud6.
Los estudios que miden el nivel de vitamina D presentan una gran variabilidad geográfica por las grandes diferencias regionales en clima, exposición solar y dieta. Por ello se plantea la necesidad de investigar específicamente en cada país el papel de los diferentes determinantes de la hipovitaminosis D10. La dieta satisface solamente el 10% de los requerimientos de vitamina D del organismo humano, siendo el 90% restante obtenido mediante el proceso de fotosíntesis que ocurre en la piel por la acción directa de los rayos solares11. Los factores de riesgo identificados repetidamente en la literatura como causas de la hipovitaminosis (fototipo de piel oscura, baja exposición al sol, falta de ejercicio físico, latitud >40º norte y las estaciones de invierno y primavera) actúan interfiriendo en el segundo mecanismo2,12. Otros factores asociados a hipovitaminosis como el déficit materno, la obesidad o la edad avanzada podrían relacionarse con ambos mecanismos de obtención de vitamina D12-14.
En España hay numerosos trabajos que miden la prevalencia de la hipovitaminosis D en población infantil 2-4,15,16. Sin embargo, la mayoría de ellos se centran en el estudio de los factores de riesgo relacionados con la exposición al sol. El trabajo de Rodríguez-Sangrador et al. incluye la medición en la dieta de la ingesta de vitamina D16. Recientemente se describía el debate sobre la necesidad de suplementar con vitamina D como un puzle en el que las piezas empiezan a encajar y se recomendaba dar vitamina D en adultos a aquellos que lo necesiten para mantener niveles séricos de 25(OH)D por encima de 20 ng/ml17,18. Aclarar si los escolares con hipovitaminosis D tienen un déficit de ingesta en la dieta ayudaría a encajar esta pieza para suplementar también a la población infantil. Para ello se requiere abordar conjuntamente tanto los factores asociados con la exposición y síntesis como con la ingesta de vitamina D.
El objetivo del estudio fue analizar el impacto de la dieta en la prevalencia de hipovitaminosis D en población infantil sana de la comarca del Goierri-Alto Urola para proporcionar recomendaciones de prevención de la hipovitaminosis D en la población escolar.
MÉTODOS
Se utilizó un diseño observacional transversal, con muestreo por conglomerados durante un año natural (1 de septiembre del 2012 al 30 de septiembre del 2013). El estudio se realizó con la financiación de una Beca de Investigación del Departamento de Sanidad del Gobierno Vasco (Proyecto Nº 2011111107) y fue aprobado por el Comité Ético de Gipuzkoa. Los niños participaron tras la firma por sus padres del consentimiento informado. La población de referencia fue la atendida por la Organización Sanitaria Integrada (OSI) Goierri-Alto Urola en Gipuzkoa y la muestra fue reclutada entre niñas, niños y adolescentes de entre 4 y 14 años, que asistían a los Servicios de Atención Primaria, siendo sus principales poblaciones Beasain, con latitud 43,05 N, y Zumárraga, con latitud 43,11 N. Durante el periodo de estudio tuvieron una irradiación solar media de 10,4-11,8 MJ/m2 (Euskalmet, Agencia vasca de Meteorología)19. Se estimó que una muestra de 298 escolares sería suficiente para conseguir una precisión del 4% en un universo de 891, con un 95% de significación, unas pérdidas del 10% y una prevalencia estimada del 20%. Los escolares se reclutaron de forma sucesiva coincidiendo con las revisiones llevadas a cabo por los pediatras de Atención Primaria a niños sanos hasta completar la muestra prevista en cada mes para poder recoger mediciones a lo largo de todo el año. Los criterios de exclusión del estudio fueron: falta del consentimiento informado, síndrome nefrótico, insuficiencia renal crónica, enfermos oncológicos, uso prolongado de ketoconazol o anticonvulsivos (fenobarbital-fenitoina), tratamiento para la tuberculosis y lesión hepática grave.
Las variables recogidas fueron: edad, sexo, etnia (caucásica y no caucásica), peso, talla, IMC, fototipo de piel con la escala de Fitzpatrick (1: menor pigmentación a 6: máxima pigmentación)20, actividad deportiva en el último mes (en tres categorías: menor tiempo que deporte escolar, únicamente deporte escolar y dos días más que deporte escolar), tiempo de exposición solar en el último mes (nada, menor de 30 minutos diarios, mayor de 30 minutos diarios, mayor de 1 hora diaria), uso de protector solar y suplementos vitamínicos en los últimos 3 meses. Se analizó analíticamente el metabolismo fosfocálcico (calcio, fósforo, magnesio, fosfatasa alcalina, hormona paratiroidea (PTH) y 25(OH) D).
Se realizó una encuesta individual sobre la alimentación mediante encuesta del recordatorio de 24 horas (ER24hs). Tras la realización de la analítica el pediatra de Atención Primaria que reclutó al escolar se encargaba de revisar y re-entrevistar a los padres sobre el cuestionario estandarizado y auto-cumplimentado con los alimentos ingeridos en las últimas 24 horas. Para la conversión de los alimentos en nutrientes se utilizó el programa DietSource 3.0 que dispone de una tabla de composición de alimentos de Nestlé Healthcare Nutrition S. A. (A. Jiménez. P. Cervera y M. Bacardi). Mediante la gestión de los platos y alimentos ingeridos, este programa desglosa el menú diario estimando las cantidades de principios inmediatos, nutrientes y distribución calórica de la dieta de cada niño. Aunque el método aplicado es menos válido que los registros basados en el peso de los alimentos consumidos durante tres o más días, la literatura que los ha comparado avala su uso21,22.
Las determinaciones analíticas del metabolismo fosfocálcico (calcio, fósforo, magnesio, fosfatasa alcalina, PTH, 25(OH) D) se realizaron en el laboratorio de la OSI Goierri-Alto Urola. Para la medida del nivel de 25(OH) D en suero se utilizó el kit comercial "Elecsys-Inmunoanalisis quimioluminiscente". Se utilizó el punto de corte de 20 ng/ml para determinar los niveles de vitamina D que se consideran deficientes y 10 ng/ml para los casos con déficit grave. Los resultados, se presentaron en función de que los valores se encontrasen dentro de los rangos normales de referencia que fueron de 10-65 pg/ml para la PTH, de 8,8-10,8 mg/dl para el calcio, de 3,0-6,5 mg/dl para el fósforo, de 1,5-2,6 mg/dl para el magnesio y para la fosfatasa alcalina <269 UI/L de 4 a 6 años y <300 UI/L de 7 a 12 años.
Análisis estadístico
El análisis univariante se realizó mediante el estadístico Chi-cuadrado o el estadístico exacto de Fisher para las variables categóricas y se aplicó el t-test de Student o el test no paramétrico U de Mann-Whitney en el caso de las variables continuas en función de su distribución. El nivel de significación utilizado a lo largo de todo el estudio fue del 5% y los análisis se realizaron con el software estadístico Stata versión 13.0. Los análisis multivariantes se llevaron a cabo mediante modelos de regresión logística en los que la variable dependiente fue la probabilidad de tener hipovitaminosis y las variables independientes los factores de riesgo asociados a la exposición y la ingesta de vitamina D. Las variables a incluir en el modelo se seleccionaron en función del interés clínico y del nivel de significación en el análisis univariante. La bondad de ajuste de los modelos se evaluó mediante el porcentaje bien clasificado, el área bajo la curva ROC y la prueba de Hosmer y Lemeshow.
RESULTADOS
Se reclutaron para el estudio 281 escolares (140 niños y 141 niñas). La prevalencia global de hipovitaminosis D en esta población, entendiendo la misma como valores séricos de 25(OH) D inferiores a 20 ng/ml, fue de un 18,1%. Los casos de déficit grave (25(OH) D <10ng/ml) representaron el 1,4%.
La tabla 1 muestra la distribución de los datos demográficos y otros factores de riesgo previamente conocidos en la muestra clasificando los escolares según el nivel de vitamina D mayor o menor (hipovitaminosis) de 20 ng/ml. Se observaron asociaciones estadísticamente significativas para la estación del año, la etnia, el fototipo de piel, el tiempo de exposición al sol y la edad del niño. El nivel medio de vitamina D en los escolares de etnia caucásica fue de 29,83 ± 9,45 ng/ml, mientras que entre los no caucásicos fue de 19,25 ± 9,71 ng/ml. En correspondencia, solo el 14,5% de los caucásicos se encontraba en el grupo con déficit de vitamina D, frente al 53,8% de los no caucásicos, siendo la diferencia en la distribución por grupos también significativa (p<0,001). En la figura 1 se muestra la frecuencia de los porcentajes de los niveles de vitamina D entre los niños de origen caucásico y aquellos de origen no caucásico. Las distribuciones que resultan son claramente distintas. Las analíticas estuvieron dentro de los rangos normales en todos los casos excepto la PTH que en 5 casos estuvo por encima del punto de corte de 65 pg/ml.
En la tabla 2 se muestra la comparación de las medias para cada uno de los micronutrientes de la dieta en las submuestras con niveles mayores o menores de 20 ng/ml en vitamina D medido en suero. Se observaron diferencias estadísticamente significativas en piridoxina B6, ácidos grasos saturados y monoinsaturados. La media de mg ingeridos de vitamina D no resultó estadísticamente significativa a pesar de que los individuos con hipovitaminosis reportaban una ingesta de vitamina D 40% menor.
Tabla 2. Contenido de nutrientes de la ingesta de 24 horas

DE: desviación estándar; g: gramos; AG: ácidos grasos; EPA: ácido icosapentaenoico; DHA: ácido docosahexaenoico; MCT: triglicéridos de cadena media.
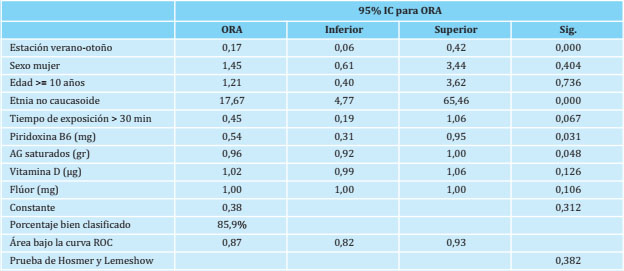
Los resultados de la regresión logística ajustados por la estación, el sexo, la edad (mayor o menor de 10 años), la etnia y el tiempo de exposición al sol muestran un efecto estadísticamente significativo de la piridoxina B6 y los ácidos grasos saturados (tabla 3). El aumento de la ingesta de piridoxina B6 en un miligramo disminuye 1,85 veces la posibilidad de presentar déficit de vitamina D en nuestra muestra. Del mismo modo, la ingesta de 1 gramo más de ácidos grasos saturados la posibilidad disminuye 1,04 veces.
DISCUSIÓN
La principal aportación de nuestro trabajo es que la dieta juega un papel reducido como factor de riesgo de hipovitaminosis D en población infantil sana. Por el contrario, y de acuerdo con la literatura2,3,5,23, los factores relacionados con la exposición al sol son los determinantes de la presencia de niveles insuficientes de vitamina D. Desde el punto de vista clínico tiene dos consecuencias. La primera es que una alimentación correcta no debe ser motivo para no valorar el posible riesgo de hipovitaminosis en un escolar. En segundo lugar, destaca que los factores de riesgo conocidos como la etnia no caucásica y las estaciones con menor exposición solar siguen siendo factores que determinan una valoración de la vitamina D en los escolares. Hay que destacar como fortalezas de nuestro estudio el tamaño de la muestra, su representatividad de población sana y la obtención de las determinaciones de la 25(OH) D a lo largo de todo un año. Una limitación de nuestro trabajo es el tipo de encuesta nutricional utilizada ya que la dieta con una ER24hs en un solo momento es un método con precisión limitada. Además, ER24hs necesita de una memoria reciente adecuada, no está recomendada para menores de 12 años y en estos casos se registró lo aportado por los padres.
Sin embargo, el trabajo de Rodríguez Sangrador et al. que realiza una encuesta sobre frecuencia de consumo de alimentos en 2 meses al año y mide el nivel de vitamina D pero lo hace en una población de solamente 47 adolescentes16.La dificultad de aplicar métodos basados en el peso de los alimentos consumidos durante varios días es la causa del escaso número de trabajos publicados. En el caso de ER24hs tuvimos unos encuestadores capacitados, pero reconocemos la debilidad de este tipo de encuesta en relación a la memoria reciente y a la baja estimación de los aportes nutritivos y de energía de una persona. A pesar de sus limitaciones, la literatura que ha comparado los métodos de medida de la ingesta de nutrientes indica que la ER24hs aporta información válida, aunque menos precisa21,22.
En el análisis de los diferentes micronutrientes de la dieta solamente aparecieron asociaciones estadísticamente significativas con la hipovitaminosis D para la piridoxina B6 y los ácidos grasos saturados tanto en el análisis univariante como en el multivariante sin que tengamos una explicación fisiopatológica para este hallazgo. Entre los micronutrientes las frecuencias de ingestas de magnesio, calcio y potasio fueron deficientes con respecto a las recomendaciones para cada sexo y edad. En cuanto a las vitaminas, lo mismo ocurrió con el ácido fólico y las vitaminas C, A, D y E. La Encuesta Nutricional del País Vasco del 2005 mostró unos hábitos nutricionales similares a los nuestros24.
Nuestros resultados indican que las hipovitaminosis D se asocian con los mismos factores que en la literatura25,26. El porcentaje con deficiencia grave (<10 ng/ml de 25(OH) D) fue pequeño (1,4%), como corresponde a una población sana. Utilizando como punto de corte 20 ng/ml, la deficiencia alcanzó el 18,15% de prevalencia. Según el Instituto Americano de Medicina (EE.UU.), el nivel de 20 ng/ml cubre las necesidades relacionadas con el metabolismo fosfocálcico del 97% de la población25. Sin embargo, con un punto de corte de ≤30 ng/ml, como lo establecen otros estudios6 el nivel de hipovitaminosis D alcanzaría un 56,3%. La hipovitaminosis D se centró en los grupos de riesgo como la población no caucásica en la que fue mayor del 50%. De hecho, un caso de raquitismo en un niño no caucásico, pakistaní, fue el desencadenante de este estudio. También fueron relevantes otras variables como la estacionalidad y el peso3,5,23. Por ello, el estilo de vida al aire libre, la exposición solar libre de protectores solares y los patrones dietéticos que aseguren una ingesta correcta de vitamina D y calcio siguen siendo las recomendaciones a seguir por la población general. Es importante resaltar que la población estudiada era sana y que solamente en 5 escolares se encontraron niveles elevados de PTH (>65 pg/ml). En ningún caso hubo manifestaciones clínicas ni se encontraron alteraciones en los niveles de calcio, fósforo y magnesio. A los cinco niños se le realizó una valoración clínica posterior y una analítica del metabolismo fosfocálcico (fosfatasa alcalina, calcio, fósforo, magnesio, PTH y vitamina D) siendo la exploración y la analítica normales. Por ello se consideró que las alteraciones en los niveles de la PTH correspondieron más a variaciones fisiológicas de adaptación que a una respuesta al déficit de vitamina26. La exposición al sol de más de 30 minutos fue estadísticamente significativa en el análisis univariante, pero esa relación desapareció en el análisis multivariante con un nivel de significación del 5% ya que la p fue de 0,67. Esta "anomalía" puede deberse al tamaño muestral ya que, aunque el Odds Ratio ajustado fue de 0,45, su intervalo de confianza superior sobrepasó la unidad.
De acuerdo con nuestros resultados, no deben realizarse cribados poblacionales de deficiencia de vitamina D y debe limitarse exclusivamente a los grupos de riesgo el hecho de suplementar con la misma6,27. Los criterios para realizar una determinación analítica de 25(OH) D y suplementar, según sus resultados, han sido descritos por los comités de expertos28-30. Sin embargo, estas indicaciones varían entre las diferentes sociedades científicas. Así la Asociación Americana de Pediatría (AAP)30 y la Asociación Europea de Pediatría (EAP)29reservan esa indicación para grupos de riesgo. Un estudio de Saggese et al.28 en un consenso global en Italia propone suplementar con vitamina D a los niños y adolescentes que presenten los siguientes factores de riesgo de deficiencia de vitamina D: etnia no caucásica con pigmentación de piel oscura, exposición reducida a la luz solar (debido a factores de estilo de vida, enfermedad crónica u hospitalización, institucionalización, discapacidad compleja, cubrir con ropas por motivos religiosos o culturales) o por uso constantes de protectores solares, adopción internacional, obesidad, enfermedades crónicas (renal, hepática, síndromes de malabsorción, terapias crónicas (anticonvulsivos-antiretrovirales-glucocorticoides-antifúngicos sistémicos). En todas estas situaciones es necesaria monitorizar al menos una vez al año el estado de la vitamina D.
Las necesidades de vitamina D se cubren en un 90% con la exposición solar y el 10% restante se consigue a través de la dieta, por lo que ambos factores deberían estar específicamente valorados en los programas de Atención Primaria de la población infantil y adolescente tanto para su prevención, diagnóstico y tratamiento. En la actualidad la mejor opción de aumentar el aporte dietético de vitamina D es la fortificación de alimentos. En la Unión Europea los países se dividen en 3 categorías; los de política de fortificación obligatoria (Noruega, Reino Unido), voluntaria (España, Portugal) o que no existe fortificación. En España tienen excepción algunos productos utilizados durante un tiempo prolongado como única fuente de nutrientes por algunos grupos de población (fórmulas infantiles de inicio, continuación y cereales - productos de nutrición enteral y parenteral de uso hospitalario y las dietas de bajo valor energético para reducción de peso, cuya fortificación es obligatoria para todos los Estados miembros de la Unión Europea)31. En nuestro país existe una tendencia a fortificar la leche desnatada y semidesnatada hasta alcanzar el nivel de vitamina D de la leche entera que se pierde con el proceso del desnatado. Además, hay otros productos en el mercado que también son fortificados, como galletas, yogurt, margarinas, queso, cereales de desayuno, zumos y bebidas32.
Los niños requieren menos exposición a la luz solar que los adultos para producir cantidades suficientes de vitamina D, tanto por su mayor proporción de superficie corporal respecto a volumen como por la mayor capacidad de su metabolismo para producir vitamina D33. En relación a la exposición solar se conoce que la dosis de radiación UV efectiva para producir 1000 UI de vitamina D, que garantiza niveles suficientes de ella en sangre, se consigue con 25% de la dosis eritromatógena mínima (MED), que equivale a 10-15 minutos en un 25% de la superficie corporal (cara, brazos, manos), sin protector solar y en las horas centrales del día, de 10 a 15 horas34.
La alimentación variada, equilibrada y adaptada a las necesidades de las distintas etapas de su evolución es clave para un adecuado crecimiento físico y psicológico, para prevenir enfermedades y para obtener un óptimo estado de salud. Su vigilancia hace poco probable, en general, el riesgo de un déficit nutricional a corto y largo plazo. A pesar de ello, no debe ser un motivo para olvidar el riesgo de un déficit de la vitamina D.
Promocionar unos niveles adecuados de vitamina D en los escolares y adolescentes es importante porque el raquitismo nutricional puede desarrollarse durante toda la edad pediátrica y porque su deficiencia afecta negativamente la salud ósea35. La comparación de los numerosos estudios que valoran suplementar con vitamina D es muy compleja dada la heterogeneidad en la administración de vitamina D (intervalo, dosis, duración) y la población reclutada (sexo, edad, etnia, IMC, latitud del país de residencia, estación del año, estado basal de la vitamina D). En nuestra comarca, en una latitud poco favorable, hay poca síntesis de vitamina D al final del otoño, durante los meses de invierno y principios de la primavera. Durante este período, un nivel adecuado de vitamina D solo se mantiene con las reservas endógenas acumuladas durante el verano anterior o mediante suplementos exógenos. La presencia de hipovitaminosis D debida a factores de riesgo, las dosis a recomendar son entre 600 UI/día (exposición solar reducida) hasta 1000 UI/día (múltiples factores de riesgo de deficiencia de vitamina D). La forma de suplementar es con dosis intermitentes (semanales-mensuales) a partir de los 5-6 años y especialmente durante la adolescencia; las dosis continuas deben reservarse para niños con factores de riesgo permanentes de hipovitaminosis D28.
Este trabajo reconoce resaltar la importancia de la vitamina D durante la etapa pediátrica y el reto que supone una valoración individualizada según edad, estacionalidad, fototipo de piel, adecuado estilo de vida al aire libre, el uso controlado y prudente de los protectores solares y patrones nutritivos que aseguren una correcta ingesta de vitamina D y calcio. El estudio de la vitamina D implica también un esfuerzo para reducir las desigualdades en salud ya que se centra en un grupo social de nivel socioeconómico bajo y asociado a la inmigración. Por ello, el control pediátrico de la hipovitaminosis D en escolares es al mismo tiempo un ejercicio de puesta en marcha de estrategias de salud pública dirigidas a promover la salud infantil.











 texto en
texto en