INTRODUCCIÓN
La vitamina D es una hormona esencial para el metabolismo esquelético, ya que regula la absorción de calcio y fósforo a nivel intestinal y el remodelado óseo1,2. Además, algunos estudios sugieren que la vitamina D desempeña otras múltiples funciones a nivel extraesquelético, actuando como protectora frente a patologías como el cáncer, enfermedades inflamatorias y autoinmunes, diabetes y enfermedades cardiovasculares1-4.
La fuente principal de vitamina D es la síntesis a nivel cutáneo por la acción de los rayos ultravioleta B (UVB) sobre su precursor2, dando lugar al colecalciferol o vitamina D3. Otra fuente de colecalciferol, aunque menos importante, se encuentra en los alimentos, principalmente pescados, huevos y lácteos. Independientemente de su procedencia, el colecalciferol debe ser hidroxilado en el hígado, convirtiéndose en 25-hidroxivitamina D3 [25(OH)D] o calcifediol y, posteriormente de forma altamente regulada, en el riñón para dar lugar al metabolito activo, la 1,25-dihidroxivitamina D3 [1,25(OH)2D] o calcitriol1.
Los niveles séricos de 25(OH)D son el mejor biomarcador para evaluar los niveles de vitamina D, puesto que su concentración plasmática y su vida media son más altas que las de la 1,25(OH)2D2. Sin embargo, no existe un consenso claro sobre cuáles son los niveles óptimos de 25(OH)D en suero3.
Estudios observacionales recientes han revelado una elevada prevalencia de hipovitaminosis D a nivel mundial5, asociada a un riesgo incrementado de enfermedades esqueléticas y extraesqueléticas, en virtud de las múltiples funciones de la vitamina D.
En España, la prevalencia del déficit de vitamina D es de al menos un 80% entre las personas mayores de 65 años y de hasta un 40% en la población menor de 65 años6, a pesar del alto grado de insolación disponible que debería facilitar la síntesis de vitamina D. Así pues, la hipovitaminosis D se ha convertido en una verdadera epidemia con importantes implicaciones para la salud, por lo que gran parte de la población podría beneficiarse de la suplementación de vitamina D.
Con el fin de determinar si el diagnóstico, tratamiento y prevención de la hipovitaminosis D se lleva a cabo según las recomendaciones internacionales y teniendo en cuenta la evidencia científica, se ha analizado la práctica clínica real de la suplementación de vitamina D a partir de los conocimientos de los médicos prescriptores habituales.
MATERIAL Y MÉTODOS
Los datos presentados en este estudio se obtuvieron mediante el método Delphi7. Para ello, el comité científico elaboró un cuestionario que fue cumplimentado por un panel de expertos formado por médicos de diferentes especialidades y áreas geográficas, prescriptores habituales de calcifediol y/o colecalciferol. Tras dos rondas de circulación de la encuesta, el comité científico se reunió para recopilar, analizar y discutir los resultados.
Elaboración del cuestionario
A partir del conocimiento actual de la hipovitaminosis D y de sus consecuencias clínicas, así como de las estrategias terapéuticas y de prevención y de los métodos de diagnóstico, el comité científico multidisciplinar identificó un total de 73 variables relacionadas con la hipovitaminosis D y repartidas en 4 bloques temáticos:
Panel de expertos
El proyecto fue dirigido por un comité científico formado por 10 expertos en vitamina D de diferentes especialidades: endocrinología, reumatología, nefrología, ginecología, medicina interna, atención primaria, dermatología, digestivo y geriatría.
Un total de 180 especialistas fueron invitados a participar en el estudio, atendiendo a los siguientes criterios de inclusión: tener un mínimo de 5 años de experiencia clínica, tener experiencia prescribiendo vitamina D de forma habitual, pertenecer a centros que atienden a una alta densidad de población y, en el caso de atención primaria, pertenecer a centros situados en zonas con alta densidad de población.
Un primer grupo de participantes en el panel (40%) fueron elegidos directamente por los autores del estudio teniendo en cuenta los criterios de inclusión. El 60% restante fue completado con la invitación a expertos, a través de los delegados del patrocinador del estudio, respetando siempre los criterios de inclusión establecidos.
Análisis de resultados
El cuestionario fue formalizado por los asistentes a través de su acceso a una plataforma online. Como en todos los cuestionarios Delphi, la encuesta consistía en una serie aseveraciones en la que debían reflejar su grado de acuerdo con la afirmación propuesta por medio de una escala numérica entre 1 y 9 (≤3, desacuerdo; 4-6, dudoso; ≥7, acuerdo).
El análisis se realizó teniendo en cuenta la mediana de las puntuaciones y el porcentaje de posicionamiento, considerando que había consenso cuando menos de la tercera parte de los encuestados se posicionaba fuera de la región de tres puntos que contenía la mediana. En caso contrario, es decir, cuando los panelistas mostraban opiniones enfrentadas (posicionamiento equivalente en los sectores extremos de la escala) o cuando había una mayor dispersión de opiniones (distribución equivalente del posicionamiento en los tres sectores de la escala), se consideró que no había consenso por polarización o por indeterminación, respectivamente. Los ítems que no alcanzaron el consenso en la primera ronda se mantuvieron en la segunda ronda de circulación de la encuesta, cuyos resultados se analizaron según lo descrito anteriormente.
Para formalizar el cuestionario se les concedió un plazo de 26 días para la primera ronda, y 11 días para la segunda.
Los datos aportados por los participantes estuvieron sujetos a una cláusula de confidencialidad, y solo fueron utilizados con fines estadísticos sin que se produjera difusión de los mismos por ningún medio.
RESULTADOS
En este estudio participaron 146 expertos de los 180 invitados (81%) en la primera ronda de circulación de la encuesta Delphi con la siguiente distribución por especialidades: nefrología 9, reumatología 27, geriatría 10, endocrinología 23, medicina familiar y comunitaria 39, ginecología y obstetricia 9, medicina interna 9, aparato digestivo 9, pediatría 1, dermatología 9 y urología 1. De los 146 expertos iniciales, 125 participaron en la segunda ronda (85,6% de participación respecto a la primera ronda). Los 21 expertos que se retiraron en segunda ronda lo hicieron por falta de disponibilidad o compatibilidad con otras actividades profesionales. Este panel de expertos estaba formado por representantes de diferentes especialidades y áreas geográficas según se muestra en la figura 1.
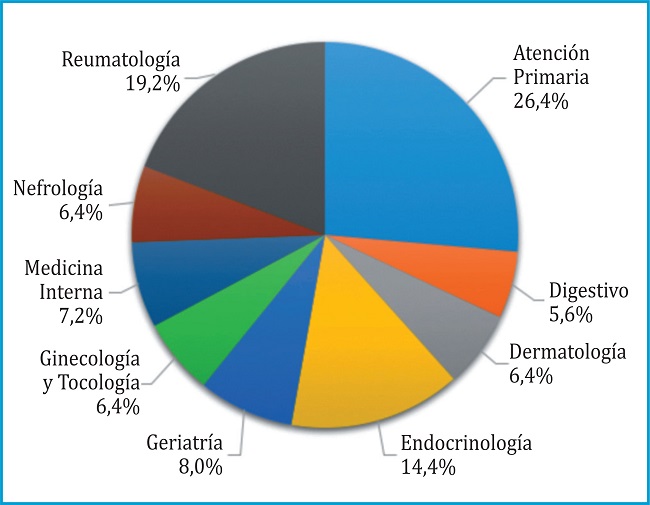
Figura 1. Características del panel de médicos que participaron en el estudio. (A) Distribución de los médicos según su especialidad.
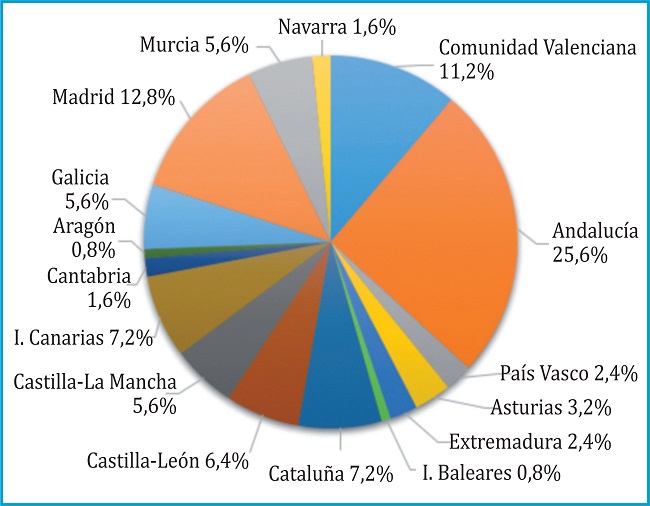
Figura 1. Características del panel de médicos que participaron en el estudio. (B) Distribución de los médicos según la Comunidad Autónoma en la que ejercen su profesión.
En la primera ronda se analizaron 73 aseveraciones de las cuales 47 (64,4%) alcanzaron consenso en el acuerdo. Las 26 aseveraciones restantes, 25 indeterminadas y una con polarización de opiniones, pasaron a la segunda ronda de circulación de la encuesta. En esta fase se alcanzó un nuevo nivel de acuerdo, reduciéndose a 16 (21,9%) las aseveraciones no consensuadas (figura 2), de las cuales 14 quedaron como indeterminadas y 2 con polarización de opiniones. Por lo tanto, tras finalizar la segunda ronda se obtuvo el nivel de consenso en el acuerdo sobre 57 (78,1%) de las 73 aseveraciones de la encuesta (figura 2).
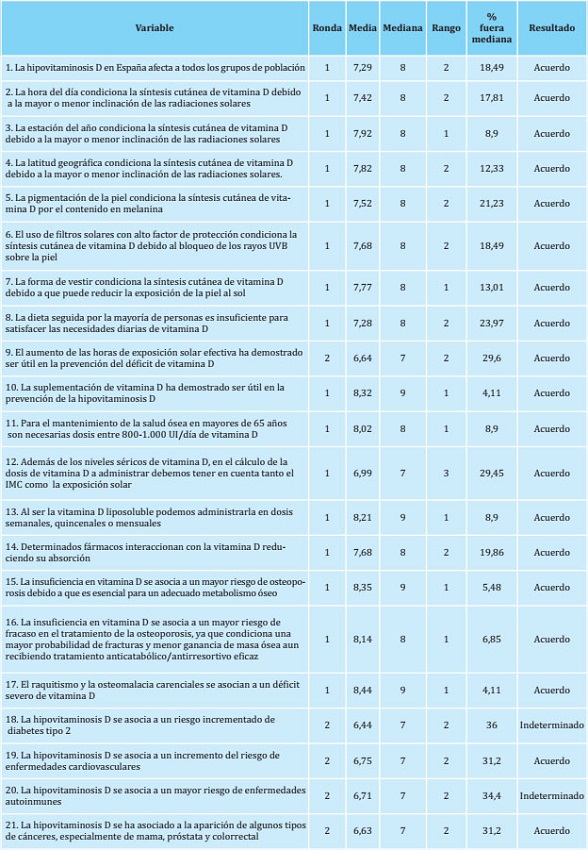
El bloque 1, Vitamina D y salud en general, fue el que alcanzó mayor consenso. Los encuestados estuvieron de acuerdo en 19 (90,5%) de las 21 aseveraciones que formaban este bloque (tabla 1), 16 en la primera ronda y 3 en la segunda, mientras que las 2 restantes (9,5%) fueron indeterminadas por dispersión o no posicionamiento de los expertos.
En el bloque 2, Evaluación de la hipovitaminosis D, se obtuvo consenso en un total de 19 aseveraciones, 16 en la primera ronda y 3 en la segunda, lo que corresponde a un 73,1% de las 26 propuestas (tabla 2). De las 7 aseveraciones que no alcanzaron consenso, 5 (19,2%) fueron indeterminadas y 2 (7,7%) mostraron polarización en el posicionamiento de los encuestados al finalizar la segunda ronda.
El bloque 3, Tratamiento con vitamina D según el perfil del paciente, es el que obtuvo un menor grado de consenso. El porcentaje de acuerdo fue del 68,4%, correspondiente a 13 aseveraciones consensuadas, 10 en la primera ronda y tres en la segunda, de las 19 propuestas (tabla 3). Las 6 aseveraciones restantes quedaron como indeterminadas, dando lugar a un 31,6% de no consenso por dispersión de opiniones. Ninguna de las aseveraciones no consensuadas de este bloque presentó polarización en los resultados.
Tabla 3. Nivel de acuerdo alcanzado en el bloque 3: Tratamiento con vitamina D según el perfil del paciente.
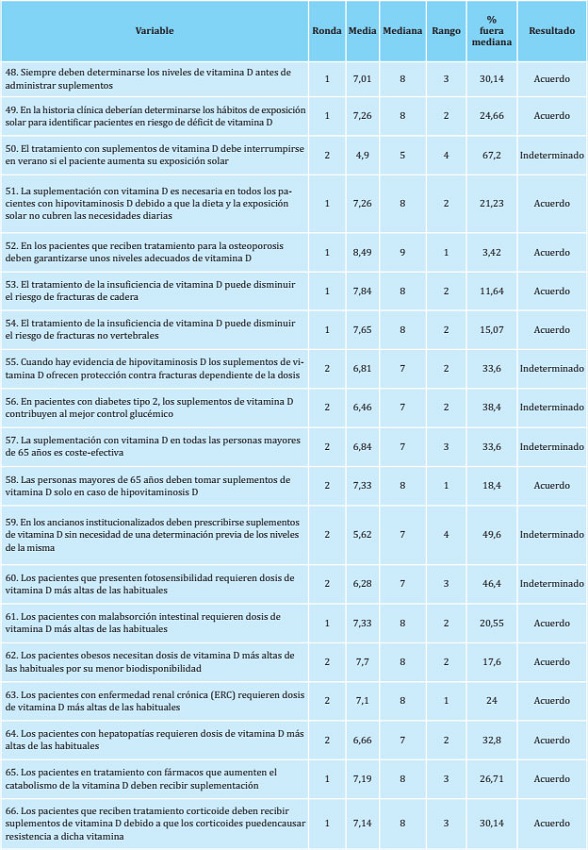
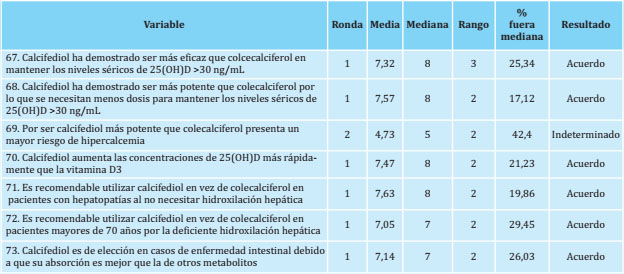
En el bloque 4, Diferencias entre suplementos, se obtuvo consenso en 6 de las 7 aseveraciones propuestas (tabla 4), todas en primera ronda, lo que corresponde a un porcentaje general de consenso del 85,7%. La aseveración que no obtuvo consenso quedó como indeterminada.
DISCUSIÓN
Esta encuesta Delphi logró el consenso en el 78,1% de las aseveraciones (figura 2) que se formularon para evaluar el conocimiento sobre la vitamina D y sobre el diagnóstico, el tratamiento y la prevención de la hipovitaminosis D.
En relación a la vitamina D y la salud en general, hubo acuerdo en que en España la hipovitaminosis D afecta a todos los grupos de población, lo que indica que los expertos encuestados reconocen su alta prevalencia en nuestro país6, y en que su severidad depende de factores ambientales, como la hora del día, la estación del año8 y la latitud geográfica, y de factores individuales, como la pigmentación de la piel, la dieta, el uso de filtros solares y la forma de vestir, ya que todos ellos condicionan la síntesis cutánea de vitamina D3. Como bien apuntan los expertos, la dieta es insuficiente para satisfacer las necesidades diarias de vitamina D y ello se debe a que son pocos los alimentos naturales con alto contenido de esta vitamina2. Además, la reducción de la exposición solar debida al cambio del estilo de vida ha ido en detrimento de la síntesis cutánea de vitamina D. Ante esta situación, y tal como reconocen los expertos, se debería considerar el aumento de las horas de exposición solar efectiva y segura, teniendo en cuenta los ya conocidos riesgos cancerígenos asociados a esta, de forma que se alcance un balance entre la exposición solar, alimentación y suplementación de vitamina D, como medidas para la prevención de la hipovitaminosis D. Según la Sociedad Española de Investigación Ósea y del Metabolismo Mineral (SEIOMM), se recomiendan 15 minutos de exposición solar diaria en brazos y cara, entre los meses de marzo y octubre, para población caucásica, con factor de protección entre 15 y 30, teniendo en cuenta la intensidad de la radiación y la latitud. En población anciana y pacientes con osteoporosis, se recomiendan 30 minutos de exposición solar diaria9.
Debido a las variaciones individuales a los suplementos de vitamina D es necesario establecer la dosificación adecuada para cada paciente. Para ello, los expertos estuvieron de acuerdo en que, además de los niveles séricos de 25(OH)D, hay que tener en cuenta el Índice de Masa Corporal (IMC) (considerando la relación existente entre el IMC y las concentraciones de 25(OH)D)10, el grado de exposición solar habitual del paciente y el uso de determinados fármacos que pueden alterar la absorción y el catabolismo de la vitamina D11. También hubo acuerdo en que la suplementación puede establecerse con una pauta semanal, quincenal o mensual sin afectar a su eficacia12,13, y en que esta debe ser de 800-1.000 UI/día en las personas mayores de 65 años, para alcanzar concentraciones plasmáticas suficientes de 25(OH)D9.
En cuanto a las consecuencias clínicas de la hipovitaminosis D, los expertos encuestados reconocieron que sobre el tejido esquelético aumenta el riesgo de osteoporosis1 y fracturas14, además de asociarse a raquitismo2 y osteomalacia2, mientras que sobre el sistema extraesquelético aumenta el riesgo de enfermedades cardiovasculares2,15 y de aparición de algunos tipos de cáncer, especialmente de mama, próstata y colorrectal3,16. Sin embargo, y pese a que se observó una orientación hacia el acuerdo, no hubo consenso en considerar que la hipovitaminosis D se asocia a un mayor riesgo de diabetes tipo 2 (DM2) y de enfermedades autoinmunes. La mayoría de los expertos que se mostraron en desacuerdo reconocieron que ciertos estudios habían mostrado una asociación entre hipovitaminosis D y DM217 o enfermedades autoinmunes18, pero no una relación directa de causalidad, lo que sugiere que los participantes interpretaron que las aseveraciones pretendían establecer una relación de causa-efecto entre la hipovitaminosis D y DM2 o enfermedades autoinmunes, lo que podría explicar la falta de consenso. De hecho, la contribución real de los niveles bajos de vitamina D como causa de DM2 o de enfermedades autoinmunes resulta controvertida, sobre todo teniendo en cuenta las discrepancias entre las observaciones y los ensayos clínicos de intervención. Estas discrepancias existen también en los estudios de los beneficios de la vitamina D a nivel extraesquelético en general. Ello se debe a que, en muchos de estos estudios de intervención, los participantes presentaban al inicio unos niveles séricos de 25(OH)D normales, por lo que difícilmente se podría observar un beneficio con la suplementación de vitamina D. Este es el caso del estudio de Pittas y colaboradores19 sobre los beneficios de la vitamina D en la prevención de DM2, y del estudio VITAL20 sobre los efectos de la suplementación de vitamina D en la prevención de cáncer y enfermedades cardiovasculares, ambos con resultados negativos. Desde un punto de vista fisiopatológico, la suplementación con vitamina D puede que no proporcione ninguna protección si no hay evidencia de hipovitaminosis D21,22, por lo que los estudios de intervención deben realizarse en pacientes con deficiencia de vitamina D tal y como recomiendan diferentes autores21,22.
Respecto a la evaluación de la hipovitaminosis D, los expertos reconocieron que los niveles de 25(OH)D son el mejor biomarcador del estatus de vitamina D1,2,11, ya que reflejan tanto el aporte dietético como el de la exposición solar y la suplementación. También hubo acuerdo en que concentraciones séricas de 25(OH)D por debajo de 30 ng/mL indican insuficiencia de vitamina D, mientras que valores inferiores a 10 ng/mL indican déficit severo13. Sin embargo, la falta de consenso en el desacuerdo en considerar insuficiencia cuando las concentraciones de 25(OH)D son inferiores a 20 ng/mL pone de manifiesto que las definiciones de insuficiencia (<30 ng/mL) y déficit (<20 ng/mL) de vitamina D no están tan claras3. También hubo variabilidad de opiniones en relación con las concentraciones seguras de 25(OH)D. Si bien hasta hace poco tiempo se consideraba que concentraciones de 25(OH)D menores de 150 ng/mL no presentaban riesgos de toxicidad11,13, actualmente se recomienda mantener los niveles séricos entre 30-50 ng/mL6. Ello se debe a las observaciones de que valores séricos de 25(OH)D superiores a 50 ng/mL se asocian a un mayor riesgo de mortalidad cardiovascular23, aunque en el 2017 se publicaron dos estudios que ponen en duda estos resultados24,25. En el primero de ellos, al estandarizar los valores séricos de 25(OH)D de un estudio previo, ya no se encontró una mayor mortalidad24, y en el segundo, que fue el primer y único metaanálisis que ha utilizado valores estandarizados de 25(OH)D y datos individuales, tampoco se observó una mayor mortalidad con valores séricos superiores a 50 ng/mL25.
Por otro lado, una vez alcanzados los niveles recomendados de 25(OH)D, es necesario que los pacientes continúen con una dosis de mantenimiento para que no reaparezca la hipovitaminosis D, puesto que las causas de la insuficiencia se mantienen.
En cuanto al cribado del déficit de vitamina D, sociedades científicas como el National Institute for Health and Care Excellence (NICE), United States Preventive Services Task Force (USPSTF), Endocrine Society y la Sociedad Española de Endocrinología, se han posicionado en contra del cribado universal6,11,26,27, probablemente porque no hay evidencias de que sea coste-efectivo. En este sentido, muchos expertos reconocieron que el cribado debe realizarse únicamente en pacientes con patologías asociadas a hipovitaminosis D y en grupos de riesgo como mayores institucionalizados, tal y como lo establecen las recomendaciones. Sin embargo, algunos de los encuestados opinaron que el cribado debería ser universal a partir de los 18 años, posición que posiblemente se deba a la alta prevalencia de hipovitaminosis D. A pesar de estas discrepancias, sí hubo acuerdo en que la medición de niveles de 25(OH)D era necesaria en personas mayores con riesgo de caídas, en pacientes que presentan osteoporosis con o sin fractura osteoporótica, fracturas por fragilidad, enfermedad renal crónica, alteraciones hepáticas o enfermedad intestinal y en pacientes tratados con fármacos que pueden interaccionar con la vitamina D6,12. Los expertos también reconocieron que la hormona paratiroidea es un marcador válido de déficit de vitamina D puesto que existe una asociación entre déficit de vitamina D y el hiperparatiroidismo secundario2,3.
En relación con los métodos de determinación de la 25(OH)D y a pesar de las diferencias observadas entre ellos1,11, no hubo consenso en el desacuerdo en que todos los métodos eran similares ni en que la mayoría de ellos sobreestimaba los niveles de 25(OH)D, lo que sugiere que muchos de los encuestados no se habían planteado o desconocían la importancia del método de determinación de 25(OH) vitamina D. Sin embargo, sí reconocieron la importancia de utilizar el mismo método en todas las mediciones de seguimiento de la suplementación de vitamina D, las cuales debían realizarse en los días previos a una siguiente toma, cada 3-4 meses a partir del inicio del tratamiento hasta alcanzar los niveles adecuados de 25(OH)D6, y luego en intervalos cada 6-12 meses. También hubo acuerdo en que existe la necesidad de estandarizar estas técnicas, algo que puede realizarse mediante la implementación de los materiales de referencia para la medida de 25(OH)D elaborados por el National Institute of Standars and Technology11. En general, la mayoría de hospitales utilizan los inmunoensayos para medir las concentraciones séricas de 25(OH)D, aunque estos métodos no están estandarizados y sobreestiman estas concentraciones28 al presentar reactividad cruzada con otros metabolitos inactivos de la vitamina D, como el 24-25 (OH)D y el epímero C3. En cambio, la cromatografía líquida con espectrometría de masas en tándem (LS-MS/MS), que es el método de referencia, no presenta el problema de la sobreestimación de la 25(OH)D, ya que permite analizar de forma independiente cada uno de los metabolitos de la vitamina D28, lo que se traduce en un aumento del porcentaje de hipovitaminosis D29. Sin embargo, este método no es aplicable a la rutina clínica porque es más complejo, lento y costoso que los inmunoensayos. Además, los valores que definen la insuficiencia y la deficiencia de vitamina D se basan en resultados de inmunoensayos por lo que, a pesar de que no hubo acuerdo entre los expertos, estos métodos son aceptables para determinar la concentración de 25(OH)D en la práctica clínica. Tampoco hubo acuerdo en establecer que la monitorización de la 25(OH)D se debe realizar en invierno o principios de primavera, cuando la síntesis de vitamina D es más deficiente. En general, la monitorización debería realizarse en todos los pacientes en riesgo de hipovitaminosis D, independientemente de la época del año. No obstante, los centros de atención primaria con acceso limitado a la medición de 25(OH)D y que no pueden solicitarla sin justificación, podrían optar por medir las concentraciones de 25(OH)D en invierno o principios de primavera, que es la época en que hay más posibilidades de que el paciente presente hipovitaminosis D.
En cuanto al tratamiento con vitamina D, aunque algunos expertos contemplaron su interrupción en verano si se acompañaba de una dieta rica en vitamina D y siempre que la hipovitaminosis D no fuera grave y no existieran patologías que la perpetuaran, se desaconseja la retirada de la suplementación en verano. En este sentido, al igual que con la monitorización de la 25(OH)D, hay que tener en cuenta que la diferencia entre las concentraciones de 25(OH)D en verano y en invierno es pequeña y que existen muchos factores que, junto con la variación de la exposición solar, pueden intervenir en la hipovitaminosis D.
A pesar de que los expertos reconocieron que la suplementación debe realizarse solo después de confirmar la hipovitaminosis D, incluso en pacientes mayores de 65 años, hubo dispersión de opiniones sobre el hecho de prescribir suplementos de vitamina D a los ancianos institucionalizados sin determinar los niveles séricos de 25(OH)D. En este sentido, lo ideal es conocer los niveles séricos de 25(OH)D para ajustar las dosis. Sin embargo, la prevalencia de hipovitaminosis D en este grupo de población es del 87%30 por lo que, en caso de no tener acceso a la determinación de los niveles de 25(OH)D, la suplementación con dosis seguras, como serían las dosis entre 1.000 y 2.000 UI diarias de vitamina D, que son las recomendadas por la Internacional Osteoporosis Foundation (IOF) para esta población13, sea probablemente la situación con un coste-beneficio más efectivo, sobre todo a nivel de prevención de fracturas y de pérdida de fuerza muscular.
Por otro lado, no hubo acuerdo en que la suplementación con vitamina D en todas las personas mayores de 65 años sea coste-efectiva. Algunos expertos comentaban al respecto que para conocer este dato deberían realizarse en España estudios de costeefectividad similares al realizado por las guías NICE en el Reino Unido, en las que se recomienda directamente la suplementación de vitamina D en mayores de 65 años, mujeres gestantes y lactantes y niños menores de 4 años27.
Según los expertos, la suplementación con vitamina D es necesaria en todos los pacientes con insuficiencia o deficiencia de vitamina D. En este sentido, hubo acuerdo en que conocer los hábitos de exposición solar de los pacientes sería útil para identificar a aquéllos en riesgo de hipovitaminosis D. También hubo acuerdo en que los pacientes que reciben tratamiento con corticoides o con fármacos que aumentan el catabolismo de la vitamina D requieren suplementación, lo que implica que reconocieron que estos pacientes están en riesgo de hipovitaminosis D6,13. Además, hay que tener en cuenta que ciertas patologías interfieren en la síntesis y la biodisponibilidad de la vitamina D, por lo que hubo acuerdo en que los pacientes que presentaban malabsorción intestinal, enfermedad renal crónica, hepatopatías u obesidad requerían de dosis de suplementación de vitamina D más altas13. Tal necesidad no fue consensuada para los pacientes con fotosensibilidad, en cuyo caso lo más recomendable sería establecer la dosis de vitamina D en función de los niveles séricos de 25(OH)D y no prescribir dosis más altas, como contemplan algunos expertos, porque la exposición solar de estos pacientes sea menor o menos efectiva por el uso de cremas con protección solar.
Además, los expertos reconocieron la importancia de mantener unos niveles adecuados de 25(OH)D en los pacientes con osteoporosis, ya que puede reducir el riesgo de fracturas, tanto de cadera como no vertebrales13. Sin embargo, no hubo acuerdo en que la reducción de fracturas por los suplementos de vitamina D fuera dependiente de la dosis. Este resultado no es de extrañar teniendo en cuenta las discrepancias entre diferentes estudios. Así pues, mientras que el metaanálisis de Bischoff-Ferrari y colaboradores demuestra que dosis diarias de 800 UI o superiores son más beneficiosas para la reducción de fracturas en pacientes mayores de 65 años31, el estudio de Bolland y colaboradores no encuentra evidencias de que los suplementos de vitamina D reduzcan las fracturas32, si bien cabe destacar que este último tiene muchas limitaciones22.
Tampoco hubo consenso, pese a la orientación hacia el acuerdo, en considerar que, en pacientes con DM2, los suplementos de vitamina D contribuyen a un mejor control glucémico. Aunque mayoritariamente los expertos que no estuvieron de acuerdo pensaban que no había estudios concluyentes al respecto, cabe destacar que ha quedado demostrado que los suplementos de vitamina D contribuyen a un mejor control glucémico33, induciendo una mejoría significativa cuando los niveles de 25(OH)D son inferiores a 20 ng/mL, aunque esto no se produce cuando están por encima de 20 ng/mL.
En cuanto a las diferencias entre suplementos, los expertos reconocieron que el calcifediol es más potente que el colecalciferol, por lo que se requieren dosis más bajas, aumenta más rápidamente las concentraciones de 25(OH)D y es más eficaz manteniéndolas por encima de 30 ng/mL6,34. También hubo acuerdo en que el calcifediol es el fármaco de elección en pacientes con deficiente hidroxilación hepática debido a hepatopatías o edad avanzada (>70 años) por no necesitar hidroxilación hepática34,35, y en pacientes con enfermedad intestinal porque se absorbe mejor que los otros metabolitos34.
Recientemente, la Agencia Española del Medicamento ha publicado una nota informativa sobre la aparición de hipercalcemia por sobredosificación de colecalciferol en niños y de calcifediol en adultos36, aunque en los estudios más recientes sobre el uso del calcifediol no se ha descrito ninguna toxicidad asociada a este fármaco12,37.
En resumen, los datos de este estudio muestran que existe un consenso sobre la alta prevalencia de la hipovitaminosis D en España y la necesidad de prescribir suplementos de vitamina D en pacientes con insuficiencia y déficit de esta vitamina. Sin embargo, la falta de consenso para algunos ítems pone de manifiesto que no hay un conocimiento adecuado sobre la vitamina D entre los expertos encuestados, sobre todo por lo que respecta a las recomendaciones para la evaluación y el tratamiento del déficit de esta vitamina. Por lo tanto, es necesario realizar acciones formativas destinadas a proporcionar una adecuada actualización de los conocimientos a los prescriptores habituales de vitamina D.











 texto en
texto en