INTRODUCCIÓN
Las células madre mesenquimales o MSC (mesenchymal stem cells o mesenchymal stromal cells) son células multipotentes (1,2). La capacidad de las MSC para diferenciarse en diversos linajes celulares, así como sus actividades antiinflamatorias e inmunosupresoras, las han convertido en una herramienta con mucho potencial en terapia celular y medicina regenerativa. Las MSC participan en la homeostasis del organismo mediante la regeneración y reparación de tejidos. Entre los tipos celulares a los que pueden diferenciarse las MSC se encuentran los osteoblastos. La diferenciación osteoblástica está controlada por varias vías de señalización, entre las que destacan la vía canónica Wnt/β-catenina, y el aumento de la expresión y activación del factor de transcripción RUNX2 (3,4). Las MSC también pueden diferenciarse hacia adipocitos por inducción del factor de transcripción PPARγ (peroxisome proliferator-activated receptor γ), el cual regula la expresión de genes adipogénicos e induce el desarrollo del fenotipo adipocítico (4).
Durante el proceso de envejecimiento o en determinadas enfermedades como la diabetes, las MSC tienden a diferenciarse hacia adipocitos en detrimento de la osteoblastogénesis (5,6). Esto aumenta la adiposidad de la médula ósea y disminuye la capacidad de la formación de hueso. Lo que favorece la pérdida de masa ósea y la aparición de osteoporosis (7,8). Así, estrategias terapéuticas que activen la diferenciación osteoblástica e inhiban la adipogénica pueden contribuir a promover la regeneración ósea (9).
Las aplicaciones terapéuticas de las MSC poseen varios obstáculos. Entre ellos se encuentra la baja viabilidad de las células trasplantadas, su heterogeneidad innata, factores no identificados relacionados con la edad del donante y el potencial tumorigénico de estas células (10). Estudios recientes indican que gran parte de las propiedades terapéuticas de las MSC están vinculadas a sus efectos paracrinos ejercidos a través de su secretoma (11), el cual, está compuesto por una fracción soluble, rica en factores de crecimiento y citoquinas, y otra vesicular, que contiene diversos tipos de moléculas con una alta capacidad regenerativa (12). Distintos estudios han mostrado que existe un efecto sinérgico cuando se utilizan conjuntamente ambas fracciones con fines regenerativos o inmunomoduladores (13,14). No obstante, en algunos trabajos se ha demostrado que la fracción vesicular es la principal responsable de la inducción de determinados procesos fisiológicos potencialmente regenerativos. Así, por ejemplo, vesículas extracelulares (EV) derivadas de MSC de médula ósea aumentaron la migración y proliferación in vitro de fibroblastos dermales y la angiogénesis en las células endoteliales de la vena umbilical humana (HUVEC). Mientras que los medios acondicionados sin EV no tuvieron ese efecto (15). Debido a las propiedades regenerativas de estas vesículas y a su estabilidad en el medio, la utilización de EV derivadas de MSC, en lugar de las propias células, ha sido propuesta como una adecuada alternativa terapéutica (1,16).
Debido a la falta de consenso sobre la clasificación de las EV, la Sociedad Internacional de Vesículas Extracelulares declaró que el término genérico preferido que debe utilizarse es el de vesícula extracelular (17). El contenido de las EV depende del tipo de célula de origen y de su estado fisiológico. Los principales componentes de las EV son proteínas, lípidos y ácidos nucleicos (ARN y ADN). A nivel de proteínas destaca la familia de las tetraspaninas. Entre ellas se encuentran CD63, CD81 y CD9; las cuales son consideradas como marcadores exosomales (10,18). Entre los ácidos nucleicos presentes en las EV destacan micro ARN (miARN) con capacidad de alterar la expresión génica de las células receptoras (19). Las EV participan en la comunicación intercelular, el mantenimiento celular, la respuesta inmunitaria y la progresión de tumores (20). En el caso de las EV derivadas de MSC, desempeñan papeles importantes en procesos biológicos, como la angiogénesis, la presentación de antígenos, la apoptosis, la coagulación, la homeostasis celular, la inflamación, la diferenciación, la proliferación y la señalización intercelular (16).
La utilización de EV derivadas de MSC permite diseñar terapias libres de células. Con ello, se pueden evitar las dificultades y posibles efectos adversos que conlleva la aplicación de células en terapia celular (10). Así, EV derivadas de MSC han sido evaluadas para el tratamiento de distintas enfermedades respiratorias, musculoesqueléticas, cardiovasculares, neurológicas, hepáticas, gastrointestinales, dermatológicas y renales (21).
La secreción y contenido de las EV varía sustancialmente en función del estado fisiológico de las MSC de las que derivan, el cual a su vez está influenciado por las condiciones ambientales de su nicho (22). En este contexto, se ha demostrado que el precondicionamiento en distintas condiciones de cultivo de las MSC pueden estimular la secreción de EV y aumentar su eficacia terapéutica. En particular, esas condiciones incluyen citoquinas, hipoxia, factores tróficos y físicos, agentes químicos y farmacológicos (23).
La disminución de la disponibilidad de oxígeno por hipoxia induce una respuesta celular de adaptación en la que se incluye la alteración del contenido de las EV secretadas (24). A nivel celular, la hipoxia induce la activación del factor inducible por hipoxia-1α (HIF1α). Este factor de transcripción en condiciones de normoxia es hidroxilado y degradado por el proteosoma citoplasmático. Sin embargo, ante un daño tisular, en procesos isquémicos o en la exposición a hipoxia, la disminución de la disponibilidad de oxígeno inhibe la hidroxilación de HIF1α, lo que provoca su acumulación y translocación al núcleo, donde induce la expresión de genes implicados en la adaptación a los bajos niveles de oxígeno. Entre ellos, destacan genes relacionados con la angiogénesis, cicatrización, metabolismo anaeróbico de la glucosa, eritropoyesis, proliferación diferenciación y apoptosis, entre otros. Se ha demostrado que cientos de genes pueden ser regulados transcripcionalmente por HIF1α (25). En cuanto al efecto de la hipoxia sobre el contenido de las EV, numerosos estudios han demostrado que EV derivadas de MSC precondicionadas en hipoxia tienen una mayor capacidad terapéutica en medicina regenerativa (24).
Aunque es conocido que los efectos paracrinos de las MSC mediados por la secreción de afectan a distintos aspectos fisiológicos celulares, aún existe poca información sobre cómo pueden influir estas vesículas a la diferenciación adipogénica y osteogénica de las células precursoras. Así, el objetivo del presente trabajo ha sido estudiar cómo afectan las EV derivadas de cultivos de MSC de medula ósea humana crecidas en condiciones de hipoxia o normoxia sobre la diferenciación osteoblástica y adipogénica de MSC. Con ello, se pretende contribuir al conocimiento necesario para el posible desarrollo de nuevas vías terapéuticas para el tratamiento de patologías relacionadas con el tejido óseo y/o graso.
MATERIALES Y MÉTODOS
CULTIVO Y EXPANSIÓN DE CÉLULAS MADRE MESENQUIMALES
Las MSC de médula ósea humana se obtuvieron de cultivos criopreservados y previamente caracterizados pertenecientes a la colección de líneas celulares de nuestro grupo. MSC procedentes de un varón sano de 31 años fueron utilizadas para este estudio. Un vial de MSC criopreservadas (8 × 105 células) se sembraron en un frasco de cultivo de 75 cm2 en medio de cultivo α-MEM (Cambrex Bio Science-Lonza; Basel, Switzerland) suplementado con 10 % de FBS (Gibco-Thermo Fisher Scientific), ultraglutamina al 1 % (Cambrex Bio Science-Lonza), 0,1 mg/ml de estreptomicina, 100 U de penicilina y 1 ng/ml de FGF-2 (Fibroblast Growth Factor-2) de Sigma-Aldrich (Saint Louis, MO, United States). El medio de cultivo fue cambiado cada 3-4 días. Al alcanzar una confluencia del 80-90 %, las células se levantaron con tripsina-EDTA (Gibco-Thermo Fisher Scientific) y se volvieron a sembrar en una dilución de 1:3.
AISLAMIENTO DE LAS VESÍCULAS EXTRACELULARES DERIVADAS DE MSC
En cultivos de MSC correspondientes a un pase entre el 4 y 6, cuando alcanzaron alrededor del 70 % de confluencia, el medio de cultivo se reemplazó con medio fresco suplementado con 5 % de FBS libre de exosomas (Gibco-Thermo Fisher Scientific). Las células se mantuvieron en ese medio durante 48 h en dos condiciones de concentración de oxígeno: hipoxia (5 % CO2, 3 % O2 y 37 °C) y normoxia (5 % CO2, 16 % O2 y 37 °C). A continuación, el medio de cultivo de tres frascos de 75 cm2 (aproximadamente 50 ml) por cada condición, fue recogido y centrifugado a 4 °C durante 10 min a 300 g, 20 min a 1200 g y 30 min a 10 000 g. Después de la última centrifugación, el medio de cultivo se concentró con un Amicon®Ultra-15 Centrifugal Filter Devices 100 KDa (Millipore; Merck KGaA, Darmstadt, Alemania) hasta aproximadamente 2 ml. Del medio concentrado se purificaron las EV mediante cromatografía de exclusión de tamaño utilizando PURE-EVs Columns (HansaBioMed; Tallinn, Estonia), siguiendo las instrucciones del fabricante. Las fracciones conteniendo las EV se concentraron finalmente hasta un volumen de 300-400 μl mediante ultrafiltración en un Amicon®Ultra-15 Centrifugal Filter Devices 10 KDa (Millipore).
CARACTERIZACIÓN MORFOLÓGICA Y CUANTIFICACIÓN DE LAS VESÍCULAS EXTRACELULARES
La morfología de las EV se analizó mediante microscopía electrónica de transmisión (TEM). Brevemente, 20 μL de muestra se aplicó sobre rejillas de cobre recubiertas de carbono. Se dejó secar y se tiñeron con acetato de uranilo (UrAc) al 2 % (p/v) durante 1 minuto. Las imágenes fueron obtenidas con un microscopio electrónico de transmisión de alta resolución JEOL JEM 1400 (SCAI, Universidad de Córdoba) a un voltaje de aceleración entre 80 a 200 keV.
La concentración de las nanopartículas se determinó mediante un Nanosight NS300 en el Instituto Universitario de Nanoquímica de la Universidad de Córdoba.
Western blotting
Para la extracción de proteína total de los distintos cultivos celulares, las células fueron lisadas con “Cell Extraction Buffer” (Thermo Fisher Scientific) suplementado con 1 mM de fluoruro de fenilmetilsulfonilo (PMSF) y 50 μl/ml de cóctel de inhibidores de proteasa (PIC) (ambos de Sigma-Aldrich). El lisado se incubó en hielo durante 30 minutos, con agitación mediante vortex cada 10 minutos. Por último, el lisado se centrifugó 10 minutos a 13 000g a 4 °C, se descartó el precipitado de restos celulares y el sobrenadante fue almacenado a -20 °C hasta su utilización. La concentración de proteína se cuantificó con el kit “Bio-Rad DC Protein Assay” (Bio-Rad) según el protocolo del fabricante. Para la extracción y cuantificación de las proteínas de las EV se utilizó el mismo protocolo tras lisar las vesículas con “Cell Extraction Buffer”.
La concentración de proteína obtenida de las EV fue de entre 0,1 y 0,3 μg/ μl. Para el “Western blot” de 2 a 10 μg de proteína de cada muestra fueron cargadas en un gel de acrilamida al 8-16 % (nUView Tris-Glycine Precast Gels, NuSeP) en condiciones de desnaturalización en un sistema de electroforesis «Mini-Protean» (Bio-Rad). Después de la electroforesis, las proteínas se transfirieron a membranas de difluoruro de polivinilidina (PVDF) (Bio-Rad) usando un Trans-Blot Turbo Transfer System (Bio-Rad). Las membranas se bloquearon con una solución al 5 % de leche desnatada en polvo en tampón T-TBS (20 mM Tril-HCl pH 7,6, NaCl 150 mM, Tween al 0,05 %) durante 1 hora a temperatura ambiente. A continuación, las membranas se incubaron toda la noche a 4 °C con los anticuerpos primarios, anti-CD9 (1:700), anti-CD63 (1:700) (ambos de Invitrogen, ThermoFisher Scientific) o anti-calnexina (1:1000) de Sigma-Aldrich, en leche al 1 % en T-TBS. Tras lavar las membranas tres veces con T-TBS, se incubaron con el anticuerpo secundario, anti-Mouse IgG H & L-HRP (1:5000) (Invitrogen, ThermoFisher Scientific) para CD9 y CD63, y anti-Rabbit IgG H & L-HRP (1:3000) (Abcam) para calnexina, en leche al 1 % en T-TBS durante 1 hora. Finalmente, los restos de anticuerpo secundario fueron lavados con T-TBS y la membrana se reveló utilizando el «Sustrato Clarity Western ECL» (Bio-Rad). Las bandas se visualizaron en un sistema de documentación de geles ChemiDoc™ XRS+ de Bio-Rad a través del software ImageLab de la misma casa comercial. La intensidad de las bandas se cuantifico posteriormente con el software ImageJ 1.53t.
CUANTIFICACIÓN DE LA EXPRESIÓN GÉNICA POR PCR (POLYMERASE CHAIN REACTION)
El ARN de los cultivos inducidos a diferenciarse a osteoblastos o adipocitos se aisló usando el «NZY total RNA isolation kit” (NZYTech Lda; Lisboa, Portugal), siguiendo las instrucciones del fabricante. El ARN se cuantificó en un espectrofotómetro NanoDrop ND-1000 de Thermo Fisher Scientific y 900 ng se retrotranscribió a ADNc utilizando «iScript cDNA Synthesis Kit» (Bio-Rad), de acuerdo con las instrucciones del fabricante.
La PCR cuantitativa en tiempo real (qRT-PCR) se llevó a cabo en un LightCycler 96 Instrument de Roche Applied Science. Cada reacción de PCR se realizó en un volumen de 10 ul que contenía 1 μl de ADNc, 1 μM de cebadores (Tabla I) y 1X de “SensiFAST Sybr No-Rox Mix” (BIOLINE). El programa de amplificación de la PCR incluyó un ciclo a 95 °C durante 2 minutos (desnaturalización del ADN y activación de la ADN polimerasa) y 40-45 ciclos de 95 °C durante 5 segundos (desnaturalización del ADN) y 65 °C durante 30 segundos (hibridación de los cebadores y extensión del producto). Los resultados se analizaron con el software LightCycler 1.1 del mismo fabricante. Como gen constitutivo se utilizó POLR2A (polimerasa [ARN; ADN dirigido] II polipéptido A).
ENSAYO DE VIABILIDAD CELULAR
La viabilidad celular se determinó usando bromuro de 3-(4, 5-dimetiltiazolil-2)-2,5-difeniltetrazolio (MTT) (Sigma-Aldrich). Las MSC se sembraron en placas de 96 pocillos a una densidad de 4000 células por pocillo en medio de cultivo. Las células fueron tratadas en medio de cultivo suplementado con FBS libre de EV y con diferentes concentraciones de EV derivadas de MSC mantenidas en normoxia (MSC-EvN) o hipoxia (MSC-EvH) (3 × 107, 9 × 107 y 15 × 107 partículas/ml). A las 48 horas, se retiró el medio de cultivo y se añadieron 100 μl de DMEM (Medio Eagle Modificado de Dulbecco; Capricorn Scientific GmbH) sin FBS ni rojo fenol conteniendo 1 mg/ml de MTT. Las células se incubaron a 37 °C durante 2 horas y los cristales de formazán formados durante la incubación se disolvieron en isopropanol al 100 %. De la solución resultante se midió la absorbancia a 570 nm teniendo como referencia la de 650 nm con un espectrofotómetro de microplacas PowerWave XS (BioTek Instruments).
ENSAYO DE MIGRACIÓN CELULAR
La migración de las MSC se evaluó mediante el “Oris™ Cell Migration Assay” (Platypus technologies). Las MSC se sembraron en placas de 96 pocillos (15000 células/pocillo) y se incubaron a 37 °C con “cell seeding stoppers” en cada pocillo, hasta una confluencia del 90 %. Luego se retiraron los tapones dejando un halo de 2 mm en el medio del pocillo. Después de lavar con PBS, se agregó α-MEM + 2 % de FBS (libre de VES) conteniendo MSC-EvN o MSC-EvH en una concentración de 3 × 107, 9 × 107 o 15 × 107 partículas/ml. A las 0 h, 12 h y 18 h, se tomaron imágenes utilizando un microscopio de contraste de fase Incucyte® Systems for Live-Cell Imaging. La migración se midió calculando el porcentaje del área de cierre respecto al área abierto inicial (t = 0) según la siguiente fórmula: área de migración (%) = (A0-At)/A0 x 100, donde A0 representa el área abierta inicial, y At representa el área residual en el tiempo de medición. Para la cuantificación de las áreas en las imágenes se utilizó el software ImageJ.
DIFERENCIACIÓN A ADIPOCITOS Y OSTEOBLASTOS
Las MSC se sembraron en placas de cultivo P12 o P24 (Nalgene-Nunc-Thermo Fisher Scientific) a 3000 células/cm2. Una vez que alcanzaron una confluencia de entre el 60 y el 80 %, se diferenciaron a adipocitos u osteoblastos en presencia o ausencia de MSC-EvN o MSC-EvH. Para inducir la diferenciación de adipocitos, el medio de cultivo sin FGF se suplementó con 5 × 10-7 M de dexametasona, 50 μM de indometacina y 0,5 mM de isobutilmetilxantina. Mientras que para la diferenciación a osteoblastos, el medio fue suplementado con 10-8 M de dexametasona, 10 mM de β-glicerolfosfato y 0,2 mM de ácido ascórbico. Todos los inductores fueron obtenidos de Sigma-Aldrich.
Después de 13 días de diferenciación, se tomaron muestras de los cultivos para la extracción de ARN y análisis de la expresión génica de marcadores osteoblásticos o adipocíticos.
TINCIÓN DE LA MINERALIZACIÓN DE LA MATRIZ EXTRACELULAR
En las MSC inducidas a osteoblastos se evaluó la mineralización de la matriz mediante tinción con alizarin red S a los 21 días. Los cultivos se fijaron 10 min con formaldehído al 3,7 % y se tiñeron con una solución de alizarin red S 40 mM, pH 4,1. Todos los reactivos fueron de Sigma-Aldrich. A continuación, los pocillos se lavaron con isopropanol al 60 %, se secaron y se tomaron imágenes de los mismos. Para cuantificar la mineralización, la tinción fue eluida con ácido acético al 10 % y neutralizada con hidróxido de amonio al 10 %. En la solución resultante se cuantificó la absorbancia a 405 nm usando un espectrofotómetro de microplacas PowerWave XS de BioTek Instruments.
TINCIÓN DE VESÍCULAS GRASAS
La formación de vesículas de grasa en los cultivos inducidos a adipocitos se evaluó mediante tinción oil-red O a los 13 días de diferenciación. Los cultivos se fijaron con formaldehído al 3,7 % durante 20 minutos y se tiñeron con una solución compuesta de un 60 % de oil-red al 0,3 % (p/v en isopropanol) y un 40 % de agua destilada. Después de 15 a 20 min de incubación, las células se lavaron con agua destilada, se tiñeron con hematoxilina y se tomaron imágenes de microscopía óptica para cada uno de los pocillos. La tinción oil-red O se cuantificó por análisis de imágenes con el software ImageJ. El área de la imagen teñida con oil-red O se normalizó con el número de células correspondiente.
ANÁLISIS ESTADÍSTICO
La comparación entre los diferentes tratamientos se realizó mediante la prueba de ANOVA para detectar cambios significativos, seguido de una prueba de Tukey para identificar diferencias significativas entre pares de tratamientos. Se han considerado cambios significativos (*) para p < 0,05. Al menos 3 datos han sido obtenidos por parámetro estudiado. Los datos se muestran como la media más el error estándar de la media (Media ± ESM).
RESULTADOS
CARACTERIZACIÓN DE LAS VESÍCULAS EXTRACELULARES
En la cromatografía de exclusión de tamaño de los medios concentrados de las MSC crecidas en normoxia o en hipoxia, se obtuvieron 10 fracciones en las que se midió la absorbancia a 280 nm como estimación de la concentración de proteína. Como se muestra en la figura 1A, la cantidad de proteína eluida aumentó a partir de la fracción 7. Ello indica que las EV libres de proteína soluble se encuentran en las fracciones previas.
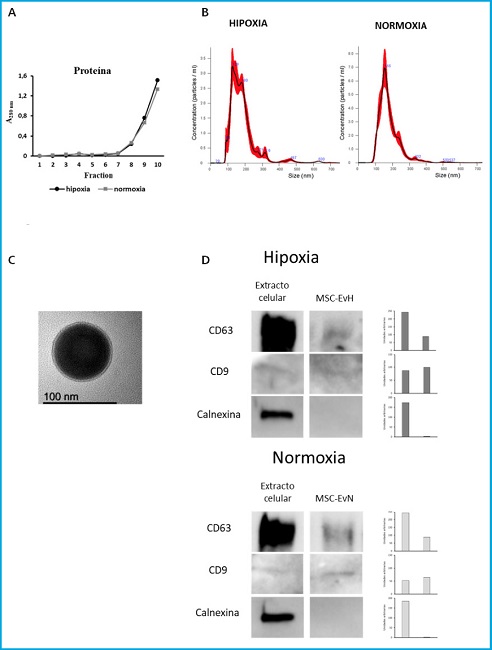
Figura 1. Caracterización de las vesículas extracelulares derivadas de MSC en normoxia e hipoxia. A. Absorbancia a 280 nm de las fracciones obtenidas por cromatografía de exclusión por tamaño. B. Distribución del tamaño de las partículas de MSC-EvN y MSC-EvH obtenido mediante Nanosight. C. Imagen obtenida por TEM de una VE mostrando su morfología y tamaño. D. Western blot de la expresión proteica de marcadores positivos para EV (CD63 y CD9) y negativos (calnexina), en extractos celulares y de EV (MSC-EvH y MSC-EvN). A la izquierda de cada uno de los marcadores se muestra la representación gráfica de la cuantificación de su expresión.
Tras la mezcla y posterior concentración por ultrafiltración de las fracciones 1 a 6, se cuantificaron y analizaron las nanovesículas obtenidas por “Nanoparticle Tracking Analysis”. El tamaño medio de los EV obtenidas de dicho análisis fue de aproximadamente 150 nm (Fig. 1B). La imagen mediante MET muestra la morfología esférica de las EV aisladas (Fig. 1C). Además, en las nanovesículas se observó la presencia de los marcadores de superficie CD63 y CD9. Mientras que la proteína celular calnexina no fue detectada (Fig. 1D).
EFECTO DE LA APLICACIÓN DE MSC-EVN Y MSC-EVH SOBRE LA VIABILIDAD Y MIGRACIÓN DE MSC
Las MSC fueron crecidas en presencia o en ausencia de 30, 60 o 150 × 106 partículas/ml de MSC-EvN o MSC-EvH durante tres días, tras los cuales se cuantificó la viabilidad celular. Como muestra la figura 2A, la viabilidad de las MSC tendió a aumentar con la concentración de VE. Este incremento fue significativo con la mayor concentración utilizada de ambos tipos de EV, siendo ligeramente superior en las tratadas con las derivadas de condiciones de hipoxia (Fig. 2A).

Figura 2. Viabilidad y migración de las MSC en presencia o ausencia de MSC-EvH o MSC-EvN. A. Efecto del tratamiento con MSC-EvH (H) o MSC-EvN (N) a concentraciones de 3x107 partículas/ml (30), 6 × 107 partículas/ml (60) y 15 × 107 partículas/ml (150), sobre la viabilidad de cultivos de MSC. B. Igual que en (A), pero sobre la migración celular. Las fotos representan imágenes representativas de los cultivos tratados a las 0 y 18 h después del inicio de la migración. *p < 0,05 vs. control (células no tratadas).
La migración de las MSC en presencia de diferentes concentraciones de EV también tendió a ser mayor. Sin embargo, estos cambios no fueron significativos en el caso de los tratamientos con las MSC-EvH. Por su parte, las MSC-EvN si produjeron un aumento significativo de la migración celular, aunque solamente con la mayor concentración utilizada (Fig. 2B).
EFECTO DE LAS VESÍCULAS EXTRACELULARES EN LA DIFERENCIACIÓN DE LAS MSC A OSTEOBLASTOS
Teniendo en cuenta los resultados obtenidos sobre la viabilidad y la migración de las MSC, para la evaluación del efecto de las EV sobre diferenciación celular se seleccionó para este estudio la concentración de 15 × 107 partículas/ml de MSC-EvN y MSC-EvH.
La mineralización de las MSC diferenciadas a osteoblastos aumentó significativamente con ambos tipos de vesículas. Este aumento fue superior en los cultivos tratados con las EV derivadas de cultivos en hipoxia (Fig. 3A). En cuanto a la expresión de genes marcadores osteoblásticos, no se encontraron cambios significativos en los genes que codifican el factor de transcripción RUNX2 y la proteína de matriz extracelular colágeno tipo 1 alfa (COL1A1). Sin embargo, se observó un aumento significativo en la expresión del gen del factor de transcripción SP7, también conocido como osterix, con el tratamiento con MSC-EvH. Además, los tratamientos con MSC-EvH y MSC-EvN indujeron significativamente la expresión del gen de la sialoproteína de unión a integrina (IBSP). En este caso, el cambio fue mayor en las EV derivadas de MSC en hipoxia respecto a las obtenidas de cultivos en normoxia (Fig. 3B). Estos resultados sugieren que las EV derivadas de MSC en hipoxia tienen más capacidad de favorecer la osteoblastogénesis que las obtenidas de cultivos en normoxia.
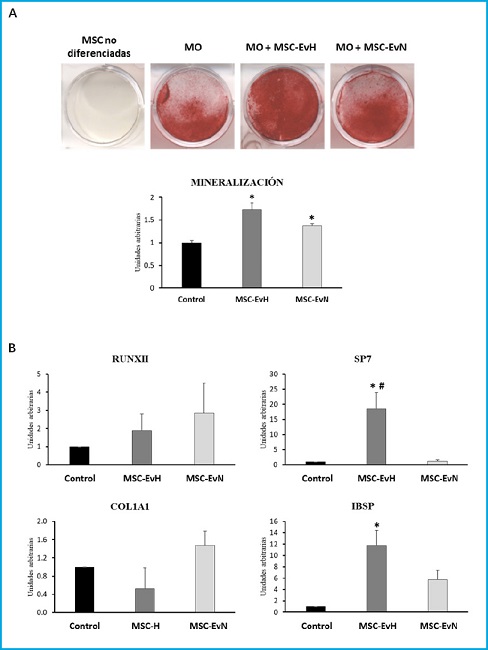
Figura 3. Efecto de las vesículas extracelulares derivadas de MSC en la diferenciación osteogénica. A. Imágenes representativas y cuantificación de la tinción alizarin red S de cultivos de MSC a los 21 días de diferenciación en medio osteoblástico (MO) en presencia o ausencia de MSC-EvH o MSC-EvN. B. Expresión de los genes osteoblásticos RUNX2, SP7, COL1A1 e IBSP a los 13 días de diferenciación en cultivos tratados con MSC-EvH y MSC-EvN. Los datos se presentan como la media ± ESM. *p < 0,05 vs. control (cultivos no tratados); #p < 0,05 vs. MSC-EvN.
EFECTO DE LAS VESÍCULAS EXTRACELULARES EN LA DIFERENCIACIÓN DE LAS MSC A ADIPOCITOS
En el análisis fenotípico de las MSC diferenciadas a adipocitos tratadas con MSC-EvH o MSC-EvN, no se observaron cambios significativos en la formación de vesículas de grasa respecto a los cultivos no tratados (Fig. 4A). En cuanto a la expresión de los genes adipogénicos PPARG2, LPL y FASN, tampoco se observaron diferencias entre los distintos tratamientos y el control. Sin embargo, la expresión de FABP4 en los cultivos tratados con MSC-EvN aumentó significativamente respecto al control y a los cultivos tratados con MSC-EvH. La expresión en estos últimos no mostro cambios en relación a los cultivos no tratados (Fig. 4B).

Figura 4. Efecto de las vesículas extracelulares derivadas de MSC en la diferenciación adipogénica. A. Imágenes y cuantificación de la tinción oil red O en cultivos de MSC después de 13 días en medio adipogénico (MA) en presencia o ausencia de MSC-EvH o MSC-EvN. (imágenes a 200x). B. Expresión de los genes adipogénicos PPARG2, LPL, FABP4 y FASN a los 13 días de diferenciación en cultivos tratados con MSC-EvH y MSC-EvN. Los datos se presentan como la media ± ESM. *p < 0,05 vs. control (cultivos no tratados); #p < 0,05 vs. MSC-EvN.
DISCUSIÓN
Nuestro estudio pone de manifiesto que la utilización de la cromatografía de exclusión por tamaño para el aislamiento de las EV, produce vesículas con alta pureza y poca contaminación de proteínas solubles (26). Los resultados de los tratamientos con ambos tipos de EV, MSC-EvH y MSC-EvN, indican que aumentan la viabilidad de los cultivos de MSC in vitro cuando se aplicaron a una concentración de 15 × 107 partículas/ml. El efecto positivo de EV derivados de MSC sobre la viabilidad de distintos tipos celulares ha sido descrito en diferentes estudios (15,27). Algunos autores han mostrado que EV derivadas de MSC no tienen afecto sobre la viabilidad de MSC procedentes de médula ósea (28). No obstante, esos resultados se han obtenido con EV obtenidas por ultracentrifugación y después de mantener las células 12 h en medios de cultivo nuevo (28) y no 48 h como en nuestro caso. Por lo que las distintas condiciones metodológicas pueden afectar al contenido de las EV y explicar las diferencias observadas entre distintos estudios. Nuestros datos no muestran diferencias entre el efecto de MSC-EvH y MSC-EvN sobre la viabilidad de los cultivos de MSC. Sin embargo, algunos autores han descrito que las EV derivadas de MSC cultivadas en hipoxia tienen más capacidad de aumentar la viabilidad celular que las obtenidas en normoxia (29,30). Sin embargo, hay que resaltar que estos estudios han sido realizados principalmente sobre células endoteliales y no sobre MSC. Así, hay que tener en cuenta que la hipoxia provoca la producción de factores que estimulan e inducen a las células endoteliales para que formen nuevos vasos para suplir la disminución de los niveles de oxígeno, como por ejemplo el factor de crecimiento endotelial vascular (VEGF) (31). Estos factores pueden ser abundantes en las EV extracelulares derivadas de MSC mantenidas en hipoxia, pero nuestros datos sugieren que podrían no tener un efecto significativo sobre la viabilidad de las MSC.
El tratamiento con MSC-EvH y MSC-EvN tendió a aumentar la migración de las MSC. En otros tipos celulares como células endoteliales, fibroblastos y queratinocitos se ha demostrado que las EV derivadas de MSC favorecen su capacidad de proliferación y migración (32,33). El aumento de la inducción de la migración se asocia a una mayor capacidad regenerativa de las EV (34). Nuestros resultados muestran que la migración de las MSC no estuvo influida significativamente cuando fueron tratadas con MSC-EvH. Ello sugiere, que las condiciones de cultivo en hipoxia utilizadas no produjeron EV enriquecidas en factores que estimularan la migración de estas células.
La utilización de EV derivadas de células óseas, como MSC de médula ósea, está emergiendo como una posible estrategia terapéutica para el tratamiento de patologías óseas, incluida la osteoporosis (35,36). Nuestros resultados muestran que la diferenciación osteogénica de MSC in vitro es potenciada cuando los cultivos son tratados con EV derivados de MSC, principalmente con las MSC-EvH. Los cultivos tratados con estas EV presentaron una mayor mineralización y expresión de genes osteoblásticos como SP7 e IBSP. El primero codifica a un factor de transcripción esencial para la diferenciación osteogénica (37) y el segundo a la sialoproteína de unión a integrina, una proteína de la matriz extracelular involucrada en la mineralización (38). Estos resultados apoyan lo descrito previamente por otros estudios en los que se demuestra la capacidad osteogénica de EV obtenidas de MSC (39-41). Experimentos in vivo en un modelo de fractura ósea han mostrado que EV derivadas de MSC cultivadas en condiciones de hipoxia, promueven la curación de las fracturas óseas en mayor medida que las EV obtenidas de MSC en normoxia. Ello es debido en parte a que favorecen la angiogénesis a través del miR-126, el cual regula la vía de señalización angiogénica SPRED1/Ras/Erk (40). En nuestro caso, no hemos evaluado el posible efecto de las MSC-EvH sobre células endoteliales, pero si hemos demostrado que inducen la osteoblastogénesis de las células precursoras. Por lo tanto, el tratamiento con MSC-EvH podría favorecer la regeneración ósea a través de su inducción de la angiogénesis en células endoteliales y de la diferenciación osteoblástica de las MSC. Así, otros estudios apoyan que EV derivadas de MSC tienen un alto potencial en la regeneración ósea por su capacidad de favorecer tanto la angiogénesis como la osteoblastogénesis (39). En el efecto positivo de las EV derivadas de MSC sobre la osteoblastogénesis in vitro e in vivo, se ha observado que intervienen miARN como el miR-196a, el miR-335 y el miR-27a (41-43).
Las MSC son también precursoras de adipocitos. Generalmente, los factores que favorecen la diferenciación adipogénica afectan negativamente a la osteogénesis y viceversa (9). Sin embargo, nuestros resultados indican que ni las MSC-EvH ni las MSC-EvN afectaron significativamente a la adipogénesis. Solo destaca que los niveles de mRNA de FABP4 aumentó con el tratamiento con MSC-EvN. El gen FABP4 codifica una proteína de unión a ácidos grasos implicada en diferentes funciones extracelulares, por lo que la aplicación de MSC-EvN puede afectar a aspectos relacionados con el metabolismo de los ácidos grasos durante la adipogénesis (44), que en nuestro caso no ha afectado a la acumulación de vesículas de grasa.
En conclusión, nuestros datos muestran que el tratamiento con EV derivadas de MSC mejora la viabilidad, migración y diferenciación osteogénica de MSC de médula ósea humana. La diferenciación osteoblástica es inducida principalmente cuando las EV son obtenidas de MSC expuestas a hipoxia. Ello sugiere que el precondicionamiento de las células en condiciones de bajos niveles de oxígeno, podría inducir la secreción de EV enriquecidas en factores osteogénicos. La determinación de estos factores en un futuro debe permitir conocer el mecanismo de acción de estas EV sobre la osteoblastogénesis, además de abrir otras posibilidades para el diseño de nuevas estrategias terapéuticas más eficientes para el tratamiento de patologías óseas. Los resultados de este estudio respaldan la posibilidad de utilizar una terapia libre de células basada en la aplicación de EV para el tratamiento de enfermedades sistémicas del hueso como la osteoporosis y para favorecer la formación ósea, en el caso de fracturas de difícil curación.











 texto em
texto em 



