MENSAJES CLAVE
Aventurarse en investigación sin revisar de manera sistemática lo ya conocido, especialmente cuando la investigación implica personas o animales, no es ético, carece de rigor científico y es un desperdicio.
Una revisión sistemática de pruebas imparciales (evidencias) relevantes puede determinar si la investigación es realmente necesaria.
Algunos organismos de financiación ahora requieren que los solicitantes hagan referencia a revisiones sistemáticas de investigaciones existentes.
El desperdicio en investigación también se puede reducir mediante la producción, actualización y difusión eficientes de revisiones sistemáticas.
Tanto si los investigadores en medicina de hoy en día, al igual Isaac Newton, se ven a sí mismos “a hombros de gigantes” como si no, es posible que todavía se espere de ellos que se basen de forma sistemática en investigaciones previas al planificar nuevos estudios. Aunque este problema se resaltó ya en 20051-2, numerosos estudios indican que los investigadores no utilizan una metodología sistemática para identificar y citar investigaciones previas en la justificación, diseño o discusión de nuevas investigaciones3-11. Esto es cierto, incluso en estudios clínicos de alta calidad publicados en las revistas médicas más prestigiosas4-12. Más bien, los investigadores médicos seleccionan los estudios a citar principalmente en base a preferencias y consideraciones estratégicas13-18.
El término “investigación basada en la evidencia” se acuñó en 2009 para indicar el enfoque necesario para reducir esta práctica, la cual es una importante fuente de desperdicio en investigación19 y pone en riesgo de sufrir daños innecesarios tanto a pacientes como a participantes de estudios.
En vista del fácil acceso, tanto a bases de datos de investigación como a revisiones sistemáticas de alta calidad -iniciadas por grupos como la Colaboración Cochrane y numerosos centros de síntesis de pruebas imparciales (evidencias) a nivel mundial-, existen pocas excusas para que los investigadores sigan sin basarse en evaluaciones sistemáticas actuales de investigaciones previas. Sin embargo, parece que hay autores que se libran por ser muy selectivos13-14 al citar preferentemente estudios con resultados que respaldan la intervención evaluada15-18. Algunos organismos que financian investigaciones han pasado ya a la acción. Por ejemplo, el Instituto Nacional de Investigación en Salud de Inglaterra exige a los solicitantes de financiación en investigación primaria que justifiquen cualquier investigación propuesta citando una revisión sistemática actual de investigación existente relevante para demostrar que han considerado los conocimientos de estudios previos20. Sin embargo, aún queda mucho por hacer.
Ante tales antecedentes, un grupo de investigadores decidió iniciar una red internacional (Evidence-based Research Network; EBRNetwork, http://ebrnetwork.org) para concienciar y afrontar este problema en la investigación en salud. La red pretende reducir el desperdicio en investigación al no fomentar nuevos estudios sin revisiones sistemáticas de pruebas imparciales (evidencia) existentes y mediante la creación, actualización y difusión eficientes de las revisiones sistemáticas.
No debe haber nuevos estudios sin revisión sistemática de pruebas imparciales (evidencias) existentes
La metodología de las revisiones sistemáticas requiere preguntas de investigación predefinidas, criterios de inclusión, métodos de búsqueda, procedimientos de selección, evaluación de calidad, extracción y análisis de datos, sin excluir estudios relevantes sin dar explicación alguna y que los resultados de todos los estudios contribuyan a las conclusiones de la revisión21 22. La formación científica básica para los investigadores debe incluir la comprensión de la necesidad de revisiones sistemáticas de pruebas imparciales (evidencias) existentes21,23 y la capacidad de evaluar, interpretar y utilizar de forma crítica estas revisiones. Debido a motivos científicos, éticos y económicos, las actuales revisiones sistemáticas de alta calidad deben tratarse como componente esencial en la toma de decisiones sobre si la realización de más estudios está justificada, sobre el diseño de nuevos estudios y sobre la interpretación de los resultados de nuevos estudios1-24.
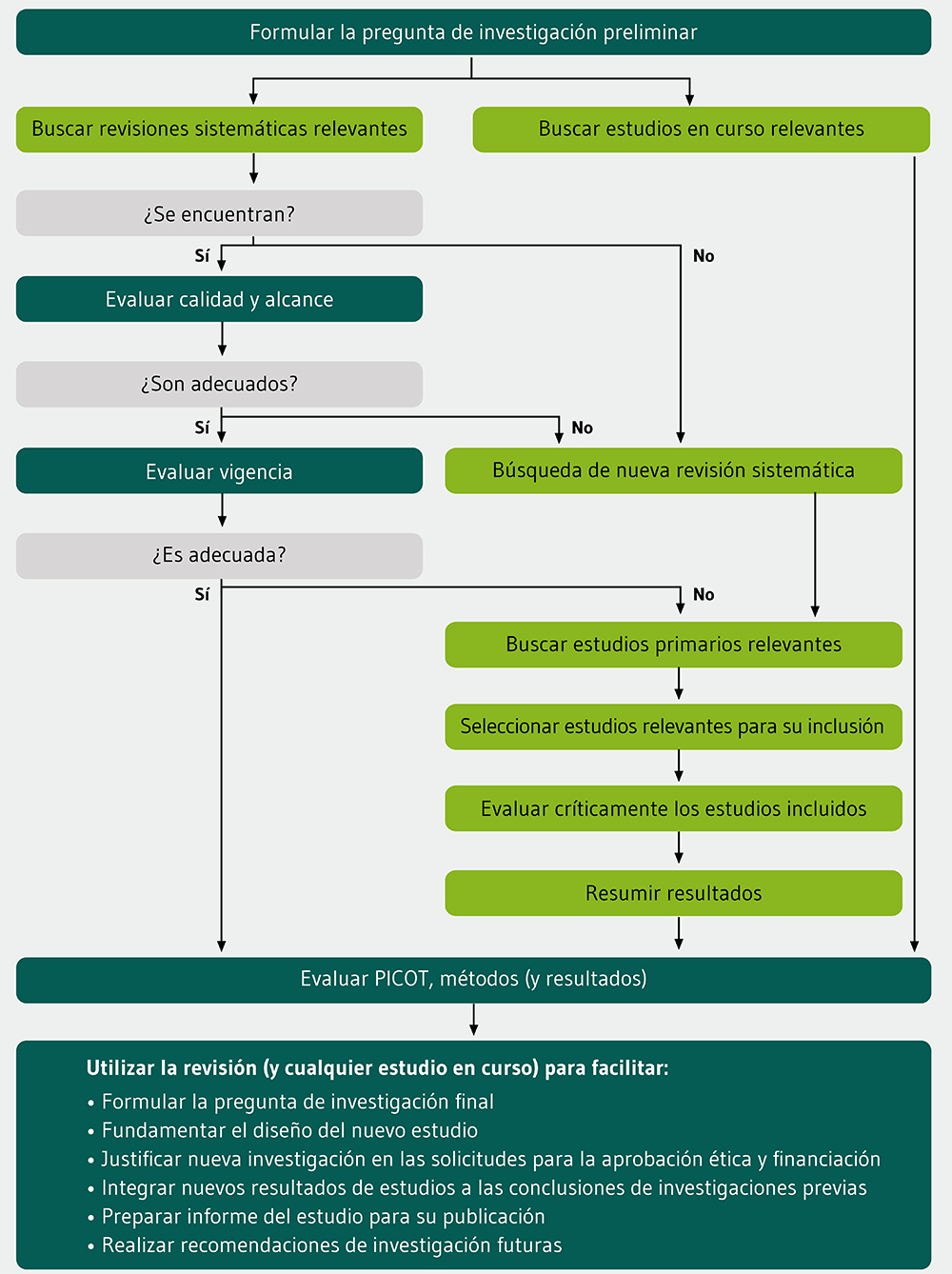
La Figura 1 muestra el proceso de la investigación basada en la evidencia, desde la pregunta de investigación inicial hasta la decisión final de continuar utilizando un diseño de estudio óptimo. El proceso propuesto pretende dar apoyo a los investigadores, no oprimirles ni pretender que proporcionen todas las respuestas: un análisis sistemático es sólo una de las muchas consideraciones en el planteamiento de la pregunta de investigación. Los investigadores pueden recurrir a la experiencia clínica, innovación y serendipia -similar al amplio abanico de consideraciones durante el proceso de revisión editorial de una revista-25.
El número de revisiones sistemáticas publicadas ha aumentado pronunciadamente en los últimos años26, por lo que (en principio) los investigadores de la mayoría de las áreas deberían ser capaces de identificar al menos una revisión relevante. Sin embargo, pese a que se disponga de revisiones sistemáticas, los investigadores aún se enfrentan a muchos retos. Por ejemplo, las revisiones sistemáticas identificadas pueden estar desactualizadas o ser de una calidad insuficiente, y necesitar por tanto un trabajo adicional (lo cual requiere habilidades pertinentes, tiempo y recursos) previo al estudio primario. Por otro lado, la falta de consideraciones y definiciones comunes en los estudios incluidos puede excluir una síntesis estadística de resultados y dificultar la integración de nuevos resultados.
El considerar estudios relevantes en curso en la preparación de revisiones sistemáticas y planificación de nuevos estudios plantea un reto más para la investigación basada en la evidencia. Aunque el registro de nuevos ensayos se ha convertido en norma27, ha habido menos progreso en el registro de otro tipo de estudios.
Creación, actualización y difusión eficientes
Llevar a cabo revisiones sistemáticas consume recursos y tiempo, y muchos investigadores clínicos no están formados para hacerlo. La integración de las revisiones sistemáticas en el contexto investigador no sólo desafía a los investigadores a adquirir las habilidades necesarias sino también a asegurar que cualquier intento de acelerar los procesos subyacentes no perjudica la calidad. Esto requiere cambios en la formación curricular; colaboración estrecha entre investigadores y bibliotecarios, especialistas en información y expertos informáticos; e inversión centrada en la optimización y automatización de los procesos.
En los últimos años varias iniciativas han empezado a abordar el problema. Principalmente, una serie de artículos acerca de cómo evitar el desperdicio en investigación28-34, llevó a la creación de la iniciativa REWARD (Reduce Waste and Reward Diligence [Reducción del Desperdicio y Recompensa de la Diligencia]; http://researchwaste.net/). También se han lanzado otras iniciativas importantes para preparar, actualizar, y difundir revisiones sistemáticas de forma más eficiente, como la Colaboración Cochrane35. La comprensión de que muchas de las tareas implicadas en la preparación de una revisión sistemática podrían automatizarse dio lugar a que en 2015 se estableciera la Colaboración Internacional para la Automatización de Revisiones Sistemáticas. Se han desarrollado nuevas formas para preparar y actualizar revisiones sistemáticas, como las “revisiones sistemáticas vivas”36-37. Se han utilizado metaanálisis acumulativos y otros métodos para identificar si se necesitan nuevas investigaciones38-41. Existen nuevos softwares de fácil manejo (http://systematicreviewtools.com/) de especial interés para los investigadores que planeen llevar a cabo una revisión sistemática. Para evitar la duplicación de esfuerzos y asegurar que todas las revisiones se publican, ahora es posible registrar revisiones sistemáticas en PROSPERO42, y existe otro registro destinado a revisiones sistemáticas de estudios en animales (http://www.syrcle.nl/).
Responsabilidades de la investigación basada en la evidencia
Nuestra declaración de investigación basada en la evidencia establece las responsabilidades de todos aquellos involucrados en la investigación en salud (recuadro). Como se muestra en la Figura 1, la responsabilidad del investigador es la de planificar y llevar a cabo una nueva investigación estando al tanto de las investigaciones previas y en curso relevantes para esta nueva investigación propuesta. Resulta innecesario preparar una nueva revisión sistemática si ya existen revisiones válidas. Todos los investigadores deberían poder buscar, evaluar de forma crítica e interpretar revisiones sistemáticas en el contexto de resultados de nuevos estudios. Se puede externalizar la realización o actualización de una revisión sistemática, aunque se ha sugerido que todos los investigadores de la salud deberían empezar su formación preparando al menos una revisión sistemática para garantizar que poseen conocimientos suficientes23.
Es crucial que, no sólo los investigadores, sino todos los actores clave en el proceso científico -como pacientes, financiadores y reguladores de la investigación, comités de ética y editoriales- reconozcan su responsabilidad en la investigación basada en la evidencia. El desperdicio en investigación y el daño innecesario a pacientes puede prevenirse concediendo la aprobación sólo a aquellas propuestas documentadas en una revisión sistemática actual. Exigir referencias a revisiones sistemáticas que sinteticen todos los estudios previos relevantes debe convertirse en un principio básico para todos aquellos que velen por el proceso investigador hasta su publicación.
Los investigadores y formadores con experiencia deben asegurarse de que a los nuevos investigadores se les enseña cómo llevar a cabo investigaciones basadas en la evidencia23. Por su parte, los especialistas en información y los bibliotecarios desempeñan un papel decisivo en la enseñanza a estudiantes de búsquedas sistemáticas de revisiones sistemáticas, así como en la preparación y publicación de estudios acerca de formas mejoradas de llevar a cabo búsquedas bibliográficas.
Por último, pero no por ello menos importante, la investigación y la financiación suficientes de la automatización en la realización de revisiones sistemáticas son cruciales para alcanzar y preservar la investigación basada en la evidencia, debido a que el volumen creciente de bibliografía sanitaria y el aumento en la complejidad de las intervenciones estudiadas26 hacen que sea imposible afrontar la carga de trabajo utilizando métodos manuales tradicionales de revisión.
Invitación a la acción
La tarea de identificar y abordar los retos de todas las partes interesadas sólo puede afrontarse con eficiencia a través de la colaboración internacional. La EBRNetwork ha preparado una hoja de ruta para las publicaciones (incluyendo una revisión sistemática sobre el estado actual y los efectos de la propia investigación basada en la evidencia) para concienciar acerca de los retos de los distintos grupos interesados (artículos de implicación) y para sugerir cómo lidiar con las tareas identificadas en la declaración de la investigación basada en la evidencia, o implícitas en esta, (artículos de guía). Para más información, consultar www.ebrnetwork.org.
DECLARACIÓN DE LA INVESTIGACIÓN BASADA EN LA EVIDENCIA
Aventurarse en la investigación cuando ninguna revisión sistemática muestre que existe una incertidumbre genuina, especialmente cuando la investigación implica personas y animales, no es ético, carece de rigor científico y es un desperdicio. Los investigadores, financiadores, entidades reguladoras y comités de ética/juntas de revisión institucional de investigación, editoriales de investigación, instituciones/formadores de investigación, y especialistas de información a menudo no utilizan sistemáticamente investigaciones previas cuando se preparan para iniciar, financiar o publicar resultados de nuevos estudios.
A continuación se establecen las responsabilidades de las partes interesadas para cumplir con los siguientes objetivos de la investigación basada en la evidencia:
No realizar nuevos estudios sin suficientes revisiones sistemáticas de pruebas (evidencias) existentes que justifiquen nuevas investigaciones, y
la producción, actualización y accesibilidad eficientes de las revisiones sistemáticas.
Objetivo 1: No realizar nuevos estudios sin suficientes revisiones sistemáticas de pruebas (evidencias) existentes que justifiquen nuevas investigaciones.
Investigadores:
Priorizar preguntas de investigación después de haber considerado sistemáticamente la totalidad de investigaciones previas y en curso relevantes.
Saber cómo buscar eficientemente revisiones sistemáticas y estudios en curso relevantes. Si la búsqueda indica que no existen revisiones sistemáticas actualizadas y relevantes, los investigadores deben conocer las opciones para preparar o actualizar la revisión necesaria.
Ser capaces de evaluar el riesgo de sesgo en revisiones sistemáticas.
Ser capaces de supervisar a estudiantes de estudios superiores en el uso y realización de revisiones sistemáticas.
Organismos de financiación:
Evaluar si los candidatos para recibir financiación han utilizado revisiones sistemáticas de investigaciones previas para identificar y ayudar a priorizar preguntas de investigación o agendas.
Evaluar si los candidatos han mostrado respaldo suficiente a su investigación propuesta mediante la referencia a revisiones sistemáticas de investigaciones previas.
Evaluar si los diseños de los nuevos estudios propuestos están documentados por revisiones sistemáticas de investigaciones previas.
Entidades reguladoras, incluyendo comités de ética de investigación/juntas de revisión institucional:
Evaluar si los candidatos han mostrado respaldo suficiente a sus preguntas de investigación mediante la referencia a revisiones sistemáticas de investigaciones previas. Esta expectativa se extiende más allá de ensayos con asignación aleatoria.
Evaluar si los diseños de los nuevos estudios propuestos han sido documentados mediante referencias a revisiones sistemáticas de investigaciones previas.
Editores y revisores:
Evaluar si la justificación y el diseño de los estudios están adecuadamente descritos en el contexto de revisiones sistemáticas de investigaciones previas.
Evaluar si la descripción de las investigaciones previas es suficiente para posibilitar la interpretación de los resultados de los estudios entregados dentro de la totalidad de la pruebas imparciales (evidencia) relevantes.
Evaluar si las propuestas de investigaciones adicionales tienen en consideración investigaciones previas y en curso.
Evaluar si las propuestas de investigaciones adicionales incluyen descripciones claras de poblaciones objetivo, intervenciones, comparaciones, medidas de resultados, y tipos de estudio.
Formadores:
Enseñar la importancia de una estrategia imparcial en la síntesis de los conocimientos (revisión sistemática).
Enseñar cómo buscar o realizar y utilizar revisiones sistemáticas en la planificación e interpretación de la investigación adicional.
Pacientes y consumidores:
Antes de acceder a participar en la investigación, los pacientes deberían exigir que los proyectos de investigación hayan sido documentados por revisiones sistemáticas de lo que ya se conoce.
Objetivo 2: Producción, actualización y accesibilidad eficientes de las revisiones sistemáticas.
Especialistas en revisiones sistemáticas:
-
Participar en actividades de investigación y desarrollo para:
a. Mejorar la realización y actualización de revisiones sistemáticas.
b. Desarrollar la automatización en la realización de revisiones sistemáticas.
c. Desarrollar herramientas para realizar revisiones sistemáticas con más eficiencia.
Especialistas en información y bibliotecarios
Ayudar a desarrollar métodos para aumentar la calidad y actualización de las búsquedas bibliográficas.
Participar en la enseñanza a los investigadores de cómo realizar búsquedas de calidad alta de estudios relevantes.
-
Participar en actividades de investigación y desarrollo para:
a. Mejorar la producción y actualización de revisiones sistemáticas.
b. Desarrollar la automatización en la realización de revisiones sistemáticas.
c. Desarrollar herramientas para realizar revisiones sistemáticas con más eficacia.
Informáticos, programadores e ingenieros de inteligencia artificial:
-
Participar en actividades de investigación y desarrollo para:
a. Mejorar la producción y actualización de revisiones sistemáticas.
b. Desarrollar la automatización en la realización de revisiones sistemáticas.
c. Desarrollar herramientas para realizar revisiones sistemáticas con más eficacia.
Organismos de financiación:
-
Respaldar el desarrollo y la investigación para:
a. Mejorar la producción y actualización de revisiones sistemáticas.
b. Desarrollar la automatización en la realización de revisiones sistemáticas.
c. Desarrollar herramientas para realizar revisiones sistemáticas con más eficacia.
Recomendaciones
Las instrucciones para los autores deberían incluir requisitos de pruebas imparciales (evidencia) que justifiquen la investigación para la que se solicita la publicación.
Las revisiones sistemáticas deberían reconocerse como investigación por derecho propio, comparables con otro tipo de actividad investigadora.
Se debería preparar, acordar y promover una clara definición de revisión sistemática de alta calidad.