My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ars Pharmaceutica (Internet)
On-line version ISSN 2340-9894
Ars Pharm vol.56 n.1 Granada 2015
https://dx.doi.org/10.4321/S2340-98942015000100007
Microorganismos probióticos y salud
Probiotic microorganisms and health
María Teresa Sánchez, María Adolfina Ruiz, María Encarnación Morales
Departamento de Farmacia y Tecnología Farmacéutica. Facultad de Farmacia. Universidad de Granada (España)
Dirección para correspondencia
RESUMEN
Objetivo: Mostrar los beneficios de los microorganismos probióticos sobre la salud y su aceptación por parte del consumidor, así como hacer una recopilación de todos los productos probióticos disponibles en el mercado farmacéutico.
Material y métodos: Se realizó un estudio del mercado farmacéutico en relación a las formas farmacéuticas con microorganismos probióticos existentes y su evolución en los últimos años. La clasificación de todos los productos probióticos se llevó a cabo en función de la forma farmacéutica en la que se presentan;cada producto irá acompañado de la dosis de microorganismos probióticos que contiene, expresada como Unidades Formadoras de Colonias (UFC).
Resultados: Es cada vez mayor el número de cepas probióticas aisladas y los beneficios mostrados sobre la salud del hombre. Encontramos gran diversidad de productos probióticos disponibles en oficinas de farmacia como consecuencia de una demanda cada vez mayor por parte del consumidor; no obstante, cabe resaltar el hecho de que muchos de ellos carecen en envase de información necesaria, por ejemplo, la dosis contenida.
Conclusiones: El interés por parte de la industria farmacéutica en lazar nuevas formas farmacéuticas contenidas en microorganismos probióticos será cada vez mayor e irá ligado a la necesidad de una reglamentación específica para estos productos. Muchos de ellos no contienen la dosis mínima requerida para obtener un efecto beneficioso en la salud lo que supone una publicidad engañosa para el consumidor, por tanto, deberían ser retirados del mercado, publicitando únicamente aquellos que contengan una dosis terapéutica y cuyos efectos estén avalados por diferentes ensayos clínicos.
Palabras clave: Beneficios en salud, Presentaciones farmacéuticas, Probióticos.
ABSTRACT
Aims: Show the benefits of the probiotic microorganisms on health and its acceptance by the consumer. As well as collect those probiotic products available in pharmaceutical market.
Materials and methods: A study of the pharmaceutical marketin relation to the existing dosage forms with probiotic microorganisms and their evolution in recent years was made. Classifying probiotic products was conducted according to the dosage form in which they are presented; each product must be accompanied by the dose of probiotic-containing, expressed as Colony Forming Units (CFU).
Results: It is increasing the number of probiotic strains isolated and the benefits that its shown on human health. We found a diversity of probiotic products available in pharmacies as a result of an increasing demand by consumers; it is important to note that many of them lack necessary information on packaging, for example, the dose contained.
Conclusions: The interest of the pharmaceutical industry in develop new dosage forms contained in probiotic microorganisms will be growing and will be linked to the need for a specific regulation for these products. Many of them do not contain the required dose to obtain a beneficial effect on health which is misleading advertising to consumers, therefore, they should be removed from the market, advertising only those products which contain a therapeutic dose and whose effects are endorsed by various clinical trials.
Key words: Health, Pharmaceutical Preparations, Probiotic.
Introducción
Desde tiempos inmemoriales se ha atribuido a los microorganismos un papel predominante en el entorno de nuestra vida, formando parte de todos los ecosistemas en los que nos movemos cotidianamente y ejerciendo una importante labor en nuestro organismo. En 1908, Elia Metchnikoff postuló por primera vez la importancia del consumo de leche fermentada con la especie Lactobacillus en la longevidad de los pastores de los Balcanes, mediante la supresión de las bacterias putrefactivas de la microbiota intestinal. Actualmente, tras numerosas redefiniciones, la FAO/OMS (2001) define probiótico como "microorganismos vivos que confieren efecto beneficioso para la salud del hospedador, cuando se administran en cantidad adecuada". Esta cantidad varía de un país a otro en función de su legislación; sin embargo, generalmente un producto probiótico debería contener >106- 108 CFU/g ó>108- 1010 UFC/dosis de células viables1. Además, los probióticos son definidos como seguros según el acrónimo inglés "GRAS" ("generallyrecognized as safe").
Los avances científicos de los últimos años respecto a la correlación existente entre la microbiota humana y el estado de salud del individuo avalan la necesidad de los mismos. Son numerosos autores los que tratan de evidenciarlos efectos beneficiosos que ejercen estos microorganismos sobre diferentes patologías, tales como:
- Diarrea: infantil2, diarrea asociada a antibióticos3, diarrea del viajero4.
- Enfermedad inflamatoria intestinal (EII): colitis ulcerosa5 y enfermedad de Crohn6.
- Intolerancia a la lactosa7.
- Úlcera gastroduodenal 8.
- Infecciones del tracto respiratorio 9.
- Reducción de los niveles de colesterol 10;11.
- Efectos contra la obesidad12 y diabetes13
- Alergias 14;15, enfermedades de la piel y eczemas16.
- Cáncer17.
- Vaginitis y enfermedades urogenitales18.
Las cepas probióticas comúnmente usadas pertenecen a los géneros Lactobacillus, Bifidobacterium, E.coli Nissle 1917 y Saccharomyces boulardii. No todos los probióticos poseen las mismas propiedades beneficiosas. Además, cuando se adscribe un efecto beneficioso a una cepa, este no se puede extrapolar a las restantes cepas de la misma especie. Se han realizado ensayos clínicos usando diferentes cepas y formulaciones, obteniéndose como conclusión final que no sólo hay que tener en cuenta la especificidad de la cepa o la localización de la enfermedad diana; sino que la dosis, ruta, duración y frecuencia de administración también deben considerarse cuidadosamente 19. Así, para obtener beneficios sobre la salud, es recomendada una dosis de 5 mil millones de unidades formadoras de colonias (UFC) durante al menos 5 días (5x109UFC / día) 20. Puesto que la principal vía de administración de los microorganismos probióticos es la vía oral, con objeto de proporcionar estos efectos beneficiosos en el hospedador, las bacterias probióticas deben sobrevivir a lo largo del tracto gastrointestinal, tolerar el ácido, la bilis y las enzimas a nivel gástrico y, posteriormente, adherirse al epitelio intestinal 21; es por ello que deben administrarse incluidos en formas farmacéuticas o bien en alimentos que le otorguen protección frente a esas condiciones adversas. Estos productos probióticos, además, deben garantizar la supervivencia de los microorganismos en forma viabledurante el almacenamiento hasta el final de vida útil (>106 UFC/g) 22. El interés comercial de los probióticos se ve acrecentado de forma paulatina, según se avanza en el conocimiento acerca de la relación existente entre ellos y la microbiota intestinal, su interacción y el desencadenamiento de una serie de efectos positivos sobre el individuo, por tanto, abren una alternativa muy esperanzadora tanto en el ámbito de la alimentación funcional como en la mejora y profilaxis de determinadas patologías.
Por todo ello, el objetivo fundamental del presente trabajo ha sido realizar una exhaustiva revisión de las formas farmacéuticas portadoras de bacterias probióticas existentes en nuestro país, así como de sus ventajas, inconvenientes, dosis y efectividad.
Materiales y métodos
En primer lugar, se pretende analizar la evolución y relevancia de los productos probióticos en el sector farmacéutico durante los últimos años, así como la demanda esperada para tiempos futuros. Con este fin, se utilizaron las páginas Web PubMed, ScienceDirect y la revista electrónica El probiótico como principales fuentes para la búsqueda de los trabajos de investigación más interesantes publicados sobre la materia. Por otro lado, se realizó un estudio de mercado, con objeto de especificar todas aquellas modalidades farmacéuticas que podemos encontrar en oficinas de farmacia a disposición del consumidor. Para ello, fue imprescindible la información aportada por el Centro de Información del Medicamento, contrastada con los datos facilitados por los laboratorios implicados. La información así obtenida fue cuidadosamente analizada, resaltando aquellos resultados más relevantes en cuanto al desarrollo de nuevas formas farmacéuticas con microorganismos probióticos y sus exigencias.
Resultados y discusión
El creciente interés de mercado en promover la salud de forma natural ha intensificado la investigación en este área. Un análisis global reciente acerca del mercado de probióticos estimó un crecimiento anual del 7%, impulsado principalmente por un aumento de petición por parte de los consumidores asiáticos y europeos, con un pronóstico de 48 billones de dólares en los próximos 5 años (GlobalIndustryAnalysisReport 2012). Asimismo, podemos encontrar probióticos bajo diferentes modalidades farmacéuticas como especialidades farmacéuticas de administración oral, suplementos dietéticos, soluciones de rehidratación oral, preparados para lactantes y especialidades de uso urogenital; así como incluidos en una gran variedad de alimentos. Mientras que estos alimentos se relacionan con el mantenimiento del funcionamiento normal del organismo o con la reducción de los riesgos de enfermedad en un amplio núcleo de población tanto sanos como no tan sanos; las modalidades farmacéuticas son consideradas como una solución terapéutica primaria en una situación de enfermedad especifica 23.
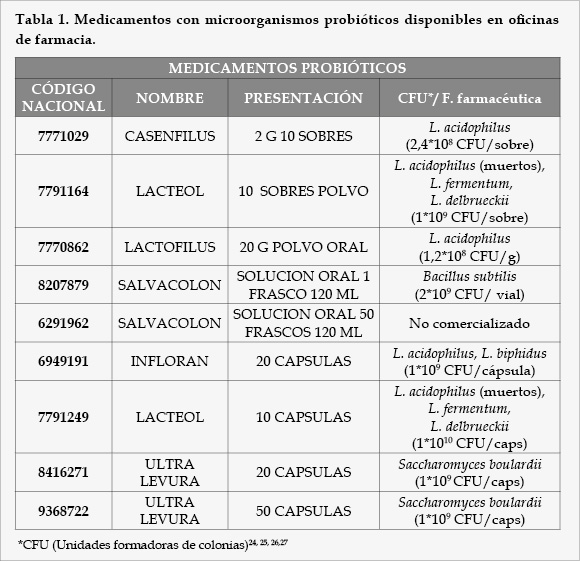
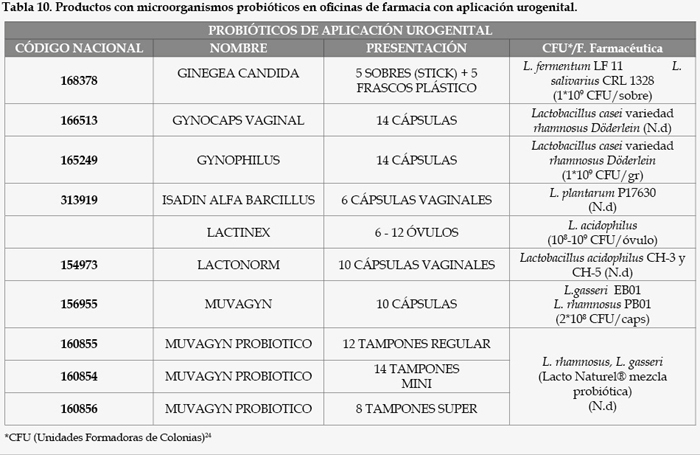
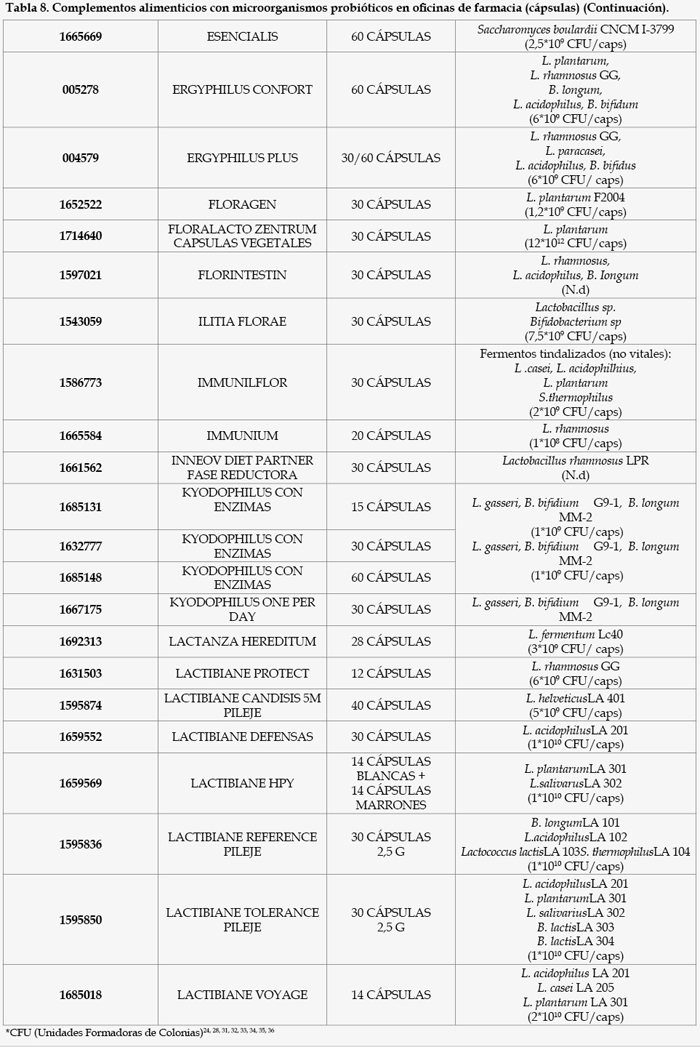
Como resultado de un exhaustivo análisis del mercado farmacéutico en España, encontramos que las diferentes modalidades farmacéuticas contenidas en microorganismos probióticos disponibles en oficinas de farmacia son las siguientes (Tablas 1, 2, 3, 4, 5, 6, 7, 8, 9, y 10).



Como podemos observar, la mayor parte de los productos comercializados son en forma de cápsulas o sobres mientras que los comprimidos disponibles son mínimos. La falta de comprimidos con probióticos y el solapamiento con otras formas farmacéuticas, mayoritariamente cápsulas, ha ido en detrimento de la dosis de bacterias administrada por forma farmacéutica, la cual debe ser suficiente para generar un efecto satisfactorio sobre la salud del paciente. Así, las condiciones tecnológicas empleadas para la obtención de cápsulas son menos agresivas, por tanto, la supervivencia de las bacterias será muy alta y permitirá un menor coste de producción. Por el contrario, la compresión requiere de presiones altas que conlleva la pérdida de una gran parte de las bacterias.
Sin embargo, son múltiples las ventajas que nos aportan los comprimidos y no las cápsulas, como puede ser el permitirnos alcanzar una liberación controlada o modificada del principio activo. En estos últimos años, la investigación en el diseño de formas farmacéuticas se ha centrado en la búsqueda de sistemas que permitan controlar el momento, lugar y velocidad de liberación del principio activo tras su administración. Las razones, entre otras, se derivan del deseo de alcanzar la liberación prolongada de los compuestos altamente solubles en agua, alcanzar velocidades de liberación que responden a un objetivo dado, disminuir el número de administraciones diarias y reducir al mínimo efectos secundarios. Es por ello, que se plantea como centro de las investigaciones futuras el diseño y desarrollo de comprimidos probióticos que supongan una gran innovación en el sector y que aporten un control en la liberación del probiótico contenido.
La disponibilidad de microorganismos probióticos en gran diversidad de alimentos, complementos alimenticios y especialidades farmacéuticas está proporcionando cambios para el consumidor y personal sanitario en cuanto a la elección del producto óptimo para una adecuada aplicación en la persona indicada.
El problema principal asociado al comercio de estos productos reside en la carencia de información suficiente en el etiquetado de muchos de ellos (UFC/uda/ g, cepas contenidas, ensayos clínicos realizados que avalen su eficacia...) siendo esto un motivo de desconfianza por parte del consumidor acerca de los beneficios sobre su salud que ofertan. El interés por parte de la Industria Farmacéutica en el desarrollo de nuevas especialidades contenientes en microorganismos probióticos deberá ir ligado al establecimiento de una regulación para los mismos con objeto de presentar aquella información asociada a disposición del consumidor.
Conclusión
En base a lo anteriormente expuesto, parece claro que la utilización de microorganismos probióticos como potenciadores de la salud constituye una herramienta prometedora en el avance de diversos campos como el alimentario o el farmacéutico y con ello surge la necesidad de desarrollar nuevas especialidades farmacéuticas y otros productos portadores de los mismos. El éxito de estos microorganismos depende del medio que se utilice para administrarlos, es por ello que se debe resaltar la importancia que tienen las formas farmacéuticas en asegurar la protección de estos microorganismos en todo momento permitiendo la llegada de estos en un número suficiente al lugar de acción. Solo así se garantizará la obtención de los efectos positivos sobre la salud del consumidor, puesto que es recomendada una dosis de al menos 5 mil millones de unidades formadoras de colonias durante mínimo 5 días (5 x 109 UFC / día).
Como se ha dicho anteriormente, la demanda de estos productos probióticos está en alza, lo cual plantea un reto para la industria farmacéutica, que deberá seleccionar aquellos procesos tecnológicos y condiciones de producción adecuados a el fin de solventar los problemas asociados a la sensibilidad de estos microorganismos probióticos; garantizando finalmente una dosis óptima en cada forma farmacéutica. Se debe plantear el desarrollo de formas farmacéutica innovadoras, que supongan un avance en este ámbito, con la finalidad de controlar la liberación de la carga probiótica contenida.
No obstante, se necesita una regulación específica que establezca parámetros de seguridad, dosis y etiquetado. La regulación sobre cuestiones nutricionales y de salud existente en Europa, se espera que ayude a poner orden en las alegaciones de los productos, si bien no debería impedir el desarrollo y la innovación en el sector; debería eliminar del mercado aquellos productos que no cumplan con la definición o que reivindican beneficios sobre la salud no fundamentados permitiendo a los productos farmacéuticos obtener el reconocimiento que merecen, basado en investigaciones realizadas.
Agradecimientos
Queremos expresar nuestro agradecimiento a la Farmacia Josefina Tarifa, La Rábita (Granada) por la ayuda prestada en la consecución de este trabajo.
Conflicto de interés: Undeclared
Financiación: Undeclared
Bibliografía
1. Champagne CP, Ross RP, Saarela M, Hansen KF, Charalampopoulos D. Recommendations for the viability assessment of probiotics as concentrated cultures and in food matrices. Int J Food Microbiol. 2011; 149: 185-193. [ Links ]
2. Dubey AP, Rajeshwari K, Chakravarty A, Famularo G. Use of VSL#3 in the treatment of rotavirus diarrhea in children: preliminary results. J Clin Gastroenterol.2008; 42 (Suppl. 3 Pt 1): 126-129. [ Links ]
3. Hempel S, Newberry SJ, Maher AR, Wang Z, Miles JN, Shanman R. Probiotics for the prevention and treatment of antibiotic-associated diarrhea:a systematic review and meta-analysis. JAMA. 2012; 307:1959-69. [ Links ]
4. De Vrese M, Offick B. Probiotics and Prebiotics: Effects on Diarrhea. Bioactive Foods in Promoting Health: Probiotics and Prebiotics. 2010; Chapter 14. [ Links ]
5. Meijer BJ, Dieleman LA. Probiotics in the treatment of human inflammatory bowel diseases. J Clin Gastroenterol. 2011; 45: 139-144. [ Links ]
6. Guslandi M, et al. Saccharomyces boulardii in maintenance treatment of Crohn's disease. Dig Dis Sci. 2000; 45: 1462-1464. [ Links ]
7. Montalto M, Curigliano V, Santoro L, et al. Management and treatment of lactose malabsorption. World J Gastroenterol. 2006; 12:187-191. [ Links ]
8. Gotteland M, Brunser O, Cruchet S. Systematic review: are probiotics useful in controlling gastric colonization by Helicobacter pylori? Aliment Pharmacol Ther. 2006; 23: 1077-1086. [ Links ]
9. Alexandre Y, Le Blay G, Boisramé-Gastrin S, Le Gall F, Héry-Arnaud G, Gouriou S, Vallet S, Le Berre R. Probiotics: A new way to fight bacterial pulmonary infections? Les probiotiques: une nouvelle armethérapeutiquecontre les infections respiratoires?. Med Mal Infect. 2014; 44: 9-17. [ Links ]
10. Larsen LA, Raben A, Haulrik N, Hansen AS, Manders M, Astrop A. Effect of 8 week intake of probiotic milk products on risk factors for cardiovascular diseases. Eur J Clin Nutr. 2000; 54: 288-297. [ Links ]
11. Xiao JZ, Kondo S, Takahashi N et al. Effects of milk products fermented by Bifidobacteriumlongum on blood lipids in ratsand healthy adult male volunteers. J Dairy Sci. 2003; 86 (7): 2452-2461. [ Links ]
12. Tulika A, Satvinder S, Kumar Sharma R. Probiotics: Interaction with gut microbiome and antiobesity potential. Nutrition. 2013; 29: 591-596. [ Links ]
13. Qin J, Li Y, Cai Z, Li S, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012; 490:55-60. [ Links ]
14. Waligora-Dupriet AJ, Butel MJ. Microbiota and allergy: from dysbiosis to probiotics. En: Pereira C, editor. Allergic diseases-highlights in the clinic, mechanisms and treatment. 2012; p. 413-434. [ Links ]
15. Ozdemir O. Various effects of different probiotic strains in allergic disorders: an update from laboratory and clinical data. Clin Exp Immunol. 2010; 160:295-304. [ Links ]
16. Bunselmeyer B, Buddendick K. Probiotics and Prebiotics-Prevention and Therapy in Atopic Eczema. Bioactive Foods in Promoting Health: Probiotics and Prebiotics. 2010 [ Links ]
17. Serban DE. Gastrointestinal cancers: Influence of gut microbiota, probiotics and prebiotics. Cancer letter. 2013; 345: 258-270. [ Links ]
18. Iannitti T, Palmieri B. Therapeutical use of probiotic formulations in clinical practice. Clinical Nutrition. 2010; 29:701-725. [ Links ]
19. Theodorakopoulou M, Perros E, Giamarellos-Bourboulis EJ, Dimopoulos G. Controversies in the management of the critically ill: the role of probiotics. Int J Antimicrob Agents. 2013; 42S: S41-S44. [ Links ]
20. Gupta V, Garg R. Probiotics. Indian J Med Microbiol. 2009; 136: 2015-2031. [ Links ]
21. Huang Y, Adams MC. In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria. Int J Food Microbiol. 2004; 91(3): 253-260. [ Links ]
22. Chaikham P, Apichartsrangkoon A, Jirarattanarangsri W, Van de Wiele T. Influence of encapsulated probiotics combined with pressurized longan juice on colon microflora and their metabolic activities on the exposure to simulated dynamic gastrointestinal tract. Food Res Int. 2012; 49: 133-142. [ Links ]
23. Foligné B, Daniel C, Pot B. Probiotics from research to market: the possibilities risk and challenges. Curr Opin Microbiol. 2013; 16: 284-292. [ Links ]
24. CIM (Centro Información Medicamento). [ Links ]
25. https://www.casenfleet.com (consulta 10/03/2014) [ Links ]
26. https://www.salvatbiotech.com (consulta 10/03/2014) [ Links ]
27. https://www.suplements.com (consulta 10/03/2014) [ Links ]
28. https://www.stada.es (consulta 10/03/2014) [ Links ]
29. https://www.sorianatural.es (consulta 10/03/2014) [ Links ]
30. https://www.arkopharma.es (consulta 11/03/2014) [ Links ]
31. https://www.pileje.es (consulta 11/03/2014) [ Links ]
32. https://www.aquilea.com (consulta 11/03/2014) [ Links ]
33. https://www.nutergia.es (consulta 12/03/2014) [ Links ]
34. https://www.inneov.es (consulta 12/03/2014) [ Links ]
35. https://www.dhu.es (consulta 13/03/2014) [ Links ]
36. https://www.bayer.es (consulta 13/03/2014) [ Links ]
37. https://www.ordesa.es (consulta 14/03/2014) [ Links ]
38. Brandy LJ, Gallaher DD, Busta FF. The role of probiotic cultures in the prevention of colon cancer. J Nutr. 2000; 130 (suppl. 2S): 410S-414S. [ Links ]
39. Chen CC, Louie S, Shi HN, Walker WA. Preinoculation with the probiotic Lactobacillus acidophilus early in life effectively inhibits murine Citrobacterrodentium colitis. Pediatr Res. 2005; 58: 1185-1191. [ Links ]
40. De Vrese M, Offick B. Bioactive Foods in Promoting Health. Institute of Physiology and Biochemistry of Nutrition, Federal Dairy Research Center, Kiel, Germany. 2005; 205- 227. [ Links ]
41. Elmer GW, McFarland LV. Biotherapeutic agents in the treatment of infectious diarrhea. Gastroenterol Clin. 2001; 30: 837-854. [ Links ]
42. Furrie E. Probiotics and allergy. Proc Nutr Soc. 2005; 64:465-469. [ Links ]
43. Galvez J, Comalada M, Xaus J. Prebiotics and Probiotics in Experimental Models of Rodent Colitis: Lessons in Treatment or Prevention of Inflammatory Bowel Diseases. Bioactive Foods in Promoting Health: Probiotics and Prebiotics. 2010; Chapter 35. [ Links ]
44. Ghadimi D, Fölster-Holst R, de Vrese M, Winkler P, Heller KJ, Scherenmeir J. Effect of probiotic bacteria and their genomic DNA on Th1/ th2- cytokine production by peripheral blood mononuclear cells of healthy and allergic subjects. Inmunobiology. 2008; 213: 677-692. [ Links ]
45. Guarino A, Canani NB, Spagnuolo MI. Oral bacterial therapy reduces the duration of symptons and of viral excretion in children with mild diarrea. J Pediatr Gastroenterol Nutr.1997; 25:516-519. [ Links ]
46. Homayoni A, Vaghef E, Alipoor B, Vaghef L, Javadi M. Do probiotics act more efficiently in foods than in supplements? Nutrition. 2012; 28: 733-736. [ Links ]
47. Kalliomaki MA, Isoulari E. Probiotics and down regulation of the allergic response. Inmunol Allergy Clin North Am. 2004 ;24: 739-752. [ Links ]
48. Kieran M, Hollie M, Chris W, Glann R. Using probiotics and prebiotics toimprove gut health. DDT. 2003; 8: 692-700. [ Links ]
49. Lara-Villoslada F, Olivares M, Xaus J. Safety of probiotic bacteria. Bioactive Foods in Promoting Health: Probiotics and Prebiotics. 2010; 4: 47-58. [ Links ]
50. Lievin L, Peiffer V, Hudault I, et al. Bifidobacterium strains from resident infant human gastrointestinal microflora exert antimicrobial activity. Gut. 2000; 47: 646-652. [ Links ]
51. Lin MY, Yen CL, Chen SH. Management of lactose maldigestion by consuming milk containing Lactobacilli. Dig Dis. 1998; 43: 133-137. [ Links ]
52. López C, De la Cruz J, Urbanos C. Uso potencial de los probióticos. FMC. 2006; 13(10): 622-627. [ Links ]
53. Madsen K, Cornish A, Soper P, et al. Probiotic bacteria enhance murine and human intestinal epithelial barrier function. Gastroenterology. 2001; 121: 580-591. [ Links ]
54. Marteau P, Shanahan F. Basic aspects and pharmacology of probiotics: an overview of pharmacokinetics, mechanisms of action and side-effects. Best Pract Res Clin Gastroenterol. 2003; 17: 725-740. [ Links ]
55. McFarland LV. Epidemiology, risk factors and treatments for antibiotic associated diarrhea. Dig Dis. 1998; 16: 292-307. [ Links ]
56. Morrison DJ, Mackay WG, Edwards CA, et al. Butyrate production from oligofructose fermentation by the human faecal flora: What is the contribution of extracellular acetate and lactate? Br J Nutr. 2006; 96: 570-577. [ Links ]
57. Nguyen TD, Kang JH, Lee MS. Chacarterization of Lactobacillus plantarumPH04, a potential probiotic bacterium with cholesterol-lowering effects. Int J Food Microbiol. 2007; 113: 358-361. [ Links ]
58. Ouwehand AC, Salminen S, Isolauri E. Probiotics: an overview of beneficial effects. Antonie Van Leeuwenhoek. 2002; 82: 279-289. [ Links ]
59. Patel A, Shah N, Prajapati JB. Clinical appliance of probiotics in the treatment of Helicobacter pylori infection - a brief review. MikrobiolZh. 2013; XX: 1-9. [ Links ]
60. Podolsky DK. Inflammatory Bowel Disease. N Engl J Med. 2002; 347 (6): 417-421. [ Links ]
61. Preidis GA, Versalovic J. Targeting the human Microbiome with antibiotics, probiotics and prebiotics: gastroenterology enters the metagenomics era. Gastroenterology. 2009; 136:2015-2031. [ Links ]
62. Ramos A, Monteoliva M, Nader FE, editores. Probióticos y salud. Parte segunda: Probióticos y Salud Humana. Capítulos 3,4,7,8,9,15,21,24,25,26. [ Links ]
63. Sanders ME, Heimbach JT, Pot B, et al. Health claims substantiation for probiotic and prebiotic products. Gut microbes. 2011; 2: 127-133. [ Links ]
64. Schultz M, Linde HJ, Lehn N, et al. Immunomodulatory consequences of oral administration of Lactobacillus rhamnosus strain GG in healthy volunteers. J Dairy Res. 2003; 70: 165-173. [ Links ]
65. Talaie F, Atyabi F, Azjdarzadeh M, Dinarvand R, Saadatzadeh A. Overcoming therapeutic obstacles in inflammatory bowel diseases: A comprehensive review on novel drug delivery strategies. Eur J Pharm Sci. 2013; 49: 712-722. [ Links ]
66. Taranto MP, Medici M, Perdigon G, Ruiz Holgado AP, Valdez GF. Evidence for hypocholesterolemic effect of Lactobacillus Reuteri in hypercholesterolemic mice. J Dairy Sci. 2000; 81: 2336-2340. [ Links ]
67. Zhu Y, Luo M, Jobin C, Young H. Gut microbiota and probiotics in colon tumorigenesis. Cancer Letters. 2011; 309: 119-127. [ Links ]
68. Zyrek A A, Cichon C, Helms S, et al. Molecular mechanisms underlying the probiotic effects of Escherichia coli Nissle 1917 involve ZO-2 and PKC zeta redistribution resulting in tight junction and epithelial barrier repair. Cell Microbiol. 2007; 9: 804-816. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dra. María Adolfina Ruiz.
Dpto. Farmacia y Tecnología Farmacéutica.
Facultad Farmacia, Universidad de Granada.
Campus Cartuja, s/n
18071, Granada, España.
Received: 17.06.2014
Accepted: 10.11.2014