My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ars Pharmaceutica (Internet)
On-line version ISSN 2340-9894
Ars Pharm vol.57 n.4 Granada Oct./Dec. 2016
https://dx.doi.org/10.30827/ars.v57i4.5564
ARTÍCULO DE REVISIÓN
La lucha contra el gusano de Guinea o la recompensa del esfuerzo solidario
The fight against the Guinea worm or the reward of the solidarity endeavor
Francisco Javier Adroher
Departamento de Parasitología, Facultad de Farmacia, Universidad de Granada.
Dirección para correspondencia
RESUMEN
Introducción: Dracunculus medinensis o gusano de Guinea es el mayor nematodo parásito del hombre y causa unas úlceras que generan una importante incapacidad durante 2-4 meses, generalmente, que coincide con los periodos de siembra o recogida de las cosechas. Por ello, esta enfermedad, denominada dracunculosis, provoca importantes pérdidas económicas. En sociedades pobres, las más afectadas, estas pérdidas las mantienen en un círculo vicioso de pobreza del que no pueden salir sin ayuda. La dracunculosis forma parte del grupo de enfermedades tropicales olvidadas que, según la OMS, afecta a más de 1000 millones de pobres del mundo.
Objetivo: Dar a conocer a la sociedad científica hispanohablante el estado actual de la enfermedad y de su lucha contra ella.
Material y métodos: Se ha llevado a cabo una búsqueda bibliográfica en bases de datos científicas, especialmente PubMed (Medline) de la Biblioteca Nacional de Medicina (NML) de Estados Unidos, y se han revisado los informes publicados por los principales organismos e instituciones implicados en la lucha contra la dracunculosis, especialmente The Carter Center, la Organización Mundial de la Salud y Centers for Disease Control and Prevention (CDC) de EE.UU.
Resultados: En 1986 se inició una campaña de erradicación basada en las características epidemiológicas de la enfermedad y en la implicación de los países endémicos, lo que permitía plantear ese objetivo, aprobado por la Asamblea Mundial de la Salud en 1981. Este parásito se distribuía por 18 países de África y 3 de Asia, afectando a 5-10 millones de pobres, según la OMS. El esfuerzo solidario de instituciones, fundaciones, empresas y personal, sobre todo voluntario, ha permitido reducir el número de casos en más del 99,99% tras 30 años de campaña. En 2015 se han contabilizado sólo 22 casos limitados a 4 países de África: Malí, Etiopía, Sudán del Sur y Chad. En 2016 se han detectado 25 casos: 16 en Chad, 3 en Etiopía, 6 en Sudán del Sur y ninguno en Malí (datos provisionales1).
Conclusión: Se trabaja con la esperanza de que en 2020 la enfermedad esté erradicada del planeta, siendo así la primera de un parásito, mostrándose además que el trabajo de educación sanitaria de la población afectada ha resultado vital para el éxito de la campaña de erradicación.
Palabras clave: Gusano de Guinea; dracunculosis; Dracunculus medinensis; pobreza; ciclo de vida; voluntariado; solidaridad; educación sanitaria; erradicación.
ABSTRACT
Introduction: Dracunculus medinensis or Guinea worm is the largest nematode parasite in man and causes ulcers that generate a major disability generally for 2-4 months, coinciding with the periods of planting or harvesting of the crops. Therefore, this disease, denominated dracunculiasis, causes important economic losses. In poor societies, those most affected, these losses keep them in a vicious circle of poverty from which they can not leave without help. Dracunculiasis is one of a group of Neglected Tropical Diseases that, according to the WHO, affects more than 1 billion poor people in the world.
Objective: Introduce to the Spanish-speaking scientific community about the current status of the dracunculiasis and its fight against it.
Material and methods: A bibliographic search has been carried out in scientific databases, especially PubMed (Medline) of the National Library of Medicine (NML) of the United States, and the reports published by the main organisms and institutions involved in the fight against dracunculiasis have been reviewed, especially those of The Carter Center, the World Health Organization and Centers for Disease Control and Prevention (CDC).
Results: An eradication campaign was initiated in 1986, based on the epidemiological characteristics of the disease and the involvement of endemic countries, which allowed to raise that objective, adopted by the World Health Assembly in 1981. This parasite was occurring in 18 countries of Africa and 3 of Asia, affecting 5-10 million poor people, according to WHO. The solidarity effort of institutions, foundations, companies and people, especially volunteers, has allowed to reduce the number of cases in more than 99.99% after 30 years of campaign. In 2015, only 22 cases limited to 4 African countries were recorded: Mali, Ethiopia, South Sudan and Chad. In 2016, 25 cases have been detected: 16 in Chad, 3 in Ethiopia, 6 in South Sudan and none in Mali (provisional data1).
Conclusion: It works in the hope that in 2020 the disease will be eradicated from the planet, thus being the first of a parasite. This fight also shows that the health education work on the affected population, carried out jointly by volunteers and officials, is vital to the success of this eradication campaign.
Keywords: Guinea worm; dracunculiasis; Dracunculus medinensis; life cycle; poverty; volunteering; solidarity; health education; eradication.
Introducción
La enfermedad del gusano de Guinea es una enfermedad discapacitante, denominada también dracunculosis o dracontiasis, causada por un nematodo parásito Dracunculus medinensis (Linneo, 1758), conocido y temido desde la Antigüedad. La Organización Mundial de la Salud (OMS/WHO) estimaba en los años 80 del pasado siglo que la enfermedad del gusano de Guinea afectaba de 5 a 10 millones de los pobres de 21 países de África y Asia (Fig. 1), incluyéndose dentro del grupo de 17 enfermedades tropicales olvidadas (Neglected Tropical Diseases) y que en su conjunto afectan a más de 1000 millones de personas olvidadas. Pero en los años cuarenta del pasado siglo, afectaba a unos 50 millones de personas2, con una alta mortalidad debida a infecciones secundarias y, aunque hoy en día no pone en peligro la vida de las personas ya que su mortalidad se ha reducido considerablemente gracias a los antibióticos y a la higiene3, sí supone para los enfermos de todas las edades largos periodos de incapacidad y dolor de hasta 6 meses o más, que inciden directa y negativamente en su economía doméstica y, consecuentemente, en su nivel socioeconómico, conduciendo a un círculo vicioso que no permite salir a las familias con pocos recursos de su situación de pobreza, especialmente aquellas que sobreviven gracias al campo. Pero esta situación se puede y se debe evitar. Por ello, la Asamblea Mundial de la Salud, órgano político de la OMS, en 1981, aprobó una campaña de erradicación de la enfermedad del gusano de Guinea. Y el logro está próximo.
Material y métodos
Este artículo se ha elaborado tras revisión bibliográfica en la base de datos, de uso libre en internet, PubMed (Medline) de la Biblioteca Nacional de Medicina (NLM) de EE.UU. empleando los términos de búsqueda "Guinea worm", "dracontiasis" y el término truncado "dracuncul*" que incluye "dracunculosis", "dracunculiasis" y "Dracunculus". Así mismo se empleó el término "medinensis" que incluye los artículos con los diversos nombres con el que se ha conocido el parásito y que son sinonimias del mismo, como "Dracunculus medinensis", "Vena medinensis", "Filaria medinensis", "Gordius medinensis", ... Estos términos fueron cruzados con "eradication", "history" (que incluye "life history"), "life cycle" o "lifecycle". Igualmente acudimos a las webs de los organismos y fundaciones implicados en el programa de erradicación de la dracunculosis, es decir, de la Organización Mundial de la Salud (www.who.int ), de Centers for Disease Control and Prevention de EE.UU. (CDC) (www.cdc.org) y de The Carter Center (www.cartercenter.org), aunque también visitamos y recogimos alguna información de otras instituciones que colaboran o lideran campañas sanitarias en el tercer mundo como Rotary International (www.rotary.org), Bill and Melinda Gates Foundation (www.gatesfoundation.org), Neglected Tropical Diseases Support Center (www.ntdsupport.org) y otros, de donde recogimos datos procedentes de informes relativos a este parásito o a la enfermedad que produce.
Resultados
La enfermedad del gusano de Guinea y sus consecuencias en el hombre y la sociedad
La enfermedad del gusano de Guinea causa úlceras, generalmente en pies y piernas, muy dolorosas y ardientes, que impiden al enfermo andar normalmente, incapacitándolo generalmente por 2-4 meses de media. Esas úlceras, si no se cuidan, se convierten en vías de entrada de patógenos que agravan la incapacidad de los enfermos y pueden conducir a su muerte por tétanos, gangrena, septicemia, etc.
Esta incapacidad incide directamente en la economía doméstica de las personas afectadas y, consecuentemente, en su nivel socioeconómico. En estas familias, el padre trabaja en el campo, la madre en la casa y los hijos procuran ir a la escuela. Los padres van sacando adelante la economía familiar, mientras los hijos se van formando para un futuro mejor. Pero si el padre sufre la enfermedad del gusano de Guinea, que coincide, por sus características epidemiológicas, con el momento de la siembra o de la recogida de la cosecha, habrá importantes pérdidas en la economía familiar. Los hijos dejarán la escuela para sustituir al padre en su labor en el campo, con ayuda de las madres4, perdiendo así su oportunidad de adquirir una formación que les pueda augurar un futuro mejor. Este absentismo escolar también se produce porque el niño se infecte, pues al menos un tercio de los casos de enfermedad ocurren en niños. En este sentido se ha calculado que, en áreas endémicas, el absentismo escolar supone la pérdida del 25% de los días de clase, mientras en las no endémicas la pérdida es sólo del 2,5%5, 10 veces menor. A veces, es toda la familia la que se ve afectada. Por tanto, la economía familiar se puede hundir. Así, nunca se sale de ese círculo de pobreza. Las familias pobres, seguirán siendo pobres. Las sociedades no se desarrollarán, pues habrá baja productividad agraria, baja asistencia a la escuela, madres enfermas que deben atender a niños pequeños, quizás también enfermos, y que debido a su incapacidad no los llevarán a sus revisiones médicas o a sus vacunaciones, ya que para ello también deben desplazarse a pie. En estas sociedades aldeanas llegaban a estar afectados simultáneamente hasta el 50% de sus habitantes6 y muchos con más de un gusano, generalmente entre 1 y 3, aunque se han descrito casos de individuos con más de 40 gusanos7.
Por tanto, la lucha contra el gusano de Guinea mejora no sólo la salud de los individuos, sino la productividad de la sociedad, promoviendo su desarrollo socio-económico8. En este sentido el Banco Mundial calcula que para un periodo estimado de incapacidad de 1,5 meses, el impacto económico de la campaña de eliminación del parásito en una zona determinada, con un horizonte a 10 años, supone una mejora del 44% anual en los resultados económicos de esa comunidad, medidos como Tasa de Rentabilidad Económica de la inversión9. Como el periodo de incapacidad suele ser mayor, la mejora económica también lo será. Esto ha quedado comprobado en los campos de arroz del sur de Nigeria, donde las pérdidas económicas debidas a la dracunculosis eran del orden de 20 millones USD/año antes de su eliminación10 en 2010.
Ante esta lacra de las sociedades con pocos recursos en África y Asia, en los años 80 del pasado siglo las grandes instituciones mundiales de salud empezaron a pensar que con el conocimiento que ya se tenía acumulado sobre el parásito que producía la enfermedad y su ciclo de vida, podía plantearse una lucha contra el mismo con posibilidades de vencer. En 1981, la Asamblea Mundial de la Salud (World Health Assembly) lo aprobó en su Resolución WHA 34.25, de 22 de Mayo.
En 1984, el CDC de EE.UU. se une, como centro colaborador, a la OMS y a la UNICEF para trabajar en la erradicación de la dracunculosis. En 1986, The Carter Center, fundación del expresidente de EEUU Jimmy Carter, no sólo se adhiere a esta alianza sino que se constituye en líder de la misma. Su primera labor y su principal éxito inicial fue lograr la implicación de los Ministerios de Sanidad de los países endémicos, así como la de las comunidades locales que sufrían las consecuencias de la presencia de ese gusano parásito.
La "erradicación", según asume la OMS, supone la eliminación total, por acciones deliberadas, de una enfermedad en nuestro planeta sin más necesidad de seguimiento, mientras que la "eliminación" supone la desaparición deliberada de la enfermedad sólo en una determinada región geográfica, aunque debe continuar la vigilancia y control de la misma11. Si se logra, sería la segunda enfermedad humana que se erradicara del mundo, después de que la del virus de la viruela lo fuera oficialmente en 1980, gracias a su vacuna, tras 15 años de lucha. Sería además la primera de un parásito, con el mérito adicional de que no existen vacunas ni fármacos efectivos frente al mismo y que las personas no generan inmunidad protectora contra él, con lo que pueden infectarse y sufrir la enfermedad año tras año durante toda su vida.
Ciclo de vida de Dracunculus medinensis6,12,13
Este parásito es un nematodo al que Linneo, en 1758, puso el nombre de Dracunculus medinensis, que quiere decir pequeño dragón (o pequeña serpiente) de Medina, ciudad árabe que era muy endémica. El hombre se infecta al ingerir su tercera fase larvaria (L3) que es la infectiva (Fig. 2).
En las aldeas de las personas que están en riesgo de sufrir esta enfermedad no hay infraestructuras sanitarias ni de agua potable. Con suerte puede haber un pozo o charca en la aldea o cerca de ella para recoger agua para beber, lavarse, cocinar, ... A veces tienen que recorrer kilómetros para acceder al agua. La larva infectiva vive dentro de unos pequeños crustáceos acuáticos de 1-3 mm de longitud, llamados copépodos de la familia Cyclopidae(a), principalmente de los géneros Mesocyclops, Metacyclops y Thermocyclops12, y que se encuentran en las charcas, pozos o demás fuentes de aguas tranquilas al aire libre. Cuando las personas beben agua que se ha recogido en esos lugares, tragan con ella copépodos con la larva L3 del gusano, infectándose. Como el agua se lleva para proveer la casa, toda la familia bebe de ella y puede infectarse (Fig. 2).
Las larvas L3 se liberan al digerirse estos crustáceos en el estómago, pero ellas resisten los jugos gástricos. Así llegan al intestino delgado y atraviesan la pared digestiva para buscar un lugar donde desarrollarse hasta adultos. Ese sitio es el tejido conjuntivo del abdomen y luego del tórax, donde van a crecer desde las 300-600 micras que miden, previo paso por larva L4, hasta adultos maduros de unos pocos cm (en 2 meses). El gusano macho fecunda a la hembra (aproximadamente 1 mes después), luego muere y el organismo se encarga de desintegrarlo. Pero la hembra sigue creciendo a la vez que va acumulando huevos en su útero y luego, poco a poco, se dirige hacia el tejido conjuntivo subcutáneo generalmente de las piernas, aunque puede ir a otros lugares. La hembra adulta y grávida puede medir entre 50 y 120 cm. Los huevos que están en su útero comienzan a eclosionar y a liberar la primera fase larvaria (L1) que permanece en dicho útero.
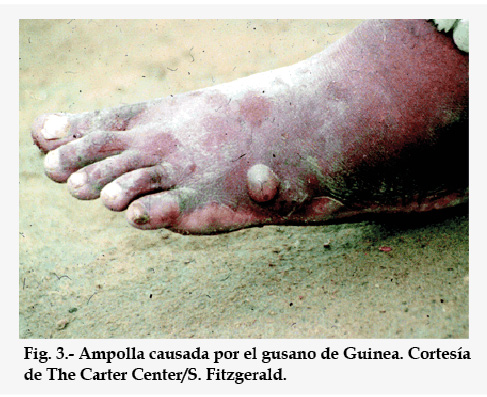
Aproximadamente 1 año después de haber entrado el parásito en el hombre, la hembra grávida dirige su boca hacia la piel del enfermo y libera sustancias que provocan la formación de una ampolla de 2 a 7 cm de diámetro, muy dolorosa y que causa una gran sensación de quemazón (Fig. 3). Esta sensación se alivia instantáneamente metiendo el pie o pierna con la ampolla en el agua fresca, pero este acto provoca la ruptura inmediata de la ampolla, convirtiéndose en una úlcera por donde asoma el gusano hembra, liberando de golpe cientos de miles de pequeñas larvas L1 que invadirán el agua. Desde ese momento, cada vez que el enfermo se meta en el agua y moje la úlcera para aliviar la quemazón y el dolor, el parásito aprovechará para eliminar más larvas. En estas condiciones, el gusano puede vivir varias semanas hasta eliminar todas las larvas que ha sido capaz de generar (unos 3 millones). Para ello, el nematodo va saliendo por el centro de la úlcera poco a poco, para facilitar la salida de su descendencia, hasta que se vacía y muere, y entonces nuestro organismo lo acaba de expulsar, lo desintegra o lo calcifica.
Esas pequeñas larvas L1 que ya están en el agua no pueden infectar al hombre, pero sí a los copépodos. Como estas larvas se mueven muy activamente, atraen a esos copépodos que las depredan. Una vez han sido ingeridas, salen del intestino y se instalan en el celoma del crustáceo donde se desarrollan a larvas L2 que luego mudan a L3. En 2-3 semanas tras la ingestión, las nuevas larvas L3 serán ya infectivas para el hombre. En cuanto éste beba agua con esos copépodos infectados, se cerrará el ciclo de vida de este parásito. Las ampollas de los enfermos aparecerán entre 10 y 14 meses después de la infección, en una época u otra del año, dependiendo de si las condiciones ambientales en la zona son favorables, es decir, aparecen cuando las condiciones climáticas permiten la formación de charcas de aguas tranquilas, con abundantes copépodos, dónde se pueda continuar el ciclo de vida del parásito.
Esto es lo que necesitamos saber del parásito para poder luchar contra él y derrotarlo.
Notas históricas sobre el gusano de Guinea
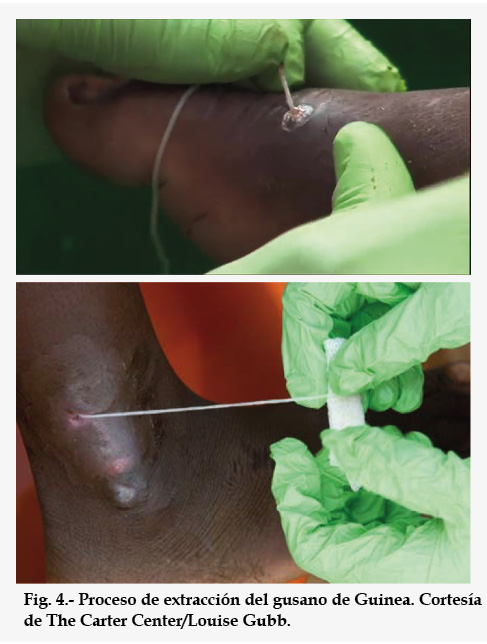
Aunque no parezca mucha información, ha costado muchos siglos recopilarla, pues esta enfermedad se conoce desde hace más de 3500 años. De hecho, en el papiro de Ebers, los egipcios ya describen un tratamiento para esta enfermedad14, por cierto, el mismo que se usa hoy día. Pero no se sabía que era un gusano. En la Antigüedad, se pensaba que podría ser una serpiente, le llamaban serpiente ardiente, que había entrado en el cuerpo, no se sabía cómo, pero sí sabían cómo sacarla. Se trataba de coger el extremo del gusano que sale por la úlcera (Fig. 4) y atarlo a un palo e ir tirando despacio del gusano y enrollándolo en el palo unos pocos centímetros cada día, así durante 2-3 semanas13. Había que ser paciente, pues un tirón podía romper el gusano y retraerse hacia el interior de la pierna, liberando su contenido y produciendo una reacción de tipo alérgico muy dolorosa por la enorme cantidad de antígenos del parásito que se liberan debido a su gran tamaño. Además, al retraerse el nematodo podían introducirse con él gérmenes que darían lugar a infecciones secundarias más o menos graves13.
Como ya hemos referido, la herida causada por el gusano es muy dolorosa y ardiente y se teme desde la Antigüedad. Este temor al gusano aparece ya en el Antiguo Testamento, cuando durante el éxodo de los israelitas hacia la tierra prometida, estando próximos al Mar Rojo, fueron atacados por serpientes ardientes. Moisés intercedió por su pueblo, y finalmente Dios le explicó el tratamiento: enrollar la serpiente en una vara. El relato está en el libro Números, capítulo 21, versículos 6-9. En el (6) dice: "Y el Señor envió serpientes ardientes a su pueblo, y ellas mordían a la gente; y mucha gente de Israel murió ..." Y en el (8) "Y el Señor dijo a Moisés: Haz que una serpiente ardiente se enrolle sobre una vara; y acontecerá que cualquiera que sea mordido, cuando la mire, vivirá."
De hecho la vara con una serpiente enrollada que porta el dios griego Asclepio, dios de la Medicina, o su homólogo romano Esculapio (Fig. 515), según diversos historiadores podría ser la representación del proceso de extracción del gusano de Guinea14, ya que se consideraba una serpiente. Símbolo universal de la Medicina aparece representado (Fig. 5) en el emblema de la OMS14 o, parcialmente, en el símbolo de la Farmacia.
A pesar de que en la Antigüedad muchos pensaban que se trataba de pequeñas serpientes, Galeno, en el s. II, propuso que se trataba de un nervio dañado, y durante la Edad Media se pensó que podría ser un nervio o una vena degenerada, por lo que recibió el nombre de Vena medinae16. En 1674, Velschius de Viena publicó su tratado sobre la Vena medinensis15 en el que ilustra la extracción del helminto por médicos persas y en el que se recoge ya el conocimiento moderno de la enfermedad incluida su etiología por un gusano. Aunque se sospechaba que el agua intervenía en su transmisión, no se sabía cómo. En este sentido, comentar que hacia 1661-62(b) Monseñor Lambert, obispo de Beirut, visitó la ciudad comercial persa de Lar, donde encontró muchos enfermos con el gusano de Guinea. Hombre erudito, Lambert aconsejó a los habitantes de la ciudad diciéndoles: "La forma de evitar este gusano es beber sólo vino" aclarando después "o si se debe beber agua, sólo hacerlo cuando ha sido cuidadosamente filtrada a través del lino"14. No hubo nuevos avances dignos de mención hasta el siglo XIX. Así, en 1870 Alekséi Fédchenko, explorador y naturalista ruso, logró desentrañar la intervención de los copépodos en el ciclo de vida del parásito17, trabajando en zonas endémicas del Turkestán ruso en Asia Central, sugiriendo que la filtración o ebullición del agua debía impedir la transmisión de la infección al hombre18. De hecho, las autoridades rusas lograron eliminar la dracunculosis en la Unión Soviética en 1932, implementando, entre otras medidas, las sugeridas por Fedchenko18. La confirmación final del ciclo fue hecha en 1914 por Turkhud19, médico indio que trabajaba en un hospital de Bombay, y que infectó voluntarios humanos a partir de copépodos que hospedaban la larva del parásito, logrando así demostrar experimentalmente la forma de infección del hombre y completando el rompecabezas del ciclo de vida del gusano de Guinea, 35 siglos después de la primera mención escrita de la enfermedad con su tratamiento.
La primera estimación que conocemos del número de afectados por esta enfermedad se publicó en 1947 por Stoll que calculó en unos 50 millones de enfermos distribuidos por África y Asia2.
En un exhaustivo artículo sobre la dracunculosis en América, Watts20 recoge que la primera referencia de esta enfermedad en el continente fue en unos marineros holandeses llegados de Ámsterdam a Buenos Aires en 1599, que habían hecho escala en la costa de Guinea, aunque es posible que se dieran casos desde el inicio de la trata de esclavos, con los que se importó el gusano desde África Occidental. Aunque un gran número de casos eran importados con los esclavos, en determinadas regiones del Caribe y de Sudamérica se dieron casos autóctonos debido a la contaminación de la fuentes de agua de bebida. En el s. XIX, con la prohibición de la trata de esclavos el número de casos se redujo para ir desapareciendo de las zonas donde se había establecido el parásito por la mejora de las condiciones de suministro de agua y por el conocimiento de los trabajos de Fedchenko17 sobre la forma de transmisión del gusano. A finales del s. XIX ya no se denuncian casos autóctonos. Aunque sigue habiendo esporádicamente casos importados, estos ya no se establecen en América (ver artículo de Watts20 para datos más detallados y referencias).
Campaña de erradicación de la dracunculosis
Para programar una campaña de erradicación, primero tenemos que ver si es posible ganar esa lucha contra el gusano. Ya hemos comentado su ciclo de vida.
Los criterios científicos21 que facilitan este trabajo en este caso son: 1o Ciclo de vida totalmente conocido. 2o No existen reservorios animales. Es decir, no hay otros animales que se infecten de forma natural, por lo que sólo necesitamos erradicarlo del hombre. 3o No existen portadores humanos, ya que si no tienen aún síntomas, no pueden transmitir la enfermedad. Sólo la disemina cuando el enfermo presenta la úlcera por donde sale la hembra del gusano. Y conocemos el periodo de incubación que es de alrededor de 1 año. Por lo que una vez erradicado el parásito no podrá volver a aparecer por causa de individuos donde se hubiera podido quedar hipotéticamente acantonado por más tiempo. 4o La enfermedad tiene un fácil diagnóstico, muy conocido entre las sociedades afectadas. La ampolla dolorosa y ardiente es suficiente para diagnosticar la enfermedad en zonas endémicas. Y 5o, es una enfermedad estacional. Con lo que sabemos en qué momentos del año aparecerá, aunque bien es cierto que depende del clima propio de la zona geográfica afectada. En cada zona aparecerá en unas fechas, pero siempre las mismas. Ello facilita la preparación de las intervenciones contra el gusano en las distintas zonas.
Pero también existen criterios políticos21 que deben tratar de cumplirse y que son los más difíciles de satisfacer.
1o.-Debe haber fondos económicos. Los organismos de los que hemos hablado antes, aportan importantes fondos para que sea posible la erradicación, sin embargo, sería bueno conseguir más, sobre todo en periodos de crisis económica en las que los países reducen sus aportaciones a campañas que no les afectan directamente.
2o.-Debe haber implicación política y económica de los países endémicos. Las poblaciones afectadas por esta enfermedad son pobres, con lo que su influencia política en sus países es nula, lo que conlleva que se dependa de los vaivenes políticos de los gobernantes de turno. Además, las zonas endémicas están en áreas geográficas afectadas con frecuencia por conflictos armados, lo que dificulta no sólo la financiación sino que compromete la acción de los voluntarios en las zonas de conflicto.
3o.-Debe haber implicación de las comunidades afectadas. Esta es la única implicación que parece asegurada, pero en cualquier caso hay que convencer a esas comunidades de que la enfermedad se puede evitar.
Cumpliendo estos criterios, aunque en diversa medida, ¿cómo podemos luchar contra el parásito? La lucha contra los parásitos se centra en romper sus ciclos de vida, impidiendo así que los completen y, por tanto, desaparezcan o, al menos, reduzcan su número, reduciendo así su repercusión en el hombre. Una vez que este gusano cumple los requisitos anteriores, vamos a ver dónde podemos intervenir para romper su ciclo de vida. En él intervienen el hombre, los copépodos y el agua. Nos debemos plantear 2 preguntas:
1a.- Cómo prevenir la infección, es decir, cómo evitar que una persona se infecte22:
Sabemos ya que la infección se adquiere al beber agua con copépodos infectados. Por tanto, la 1a medida será impedir que el agua que se bebe contenga esos copépodos, y ello se puede hacer, de un modo barato y rápido, filtrando esa agua con una malla de luz inferior al tamaño del copépodo. Pero antes de eso, hay que convencer a las personas, que esta infección se adquiere a través del agua que beben, para que usen filtros (Fig. 6). Es decir, hay que emprender medidas de educación sanitaria, intensas y extensas. Esto es un gran reto pues las sociedades afectadas suelen creer que estas enfermedades son enviadas por los dioses o son producto de mal de ojo o maldiciones de brujos y chamanes de tribus vecinas. Por ejemplo, convencer al jefe del poblado o de la tribu a veces es suficiente para conseguir que las comunidades sigan estas medidas de prevención.
Igualmente, sabemos que la infección se propaga cuando la persona infectada mete sus ampollas y úlceras en el agua de las charcas pues, en ese momento, la hembra del gusano va a aprovechar para liberar las larvas que van a infectar a los copépodos. Así, la 2a medida será impedir que estas larvas del gusano lleguen al agua. Esto es más difícil de solucionar. Requiere un nuevo trabajo de educación sanitaria sobre los enfermos para que comprendan su papel en el mantenimiento de la transmisión del parásito. Desde el punto de vista práctico, se ha visto que da muy buenos resultados tratar adecuadamente la úlcera y vendarla. Las vendas, además de mantener protegida la herida, tienen una ventaja adicional y es que el enfermo no quiere meterse con la venda en el agua, pues se le humedece y estará incómodo hasta que se seque, con lo que evita mojársela, impidiendo así que la hembra pueda liberar larvas al agua (Fig. 7).
Sabemos también que la transmisión se mantiene gracias a los copépodos infectados que están en las fuentes de suministro de agua de bebida. Por lo que la 3a medida será eliminar esos copépodos de esas fuentes de agua. Para ello se implica activamente a las comunidades afectadas por lo que algún representante de las mismas se encargará de añadir un producto químico que mata a los copépodos pero que no afecta a los peces ni a los animales que beban de esa agua, incluido el hombre. Este producto tiene las ventajas de ser muy poco tóxico, no dar sabor, ni olor ni color al agua, y ser residual, permaneciendo alrededor de 1 mes activo, con lo que esos voluntarios sólo deben ir una vez al mes a las distintas fuentes de agua de las que se proveen sus paisanos para añadir ese producto, un organofosforado conocido como temephos (Abate®)23. Además, como también actúa como insecticida, mata las larvas acuáticas de los mosquitos, con lo que se reducen los casos de enfermedades transmitidas por mosquitos (malaria, filariasis linfática, fiebre amarilla, dengue, ...).
Además, sabemos que las poblaciones afectadas carecen de fuentes de agua segura, por lo que habría que tomar una 4a medida, que sería proveer a las poblaciones endémicas de fuentes de agua de bebida limpia y segura. Por supuesto que lo ideal sería dotar de infraestructuras de agua potable. Pero ello es imposible a corto o medio plazo. El objetivo se puede alcanzar construyendo, en las aldeas o cerca de ellas, pozos protegidos por pretiles adecuados que no permitan que la gente se pueda meter en el agua, con lo que no llegarán las larvas del parásito a la misma interrumpiéndose así el ciclo del gusano. Mejor aún, si se puede cerrar totalmente el pozo y proveerlo de una bomba impulsora para obtener el agua.
La 2a pregunta sería: Si se da un caso de dracunculosis ¿cómo se debe controlar? Un caso se considerará controlado si se dan todas las condiciones siguientes22,24: 1a) si se detecta la enfermedad antes de la aparición del gusano o en las primeras 24 horas; 2a) si el paciente no se ha introducido en ninguna fuente de agua desde que emergió el gusano (o si lo ha hecho, tratar inmediatamente la fuente de agua con temephos); 3a) si un voluntario ha tratado al paciente adecuadamente, es decir, mediante la limpieza y vendado de las lesiones desde que emergen los gusanos hasta que hayan sido extraídos completamente de forma manual y mediante la educación sanitaria para disuadir al paciente de introducirse en cualquier fuente de agua, evitando así contaminarla; y 4a) si el proceso de contención, incluyendo la verificación del caso como una dracunculosis, se valida por un supervisor dentro de los 7 días de la aparición del gusano.
Como hemos comentado, todas estas medidas incluyen una gran labor de educación sanitaria25, para que los enfermos y sus familias comprendan las vías de infección y transmisión y las formas de evitar ambas y que estén dispuestos a hacerlo. Así mismo requieren mucho personal25, fundamentalmente voluntarios, siendo siempre mucho mejor implicar a personal autóctono, pues despertará una mayor confianza entre sus familiares y vecinos que los no autóctonos. Todo este personal se necesita para el trabajo sobre el terreno, que es mucho, laborioso y pertinaz, pues no se puede dejar ninguna aldea sin visitar y formar, ninguna fuente de agua sin tratar y ninguna persona sin formación y sin tratamiento.
Muchas horas de trabajo y esfuerzo se consumen también en la rumorología. Es decir, que en esta campaña deben comprobarse todos y cada uno de los casos sospechosos de dracunculosis, por tanto hay que comprobar todos los rumores que se difunden sobre posibles enfermos. Para tener una idea de lo que esto supone, en 2015 se recogieron 10.050 rumores sólo en Sudán del Sur, se pudieron investigar 9.831 (el 97,8%) y sólo se confirmaron 5 casos (el 0,05% de los investigados)26.
En resumen, el trabajo del personal consiste en: Educación sanitaria, búsqueda y seguimiento individual de los casos que aparecen, tratamiento inmediato de todos los casos y tratamiento con Abate® de todas las fuentes de suministro de agua de bebida no segura. Como dato orientativo para saber de cuanto personal voluntario estamos hablando, cuando se firmó la paz en Sudán en 2005 que permitió la creación de la región autónoma de Sudán del Sur, zona endémica del gusano de Guinea independiente desde 2011, se necesitaron casi 11000 voluntarios27 para una superficie de 619.000 km2. La OMS en 1991 estimaba que sólo en África vivían en situación de riesgo de adquirir la enfermedad 120 millones de personas28, en un área de unos 10 millones de km2. Es decir se hubiesen requerido en ese momento entre 120.000 y 200.000 voluntarios que debían ser previamente formados en la mayoría de los casos. Y llevamos 30 años de campaña.
Participantes en la campaña de erradicación29,30
The Carter Center que lidera la campaña de erradicación, recopila y distribuye el número de casos, y proporciona apoyo técnico y financiero a los Programas Nacionales de los países endémicos para interrumpir la transmisión de la enfermedad y llevar los casos hasta cero. Cuando se interrumpe la transmisión, este Centro ofrece asistencia continua en el desarrollo y fortalecimiento de la vigilancia en las zonas libres del parásito y en la preparación de las naciones para la certificación oficial por la OMS de la eliminación del gusano. Los Ministerios de Sanidad de los países endémicos que supervisan los programas de eliminación nacionales del gusano de Guinea y reúnen y entrenan a los trabajadores de campo y al personal de supervisión para su labor, tanto voluntarios como funcionarios. La Organización Mundial de la Salud que se encarga de la certificación de los países como libres del gusano de Guinea, y es la única organización que puede certificar oficialmente la eliminación y la erradicación de una enfermedad, tras 3 años sin casos. Los Centers for Disease Control and Prevention de EE.UU. (CDC) que se encargan de la asistencia técnica y verifican si los gusanos de los pacientes son realmente gusanos de Guinea. La UNICEF que ayuda a proporcionar fuentes seguras de agua potable para los habitantes de zonas endémicas. Estos son los principales socios de la campaña, pero también hay colaboradores indispensables como: BASF Corporation que provee gratuitamente de Abate® a todos los países endémicos para el tratamiento de las charcas, para acabar con los copépodos. O la compañía Vestergaard que dona los filtros de tela y los filtros de tubo necesarios para eliminar los copépodos del agua de bebida. Así como muchos otros6,8,31 que colaboran a distintos niveles, bien sobre el terreno, con apoyo logístico o con financiación, destacando la Bill & Melinda Gates Foundation que ha aportado más de 65 millones USD a la campaña. Sin olvidar a todos los muchos miles de personas que participan en esta campaña de erradicación bien como voluntarios o funcionarios, o bien con donaciones a los distintos socios que participan en ella.
Resultados de la campaña de erradicación
Cuando se empezó con este programa de erradicación la OMS estimaba que podrían estar infectadas entre 5 y 10 millones de personas, viviendo en situación de riesgo más de 130 millones, principalmente en África, pero también en algunos países de Asia como Yemen, Pakistán y la India (Fig. 1); aunque Watts28 calculó unos 3,2 millones de personas infectadas en África en 1986, a los que había que sumar unas 300.000 en Asia6. El primer cálculo para la fecha de erradicación fue extremadamente atrevido, pues el objetivo era terminar con el parásito en 199510,32,33. En varias ocasiones se establecieron nuevas fechas para la consecución del objetivo de erradicación, para finalmente hacer menos caso de las fechas y centrarse en lo verdaderamente importante que era la progresión en el trabajo de erradicación de esta enfermedad. En 1995 se contabilizaron tan solo 130.000 casos34. Evidentemente no se consiguió la erradicación, pero el descenso del número de casos fue incuestionable y esperanzador, el 96% de reducción en 10 años de trabajo (Fig. 8). Y si no se logró, no fue por falta de celo y empeño en ese objetivo, sino por los continuos conflictos armados33 entre etnias y entre países de las zonas endémicas de África, lo que provocaba, por un lado, continuos movimientos de población32 hacia zonas menos conflictivas, agravando los problemas sanitarios en general y el de suministro de agua segura en particular; y, por otro, la retirada de fondos comprometidos para las campañas sanitarias de los gobiernos implicados en los conflictos, para redirigirlos a la compra de armas, al mantenimiento de los soldados o de los mercenarios. En cualquier caso en 1994 se había logrado que no hubiese ni 1 solo caso en Pakistán35,36, primer país en el que se lograba la eliminación del parásito con esta campaña de erradicación. A partir de ahí, continuó la batalla frente al parásito y poco a poco se iban añadiendo países a la lista de libres del gusano. Asia tuvo su último caso en 199735,36.
En 2015 (Fig. 8), tras 30 años de lucha, se registraron sólo 22 casos distribuidos en 4 países: Chad, Etiopía, Malí y Sudán del Sur22,30; lo que supone una reducción de más del 99,99% desde el inicio de la campaña22. Por ahora se ha eliminado el parásito en 17 de los 21 países que eran endémicos en 198630. En 20161 se han contabilizado 25 casos (datos provisionales a 11-enero-2017). De los 4 países afectados en 2015, en 1, Malí, no se ha registrado ningún caso este año, sin embargo, en Chad hay un repunte (de 9 casos en 2015 a 16 en 2016) por causas que se comentan en el siguiente epígrafe. Etiopía se mantiene con 3 casos en 2016 y Sudán del Sur pasa de 5 casos en 2015 a 6 en 2016.
Si todo sigue así, a pesar de los conflictos que siguen asolando África y en nuestro caso, sobre todo, pero no únicamente, el norte de Malí y Sudán del Sur, es posible que para 202030 la enfermedad del gusano de Guinea haya pasado a la historia, y podamos dedicar ese enorme caudal humano, capaz del logro de casi cualquier objetivo, gracias a ese esfuerzo constante, incansable, desinteresado y solidario, hacia otro de los múltiples retos que quedan por resolver. De hecho ya se está aprovechando, pues esta campaña no sólo ha logrado reducir el número de casos, sino que ha evitado por lo menos 80 millones de casos30 de esta enfermedad devastadora entre las personas más pobres y desatendidas del mundo y ha ayudado a establecer sistemas de salud con base en las aldeas en miles de comunidades30, que ahora disponen de redes de personal sanitario y voluntarios, que proporcionan educación sanitaria y que intervienen para prevenir también otras enfermedades, especialmente las transmitidas por el agua, que son una causa importante de mortalidad infantil. La construcción de fuentes de agua de bebida segura ha reducido el número de casos independientemente de que su etiología sea vírica, bacteriana o parasitaria.
Y todo esto por menos de 333 millones USD30. Mientras que la financiación masiva se canaliza en otras campañas sanitarias como la erradicación de la polio o el control del SIDA, la tuberculosis y la malaria -por ejemplo: la vacunación frente a la polio supone 1000 millones USD anuales37-; la enfermedad del gusano de Guinea está a punto de ser erradicada sin ningún tratamiento farmacológico ni vacuna. Su desaparición será una prueba de que las personas pueden ser persuadidas para cambiar su comportamiento a través de la educación sanitaria25. Se estima que se necesitarán aún 213 millones USD30 de aquí al 2020 para completar la erradicación, y para certificar que esta lacra ha sido erradicada. Como en cualquier campaña de erradicación, los últimos casos serán los más difíciles y caros, pero "la recompensa final es un mundo libre de la enfermedad del gusano de Guinea para las generaciones futuras"30. Como ya sabemos el hombre es capaz de las mayores atrocidades, pero también de las mayores heroicidades basadas en el esfuerzo común y solidario. Este es un ejemplo de ello.
Problemas surgidos recientemente: ¿cambios en la epidemiología del parásito?
Hasta la erradicación de la enfermedad, siempre existe el peligro de la reintroducción del parásito en zonas libres del mismo. De hecho en Chad se había eliminado el parásito en 20016, pero se ha detectado su reintroducción en 2010 asociada a un cambio epidemiológico, no totalmente dilucidado, que incluye a los perros (Fig. 9) en el ciclo de vida en sustitución del hombre38. Puesto que el movimiento que hacen los animales con la lengua para beber aleja a los copépodos, los perros no se infectan al beber agua, por lo que se ha sugerido que se infectan al consumir las vísceras de los peces de agua dulce que podrían contener la L3 del parásito tras ingerir los copépodos infectados, actuando los peces como hospedadores paraténicos. Estas vísceras provendrían de la actividad humana, al eviscerar los peces y tirar las vísceras sin procesar dejándolas al alcance de los perros38. A partir de octubre de 2013, el Programa de Erradicación del Gusano de Guinea del Chad instó a la población en situación de riesgo a cocinar suficientemente el pescado para matar a las posibles larvas del gusano y a enterrar las vísceras de los pescados para evitar su ingesta por perros y gatos22. Nuevos esfuerzos en educación sanitaria comienzan a dar sus frutos en febrero de 2014.
Un año después se insta a la población con perros infectados a atarlos hasta la extracción total de los gusanos de Guinea, para evitar la diseminación del parásito, premiando a los dueños de los perros con un pago equivalente a 20 USD por informar del caso y mantener al perro atado, duplicándose así el porcentaje de perros infectados atados desde el 40% de 2014 al 81% de los primeros meses de 201622. Y a partir de agosto de 2014, mediante técnicas innovadoras, se aplica Abate® a zonas accesibles, tanto para perros como para humanos, de las fuentes de agua difíciles de controlar (lagunas, remansos de los ríos) y que son acordonadas para delimitarlas. Actualmente se están estudiando las peculiaridades epidemiológicas de este nuevo brote de dracunculosis en Chad en colaboración con The Carter Center, el CDC y la Universidad de Georgia (EEUU) para desarrollar nuevas medidas de control. De hecho se ha detectado una larva L3 del gusano de Guinea en una rana salvaje autóctona, Phrynobatrachus francisci, que actúa como hospedador paraténico39. El número de casos humanos se ha estabilizado en unos 10-15 anuales, mientras que el de perros infectados, se sigue incrementando pero a un ritmo muy inferior (la tercera parte) en los primeros 6 meses de 2016 (653 perros infectados) que los correspondientes de 201522. A partir de ahora, con estas medidas y otras que se puedan implementar (desde octubre de 2016 se están aplicando 2 antihelmínticos activos frente a filarias de perros, Heartgard® y Advocate®, para ver si alguno de ellos puede ser útil frente a esta infección en los animales40), se espera que el número de casos de dracunculosis humana y animal se reduzca paulatinamente hasta desaparecer.
Conclusiones
Este trabajo de revisión arroja diversas conclusiones, siendo las más trascendentales, a juicio del autor, las siguientes:
1.- Las características del ciclo de vida y de la epidemiología de Dracunculus medinensis permiten afrontar la erradicación del parásito con posibilidades de lograrla.
2.- El compromiso solidario y el esfuerzo incansable de las instituciones de salud y fundaciones, mencionadas anteriormente en el desarrollo del artículo, ha sido y es vital para alcanzar este hito de la erradicación.
3.- La educación sanitaria se ha mostrado como una herramienta imprescindible y primordial para los logros alcanzados en la lucha contra la dracunculosis.
4.- El esfuerzo inestimable del voluntariado y funcionariado implicado en el trabajo sobre el terreno es absolutamente imprescindible para conseguir el objetivo de la erradicación.
5.- La continuación de este trabajo tanto en las áreas endémicas como la vigilancia extrema en las que ya se han liberado del parásito, es imprescindible hasta que se haya certificado la erradicación del gusano de Guinea por la OMS.
Conflicto de interés
No existe conflicto de interés.
Agradecimientos
El autor agradece a la Decana de la Facultad de Farmacia de la Universidad de Granada, Profa Dra. Ana I. del Moral García, su invitación para dar una conferencia, dentro de los actos de celebración de nuestra patrona, el pasado 4 de diciembre, sobre la enfermedad del gusano de Guinea y a la editora de Ars Pharmaceutica, Profa Dra. Ma Dolores Ruiz López, que me animó a convertir la conferencia en este trabajo de revisión invitándome a presentarlo para su publicación en esta revista científica.
Notas
(a) En los artículos en inglés acerca del gusano de Guinea se emplea mal el término "water flea" por copépodo. En realidad "water flea" o "pulga de agua" es un crustáceo del orden Cladocera (Clase Branchiopoda) y no un copépodo (subclase Copepoda, Clase Maxillopoda).
(b) Hopkins and Hopkins14 indican el año 1650, pero Mons. Lambert no fue nombrado obispo de Beirut y vicario apostólico de la Cochinchina hasta 1658 y ordenado obispo en 1660 (no hay uniformidad en las fuentes consultadas, ver más abajo), trasladándose a su destino en noviembre de 1660 y llegando a Siam a mediados de 1662. Se supone que visitó la ciudad persa de Lar de camino hacia la Cochinchina, pues la ruta más habitual era la del Pérsico, lo que debió ocurrir entre 1661 y 1662 (ver Les Missions Etrangères. Trois siècles et demi d'histoire et d'aventure en Asie, pág. 35. Editions Perrin, 2008, ISBN 978-2-262-02571-7 y Missions étrangères de Paris. 350 ans au service du Christ, pág 4. 2008. Editeurs Malesherbes Publications, Paris ISBN 978-2-916828-10-7 y http://www.catholic-hierarchy.org/bishop/bladlm.html (acceso 9/12/2016).
Referencias
1. The Carter Center. Guinea worm case totals. https://www.cartercenter.org/health/guinea_worm/case-totals.html. Publicado en 2017. Acceso 11/01/2017. [ Links ]
2. Stoll NR. This wormy world. J Parasitol. 1947;33(1):1-18. [ Links ]
3. Magnussen P, Yakubu A, Bloch P. The effect of antibiotic- and hydrocortisone-containing ointments in preventing secondary infections in Guinea worm disease. Am J Trop Med Hyg. 1994;51(6):797-799. [ Links ]
4. Watts SJ, Brieger WR, Yacoob M. Guinea worm: An in-depth study of what happens to mothers. Soc Sci Med. 1989;29(9):1043-1049. [ Links ]
5. Water and Sanitation for Health Project (WASH). Adding Guinea Worm Control Components: Guidelines for Water and Sanitation Projects. WASH Field Report, Vol No 51.; 1988. [ Links ]
6. Ruiz-Tiben E, Hopkins DR. Dracunculiasis (Guinea worm disease) eradication. Adv Parasitol. 2006;61:275-309. doi: 10.1016/S0065-308X(05)61007-X. [ Links ]
7. Barry M. The tail end of Guinea worm - Global eradication without a drug or a vaccine. N Engl J Med. 2007;356(25):2561-2564. [ Links ]
8. Callahan K, Bolton B, Hopkins DR, Ruiz-Tiben E, Withers PC, Meagley K. Contributions of the Guinea worm disease eradication campaign toward achievement of the Millennium Development Goals. PLoS Negl Trop Dis. 2013;7(5):e2160. doi: 10.1371/journal.pntd.0002160. [ Links ]
9. Kim A, Tandon A, Ruiz-Tiben E. Cost-Benefit Analysis of the Global Dracunculiasis Eradication Campaign. Washington, D.C.; 1997. [ Links ]
10. The Carter Center. Annual Report 1992-93. Atlanta, USA; 1993. https://www.cartercenter.org/. [ Links ]
11. Dowdle WR. The principles of disease elimination and eradication. Bull World Health Organ. 1998;76(Suppl 2):22-25. [ Links ]
12. Cairncross S, Muller R, Zagaria N. Dracunculiasis (Guinea worm disease) and the eradication initiative. Clin Microbiol Rev. 2002;15(2):223-246. doi: 10.1128/CMR.15.2.223-246.2002. [ Links ]
13. Muller R. Dracunculus and dracunculiasis. Adv Parasitol. 1971;9:73-151. [ Links ]
14. Hopkins DR, Hopkins EM. Guinea worm. The end in sight. In: Encyclopaedia Britannica. Vol 1992. Medical and Health Annual. Chicago, USA: Encyclopaedia Britannica, Inc.; 1991:10-27. [ Links ]
15. Velschii GH. Exercitatio de Vena Medinensi Ad Mentem Ebnsinae, Sive de Dracunculis Veterum. Specimen Exhibens Novae Versionis Ex Arabico, Cum Commentario Uberiori. Cui Accedit Altera de Vermiculis Capillaribus Infantium. Augustae Vindelicorum: impensis Theophili Goebelii; 1674, p. 89. Obra de la Colección de Patrimonio Digitalizado de la Universidad Complutense de Madrid. https://babel.hathitrust.org/cgi/pt?id=ucm.5309434430. Acceso 11/01/2017. [ Links ]
16. Foster WD. Dracunculus medinensis. In: A History of Parasitology. Edinburgh: E. & S. Livingstone Ltd.; 1965:105-111. [ Links ]
17. Fedchenko AP. Concerning the structure and reproduction of the Guinea worm (Filaria medinensis L.) (traducido del original en ruso). Am J Trop Med Hyg. 1971; 20(4):511-523. [ Links ]
18. Litvinov SK, Lysenko A. Dracunculiasis: its history and eradication in the USSR. In: Workshop on Opportunities for Control of Dracunculiasis; 1982:97-100. [ Links ]
19. Turkhud DA. Report of the Bombay Bacteriological Laboratory for the Year 1913; 1914. [ Links ]
20. Watts S. Dracunculiasis in the Caribbean and South America: a contribution to the history of dracunculiasis eradication. Med Hist. 2000;45:227-250. [ Links ]
21. Hopkins DR. Disease eradication. N Engl J Med. 2013;368(1):54-63. doi:10.1056/NEJMra1200391. [ Links ]
22. Hopkins DR, Ruiz-Tiben E, Eberhard ML, Roy SL, Weiss AJ. Progress toward global eradication of Dracunculiasis -- January 2015-June 2016. MMWR Morb Mortal Wkly Rep. 2016;65(40):1112-1116. doi: 10.15585/mmwr.mm6540a5. [ Links ]
23. Muller R. Laboratory experiments on the control of Cyclops transmitting Guinea worm. Bull World Health Organ. 1970;42(4):563-567. [ Links ]
24. WHO. Dracunculiasis eradication: case definition, surveillance and performance indicators. Wkly Epidemiol Rec. 2003;78(37):323-328. [ Links ]
25. CDC, Global 2000 (Carter Center Inc.). Guidelines for Health Education and Community Mobilization in Dracunculiasis Eradication Programs.; 1991. [ Links ]
26. WHO. Dracunculosis eradication. https://extranet.who.int/sree/Reports?op=vs&path=/WHO_HQ_Reports/G17/PROD/EXT/Country%20Profile. Publicado en 2016. Acceso 9/12/2016. [ Links ]
27. Hopkins DR, Ruiz-Tiben E, Eberhard ML, Roy SL. Progress toward global eradication of dracunculiasis, January 2005-May 2007. MMWR Morb Mortal Wkly Rep. 2007;56:813-817, NaN 937. doi: 10.15585/mmwr.mm6540a5. [ Links ]
28. Watts S. Dracunculiasis in Africa in 1986: its geographic extent, incidence and at-risk population. Am J Trop Med Hyg. 1987;37(1):119-125. [ Links ]
29. The Carter Center. Guinea worm eradication program. https://www.cartercenter.org/health/guinea_worm/. Publicado en 2016. Acceso 9/12/2016. [ Links ]
30. The Carter Center/WHO. Eradication of Guinea Worm Disease. Case Statement.; 2016. [ Links ]
31. Senior K. The end is nigh for guinea worm disease. Lancet Infect Dis. 2009;9(3):149. doi:10.1016/S1473-3099(09)70036-2. [ Links ]
32. Watts SJ. Population mobility and disease transmission: the example of Guinea worm. Soc Sci Med. 1987;25:1073-1081. [ Links ]
33. Hopkins DR, Ruiz-Tiben E, Kaiser RL, Agle AN, Withers Jr. PC. Dracunculiasis eradication: Beginning of the end. Am J Trop Med Hyg. 1993;49(3):281-289. [ Links ]
34. CDC. Guinea Worm Wrap-up #63. Atlanta, USA; 1997. https://www.cartercenter.org/resources/pdfs/news/health_publications/guinea_worm/wrap-up/63.pdf. [ Links ]
35. Dracunculiasis. Global surveillance summary, 2000. Wkly Epidemiol Rec. 2001;76(18):133-139. [ Links ]
36. Hopkins DR, Ruiz-Tiben E, Ruebush TK, Diallo N, Agle A, Withers PC. Dracunculiasis eradication: delayed, not denied. Am J Trop Med Hyg. 2000;62(2):163-168. [ Links ]
37. Bill & Melinda Gates Foundation. La poliomielitis. http://www.gatesfoundation.org/es/What-We-Do/Global-Development/Polio. Publicado en 2016. Acceso 9/12/2016. [ Links ]
38. Eberhard ML, Ruiz-Tiben E, Hopkins DR, et al. The peculiar epidemiology of dracunculiasis in Chad. Am J Trop Med Hyg. 2014;90(1):61-70. doi: 10.4269/ajtmh.13-0554. [ Links ]
39. Eberhard ML, Cleveland CA, Zirimwabagabo H, Yabsley MJ, Ouakou PT, Ruiz-Tiben E. Guinea worm (Dracunculus medinensis) infection in a wild-caught frog, Chad. Emerg Infect Dis. 2016;22(11):1961-1962. doi: 10.3201/eid2211.161332. [ Links ]
40. CDC. Guinea Worm Wrap-up #244. Atlanta, USA; 2016. https://www.cartercenter.org/resources/pdfs/news/health_publications/guinea_worm/wrap-up/244.pdf. [ Links ]
![]() Correspondence:
Correspondence:
Francisco Javier Adroher Auroux
Departamento de Parasitología, Facultad de Farmacia,
Universidad de Granada, 18071-Granada, España.
E-correo: fadroher@ugr.es
Received: 1.12.2016
Accepted: 11.01.2017