Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Ars Pharmaceutica (Internet)
versión On-line ISSN 2340-9894
Ars Pharm vol.57 no.4 Granada oct./dic. 2016
https://dx.doi.org/10.30827/ars.v57i4.5562
ARTÍCULO ORIGINAL
El extracto acuoso de Cymbopogon citratus protege al ADN plasmídico del daño inducido por radiación UVC
Cymbopogon citratus aqueous extract protects plasmid DNA from UVC-induced damage
Maribel González-Pumariega1, Fabiana Fuentes-León1, Marioly Vernhes2, André P. Schuch3, Carlos Frederico Martins Menck3 y Ángel Sánchez-Lamar1
1. Laboratorio de Genética Toxicológica, Departamento de Biología Vegetal, Facultad de Biología, Universidad de la Habana
2. Departamento de Radiobiología, (CEADEN)
3. Departamento de Microbiologia, Instituto de Ciências Biomédicas, Universidade de São Paulo
Este trabajo fue realizado por el proyecto de colaboración internacional CAPES (Brasil)- MES (Cuba). El financiamiento y soporte fue brindado por CAPES (São Paulo, Brazil).
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar el efecto protector del extracto acuoso de Cymbopogon citratus (DC) Stapf, ante el daño inducido por las radiaciones UVC.
Material y Métodos: Para evaluar si el extracto acuoso de C. citratus era capaz de inducir roturas de cadenas en el ADN, moléculas de plásmido pBluescript SK II fueron tratadas con diferentes concentraciones del extracto (0,01 - 4,0 mg/mL), en los tiempos de exposición: 30, 60 y 90 min. El efecto fotoprotector fue evaluado aplicando el extracto vegetal antes, durante, y después de la irradiación del ADN plasmídico con 200 J/m2 de UVC. La actividad enzimática de T4 endonucleasa V fue empleada para detectar formación de CPDs. Las formas superenrollada y relajada de las moléculas de plásmido fueron separadas electroforéticamente en gel de agarosa. Adicionalmente, se midió la transmitancia del extracto acuoso a la DO de 254 nm.
Resultados: Ninguna de las concentraciones evaluadas resultó genotóxica con 30 min de tratamiento. Las concentraciones ≥ 2 mg/mL indujeron roturas de cadenas a los 90 min de incubación. El extracto de C. citratus a concentraciones ≥ 0,5 mg/mL protegió al ADN frente a las radiaciones UVC.
Conclusiones: En nuestras condiciones experimentales, el extracto acuoso de C. citratus protege al ADN frente a la genotoxicidad inducida por la luz UVC, previniendo la generación de CPDs, pero no es capaz de eliminarlas una vez formadas.
Palabras claves: extracto vegetal; fotoprotección; UV; dímeros de pirimidinas.
ABSTRACT
Aim: to evaluate the photoprotective effect of aqueous extract of Cymbopogon citratus (DC) Stapf against UVC-induced damage to ADN.
Material and methods: In the experimental procedure, samples of plasmid pBluescript SK II solutions were exposed to C. citratus aqueous extract in 0.01-4.0 mg/mL concentrations during 30, 60 and 90 min. In order to evaluate the photoprotective effect, the vegetal extract was applied before, during and after UVC radiation at 200 J/m2 doses. DNA repair enzymes T4 endonuclease V was employed in order to discriminate CPDs damage. Then, supercoiled and relaxed forms of DNA were separated after electrophoretic migration in agarose gels. Also aqueous extract transmittance was measure at 254 nm OD.
Results: None of the concentrations tested were genotoxic in 30 min of exposition. Concentrations ≥ 2 mg/mL induced strand breaks at 90 min of incubation. The C. citratus extract at concentrations ≥ 0.5 mg/mL protect DNA in front of UVC radiation.
Conclusions: In our experimental conditions, C. citratus extract protects DNA from the genotoxicity induced by light UVC, preventing the CPDs generation, but is not able to eliminate DNA damage once formed.
Key Words: plant extract; photoprotection; UV; pyrimidine dimers.
Introducción
El deterioro de la capa de Ozono, desde la década de los '70 hasta la actualidad, ha incrementado la radiación solar sobre la superficie terrestre. La radiación ultravioleta (UV), contenida en la luz solar, es uno de los mutágenos físicos ambientales más dañinos existentes en la actualidad1. Este agente físico actúa sobre diversos blancos biológicos como son las proteínas, los lípidos y el material genético. Los dímeros de pirimidina cis-syn ciclobutano (CPDs) son las lesiones más frecuentes que la luz UV ocasiona en el ADN, seguido por el fotoproducto pirimidin (6-4) pirimidona (6-4PP) y su isómero Dewar2. Diversos padecimientos de la piel, como el fotoenvejecimiento, la inmunosupresión o el cáncer, están relacionados con la generación de estas lesiones en el ADN de células epidérmicas. Por esta razón, hoy en día, la estrategia primaria en la prevención del cáncer de piel, incluye la reducción del daño al ADN3.
La actividad fotoprotectora de los bloqueadores solares sintéticos es poco satisfactoria debido a que no actúan en todo el espectro de la radiación solar, ejercen su acción por poco tiempo además de su alergenicidad probada. El tratamiento fitoterapéutico con compuestos antioxidantes y con potencial de absorber la radiación ultravioleta, puede ofrecer una fotoprotección más efectiva. Estos fitocomponentes además pueden impedir, revertir o evitar el proceso de formación y fijación de daños en el ADN4. Los fitocompuestos de plantas como Camellia sinensis, Citrus sinensis, Fragaria ananassa, varias especies del género Phyllanthus, Polypodium leucotomos y Silybum marianum, entre otros, han mostrado su capacidad fotoprotectora mediante una disminución del daño al ADN5-8.
Cymbopogon citratus (DC) Stapf, es una planta medicinal científicamente avalada como antidiarreico, hipocolesterolémico, hipoglicemiante e hipolipidémico9. En materia de protección al ADN se ha demostrado sus propiedades ante diversos agentes químicos10, 11 y la radiación gamma12, 13.
En el campo de las investigaciones antigenotóxicas, los ensayos que informan acerca de la protección del daño a nivel de estructura primaria del ADN, constituyen un excelente registro inicial. Ellos aportan elementos básicos para justificar el empleo de modelos experimentales más complejos en la búsqueda de respuestas sistémicas acerca de los mecanismos de protección. En este sentido, el ADN plasmídico en ensayos ex vivo es frecuentemente usado para el estudio de la fotoprotección al material genético6, 14.
El presente trabajo tuvo como finalidad evaluar el efecto protector del extracto acuoso de C. citratus (ECc) ante el daño inducido por las radiaciones UVC, mediante el ensayo ex vivo con ADN plasmídico pBluescript SK II.
Materiales y métodos
Extracto acuoso de Cymbopogon citratus (DC) Stapf (ECc)
Las plantas de C. citratus fueron recolectadas en Junio del 2007, en el área de la Ciudad de La Habana, Cuba. Los especímenes fueron verificados en la estación de Plantas Medicinales de Güira de Melena, Artemisa, Cuba (# herbario: 4593). El extracto acuoso fue preparado con las hojas siguiendo la metodología descrita por Cápiro y colaboradores en 200511. Posteriormente fue liofilizado el sobrenadante del extracto. Las soluciones de trabajo fueron filtradas (miliporo de 0,2 μm) y a partir de una solución de 16 mg/mL se prepararon diluciones de trabajo cuyas concentraciones fueron 0,01; 0,1; 0,5; 1; 2 y 4 mg/mL.
Modelo experimental y endonucleasa
Se empleó el plásmido pBluescript II SK circular covalentemente cerrado (2961 pb). Este plásmido contiene: origen de replicación bacteriano, gen de resistencia a ampicilina y sitios de corte para más de treinta enzimas de restricción. La enzima endonucleasa V del fago T4 (T4-endo V) fue la empleada para el reconocimiento y corte de las lesiones CPDs inducidas por la radiación UV.
Soluciones de trabajo
Solución disolvente del ADN: 10 mM Tris-HCl, 1 mM EDTA, pH 7,5 (Solución TE).
Solución tampón para la reacción de digestión con la enzima endonucleasa V del fago T4: 100 mM NaCl, 10 mM EDTA, 10 mM Tris HCl, pH 8 (Solución NET).
Solución tampón de la electroforesis en gel de agarosa: 44,6 mM Tris base, 44,5 mM Ácido bórico, 50 mM EDTA, pH 8 (Solución TBE 0,5x).
Procedimientos
Para todos los procedimientos las muestras de ADN plasmídico fueron disueltas en solución TE a una concentración inicial de 100 ng/μL. El control negativo (C-) fue 1 μL de ADN, en 1 μL de solución TE y 18 μL de solución NET e incubado en hielo durante 30 min. El control positivo (C+) fue 1 μL de ADN irradiado en 18 μL de solución NET, 1 μL de T4-endo V, incubado a 37oC durante 30 min. Para todos los tratamientos el volumen final fue de 20 μL. Fueron realizadas tres réplicas como mínimo por cada ensayo independiente.
Evaluación de la genotoxicidad del ECc sobre el ADN plasmídico
Para evaluar si el extracto produce roturas de simple (SSB, de las siglas en inglés) o doble (DSB, de las siglas en inglés) cadenas en el ADN, a 1 μL de ADN se le adicionó 1 μL de extracto y 18 mL de solución NET. Se incubaron las muestras a 37oC. Se evaluaron las concentraciones 0,01, 0,1, 0,5, 1, 2 y 4 mg/mL durante 30 min. Para evaluar la incidencia del tiempo de exposición (30, 60 y 90 min) en el efecto genotóxico solo fueron tomadas las concentraciones 1, 2 y 4 mg/mL. El criterio de genotoxicidad utilizado fue la aparición de las formas relajada (FR) o lineal (FL) del plásmido en la electroforesis con gel de agarosa.
Evaluación de la eventual inhibición de la enzima T4-endo V por su exposición al ECc
Para evaluar si el extracto es capaz de inhibir la acción de la enzima T4-endo V, a 1 μL de extracto de 4 mg/mL, se le adicionaron 17 μL de solución NET y 1 μL de T4-endo V y se incubó durante 0, 10, 30 y 50 min a 37oC. Posteriormente se le añadió 1 μL de ADN irradiado con UVC. El criterio de inhibición de la actividad enzimática utilizado fue la permanencia de la forma circular superenrollada (FS) del plásmido en el gel.
Evaluación de la capacidad protectora del ECc frente a la irradiación UVC
Para evaluar la capacidad protectora del ECc se siguieron 2 esquemas experimentales de tratamiento diferentes.
1. Cotratamiento: 1 μL de ADN se mezcló con 1 μL de ECc e inmediatamente se irradió con UVC.
2. Precotratamiento: 1 μL de ADN se incubó con 1 μL del ECc durante 30 min. Luego se irradió con UVC en presencia del extracto.
La irradiación se realizó en placas petri, a una dosis de 200 J/m2, con una lámpara TUV 15W/G15 T8 Philips, de longitud de onda de 254 ηm correspondiente al espectro UVC. Posterior a cada esquema de tratamiento, se adicionaron 17 μL de solución NET y 1 μL de T4-endo V. La mezcla se incubó a 37oC, durante 30 min. El criterio de protección utilizado fue la aparición de la FS conjuntamente con la disminución o desaparición de la FR o FL del plásmido.
Electroforesis y visualización
Con la finalidad de separar las FS, FL y FR de los plásmidos, se desarrolló la electroforesis en gel de agarosa al 0,8 % disuelto en TBE (0,5 X) con Bromuro de etidio (0,1 ηg/μL), a 80 Volt y 60 mA durante 60 min. Las bandas de plásmidos fueron visualizadas empleando un transiluminador (ModeloFTM20, FUSE 2XT3, 2 AMP 25W) y fotografiados usando una cámara automática (SAMSUNG S630 FC Samsung opto-electronics CO.LTD).
Cuantificación de la transmitancia del ECc frente a las radiaciones UVC
Se midió la transmitancia de las concentraciones de 0,01, 0,1, 0,5, 1,2y 4 mg/mL del ECc a 254 nm (UVC). Fue empleado un espectrofotómetro Génesis TM Serie 10 de la Corporación ThermoElectron.
Resultados
Producción de roturas de cadenas en el ADN plasmídico por el ECc
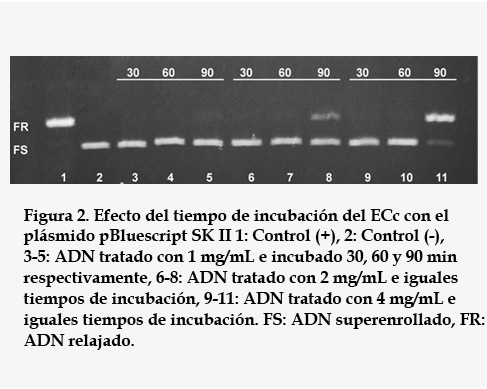
La genotoxicidad del ECc, medida como la capacidad de romper el ADN, fue evaluada como requisito previo a los experimentos de protección. En la figura 1 se muestran los resultados del efecto de ECc sobre el ADN plasmídico con 30 min de exposición. Ninguna de las concentraciones evaluadas produjo roturas en las cadenas. Sin embargo, al aumentar el tiempo de exposición a 90 min las concentraciones 2 y 4 mg/mL tuvieron un efecto clastogénico, más intenso en la máxima concentración evaluada (Figura 2).
Efecto del ECc sobre la actividad de la enzima T4-endo V
Un impedimento para la evaluación de la capacidad protectora del ECc sería una disminución de la actividad de la T4-endo V debido a la interacción de sus fitocompuestos con la enzima. Los resultados mostraron que la mayor concentración del extracto no inhibió la actividad nucleolítica de la enzima, en ninguno de los tiempos de incubación evaluados (Figura 3).
Capacidad protectora del ECc frente a la irradiación UVC
Basados en los resultados de las dos pruebas precedentes, las concentraciones de ECc seleccionadas para evaluar fotoprotección fueron: 0,01; 0,1; 0,5; 1; 2; 4 mg/mL. La capacidad fotoprotectora fue evaluada al tratar ADN con el extracto antes y durante la irradiación. Los resultados mostraron que las concentraciones del extracto a partir de 0,5 mg/mL, fueron capaces de mantener o favorecer la FS, efecto dependiente de la concentración (Figura 4). Cuando el ADN plasmídico fue tratado con el extracto 30 min previo a la irradiación se obtuvo inhibición de la formación de CPDs a partir de la concentración 0,5 mg/mL (Figura 5). Este efecto fotoprotector también fue dependiente de las dosis del extracto.
Transmitancia del ECc frente a las radiaciones UVC
Al analizar los valores de transmitancia del extracto acuoso, frente a la luz UVC 254 nm (Tabla 1), se observó que a medida que aumenta la concentración menor es la capacidad del extracto para permitir el paso de la radiación. Cerca del 50% de las radiaciones UVC son absorbidas por el extracto a la concentración de 0,1 mg/ml, concentraciones superiores a esta, bloquean totalmente el paso de las mismas.
Discusión
La radiación UV es un agente genotóxico, de naturaleza física no ionizante. Los CPDs constituyen la principal lesión originada en el ADN posterior a una irradiación con UV, lo que se ha relacionado con una serie de padecimientos de la piel ante exposición prolongada a la luz solar2. Siendo las radiaciones UVC las más energéticas y mutagénicas15 es frecuente su utilización para estudios con el mismo nivel molecular de análisis y la finalidad que se persigue en este trabajo.
En la búsqueda de compuestos con propiedades protectoras del ADN es frecuente utilizar ensayos que informan a nivel de la estructura primaria del ADN. Con el propósito de evaluar la acción genotóxica y antigenotóxica del extracto de la planta, el ADN plasmídico ex vivo, resultó un modelo experimental sumamente útil, de respuesta rápida y con validación internacional6, 14, 16, 17.
En la flora cubana la especie C. citratus posee un sólido aval como protector del ADN. El extracto acuoso de esta planta ha mostrado propiedades antigenotóxicas frente a mutágenos químicos y físicos10-13, 18. Sin embargo, la capacidad fotoprotectora de ECc en el modelo experimental con ADN plasmídico libre de célula no había sido abordada.
La evaluación de las propiedades beneficiosas de extractos de plantas obliga al desarrollo previo de experimentos de genotoxicidad. Estudios precedentes han avalado, en otros modelos biológicos, a extractos de C. citratus como no genotóxicos10, 11, 13. Estos antecedentes coinciden con los resultados encontrados en esta investigación, donde la exposición del plásmido a ECc no resultó genotóxica (Figura 1). Sin embargo, por primera vez se obtuvo evidencia experimental de que con el aumento del tiempo de exposición hasta 90 min puede causar daños clastogénicos al ADN (Figura 2). La mediación del tiempo de exposición en la expresión del daño en este modelo pudiera deberse a las interacciones químicas entre componentes del extracto y el ADN. El extracto de C. citratus, es una mezcla compleja y estudios fitoquímicos han mostrado la presencia de flavonoides, taninos, alcaloides fenoles, saponinas, aceites esenciales y esteroides19. Flavonoides como la quercetina, y su derivado la rutina, presentes en C. citratus20, son compuestos descritos en la literatura como agentes tóxicos21 y que generan daño primario el ADN, al aumentar la dosis y el tiempo de exposición22. También, varios extractos de plantas han mostrado conductas similares. Tal es el caso del extracto acuoso de Phyllanthus orbicularis6, 23.
Los resultados evidenciaron que para una misma concentración el incremento del tiempo de exposición favorece la respuesta genotóxica. El tiempo en que estos fitocomponentes pueden reaccionar directamente con el ADN, varía en dependencia de la reactividad de los mismos en las condiciones experimentales. Así mismo, un aumento de la concentración en un tiempo dado incrementa el efecto. Elementos tóxicos para la célula o el ADN pueden ser generados por interacciones entre compuestos del extracto.
En estudios de fotoprotección ha sido empleada la enzima T4-endo V, en este ensayo, para la detección de lesiones de tipo CPDs producidas por la radiación UV6. La inhibición de la enzima podría evitar la aparición de las formas relajadas o lineales, aún cuando en el plásmido se hayan formado CPDs. Tal evento conllevaría a resultados de protección "positiva" que serán falsos. En este sentido, los resultados demostraron que no existe un efecto inhibitorio de la actividad endonucleolítica de la T4-endo V por tanto se excluye tal posibilidad (Figura 3).
La capacidad de inhibir la formación de CPDs del ECc a partir de 0,5 mg/mL, justifican la potencialidad de esta planta como fotoprotector (Figuras 4 y 5). Los resultados obtenidos en precotratamiento y cotratamiento sugieren que el ECc actúa como desmutágeno por reducir o impedir con su presencia el impacto de la radiación UV sobre el ADN24. El esquema cotratamiento indica que el ECc impide que se produzca el daño genético, y esto dado la naturaleza del agente dañino, pudiera relacionarse con la capacidad de absorción del extracto.
En ambos tipos de esquema, el ECc protegió al ADN en concentraciones donde la transmitancia era baja o nula (Tabla 1). Ratifica esto, que el efecto fotoprotector del extracto se debe a su capacidad bloquedora frente a las radiaciones UV.
Entre los compuestos fenólicos bloquedores de la luz UV se encuentran los ácidos fenólicos, terpenoides, monoterpenos, taninos, flavonoides y aceites volátiles4. Ejemplos de ellos, y presentes en C. citratus, son el ácido cumárico, clorogénico y cafeico, geranial y neral. También se encuentran algunos como el limoneno, la quercetina o el kaempferol que tienen picos de absorción entre 250 y 280 ηm4, 9, 25, 26. La presencia de estos compuestos en ECc fundamenta que esta especie sea fuente natural de agentes protectores del ADN frente al daño producido por la radiación UV.
En las plantas terrestres los niveles naturales de exposición solar, evolutivamente han reforzado diferentes mecanismos de tolerancia a luz UV27. La potenciación de los sistemas de reparación es un mecanismo descrito para compuestos vegetales que reducen el daño al ADN y la carcinogénesis. Fitocomponentes como catequinas del Té verde28, silimarina29 y proantocianinas30 reducen significativamente los niveles de CPDs potenciando la eficiencia de la reparación por escisión de nucleótidos. Sobre esta base, no debe excluirse, además del mecanismo físico descrito anteriormente en compuestos del ECc, posibles propiedades bioantimutagénicas. En este sentido, experimentos futuros con sistemas celulares aportarán información al respecto.
Los resultados de esta investigación muestran la capacidad de ECc de absorber las radiaciones UV y con ello impedir la formación de daños en el ADN. Ello potencia la actividad fotoquimiopreventiva de C. citratus. Investigaciones futuras en biomodelos bacterianos y/o células eucariontes serán de gran utilidad para profundizar en el estudio de tal propuesta.
Agradecimientos
Esta investigación fue financiada por un proyecto de colaboración bilateral entre Brasil y Cuba, CAPES/MES.
Conflicto de interés
Los autores declaran que no existe ningún conflicto de interés.
Bibliografía
1. Schuch AP, Dos Santos MB, Lipinski VM, Peres LV, Dos Santos CP, Cechin SZ, et al. Identification of influential events concerning the Antarctic ozone hole over southern Brazil and the biological effects induced by UVB and UVA radiation in an endemic treefrog species. Ecotoxicol Environ Sci. 2015;118:190-8. [ Links ]
2. Cadet J, Grand A, Douki T. Solar UV Radiation-Induced DNA Bipyrimidine Photoproducts: Formation and Mechanistic Insights. Topical Current Chemical. 2015;356:249-76. [ Links ]
3. Seebode C, Lehmann J, Emmert S. Photocarcinogenesis and Skin Cancer Prevention Strategies. Anticancer Res. 2016;36:1371-8. [ Links ]
4. Rojas J, Londoño C, Ciro Y. The Health Benefits of Natural Skin UVA Photoprotective Compounds Found in Botanical Sources. International Journal of Pharmacy and Pharmaceutical Sciences. 2016;8(3):13-23. [ Links ]
5. Vernhes M, González-Pumariega M, Andrade L, Passaglia Schuch A, Moreno De Lima-Bessa K, Martins Menck FC, et al. Protective effect of a Phyllanthus orbicularis aqueous extract against UVB light in human cells. Pharmaceutical Biology. 2012. [ Links ]
6. Vernhes M, González-Pumariega M, Passaglia Schuch A, Martins CF, Sánchez-Lamar A. El extracto acuoso de Phyllanthus orbicularis K protege al ADN plasmídico del daño inducido por las radiaciones ultravioletas. Pharmaceutica. 2013;54:16-23. [ Links ]
7. Saewan N, Jimtaisong A. Natural products as photoprotection. Journal of Cosmetic Dermatology. 2015;14:47-63. [ Links ]
8. Menéndez-Perdomo IM. Actividad fotoprotectora de especies de Phyllanthus endémicas de Cuba, ante el daño al ADN inducido por la radiación UV. Tesis presentada en opción al Título Académico de Máster en Bioquímica, Mención Toxicología Facultad de Biología: Universidad de La Habana; 2016. [ Links ]
9. Shah G, Shri R, Panchal V, Sharma N, Singh B, Mann AS. Scientific basis for the therapeutic use of Cymbopogon citratus, Stapf (Lemon grass). J Adv Pharm Technol Res. 2011;2:3-8. [ Links ]
10. Cápiro N, Sánchez-Lamar Á, Fonseca G, Baluja L, Borges E. Capacidad protectora de Cymbopogon citratus (DC.) Stapf. ante el daño genético inducido por estrés oxidativo. Revista Cubana de Investigaciones Biomédicas. 2001;20(1). [ Links ]
11. Cápiro N, Sánchez-Lamar A, Baluja L, Sierra LM, Comendador García MA. Efecto de la Concentración de Cymbopogon citratus (DC) Stapf sobre la Genotoxicidad de Mutágenos Modelos, en el Ensayo Smart de Ojos W/W+ de Drosophila melanogaster. Revista CENIC Ciencias Biológicas. 2005;36:1-5. [ Links ]
12. Rao B, Shanbhoge R, Rao B, Adiga S, Upadhya D, Aithal B, et al. Preventive efficacy of hydroalcoholic extract of Cymbopogon citratus against radiation-induced DNA damage on V79 cells and free radical scavenging ability against radicals generated in vitro. Hum Exp Toxicol. 2009;28:195-202. [ Links ]
13. Cuétara E, Álvarez A, Alonso A, Vernhes M, Sánchez-Lamar A, Festary T, et al. A microanalytical variant of the SOS Chromotest for genotoxicological evaluation of natural and synthetic products. Biotecnología Aplicada. 2012;29:108-12. [ Links ]
14. Schuch AP, Garcia CCM, Makita K, Menck CFM. DNA damage as a biological sensor for environmental sunlight. Photochem Photobiol Sci. 2013;12:1259-72. [ Links ]
15. Schuch AP, Menck CFM. The genotoxic effects of DNA lesions induced by artificial UV-radiation and sunlight. J Photochem Photobiol B. 2010;99:111-6. [ Links ]
16. Moreno SRF, Freitas RS, Rocha EK, Lima-Filho GL, Bernardo-Filho aM. Protection of plasmid DNA by a Ginkgo biloba extract from the effects of stannous chloride and the action on the labeling of blood elements with technetium-99m. Braz J Med Biol Res. 2004;37:267-71. [ Links ]
17. Guha G, Rajkumar V, Mathew L, Kumar RA. The antioxidant and DNA protection potential of Indian tribal medicinal plants. Turkish Journal Biology. 2011;35(2011):233-42. [ Links ]
18. Suaeyun R, Kinouchi T, Arimochi H, Vinitketkumnuen U, Ohnishi Y. Inhibitory effects of lemon grass (Cymbopogon citratus Stapf) on formation of azoxymethane-induced DNA adducts and aberrant crypt foci in the rat colon. Carcinogenesis. 1997;18:949-55. [ Links ]
19. Ekpenyong CE, Akpan E, Nyoh A. Ethnopharmacology, phytochemistry, and biological activities of Cymbopogon citratus (DC) Stapf extracts. Chin J Nat Med. 2015;13:0321-37. [ Links ]
20. Figueirinha A, Paranhos A, Pérez-Alonso JJ, Santos-Buelga C, Batista MT. Cymbopogon citratus leaves: Characterisation of flavonoids by HPLC-PDA-ESI/MS/MS and an approach to their potential as a source of bioactive polyphenols. Food Chemistry. 2008;110:718-28. [ Links ]
21. Macías B, Suárez MF, Berenguer CA, Pérez L. Intoxicaciones por plantas tóxicas atendidas desde un servicio de información toxicológica. Revista Cubana de Plantas Medicinales. 2009;14(2). [ Links ]
22. Marcarini JC, Tsuboy MSF, Luiz RC, Ribeiro LR, Hoffmann-Campo CB, Mantovani MS. Investigation of cytotoxic, apoptosis-inducing, genotoxic and protective effects of the flavonoid rutin in HTC hepatic cells. Exp Toxicol Pathol. 2011;63:459-65. [ Links ]
23. Sánchez-Lamar A, Fiore M, Cundari E, Ricordy R, Cozzi R, De Salvia R. Phyllanthus orbicularis Aqueous Extract: Cytotoxic, Genotoxic, and Antimutagenic Effects in the CHO Cell Line. Toxicol Appl Pharmacol. 1999;239:231-9. [ Links ]
24. Bhattacharya S. Natural Antimutagens: A review. Research Journal of Medicinal Plants. 2011;5:116-26. [ Links ]
25. Schaneberg BT, Khan IA. Comparison of Extraction Methods for Marker Compounds in the Essential Oil of Lemon Grass by GC. Journal of Agricultural and Food Chemistry. 2002;50:1345-9. [ Links ]
26. Pinto ZT, Sánchez FF, Ramos A, Amaral ACF, Ferreira JLP, Escalona-Arranz JC, et al. Chemical composition and insecticidal activity of Cymbopogon citratus essential oil from Cuba and Brazil against housefly. Brazilian Journal of Vegetal Parasitology. 2015;14:36-44. [ Links ]
27. Stapleton AE, Walbot V. Flavonoids Can Protect Maize DNA from the Induction of Ultraviolet Radiation Damage. Plant Physiol. 1994;105:881-9. [ Links ]
28. Katiyar SK. Green tea prevents non-melanoma skin cancer by enhancing DNA repair. Arch Biochem Biophys. 2011;508:152-8. [ Links ]
29. Katiyar SK, Mantena SK, Meeran SM. Silymarin Protects Epidermal Keratinocytes from Ultraviolet Radiation-Induced Apoptosis and DNA Damage by Nucleotide Excision Repair Mechanism. PLos ONE. 2011;6:1-11. [ Links ]
30. Vaid M, Sharma SD, Katiyar SK. Proanthocyanidins Inhibit Photocarcinogenesis through Enhancement of DNA Repair and Xeroderma Pigmentosum Group A-Dependent Mechanism Cancer Prevention Research. 2010;3:1621-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Fabiana Fuentes-León
Tel.: +53-7-8328542
fax: +53-7-8321321
alamar@fbio.uh.cu,
fabiana@fbio.uh.cu
Received: 25.11.2016
Accepted: 20.12.2016