Puntos clave
Los tumores cerebrales recurrentes de alto grado se caracterizan por una profunda inmunosupresión y un crecimiento agresivo, las opciones terapéuticas de segunda o tercera línea son escasas y con resultados controversiales de seguridad y eficacia. Algunos ensayos clínicos están en curso, pero deben potenciarse las investigaciones en este campo.
No existe una investigación anterior que evalúe esta propuesta, que evidencia la seguridad y eficacia de la combinación cubana de interferones como nueva línea de terapia en pacientes con tumores cerebrales avanzados sin opción terapéutica.
La producción de un fármaco nacional, que responde de modo eficaz a parámetros de seguridad y supervivencia en enfermedades sin opciones terapéuticas, constituye una estrategia gubernamental para mejorar la oferta de salud a los pacientes, ampliar los horizontes de investigación con el fármaco y reducir importaciones.
Introducción
El cáncer ocasiona millones de muertes al año y origina altos costos. Los tumores primarios del Sistema Nervioso Central (SNC) corresponden al 2 % de todos los tipos de cáncer. A escala mundial en el año 2020 se diagnosticaron 308 102 casos de tumores del SNC, con 251 329 defunciones. Dentro de los tumores de encéfalo primarios, el 38 % son de alto grado de malignidad.1) En el 2018 en Cuba, esta entidad ocasionó la muerte de 617 pacientes, con una tasa ajustada entre 5,6 y 5,4 por cada 100 000 habitantes.2) El tratamiento de primera línea de los tumores de alto grado es la cirugía, seguido de radioterapia, pero se ha obtenido un limitado progreso en su tratamiento.3-5 Se estima que en más del 95 % de los casos ocurre una recurrencia en el área adyacente a la resección.6,7) La sobrevida de pacientes de alto grado persistentes o recidivantes es alrededor de seis meses, y menos del 10 % sobrevive dos años.8,9) La aplicación de enfoques inmunoterapéuticos, especialmente estrategias de combinación, han demostrado alguna eficacia contra el glioblastoma multiforme (GM). La asociación de inhibidores del punto de control inmunitario con radioterapia parece ser una estrategia a considerar, sin embargo, las reacciones de disparidad en los estudios indican la necesidad de realizar investigaciones adicionales para evaluar la eficacia en grupos específicos de pacientes. Estas terapias dianas inducen pocas respuestas completas en los enfermos, no han sido curativas y han mostrado toxicidad, sin lograr beneficios notables en la supervivencia.
Estos resultados tan pobres conducen a la búsqueda de nuevas modalidades terapéuticas que produzcan un impacto real en la supervivencia, en condiciones de seguridad para los pacientes y con factibilidad económica en su empleo.
El interferón (IFN), primer modificador de respuesta biológica efectivo, se ha utilizado con frecuencia para tratar diversas neoplasias, como el sarcoma de Kaposi10 y el mieloma múltiple.11) Existen tres tipos de Interferones: Tipo I (IFN-α e IFN-β), Tipo II (IFN-γ) y Tipo III (IFN λ1, λ2, λ3), esta clasificación se basa en la procedencia celular, la derivación genética y las propiedades de cada uno de ellos.12) Pueden ser divididos en tipos antigénicamente distintos y también por el tipo de estímulo para su inducción.13) La acción antitumoral de los interferones (IFNs) está mediada en lo fundamental por la inhibición del crecimiento y la inducción de la apoptosis de las células tumorales, ya que actúan a nivel del ciclo celular.14,15) Al controlar la apoptosis, el IFN-γ puede ejercer acción antitumoral, este efecto es dependiente del estado de diferenciación de las células y de los niveles de receptores para IFN.16,17) El IFN-α ha resultado eficaz en el tratamiento de tumores sólidos que constituyen indicaciones reconocidas de este tipo de producto, tales como carcinoma renal, de mama, basocelulares, superficial de vejiga y en carcinomas recurrentes de ovario.18-20
En el Centro de Ingeniería Genética y Biotecnología (CIGB) en La Habana, Cuba, se ha probado la combinación de IFN alfa y gamma en enfermedades oncológicas, única en el mundo, con la hipótesis de potenciar los efectos antitumoral y antiangiogénico de ambos. La característica principal de esta formulación combinada es su sinergismo, con la conservación de las propiedades biológicas descritas para ambos tipos de interferones (antiviral, antiproliferativa e inmunomoduladora). La administración del producto en un modelo experimental de ratones desnudos con un tumor glial humano implantado, demostró ser eficaz en la reducción de volumen tumoral. La farmacodinamia, evaluada en primates no humanos, mostró un elevado nivel de expresión de neopterina, que reflejó la potenciación de su acción biológica. La farmacocinética y farmacodinamia comparada en voluntarios sanos brindó datos de seguridad que avalaron su uso en humanos y una potencia biológica superior a los interferones por separado y similar a los interferones pegilados.21) En los países en desarrollo existe poca disponibilidad de las terapias de segunda o tercera línea que se emplean para el tratamiento de pacientes con tumores cerebrales recurrentes de alto grado de malignidad. El uso de los IFNs para el tratamiento de los pacientes con esta entidad puede ser potenciado a través de su combinación en busca de eficacia, sin promover toxicidad.
Desde 2009 se realiza un estudio retrospectivo en el Hospital Clínico Quirúrgico “Arnaldo Milián Castro” de Villa Clara, Cuba, para evaluar la efectividad y seguridad de la aplicación de la combinación de interferones en estos pacientes, sin otras opciones terapéuticas disponibles.
Métodos
Datos
Pacientes con tumor cerebral recurrente o progresivo de alto grado de malignidad recibieron tratamiento con el anticuerpo monoclonal nimotuzumab o con una combinación de interferones entre 2009 y 2016 en el Hospital Provincial Universitario Clínico Quirúrgico “Arnaldo Milián Castro”, de Villa Clara, Cuba. Los criterios de inclusión fueron: edad ≥18 años, cualquier género y color de piel, escala de Karnofsky al inicio del tratamiento (EK) 60-100 %, criterio diagnóstico anatomo-patológico, evaluación por imágenes, parámetros hematopoyéticos en rango normal, al menos cuatro semanas después de la cirugía y con los criterios de recuperación, las pacientes en edad fértil utilizaron un método anticonceptivo eficaz, expresa por escrito la voluntariedad del paciente. Los criterios de exclusión fueron los siguientes: infarto de miocardio en los últimos 6 meses, angina severa o inestable, implante de bypass coronario o periférico, insuficiencia cardíaca congestiva sintomática, embarazo, puerperio o lactancia, infección activa, hipersensibilidad al Interferón, enfermedades crónicas descompensadas, enfermedades con compromiso metabólico, muy mal estado general, convulsiones intratables médicamente o trastorno psiquiátrico grave.
Tratamiento y diseño del estudio
Se realizó un estudio retrospectivo unicéntrico en pacientes con tumor cerebral recurrente o progresivo de alto grado de malignidad que habían recibido tratamiento con anticuerpo monoclonal Nimotuzumab o la combinación de interferones. El Grupo Experimental (GE) recibió la combinación de interferón, se administraron 7 MUI de una mezcla de interferón alfa y gamma por vía subcutánea en un volumen de 5 mL dos veces por semana, durante cuatro semanas durante la fase de inducción. En la fase de mantenimiento se administraron 3,5 MUI de la mezcla, con la misma frecuencia de administración. El Grupo Control (GC) fue tratado con 200mg de Nimotuzumab endovenoso en un volumen de 250 mL de cloruro de sodio al 0,9 %, una vez por semana, por seis semanas durante la fase de inducción. En la fase de mantenimiento se administró la misma dosis y vía de acceso, pero disminuyó la frecuencia a dos veces por mes.
Resultados y evaluaciones
La Supervivencia Global (SG) se definió como la fecha del diagnóstico hasta la muerte por cualquier causa o la fecha de la última visita. En cada visita se evaluó la capacidad funcional según la escala de Karnofsky. Las visitas de seguimiento se realizaron cada semana durante el primer mes y luego cada tres meses hasta el final del estudio.
Este proyecto de investigación fue aprobado por el Consejo Científico Institucional y el Comité de Ética en Investigación Clínica, quienes lo evaluaron desde el punto de vista científico, metodológico y ético. Se determinó que cumplió con la Declaración de Helsinki (Principios Éticos para la Investigación Médica en Seres Humanos, adoptada por la Asamblea Médica Mundial, Seúl 2008) y sus procedimientos se realizaron de acuerdo con lo establecido en los códigos de ética nacionales e internacionales y la normativa legal vigente en Cuba (Normas de Buenas Prácticas Clínicas, CECMED 2001), así como en la Guía de Buenas Prácticas Clínicas de la Conferencia Internacional de Armonización.
Análisis estadístico
Se utilizó estadística descriptiva para las variables de control, como media, mediana, mínimo y máximo, tasa porcentual. La homogeneidad de los grupos se determinó comparando las variables de control. Para sexo y tipo histológico se utilizó la prueba de Chi-cuadrado. Para el color de la piel y las comorbilidades presentes, se utilizó la prueba exacta de Fisher. Para la edad, estadio tumoral, y capacidad funcional al inicio del estudio se utilizó la prueba de Mann-Withney. En cuanto a la capacidad funcional a lo largo de la investigación se utilizó la prueba de Mann-Withney. Las curvas de supervivencia se completaron mediante los métodos de Kaplan-Meier con una prueba de rangos logarítmicos.
Resultados
Caracterización de la muestra en estudio.
Se identificaron 44 pacientes que cumplían criterio diagnóstico en el periodo de inclusión, se excluyeron 4 enfermos, dos de ellos no estuvieron de acuerdo en participar y otros dos presentaron alguno de los criterios de exclusión, quedó constituida una muestra de 40 casos. En estos pacientes, 23 recibieron la combinación de interferones, conformando el GE, y en el GC se incluyeron 17 enfermos que se trataron con Nimotuzumab. Las variables demográficas y clínicas de interés de ambos grupos se muestran en la tabla 1. Luego del análisis estadístico, se consideró que ambos grupos resultaron comparables al inicio de la investigación. De manera global, tanto en la muestra total como por grupos se observó correspondencia con lo referido en la literatura.
Tabla 1: Distribución de pacientes según variables demográficas y clínicas de interés. Hospital Provincial Clínico Quirúrgico “Arnaldo Milián Castro”, años 2009-2020.
| Variables | Grupo exp. (n=23) | Grupo con. (n=17) | Test aplicados | P | |
|---|---|---|---|---|---|
| Sexo | Hombre | 16 (69,56 %) | 10 (58,82 %) | Chi cuadrado | 0,481 |
| Mujer | 7 (30,43 %) | 7 (41,17 %) | |||
| Color de la piel | Blanca | 18 (78,26 %) | 15 (88,23 %) | Prueba exacta de Fisher | 0,677 |
| No blanca | 5 (21,73 %) | 2 (11,76 %) | |||
| Edad | Media (años) | 50,9 | 49,4 | Test de Mann-Withney | 0,924 |
| Mediana (años) | 52 | 50 | |||
| (Mín; Máx) | (25; 76) | (24; 74) | |||
| Estadio tumoral | III | 8 (34,78 %) | 5 (29,41 %) | Test de Mann-Withney | 0,831 |
| IV | 15 (65,21 %) | 12 (70,58 %) | |||
| Tipo histológico | Oligoastrocitoma anaplásico | 2 (8,69 %) | 3 (17,64 %) | Prueba de Monte Carlo | 0,520 |
| Astrocitoma anaplásico | 6 (26,08 %) | 2 (11,76 %) | |||
| Gliosarcoma | 1 (4,34 %) | 0 | |||
| Glioblastoma multiforme | 14 (60,86 %) | 12 (70,58 %) | |||
| Ubicación topográfica por lóbulo | Frontal | 8 (34,78 %) | 9 (52,94 %) | Prueba de Monte Carlo | 0,497 |
| Parietal | 6 (26,08 %) | 4 (23,52 %) | |||
| Temporal | 5 (21,73 %) | 3 (17,64 %) | |||
| Occipital | 1 (4,34 %) | 1 (5,88 %) | |||
| Vermix | 1 (4,34 %) | 0 | |||
| Más de un lóbulo | 2 (8,69 %) | 0 | |||
| % de resección tumoral | Total 100 % | 3 (13,04 %) | 2 (11,76 %) | Test de Mann-Withney | 0,833 |
| Sub-total 90-99 % | 5 (21,73 %) | 5 (29,41 %) | |||
| Parcial 50-89 % | 15 (65,21%) | 10 (58,82 %) | |||
| Biopsia < 50 % | 0 | 1 (4 %) | |||
| Co-morbilidad | No refiere | 14 (60,86 %) | 11 (64,7 %) | Prueba de Monte Carlo | 0,683 |
| Una | 8 (34,78 %) | 6 (35,29 %) | |||
| Dos o más | 1 (4,34 %) | 0 | |||
| Escala de Karnofsky a la inclusión | KPS 100 | 3 (13,04 %) | 1 (5,88 %) | Test de Kolmogorov-Smirnov | 0,238 |
| KPS 90 | 7 (30,43 %) | 12 (70,58 %) | |||
| KPS 80 | 5 (21,73 %) | 1 (5,88 %) | |||
| KPS 70 | 5 (21,73 %) | 3 (17,64 %) | |||
| KPS 60 | 3 (13,04 %) | 0 | |||
Fuente: Historias clínicas.
Predominó del sexo masculino con razón de masculinidad de 1,8 hombres por cada mujer y el color de piel blanca. Los valores medios de edad se ubicaron en 50,9 años en el GE y 49,4 años en el GC. La incidencia de tumores cerebrales en general aumentó con la edad. Para el glioma maligno en particular, la incidencia mundial es bimodal con prevalencia en las edades más jóvenes y mayores y la distribución de edad también varía según el tipo histológico. El más común, el GM tienen la mayor incidencia en personas de entre 60 y 70 años y decrece después de ese periodo. Se refieren para ello causas competitivas de mortalidad, diferentes patrones de diagnóstico en los grupos de edades más antiguos, o diferencias reales en la incidencia de los tumores cerebrales.5,6 Al respecto, en este estudio solo dos adultos jóvenes presentaron GM, uno por grupo, con 24 y 25 años a la inclusión. Sobre el pico de incidencia de la enfermedad, el 93,3 % de los casos se presentaron después de los 45 años, para el GE el mayor rango etario fue entre 45 y 58 años con el 47,82 %, mientras que para el GC fue entre 47 y 60, con el 52,94 %, los valores de medias y medianas en ambos grupos son muy semejantes. Con respecto a las comorbilidades, más del 60 % de los pacientes no refirieron ninguna enfermedad asociada. En el GC, ningún paciente refirió más de una comorbilidad, en el GE un solo caso presentó dos o más enfermedades. Sobre las enfermedades más frecuentes, 10 pacientes refirieron hipertensión arterial.
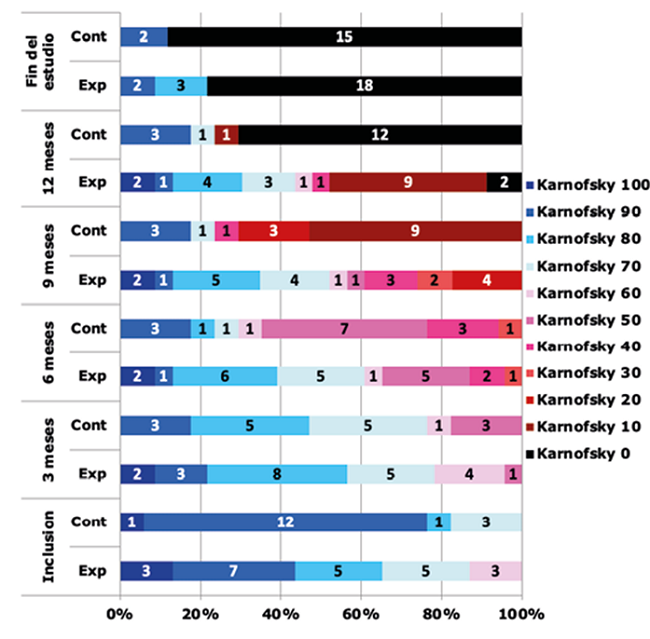
En ambos grupos prevaleció el estadio tumoral IV, 65,21 % de los pacientes del GE y 70,58 % de los casos del GC. Predominó el GM, con 60,86 % para el GE y 70,58 % para el GC. En segundo lugar de incidencia se reportó el AA para el GE, pero en el GC el segundo lugar en la incidencia fue para el oligoastrocitoma anaplásico. Como diagnóstico infrecuente quedó un caso de gliosarcoma en el GE. Un factor importante por considerar es la toma de uno o más lóbulos cerebrales, con el consiguiente peor pronóstico de la lesión. En esta investigación, para ambos grupos predominó la consideración unilobular. Dos pacientes del GE presentaron lesión multilobular frontoparietal y temporoparietal respectivamente. Otro factor analizado fue la resección tumoral, que en ambos grupos resultan similares con más del 85 % de los pacientes sometidos a resección parcial o sub-total, o sea, entre el 50 y el 99 % de la lesión extirpada. En sentido general, se esperaron mejores resultados en función del mayor porcentaje de resección. Junto al grado de resección tumoral, la escala funcional de Karnofsky preoperatorio en estos pacientes se considera factor pronóstico bien establecido. En el GE predominaron los pacientes que presentaban EK entre 90 y 70 con el 73,89 % de los casos, mientras que en el GC el 70,58 % presentó EK de 90.
Evaluación de eficacia
Análisis de la supervivencia global por grupo de estudio y estadio.
La SG por grupo de estudio se evaluó a los seis, 12 meses y al cierre del estudio y también se analizó en función al estadio tumoral. Los resultados se muestran en la Tabla 2 y en la Figura 1.
Tabla 2: Evaluación de la supervivencia global. Hospital Provincial Clínico Quirúrgico “Arnaldo Milián Castro”, años 2009-2020.
| Variable | Grupo de estudio | Media | IC 95 % | Mediana | IC 95 % | Valor de P | Porcentaje |
|---|---|---|---|---|---|---|---|
| SG-6 | Exp. | 28,870 | 20,96-36,77 | 18,0 | 7,04-28,95 | 0,096 | n=23 100 % |
| Control | 21,200 | 12,06-30,33 | 11,0 | 10,40-11,59 | n=15 88,2 % | ||
| SG-12 | Exp. | 30,571 | 22,26-38,87 | 23,0 | 11,78-34,21 | 0,294 | n=21 91,3 % |
| Control | 42,800 | 28,53-57,06 | 37,0 | 26,26-47,73 | n=5 29,4 % | ||
| SG al cierre | Exp. | 32,114 | 23,35-40,87 | 18,0 | 7,04-28,95 | 0,011 | n=5 21,7 % |
| Control | 19,118 | 10,86-27,37 | 11,0 | 10,38-11,61 | n=2 11,8 % | ||
| Estadio III | Exp. (n=8) | 47,00 | 33,21-60,78 | . | . | 0,492 | n=5 62,5 % |
| Control (n=5) | 42,80 | 30,04-55,55 | 37,00 | 26,26-47,73 | n=2 40,0 % | ||
| Estadio IV | Exp. (n=15) | 20,467 | 15,21-25,72 | 16,00 | 11,26-20,73 | 0,000 | n=0 |
| Control (n=12) | 9,250 | 7,55-10,94 | 10,00 | 9,15-10,84 | n=0 |
Fuente: Historias clínicas.
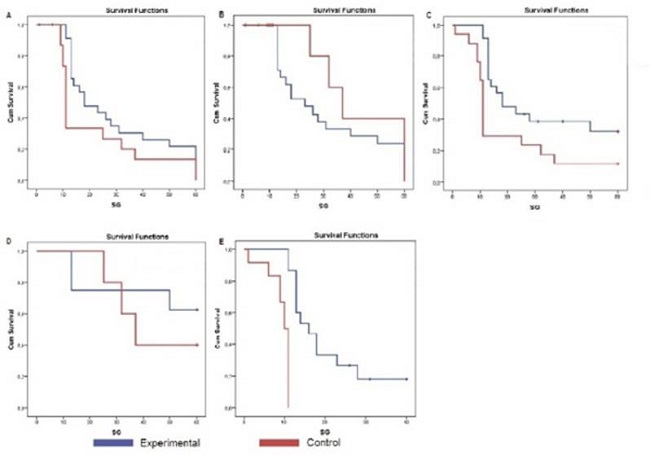
Figura 1: Curvas de Kaplan-Meier para supervivencia global, A: SG-6, B: SG-12, C: SG- Global, D: SG estadio III, E: SG estadio IV.
Aunque no se demostraron diferencias significativas en la SG entre el GE y GC en ninguna de las evaluaciones, a los seis meses el 100 % de los pacientes del GE y el 88,2 % de los casos del GC se mantenían vivos. Al año habían fallecido solamente el 8,7 % de los casos del GE, frente al 70,6 % en el GC. Al cierre del estudio el 21,7 % de los pacientes del GE aún vivía, frente al 11,8 % en el GC. Se determinó también la SG en función del estadio tumoral, en esta evaluación no hay diferencias significativas entre los valores de media para los pacientes con tumores estadio III, con 47 y 42,8 meses respectivamente para el GE y el GC. En los estadios IV la media de SG alcanzó los 20,47 meses en el GE y 9,3 meses en el GC, con diferencias significativas. La mediana para estos casos fue de 16 meses en el GE y de 10 meses en el GC. Todos los pacientes estadio IV habían fallecido al cierre.
Análisis de la tasa de control de la enfermedad y del riesgo relativo de muerte.
Se determinó la TCE para ambos grupos, obteniéndose la proporción de pacientes que redujeron o estabilizaron la enfermedad a lo largo del estudio. El GC presentó una proporción de 0,2941 y 0,4347 el GE, con diferencias significativas entre ellos (p= 0,0101). La relación entre las tasas de incidencia se corresponde con la evaluación del riesgo.
Al ejecutar el análisis de riesgo, el riesgo absoluto del GE fue de 78,26 %, con IC 95 % 61,40 %- 95,12 %, el riesgo absoluto del GC fue de 88,24 %, con IC 95 % 72,91 %- 103,55 %. El HR fue de 0,887, con IC 95 % 0,673 %-1,17 %, lo que significó una asociación positiva y directa entre el tratamiento propuesto y la supervivencia. Como el límite inferior del IC es menor que 1, no se consideró estadísticamente significativa la relación entre ambos. La posibilidad de sobrevivir para los pacientes que se trataron con la combinación de interferones fue 0,887 veces superior a los tratados solo con el nimotuzumab.
Análisis de la capacidad funcional.
Sobre la capacidad funcional se determinaron los cambios respecto al valor basal a los tres, seis, nueve y 12 meses de tratamiento, y luego al cierre. Se reportaron diferencias para el GE con respecto al GC en la inclusión, con peor capacidad funcional para los pacientes del GE. Esta salvedad en la homogeneidad de los grupos del estudio en detrimento del GE no tuvo significación estadística y resulta favorable para la investigación, pues situó en peores condiciones al GE a la inclusión. Las evaluaciones a los tres y seis meses no arrojaron diferencias entre los grupos, pero a partir de los nueve meses se evidenciaron diferencias notables que se extienden hasta el cierre de la investigación, llega a estar el 21,74 % de los pacientes del GE con una capacidad funcional favorable por encima de 80 según la escala de Karnofsky, mientras en el GC el 88,24 % de los pacientes se encuentran en el valor de la escala que corresponde al fallecimiento. El análisis de los resultados de las evaluaciones de la escala de Karnofsky en cada momento, se recogieron en la Figura 2.
Consideraciones sobre la seguridad terapéutica
No se produjeron EA graves relacionados con los fármacos en el estudio. Este resultado tan favorable contrastó con lo reportado en la literatura para los esquemas de tratamiento empleados al tratar tumores cerebrales de alto grado de malignidad.
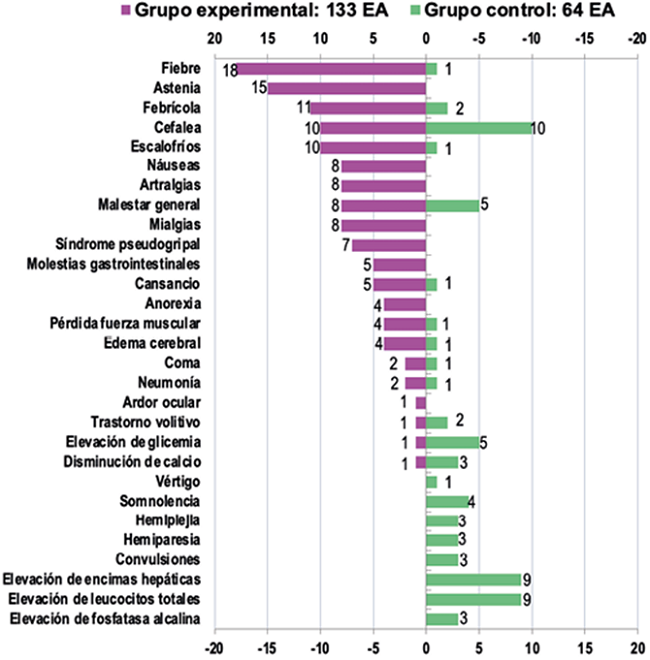
Se reportaron 197 EAs, de ellos 133 (67,5 %) correspondieron al GE y 64 eventos (32,06 %) al GC. Los EA que globalmente se reportaron con mayor frecuencia fueron la cefalea (10,15 %), la fiebre (9,64 %) y la astenia (7,61 %). En el análisis por grupo, en el GE se reportaron como EA frecuentes la fiebre (13,53 %), la astenia (11,27 %) y episodios de febrícula (8,27 %). En el GC resultó más frecuente la cefalea (15,62 %), la alteración de las enzimas hepáticas (14,06 %) y en menor medida el malestar general y la elevación de la glicemia (ambos EA con 7,81 %). Predominaron los EA de grado menor que 3, de intensidad leve o moderada (84,23 %), con relación de causalidad probable o definitiva con los fármacos de la investigación (79,18 %), que no generaron cambios en la medicación (94,41 %) y con recuperación mejoría en la mayor parte (86,81 %). Al analizar la seguridad por grupo, se observó semejanza de las mismas categorías reportadas en el análisis global, a excepción de la relación de causalidad, a predominio definitiva (72,18 %) en el GE y distribuida entre definitiva (32,81 %) y dudosa (29,69 %) en el GC. En cuanto a resultados de los EA que se presentaron, en el GE solo persistieron nueve EA (6,77 %), no se generaron secuelas o se produjeron empeoramientos por EA, para el GC los casos en los que los EA generaron secuelas que persistieron o empeoraron alcanzan el 26,56 %. El análisis de los eventos adversos por grupo se recoge en la Figura 3.
Discusión
Para los pacientes en estadio III, las pautas de tratamiento recomiendan resección máxima, radioterapia y quimioterapia con temozolamida, pese a este enfoque de tratamiento multimodal, los pacientes tienen una limitada esperanza de vida. En el estudio de Wahner (2020)22 todos recibieron los mejores esquemas de tratamiento posibles y a más del 65 % de los pacientes se les realizó cirugía de resección amplia y se obtuvo un modelo predictivo de tres escalas donde la SG a los cinco años para el mejor grupo fue de 88 %. En la presente investigación, sin definir el peor escenario posible y con limitaciones en la determinación de biomarcadores, en 11 años la SG para los AA alcanzó el 62,5 %. La investigación de Christians (2019)23 determinó para el AA SG media de 41 meses sin asociar factores pronósticos, en este estudio la media se situó en 47 meses y los valores de la mediana no pudieron establecerse. Wu (2021)24 evaluó toxicidad e indicios de efecto del zotiraciclib en dos esquemas combinado con temozolamida en AA recurrentes, se obtuvo SLP de 25 y 40 % para cada esquema, pero con neutropenia profunda. Ninguno de los estudios descritos ofreció resultados superiores a los determinados en la presente investigación para los AA.
El estándar de atención para los GM al debut ha sido bien determinado, pero a pesar de que se han desarrollado numerosas terapias contra el cáncer en las últimas décadas, pocos medicamentos han sido aprobados por la FDA en el tratamiento del GMr. En este estudio se obtuvieron resultados semejantes y superiores a algunos de los reportados. Sigue siendo un reto elevar la sobrevida en estos pacientes y son escasos los estudios con resultados que superen la mediana alcanzada en la presente investigación.
Sobre el análisis de riesgo, los estudios revisados evidenciaron resultados semejantes a los presentados en esta investigación. Para los AA, Cloughesy (2020)25 refirió HR de 1,06 para SG y Wu (2021)24 obtuvo del zotiraciclib un HR de 2,3. En los GM se reportan resultados similares, Shieh (2020)26 analizó las diferencias entre dosis estándares y elevadas de radioterapia para GMr, la dosis altas (HR=0,47) y un mayor volumen de radiación (HR=0,76) se identificaron como factores predictivos de mejor SG. El estudio de Eun (2020)27 pretendió evaluar si cambiar la intensidad de la señal de transferencia de protones de amida en RMN después del tratamiento con bevacizumab es predictivo de una respuesta temprana al tratamiento, el HR fue de 0,36. Kumar (2021)28 comparó el bevacizumab con bevacirel en cuanto a seguridad y eficacia, con un HR de 1,21. Según Biswas (2021)29, en el estudio EORTC26101 en 437 pacientes con GMr para evaluar la lomustina y el bevacizumab más lomustina, el HR fue 0,95.
Dietterle (2020)30 demostró diferencias significativas en SLP y en SG en pacientes con Karnofsky por encima de 70 antes de la cirugía. Straube (2020)31 elaboró un índice pronóstico para predecir SG en pacientes ancianos con GM, que relacionó la edad y el índice de Karnofsky, entre otros factores. Pierscianek (2020)32 diseñó una escala para evaluación preoperatoria del riesgo de supervivencia a corto plazo en GM, donde confirió peor puntaje a los pacientes con Karmofsky por debajo de 60. El estudio de Wahner (2020)22 en AA de diagnóstico reciente con los mejores esquemas de tratamiento, generó un modelo predictivo donde la capacidad funcional es uno de los parámetros que influyen en la SG. En la presente investigación, con pacientes en el GE en peores condiciones de capacidad funcional a la inclusión, se alcanzan resultados superiores a los reportados para el GC. Al analizar otros autores se observan resultados similares, que resultaron inferiores al obtenido. En los estudios internacionales sobre GMr33-37, las respuestas superiores se obtienen en pacientes con mejor capacidad funcional al inicio del tratamiento, en este estudio el GC comienza con mejor capacidad funcional que el GE para los GMr, en ningún caso revisado en la literatura se documentó un grupo de pacientes que respondiera mejor a las propuestas de tratamiento, y que comenzaran con una capacidad funcional inferior, lo que le confirió fortaleza a esta investigación.
Sobre toxicidad en los AA, el estudio de Cloughesy (2020)25 evaluó la seguridad de Vocimagene Amiretrorepvec y refirió un 26 % de pacientes con EA graves relacionados con el tratamiento. La investigación de Wu (2021)24 para toxicidad de zotiraciclib en dos esquemas, evidenció toxicidades limitantes similares de zotiraciclib, pero con EA de grado 3 o superior en 11 pacientes (20,7 %) dados por neutropenia, diarrea, enzimas hepáticas elevadas y fatiga. Con respecto a los GMr, el estudio de Detti (2021)38) con bevacizumab evidenció que el 6,5 % de los pacientes interrumpió la terapia debido a EA, todos sufrieron trombocitopenia, el 50 % severa. Los resultados del ensayo KEYNOTE-02839) en pacientes con GMr evidenciaron EA relacionados con el tratamiento en 19 pacientes, lo que representó el 73 %, y cinco pacientes experimentaron EA de grado 3 o 4. Sobre la seguridad de vacunas de DC, el metaanálisis de Li (2020)40 mostró que no existían diferencias significativas entre los pacientes tratados y los casos de control en los seis ensayos clínicos analizados, ni EA severos relacionados con el tratamiento. Los resultados, tanto para el GE como para el GC, generados en este estudio, se consideraron superiores a los reportados anteriormente, así como a otros estudios para tratar GMr.
Los resultados de este estudio coincidieron con lo descrito para combinaciones de interferones y para nimotuzumab. La combinación de interferones empleada, como se ha mencionado con anterioridad, se caracteriza por la sinergia en el efecto y la disminución de los EA tipos para los interferones por separado, tanto en frecuencia como en intensidad. Esto no es diferente en esta investigación. Duncan (2022)41 señala en un estudio de seguimiento de pacientes tratados con la combinación ante tumores de piel no melanomas que los EA informados fueron en su mayoría leves. Ante la epidemia de Sars-CoV-2, las características antivirales de los interferones motivaron ensayos clínicos con la combinación, lo que generó nuevas evidencias de la seguridad de su empleo. El estudio de Esquivel (2020)42) para comparar seguridad y eficacia en esa entidad de la combinación de interferones y el interferón alfa, dio como resultado EA en el 31,5 % de los pacientes, 28,5 % para el IFN-α y 34,4 % en el grupo de la combinación, el EA más frecuente fue la cefalea que se presentó en el 17,4 %. El meta-análisis de ensayos clínicos con nimotuzumab combinado con quimiorradioterapia en cáncer esofágico, de Viada (2021)43 evidenció que el nimotuzumab tuvo 1,6 y 1,2 veces más toxicidades de tipo hematológicas y no hematológicas respectivamente, en comparación con su GC. La comparación entre estudios pre-registro y pos-aprobación del nimotuzumab en glioma, de Álvarez (2016)44 describió 35 % y 61,7 % de EA reportados respectivamente, de los cuales 13,3 % y 11,6 % correspondieron a eventos relacionados con el nimotuzumab y 5 % de EA graves que estuvieron relacionados con el fármaco. El estudio de Saurez (2015)45 en pacientes con tumores gliales malignos evidenció que el 24,1 % de los eventos se relacionaron con nimotuzumab, con intensidad ligera y moderada. En el análisis global de seguridad en esta investigación, se consideraron semejantes la combinación de interferones y el nimotuzumab.