INTRODUCCIÓN
En los inicios de la pandemia por COVID-19 disminuyeron el número de urgencias en otorrinolaringología, al igual que el resto de las urgencias hospitalarias, entre ellas, el diagnóstico de nuevos casos de hipoacusia súbita. Las posibles causas fueron el confinamiento, el miedo de la población a contraer la infección en los centros hospitalarios, las restricciones en las visitas a los centros sanitarios [1-3] y la disminución en la incidencia de otras infecciones distintas al SARS-CoV-2 debido al uso de la mascarilla y el distanciamiento social [1]. Sin embargo, como podemos evidenciar en la literatura, son emergentes los casos de sordera súbita (SS), acúfeno y neuritis vestibular relacionados con la infección por el nuevo coronavirus [3], observándose un incremento notable de publicaciones acerca de las manifestaciones audiovestibulares del COVID-19 en forma de casos clínicos principalmente.
Las causas de la sordera súbita son desconocidas en la mayoría de los pacientes y, aunque se han propuesto varias hipótesis, la causa más probable parece ser el daño coclear causado por una noxa vascular, respuesta autoinmunitaria o el daño producido por un virus [4]. Desórdenes en la vascularización coclear debido a alteraciones en la viscosidad plasmática, agregación plaquetaria y celular y alteraciones en la función endotelial han sido descritas en estos pacientes [5,6]. La enfermedad por COVID-19 podría englobar todas esas etiologías, ya que se conoce que los coronavirus son virus neurotrópicos, por lo que pueden causar alteraciones en nervios periféricos y/o manifestaciones en el sistema nervioso central [7]. También, la respuesta inflamatoria que se desencadena ante la infección puede producir distintas variaciones en el flujo sanguíneo, además de trastornos autoinmunitarios [4, 5].
Está bien establecido que la enfermedad puede cursar desde formas asintomáticas hasta producir síntomas muy severos que pueden conducir al fallecimiento del paciente [8]. Esto hace pensar que la sordera súbita por el nuevo coronavirus podría estar infradiagnosticada, ya que este podría ser el único síntoma evidente de la enfermedad. Investigar el rol de la infección por sars-cOv-2 como posible etiología de la SS podría ofrecer la oportunidad de proponer estrategias de diagnóstico temprano y tratamiento precoz para lograr una óptima eficiencia en su manejo y evitar las secuelas [6,9,10].
Nuestro objetivo fue investigar la asociación entre la hipoacusia súbita y la infección por coronavirus como posible agente etiológico, evaluando los casos reportados hasta la actualidad y discutir cómo podría producir esta patología. Además, consideramos importante su difusión entre nuestros compañeros de otras especialidades debido a que se trata de una urgencia en otorrinolaringología que merece su conocimiento para evitar retrasos diagnósticos y terapéuticos.
MATERIAL Y MÉTODO
Se realizó una revisión sistemática en las bases de datos PubMed, EMBASE, Cochrane Library y Scielo de todas las publicaciones de casos llevadas a cabo desde marzo de 2020 hasta el 31 de enero de 2022 de hipoacusia súbita tras la infección por SARS-CoV-2, de acuerdo con las pautas PRISMA [11] sin restricción de idioma. En la búsqueda inicial se utilizaron los términos ((Hearing Loss, Sudden) OR (SSNHL)) AND ((COVID-19) OR (SARS-CoV-2)) adaptados a cada buscador. Se incluyeron para ser evaluadas todas aquellas citas bibliográficas potencialmente relevantes de cada uno de los artículos de la búsqueda. La pregunta PICO de la revisión fue la siguiente: ¿Podría la infección por COVID-19 ser causante de hipoacusia súbita?
Se incluyeron en el estudio todos aquellos casos en los que se relacionó la infección por COVID-19 confirmada mediante reacción en cadena de la polimerasa (PCR) al diagnóstico de hipoacusia súbita confirmada mediante audiometría tonal liminar (ATL), independientemente del tipo de estudio. Se consideró como caso definido de SS aquellas pérdidas auditivas neurosensoriales de más de 30 dB, en 3 o más frecuencias consecutivas, en un tiempo de instauración inferior a las 72 horas [12].
Se excluyeron aquellos casos de hipoacusia súbita relacionados con la vacunación, si no existía confirmación de la infección mediante PCR, todos los enfermos no diagnosticados de sordera súbita, SS documentadas una vez resuelta la enfermedad y que no se pueda relacionar directamente al SARS-CoV-2 como causa, todos aquellos en los que el diagnóstico no se confirmó mediante ATL, estudios combinados con otros síntomas audiológicos sin hacer separación de datos entre los grupos, aquellos estudios de casos y controles que tratasen de demostrar alteraciones en frecuencias auditivas, estudios en animales, artículos en los que traten la SS sin reportar casos clínicos, pacientes que ya presentaban problemas de audición previamente y aquellos que presentaron un proceso de SS meses antes de contraer la infección.
Se realizó la selección de artículos de forma estandarizada siguiendo los criterios anteriormente descritos. Los textos completos de los artículos que cumplieron criterios de inclusión fueron revisados por dos de los autores. Estos mismos, eligieron y extrajeron las variables para la revisión que fueron completadas por un tercero. Las discrepancias entre los dos autores se resolvieron por consenso, y en caso de no existir acuerdo, un tercer autor tomaba la decisión. Finalmente, se obtuvieron 16 artículos que cumplían los criterios de inclusión para esta revisión. De cada uno, se obtuvieron los siguientes datos por duplicado: autor, año, país de la publicación, número de pacientes incluidos en cada artículo, edad, sexo, antecedentes personales de los pacientes, lateralidad y grado de pérdida auditiva, síntomas asociados (vértigo, acufeno, parálisis facial), tratamiento para la infección por SARS-CoV-2 y para la hipoacusia súbita, y evolución auditiva tras el tratamiento. Se consideró la posibilidad de sesgo de publicación y el sesgo de pacientes no diagnosticados por no acudir a un centro sanitario.
RESULTADOS
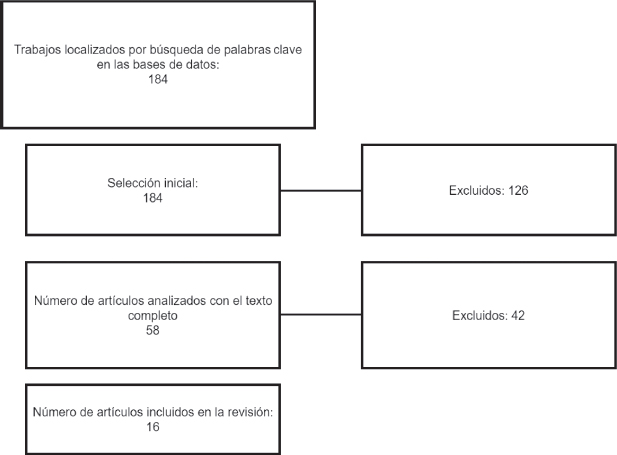
En la Figura 1 se resume la selección de artículos mediante diagrama de flujo PRISMA [11]. Se obtuvieron 184 artículos en una selección inicial. Tras eliminar duplicados y aquellos que no cumplen criterios de inclusión, se obtuvieron 58 artículos que se revisaron su texto completo y se excluyeron 42 por incumplir la definición de sordera súbita, diagnóstico clínico de hipoacusia no verificados mediante métodos objetivos, no existir confirmación de la infección por COVID-19, publicaciones que no aportaban información relevante para el estudio, cartas al editor que describieran casos ya descritos previamente, descripciones de complicaciones pulmonares o de otras áreas de la esfera otorrinolaringológica distintas a la SS, otras revisiones sistemáticas.
Los artículos se han clasificado según el año de su publicación en la Tabla 1 para aquellos casos publicados en el año 2020 y en Tabla 2 para el 2021. Finalmente, se obtuvieron un total de 30 pacientes, 10 (33,33%) en 2020 y 20 (66,67%) en 2021. De los 30 pacientes, 16 (53%) fueron mujeres y 14 (47%) fueron hombres, con una edad media de 46,75 años, siendo de 40,88 para el grupo de 2020 y 49,4 para el del 2021. Los antecedentes más frecuentemente asociados fueron los factores de riesgo cardiovascular en 4 casos (13,33%), asma y artritis reumatoide en un paciente cada uno. 10 de ellos no presentaron antecedentes de interés (33,33%) y en 13 no fueron recogidos. El origen de los artículos fueron 4 para Turquía, 2 de Reino Unido, 2 iraníes, 2 alemanes y uno procedente de España, Italia, Brasil, Irlanda, Egipto y Tailandia.
Tabla 1. Hipoacusias súbitas de pacientes COVID-19 positivos en el año 2020.
|
Autor |
País |
N |
Edad |
Sexo |
Antecedentes |
Lateralidad |
Grado pérdida |
Síntomas asociados |
Tratamiento COVID |
Tratamiento hipoacusia |
Respuesta |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Degen et al. [25] |
Alemania |
1 |
60 |
H |
No |
Bilateral |
Cofosis OD. HNS profunda OI. |
A |
UCI |
IC del OI |
NM |
|
Galougahi et al. [31] |
Irán |
3 |
22-40 |
1 H 2 M |
No |
2 OD 1 OI |
Moderada |
2 A 1 A + V |
No |
NR |
NR |
|
Kilic et al. [40] |
Turquía |
1 |
29 |
H |
NR |
OD |
Moderada |
No |
HCQ |
HCQ |
RC |
|
Koumpa et al. [43] |
Reino Unido |
1 |
45 |
H |
Asma |
OI |
Severa |
A |
UCI |
CT oral e IT |
RP |
|
Lamounier et al. [36] |
Brasil |
1 |
67 |
M |
Artritis reumatoide |
OD |
Severa |
A |
UCI |
CT oral e IT + ENX |
LM |
|
Lang et al. [27] |
Irlanda |
1 |
30 |
M |
NR |
OD |
Profunda |
A |
No |
CT oral |
NM |
|
Rhman et al. [44] |
Egipto |
1 |
52 |
H |
NR |
OI |
Severa |
A |
NR |
CT IT |
LM |
|
Sriwijitalai et al. [15] |
Tailandia |
1 |
NR |
M |
NR |
NR |
NR |
NR |
UCI |
NR |
NM |
N: número de pacientes. H: hombre. M: mujer. OD: oído derecho. OI: oído izquierdo. A: acufeno. V: vértigo. NR: no recogido. HCQ: hidroxicloroquina. ENX: enoxaparina. IC: implante coclear. CT: corticoide. IT: intratimpánico. Respuesta: recuperación completa (RC), recuperación parcial (RP) y no mejoría (NM)
Tabla 2. Hipoacusias súbitas de pacientes COVID-19 positivos en el año 2021.
|
Autor |
País |
N |
Edad |
Sexo |
Antecedentes |
Lateralidad |
Grado pérdida |
Síntomas asociados |
Tratamiento COVID |
Tratamiento hipoacusia |
Respuesta |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Bechers et al. [26] |
Turquía |
1 |
53 |
H |
No |
OD |
Profunda |
No |
No |
CT oral, IV e IT |
RP |
|
Edwards et al. [21] |
UK |
1 |
68 |
M |
HTA+DM+Dislipemia |
Bilateral |
Profunda |
A |
No |
CT oral e IT |
NM |
|
Garcia-Callejo et al. [5] |
España |
9 |
42-77 |
6 H 3 M |
NR |
NR unilateral |
Leves: 6 Moderada: 2 Severa: 1 |
3 A 1 V |
UCI |
CT IV + IT + ENX |
RC: 3 RP: 3 NM: 3 |
|
Gerstacker et al. [22] |
Alemania |
1 |
38 |
H |
Obesidad. HTA |
Bilateral |
Cofosis OI Severa OD |
V+A |
UCI |
CT oral, IV, IT IC en OI |
NM |
|
Gunay et al. [23] |
Turquia |
1 |
23 |
M |
Diálisis |
Bilateral |
Moderada |
No |
FPV + ENX + MPN |
CT oral |
RC |
|
Ozer et al. [14] |
Turquía |
1 |
62 |
M |
NR |
OI |
Moderada |
PF |
FPV + ENX |
CT oral |
RP |
|
Rahimi et al. [41] |
Irán |
1 |
60 |
M |
No |
OI |
Profunda |
A |
No |
CT IT. |
RP |
|
Ricciardiello et al. [6] |
Italia |
5 |
26 22 61 30 46 |
M H H H M |
No No IAM+HTA+DM No No |
OI OD OI Bilateral OD |
Sev Sev Prof Leve OD. Sev OI Moderada |
V+A No A A A |
No No ENX+AZN+P AZN+P AZN+P |
Todos: CT oral+ MGL+ TOH |
RP RP RP RP: OI RC: OD LM |
N: número de pacientes. H: hombre. M: mujer. HTA: Hipertensión Arterial. DM: diabetes melitus. IAM: Infarto agudo de miocardio. NR: No Recogido. OD: oído derecho. OI: oído izquierdo. Prof: profunda. Sev: severa. A: acúfeno. V: vértigo. PF: parálisis facial HCQ: Hidroxicloroquina. FPV: Favipavir. ENX: Enoxaparina. MPN: Meropenem. AZN: Azitromicina. P: prednisona IC: implante coclear. CT: corticoide. IT: intratimpánico. MGL: mesoglicano. TOH: Terapia con Oxígeno Hiperbárico. Respuesta: recuperación completa (RC), recuperación parcial (RP) y no mejoría (NM)
Todos los pacientes cumplieron criterios de hipoacusia súbita [12], siendo ésta unilateral en 25 casos (83,33%) y bilateral en 5 de ellos (16,67%). El oído derecho fue el oído afectado en 8 casos (26,67%) de sordera unilateral y el izquierdo en 7 (23,33%) pacientes. No se reportaron datos de lateralidad en 10 casos (33,33%).
Para los grados de hipoacusia se utilizó la clasificación de BIAP [13]. En las SS bilaterales, se tomó el peor oído como referencia. Se encontraron 2 casos de cofosis (6,67%), 5 de hipoacusias profundas (16,67%), 7 severas (23,33%), 9 moderadas (30%), 6 leves (20%). No se recogió este dato en un caso (3,33%). Si diferenciamos por año, en el 2020 no se reportaron casos leves.
Los síntomas asociados fueron el acúfeno aislado en 15 pacientes (50%), acompañado de vértigo en otros 3 pacientes (10%). El vértigo también se asoció como síntoma aislado en un único caso (3,33%). En 9 pacientes (30%) no aparecieron síntomas asociados. Se encontró un caso (3,33%) de parálisis facial.
14 pacientes (46,67%) precisaron ingreso en UCI como tratamiento para la infección grave por SARS-CoV-2. 9 (30%) no recibieron ningún tipo de tratamiento para la enfermedad al tratarse de casos leves o asintomáticos, un paciente recibió hidroxicloroquina oral, 2 pacientes recibieron favipavir y enoxaparina, uno de ellos junto con meropenem y otros 2 pacientes tomaron azitromicina y prednisona, uno de ellos con enoxaparina asociada.
Respecto al tratamiento de la SS, 2 pacientes (6,67%) precisaron implante coclear (IC), correspondiendo a dos de los 5 casos con afectación bilateral. En el de 2020, el IC fue el tratamiento de primera línea tras el diagnóstico, y en el paciente de 2021, se implantó tras el fracaso del tratamiento conservador con corticoide (CT) oral, intratimpánico e intravenoso. En el resto de los pacientes, 3 (10%) fueron tratados con CT oral, 3 (10%) asociándolo a intratimpánico. En un paciente (3,33%) se trató con CT intravenoso asociado a oral e intratimpánico, dos pacientes (6,67%) únicamente con inyecciones de CT intratimpánico, 5 (16,67%) con CT oral, mesoglicano y terapia con oxígeno hiperbárico. 9 pacientes se trataron con corticoide intravenoso e intratimpánico (30%) y 1 con hidroxicloroquina (3,33%). En los 4 casos restantes (13,33%) el tratamiento no fue recogido.
Hemos tomado los criterios de la SEORL de 2019 para establecer el grado de mejoría auditiva tras el tratamiento: recuperación completa (RC, umbral auditivo en ATL final inferior o igual a 10dB del umbral previo), recuperación parcial (RP, mejoría superior a 10dB, sin alcanzar mejoría completa) y no mejoría (NM, no se evidencia mejoría) [12].
En caso de las sorderas bilaterales, se ha tomado el peor oído para su clasificación. Así, se produjo una recuperación completa en 5 pacientes (16,67%), en 11 (36,66%) se objetivó una recuperación parcial, no existió mejoría en 11 pacientes (6,66%) y en 3 casos (10%) no fue recogido este dato.
DISCUSIÓN
Durante la pandemia por COVID-19 hemos ido conociendo los distintos síntomas que esta infección puede producir. Inicialmente se conocieron las manifestaciones respiratorias, cardiológicas y gastrointestinales de la enfermedad, para posteriormente comenzar a evidenciar las características neurotrópicas y neuroinvasoras que podían conducir a enfermedades neurológicas como el Síndrome de Guillain-Barré, encefalopatía, ictus y otros síntomas neurológicos como la anosmia [14, 15]. Posteriormente, el 15 de marzo de 2020, en Tailandia se reportó el primer caso de SS asociado a la infección por COVID-19, aunque en él no se reportaron ni las características clínicas, audiológicas ni terapéuticas del paciente. Únicamente que preciso ingreso en UCI y la irreversibilidad del cuadro auditivo [16].
Las manifestaciones otorrinolaringológicas (ORL) son frecuentes. El primer estudio que informó de la aparición de síntomas en la esfera ORL asociados a esta infección fue en una cohorte hospitalaria [8], en la que, de 155 pacientes ingresados, 89 tuvieron algún tipo de manifestación en este área, siendo las más frecuentes la tos (43,8%), la anosmia (35,4%), la odinofagia (27%) y la ageusia (16,1%). Como manifestaciones audiológicas, se reportaron 4 casos de otalgia (2%), 2 de acúfeno (1,2%) y uno de SS (0,6%). Ninguno de estos pacientes precisó ingreso en UCI.
La SS idiopática puede ser resultado de múltiples etiologías. Se han propuesto distintas causas que incluyen eventos vasculares, infecciones virales y trastornos autoinmunes [17]. La infección por SARS-CoV-2 podría englobar las tres causas.
Los eventos vasculares son más frecuentes en pacientes de edad avanzada y en el sexo masculino, en los que la enfermedad cardiovascular es más frecuente. Existe un incremento de incidencia de SS en pacientes con factores de riesgo cardiovascular (FRCV), aunque los estudios etiopatológicos en hueso temporal no muestran evidencias que apoyen este hecho [17], pero existe un aumento de casos en pacientes con genes relacionados con estados protrombóticos que incrementan la susceptibilidad a padecer eventos microvasculares [12]. En los pacientes COVID-19, los trastornos cardiovasculares, incluyendo anomalías en la coagulación, agregación plaquetaria y endotelitis han sido reportadas [5, 18, 19]. Las secuelas, pueden resultar en trombosis o isquemia del oído interno, que podría justificar una SS, ya que la cóclea y los canales semicirculares no disponen de irrigación colateral, lo que se traduce en una mayor susceptibilidad a la isquemia [20]. Chern et al. [21] reportaron un caso de SS bilateral de varias semanas de evolución como consecuencia de una hemorragia laberíntica bilateral en una mujer sana de 19 años con clínica concomitante de anosmia y con diagnóstico serológico mediante IgG positiva durante las primeras etapas de la pandemia. Aunque no se pudo confirmar la asociación, la aparición de una hemorragia tan severa en una persona joven y sana, puede hacernos pensar en el SARS-CoV-2 como agente causal de este evento vascular.
En esta revisión, 4 pacientes presentaron FRCV. Tenemos una mujer de 68 años hipertensa, diabética y dislipémica, con SS bilateral profunda acompañada de acúfeno, sin mejoría tras tratamiento [22]. Un varón de 38 años, obeso e hipertenso, que también presentó una hipoacusia bilateral severa en oído derecho y cofosis del izquierdo sin mejoría tras la medicación, que precisó un IC en el oído izquierdo [23]. Una mujer de 23 años, en diálisis, que cursó con una SS moderada bilateral, que sí respondió a la medicación. En este caso se trató, además de los corticoides, con Favipavir [24]. Los pacientes urémicos desarrollan aterosclerosis precoz por disfunción endotelial, presente antes incluso de iniciar la diálisis, agravada con ella. Por ello, se consideran pacientes de elevado riesgo cardiovascular con un incremento en la morbimortalidad [25]. El último caso, se trataba de un hombre de 61 años hipertenso, diabético y con antecedentes de infarto agudo de miocardio, con una sordera unilateral profunda, y una respuesta parcial al tratamiento que incluyó, además del CT oral, terapia con oxígeno hiperbárico y Enoxaparina, quedando como secuela una hipoacusia moderada [6]. De los 5 casos bilaterales recogidos en esta revisión, 3 presentaron FRCV. A contrario que los 4 pacientes que presentaron factores de riesgo cardiovascular y uno con artritis reumatoide, los demás no tenían antecedentes importantes (un caso de asma), y son en su mayoría pacientes jóvenes (media de edad de 46,75 años), en los que existe una alta probabilidad de que la hipoacusia esté relacionada directamente con el COVID-19.
Las manifestaciones neurológicas de los virus son bien conocidas. Hay varios en los que está descrito que puedan producir hipoacusia, bien sea, congénita o adquirida, unilateral o bilateral [29, 30, 31]. Estos virus pueden dañar directamente las estructuras del oído interno, inducir una respuesta inflamatoria causante del daño, o incrementar la susceptibilidad para otras infecciones bacterianas o fúngicas que produzcan hipoacusia. Es típicamente neurosensorial [31, 32], aunque pérdidas transmisivas o mixtas también pueden observarse con ciertos virus. Ocasionalmente, la recuperación espontánea auditiva tras la infección puede suceder [31]. Plantearnos que el SARS-CoV-2 sea otro de estos virus causantes de hipoacusia parece ser una posibilidad [32], ya es bien conocido el daño neural causante de anosmia y ageusia por otros coronavirus [33].
Como posibles causas de SS por la acción viral se postula una cocleitis o neuritis por invasión directa de las estructuras del oído interno o del nervio vestibulococlear [28, 33, 34]. O bien, mediante un mecanismo inmunomediado, induciendo respuestas cruzadas en las que los linfocitos T, o los anticuerpos, identifiquen antígenos del oído como antígenos virales produciendo daño en oído interno [7, 28] o también como secuela de la producción excesiva de citocinas proinflamatorias [26]. No está claro cómo accede el virus al sistema nervioso, si es por un mecanismo neuroinvasivo, neurotrópico, neurovirulento, inmunomediado o una mezcla de ellos, pero parece estar clara su afectación debido a que ya se han reportado otras afectaciones neurológicas como la anosmia, ageusia, ictus, cefalea, encefalopatía, polineuropatía o el síndrome de Guillain Barré [7, 18]. Mustafa et al. [31] realizaron un estudio de casos y controles donde demostraron el posible daño inducido por la infección en las células ciliadas cocleares, aunque se curse la infección de forma aparentemente asintomática. En él se tomaron como casos 20 individuos entre 20-50 años positivos para el SARS-CoV-2, todos ellos asintomáticos, y como controles 20 individuos normoacúsicos no infectados. A ambos se les realizó una batería de pruebas audiológicas (ATL, otoemisiones acústicas evocadas transitorias y timpanometría) que se les repitió a las dos semanas. Se observaron diferencias significativas (p<0,05) en 4, 6 y 8 kHz en la ATL y en la amplitud de las OEA (p<0,001).
Fidan et al. [35] compararon el número de eventos de SS sucedidos entre el 1 de abril y 30 de septiembre de 2020 y el mismo periodo de 2019. Observaron 27 casos más durante el 2020 (68 en total) con un ratio de 8,5/100.000 habitantes, de los cuales, 41 (60,3%) presentaron síntomas relacionados con el COVID-19, en comparación con 4 (9,8%) en 2019 (p<0,001). Además, los pacientes en 2020 fueron una media de 15,5 años más jóvenes (p=0,0141) y consultaron 1,7 días de media más tarde (p<0,001). Por tanto, detectaron un incremento de la incidencia durante la expansión del virus, con un 60,3% de pacientes con síntomas en posible relación con la infección. Otros autores también reportaron un incremento en el número absoluto de SS durante el periodo la pandemia [36].
Los síntomas asociados fueron el acúfeno en un 50% de los casos y el vértigo, sólo o acompañado de acúfeno (13,33%). El SARS-CoV-2 cruza la barrera hematoencefálica, quizá debido a la respuesta inflamatoria o a través del bulbo olfatorio [19], de esta misma forma, este virus podría producir una neuritis vestibular o una laberintitis asociada o no a hipoacusia. También, por un mecanismo inmunomediado como el caso reportado por Chern et al. [21], en el que tras el tratamiento esteroideo mejoró la clínica vertiginosa, sin embargo, como secuela persistió una hipoacusia fluctuante en oído derecho, a favor de un mecanismo vascular inmunomediado. Así mismo, en esta revisión se recoge una paciente con antecedentes de artritis reumatoide [37], cuya enfermedad de base podría predisponer a este mecanismo frente a otros.
La asociación entre vértigo y SS está bien establecido y descrito como un factor de mal pronóstico en el contexto de una SS12. En el caso de Beckers et al. [27] (Tabla 2), el paciente no presentó clínica vertiginosa, pero en su estudio mediante v-HIT se objetivó una hipofunción del canal semicircular anterior derecho, con una respuesta parcial al tratamiento esteroideo. Esta respuesta parcial también se objetivó en el caso de Riccardiello et al. [6]. El caso reportado por Gerstacker [23] no presentó ningún tipo de mejoría, cursando con una sordera súbita bilateral acompañada de acúfenos y vértigo intenso, con una hipofunción vestibular izquierda documentada mediante v-HIT. En este paciente, los autores reflejan el uso de Furosemida dos días previos al cuadro. Perret et al. [38] publicaron un caso de laberintitis diagnosticado mediante clínica y RM, que cursó con vértigo e hipoacusia súbita, en el que los estudios serológicos y de autoinmunidad fueron negativos, solo obteniéndose positiva la PCR para el SARS-CoV-2. Ozer et al. [15] publicaron una asociación entre afectación el VIII y del VII par craneal que evidenciaron electrofisiológicamente. Además, recogieron otros 14 casos de parálisis facial con positividad para la infección. Podemos decir que la afectación neurológica por el SARS-CoV-2 podía ser causante de distintas entidades como hipoacusia, vértigo, anosmia, u otras como parálisis facial, tanto aisladas como asociadas entre sí.
Consideramos importante reflejar que hay autores que se muestran contrarios a establecer esta asociación. Van Rijssen et al. [39], en un documento de reciente publicación, describen todas las SS diagnosticadas desde noviembre de 2020 a marzo de 2021. Fueron un total de 25 pacientes, de los que ninguno fue positivo para SARS-CoV-2 por lo que concluyeron que no existía una aparente relación. Chari et al. [2] compararon la incidencia de SS entre marzo y mayo de 2019 y el mismo periodo de 2020 en el que nos encontramos en la primera ola de COVID-19. La incidencia la calcularon teniendo en cuenta el número de pacientes atendidos en urgencias con los que finalmente tuvieron el diagnóstico de SS. En 2019, 71 pacientes fueron diagnosticados de SS, suponiendo un 1,77% de incidencia. En el 2020, fueron diagnosticados 13 pacientes con un 1,91% de incidencia. Los autores se mostraron contrarios a establecer esta asociación, aunque recalcaron el sesgo que deja ver los datos de incidencia, debido a que los pacientes no acudían a urgencias en esta primera ola por miedo a contraer la enfermedad. Otros autores como Beckers et al. [27] relacionaron el COVID-19 a la SS de su paciente, sin embargo, también señalan el riesgo de una falsa asociación. Guigou et al. [40] describieron el caso de un hombre de 29 años, que presentó una hipoacusia súbita moderada bilateral, por cocleitis demostrada mediante RMN en el contexto de una infección por SARS-CoV-2 sintomática con anosmia, ageusia, y positividad serológica para sífilis, signos de meningitis en la punción lumbar, pero sin lograr demostrar la neurosífilis pese a su sospecha. Se trató con Aciclovir, ceftriaxona y corticoides, logrando una recuperación completa a los 18 días tras inicio del tratamiento. En este caso no se logró confirmar la etiología debido a que también se han descrito dos casos de hipoacusia súbita en el contexto de una neurosífilis. Los autores piensan que la pronta recuperación de la hipoacusia podría estar más a favor de la etiología viral, y que la sífilis, podría facilitar la infección y la afectación viral, como sucede con la coinfección por VIH. Existen escasos estudios que reporten datos de incidencia, García-Callejo et al. [5] reportaron una incidencia total de la enfermedad en 2019 de 6/100.000 habitantes/año y en el período de estudio (entre febrero de 2020 y marzo de 2021) de 16,6/100.000 habitantes/año.
También es importante señalar que los fármacos ototóxicos como la azitromicina, hidroxicloroquina han sido usadas de forma extensiva en los comienzos de la pandemia como agentes terapéuticos. Son conocidos ototóxicos, que también contribuyen a la afectación auditiva causada por el virus [24, 32]. Por tanto, además del daño citopático directo del SARS-CoV-2, la respuesta inflamatoria, la tormenta de citoquinas y los eventos cerebrovasculares, especialmente en la circulación posterior, se suman los fármacos ototóxicos usados al comienzo de la pandemia para tratar a estos pacientes.
En cuanto al tratamiento para la sordera súbita, prácticamente todos los autores abogan por el uso de corticoides en sus distintas formas de administración. No es el caso de Kilic et al. [41] en el que reportaron 5 casos al comienzo de la pandemia de SS, en los que únicamente uno de ellos fue positivo para el nuevo coronavirus y trataron con hidroxicloroquina y a los otros 4 pacientes con prednisona oral. 4 pacientes experimentaron recuperación completa de la hipoacusia, excepto uno de ellos del grupo de pacientes negativos. Este artículo fue escrito durante la primera ola de la pandemia, donde la hidroxicloroquina era el tratamiento utilizado, que ya no lo es en la actualidad. Además, como mencionamos antes, es un potencial agente ototóxico. Mohammed et al. [36] publicaron su experiencia en el manejo de las SS durante los primeros 4 meses de la pandemia con 12 casos tratados mediante corticoides intratimpánicos por su mayor seguridad, al existir por aquel entonces controversia con el uso de esteroides orales ante una posible infección por SARS-CoV-2, considerando esta modalidad de tratamiento segura y efectiva. El paciente reportado por Rahimi et al. [42] también fue tratado con metilprednisolona intratimpánica experimentando una mejoría parcial en la ATL, pero con una llamativa mejoría en la audiometría verbal y en la acufenometría. En dos pacientes [15, 24], se asoció favipavir y enoxaparina como tratamiento para la infección al corticoide oral, obteniendo una recuperación completa y otra parcial de la hipoacusia moderada de ambos pacientes. Los casos más severos, se reportaron en pacientes hospitalizados en UCI, en los que el virus posiblemente haya invadido mayor número de estructuras neurales y el diagnóstico haya sido más tardío. Si nos fijamos en ambas tablas, en 2020 (Tabla 1) contamos con un mayor número de casos con ingreso en UCI y con una peor evolución. Coincide además con el periodo en el que los corticoides intravenosos no se utilizaban para tratar a estos pacientes intensivados. Sin embargo, en el periodo de 2021 (Tabla 2), los 9 pacientes reportados por García-Callejo [5] han sido tratados con corticoides intravenosos durante su estancia en UCI. Parece lógico pensar que el tratamiento vigente hasta la actualidad para los pacientes con SS con corticoides en los primeros 45 días tras el inicio del episodio es el más adecuado también para los pacientes infectados [12]. Sin embargo, hace falta un mayor número de estudios para identificar los pacientes que no responderán correctamente al tratamiento, y saber si la infección por SARS-CoV-2 juega un papel clave en este desenlace. Por último, queremos recalcar la posibilidad del implante coclear como método terapéutico posible para el tratamiento de casos refractarios, tal y como se ha utilizado en dos pacientes de nuestra revisión. Así mismo, queremos señalar una reciente publicación que describe la importancia de la detección de una posible infección por este coronavirus en pacientes implantados que presenten una disminución repentina o gradual de la inteligibilidad [43].
Por todo ello, estamos de acuerdo con otros autores [3, 32] en solicitar una PCR para COVID-19 ante la aparición de síntomas audiovestibulares, ya que es más accesible actualmente que durante las primeras etapas de la pandemia, pero únicamente en aquellos casos en los que exista un alto índice de sospecha por la clínica asociada de que pueda tratarse de un caso positivo, tal como se recomiendan los estudios serológicos en otros consensos de hipoacusia súbita [20].
CONCLUSIONES
La infección por SARS-CoV-2 podría presentarse como un nuevo agente etiológico en la sordera súbita, atribuible al neurotropismo, neuroinvasión, fenómenos inmunomediados y cardiovasculares inducidos por la infección. Podría ser útil incluir la PCR de SARS-CoV-2 dentro de la batería de pruebas diagnósticas ante un caso nuevo de SS si presenta síntomas compatibles debido a podría ayudarnos a filiar la causa. El tratamiento debe instaurarse desde los estadios más precoces para lograr tasas mayores de éxito. Los corticoides, bien sean orales, intravenosos o intratimpánicos continúan siendo nuestra mejor y más efectiva arma de tratamiento. Se podría valorar la necesidad de implantar el favipavir o la enoxaparina como posibles adyuvancias en casos seleccionados, aunque la evidencia es pobre y hacen falta más estudios. El implante coclear supone una posibilidad en el tratamiento para las sorderas súbitas bilaterales tras la infección por COVID-19 en aquellos pacientes que no responden a tratamiento médico.