Introducción
La regucalcina o “senescence marker protein 30” (SMP30 o RGN) fue descubierta en 1978 (1). El origen de su denominación se debe a que esta proteína se une al Ca2+ y puede regular el efecto del Ca2+ sobre la función de las células hepáticas (2,3). En los últimos años, se ha demostrado que la SMP30 desempeña un papel multifuncional como proteína reguladora en el mecanismo de señalización intracelular en muchos tipos de células (4,5,6,7). La expresión de la SMP30 se manifiesta en hígado y riñón de los ratones, pero también se pronuncia levemente en el corazón, cerebro, huesos y otros tejidos (8,9,10).
Esta proteína puede desempeñar un rol fundamental en la regulación de la función celular. La pérdida ósea y la hiperlipidemia se inducen en ratones a los que se le administró SMP30 de manera transgénica (TG) in vivo (11,12), lo que respalda su papel fisiopatológico. Por lo tanto, la SMP30 puede ser una molécula clave como proteína reguladora en un cuerpo vivo.
Teniendo en cuenta esta función celular de la SMP30, surge el planteamiento de si podría tener la misma relevancia en seres humanos, donde se ha visto que el cromosoma humano Xp 11.3-Xp 11.23 incluye el gen que codifica la RGN (13). Además, se ha demostrado que la RGN está involucrada en la carcinogénesis (14), observando que la expresión del gen y la proteína se reduce en los tejidos tumorales en pacientes humanos. Por lo tanto, la expresión suprimida del gen de RGN se propone para abordar la carcinogénesis, ya que esta desempeña un papel clave como molécula supresora en la proliferación celular y la carcionogénesis.
La SMP30 también tiene un importante papel en la regulación del metabolismo óseo, demostrando que la deficiencia de esta proteína endógena induce osteomalacia en ratones con genes inactivos de RGN in vivo (15). De la misma manera, se ha confirmado que los marcadores bioquímicos óseos se alteran en ratones TG (11) y que la sobreexpresión de la SMP30 causó una disminución en la actividad de la fosfatasa alcalina, una enzima marcadora de osteoblastos (16), en los tejidos diafisarios y metafisarios femorales, lo que sugiere una disminución en la formación de hueso osteoblástico. Por lo tanto, la observación con marcadores bioquímicos y el índice morfológico óseo respaldan la opinión relativa a que la sobreexpresión de la RGN conduce a la pérdida ósea (osteoporosis) (17).
El estudio con ratones TG puede ser útil para dilucidar el nuevo mecanismo patogénico en la progresión de la osteoporosis. Además, la determinación del mecanismo celular por el cual la sobreexpresión de la SMP30 induce la pérdida ósea puede proporcionar hallazgos novedosos sobre el mecanismo regulador del homeostasis ósea. Por lo tanto, el propósito de este trabajo ha sido revisar la literatura científica con relación al papel de la SMP30 en la pérdida de masa ósea.
Métodos
Búsqueda bibliográfica.
Se realizó una búsqueda bibliográfica en la base de datos PubMed utilizando las palabras clave “SMP30 AND bone” “Regucalcin AND bone” y “RGN AND bone” identificando un total de 31 artículos hasta el 5 de marzo de 2020.
Clasificación de artículos.
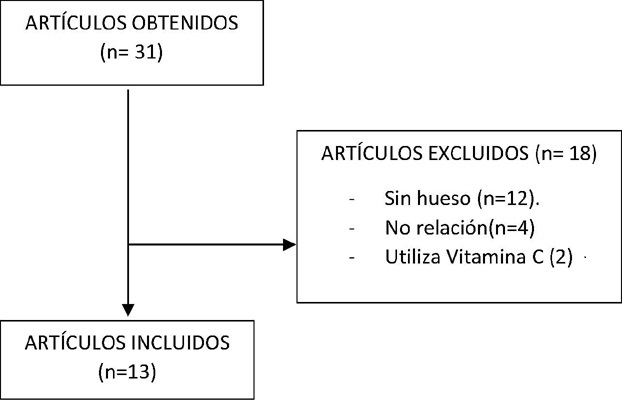
La clasificación de los artículos se puede observar en la Figura 1. Tras analizar cada uno de ellos, se eliminaron los que no incluían en sus estudios “bone”, los que utilizaban vitamina C combinados con SMP30 y aquellos que no tenían relación con el tema tratado. Un total de 13 artículos que cumplían los criterios de inclusión fueron incluidos para su análisis en esta revisión (Figura 1).
Criterios de inclusion
Solo se tuvieron en cuenta para la presente revisión sistemática aquellos artículos que cumplieron los siguientes criterios de elegibilidad: a) evaluar la SMP30. b) presentar resultados relativos al efecto sobre la masa ósea. c) muestra compuesta por personas o animales. d) artículos escritos en lengua inglesa y española.
Resultados
Los resultados se han expresado de acuerdo con lo indicado por cada autor, ninguno de los datos mostrados en este apartado ha sido objeto de interpretación.
Para una mejor comprensión, se abordará este apartado en los siguientes subapartados: cambios en el contenido de calcio, incidencia sobre la vía NF-Kb, cambios en los componentes bioquímicos óseos, cambios en células similares a los osteoclastos con incremento de la edad y supresión, y diferenciación osteoblástica y mineralización en el cultivo de células de médula ósea ex vivo.
Cambios en el contenido de calcio
Una de las variables más importantes que se ha analizado ha sido los cambios en el contenido de calcio donde se demostró que el ARNm de la SMP30 se expresa en las células de la médula ósea de ratones normales, y que la expresión de esta proteína aumenta en las células de ratones TG (18), lo que sugiere que la SMP30 tiene un papel funcional en las células de las médulas de estos animales, pero se ha detectado pérdida ósea en estos ratones TG (11).
La disminución en el contenido de calcio diafisario y metafisario femoral en los ratones TG no se debilitó significativamente con el aumento de la edad. A partir de esta observación, se supone que el desarrollo de pérdida ósea en ratones TG con el aumento de la edad se previene por factores endógenos en dichos animales.
En relación con lo anterior, Uchiyama et al (19) analizaron el cambio en contenido de calcio óseo en ratones TG, se examinó que el cambio en el contenido de calcio en los tejidos femoraldiafisarios y metafisarios de estos animales disminuyó significativamente (tanto en machos como en hembras) en comparación con los ratones normales (salvajes).
Yamaguchi et al (18) apreciaron cambios en los componentes bioquímicos óseos en ratones TG con SMP30, observando una disminución en el contenido de calcio, siendo esta disminución mayor en hembras que en machos. En ambos sexos se observaron que los ratones machos de 10 semanas de edad, los niveles de calcio en la diáfisis disminuyeron con respecto a los ratones normales siendo 225 mg/g a 210 mg/g, en la metáfisis se apreció una disminución de 180 mg/g a 160 mg/ g. Del mismo modo, la diáfisis en las hembras disminuyó de 240 mg/g a 220mg/g y en la metáfisis de 185 mg/g a 150 mg/g (P<0.01).
Además, en ratones de 36 semanas de edad, la diáfisis en macho disminuyó de 285 mg/g a 250 mg/g de contenido de calcio, en la concentración en la metáfisis disminuyó de 250 mg/g a 225 mg/g. De manera similar, la concentración de calcio en hembras, se vio que en la diáfisis disminuyó de 292 mg/g a 280 mg/g mientras que en la metáfisis paso a ser de 282 mg/g a 200 mg/g (P<0.01).
La disminución en el contenido de calcio femoral observado en ratones TG se observó con el aumento de la edad, lo que sugiere que la pérdida ósea no se restaura con el modelado óseo.
Incidencia sobre la vía NF-kB
Otra de las variables importantes que se analizó fue la incidencia de la SMP30 dobre la vía NF-Kb (vía de transducción de señales del factor nuclear kappa B) y el efecto supresor de la TNF-a sobre la expresión de ARNm de la SMP30.
La TNF-a tiene un potente efecto supresor sobre la expresión de ARNm de la SMP30, lo que sugiere que la citocina tiene un papel como regulador negativo en la expresión de ARNm de SMP30 (20). El efecto de TNF-a está mediado a través de la señalización de NF-kB que está implicada en el receptor de TNF factor asociado (TRAF6) en células osteoblásticas (21). El efecto supresor de TNF-a sobre la expresión de ARNm de SMP30 puede estar mediado a través de la señalización de NF-kB en células osteoblásticas, ya que se ha demostrado que existen sitios de unión de NF-kB en el promotor región del gen de la RGN en las células osteoblásticas (22).
No obstante, Yamaguchi et al (22) demostraron que la SMP30 estimuló notoriamente la osteoclastogénesis dependiente de la dosis in vitro, incidiendo significativamente sobre la actividad basal de NF-Kb. También, se estudió las concentraciones patológicas de TNF-a que inhibe potencialmente la formación del hueso in vivo y qué papel juega la SMP30 para potenciar la acción supresora de la misma, observándose así que la SMP30 aumentó el efecto supresor de la TNF-a.
Como resultado, se encontró que la adición de SMP30 con 1 a 100 nM estimulaba significativamente la actividad basal de NF-kB (P<0.01).
Cambios en los componentes bioquímicos óseos
Otro aspecto a destacar, es la identificación de los cambios en los componentes bioquímicos óseos, ya que, se han alterados en ratones TG.
Por un lado, el contenido de ADN en los tejidos óseos puede ser un índice de crecimiento, tanto en estos tejidos como en el número de células óseas. Hay que tener en cuenta que el crecimiento óseo se asocia con la disminución de las células óseas (incluidas las células osteoblásticas) y los condrocitos pueden inducirse en los tejidos metafisarios femorales de los ratones que sobreexpresan SMP30.
La sobreexpresión de SMP30 causó una disminución en la actividad de fosfatasa alcalina, una enzima marcadora de osteoblastos (16) en los tejidos diafisarios y metafisarios femorales, lo que sugiere una disminución en la formación de hueso osteoblástico.
Por otro lado, Yamaguchi et al, identificaron cambios en el contenido de ADN en los tejidos diafisarios y metafisarios femorales, observando una disminución significativa en el contenido de ADN en los tejidos metafisarios femorales, siendo una mayor disminución en hembras que en machos, los valores que se obtuvieron fueron: 3,3 mg/g pasaron a ser 2,6 mg/g (P<0.01).
Curiosamente, otro de los resultados que se observaron fue que los ratones hembras TG con SMP30 causan una disminución notable en la masa ósea en comparación con la de los ratones machos. Se sabe que la deficiencia de la hormona ovárica con el envejecimiento conduce a la osteoporosis con una disminución en la masa ósea (23), aunque la deficiencia de estrógenos no ha determinado en ratones TG, la sobreexpresión de la SMP30 causa pérdida ósea independientemente de la edad.
Cambios en células similares a los osteoclastos con incremento de la edad
Los cambios en células similares a los oseoclastos en función del incremento de la edad es otra variable relevante, ya que, se descubrió que la formación de células similares a los osteoclastos a partir de células de médula ósea se estimulaba en ratones TG con el aumento de la edad. Se ha demostrado que la SMP30 se expresa en las células de la médula ósea de ratones normales (de tipo salvaje) y TG con SMP30.
Se especula que esta proteína se libera de las células de la médula ósea de los ratones TG, y que la misma tiene un efecto estimulante sobre la formación de osteoclastos a partir de las células de la médula. Queda por dilucidar si la SMP30 tiene un efecto estimulante directo sobre la formación de células similares a los osteoclastos en el sistema de cultivo óseo.
Tanto es así que, Uchiyama et al (19) observaron que en los ratones TG con SMP30 no se debilitó significativamente la disminución del contenido de calcio en los tejidos femoraldiafisarios y metafisarios con el aumento de la edad, encontrando así que por factores endógenos en ratones TG el desarrollo de la pérdida ósea puede suprimirse e inhibir la función de los osteoclastos. Además, se vio que en ratones machos se incrementó el número de células similares a los osteoclastos, siendo este aumento del 10 a 25 números /cultivos en una edad de 5 semanas, en 14 semanas se apreció un aumento de 8 a 100 números/cultivo, en 25 semanas hubo un incremento de 8 a 105 números/ cultivo y en 50 semanas se observó un aumento de 30 a 137 números/cultivo (P< 0.01).
En definitiva, la reabsorción ósea osteoclástica aumenta en ratones TG machos y hembras transgénicas con edad creciente.
Supresión y diferenciación osteoblástica y mineralización en el cultivo de células de médula ósea ex vivo
Por último, la SMP30 juega un rol importante en la supresión y diferenciación osteoblástica y en la mineralización en el cultivo de células de médula ósea ex vivo, debido a que los osteoblastos estimulan la formación de hueso y la mineralización.
La SMP30, que se expresa en las células osteoblásticas, puede liberarse en fluidos extracelulares. Esta liberación puede unirse a las membranas plasmáticas de las células y transmitir una señal a las células para regular diversas expresiones génicas y mineralización en las células osteoblásticas.
De nuevo, Yamaguchi (24) determinó el efecto de la SMP30 exógena en la formación de osteoblastos, cultivando células de médula ósea obtenidas de ratones durante 7 y 14 días, se observó que la formación de osteoblastos se suprimió significativamente después del cultivo durante 14 días en presencia de SMP30 (0,01 a 10 nM), por lo tanto, se encontró que esta proteína administrada de manera exógena tiene un efecto supresor sobre la diferenciación y mineralización osteoblástica en células primarias de médula ósea ex vivo.
Por ello, el cultivo con RGN (0.01 a 10 nM), que es la concentración fisiológica en sangre (25) causó un efecto supresor significativo sobre la mineralización en las células de la médula ósea.
Se debe señalar que la pérdida ósea, que se induce en ratones TG puede deberse en parte a la supresión de la formación de hueso osteoblástico. Como resultado, se ha encontrado que la SMP30 exógena revela efectos supresores sobre la osteoblastogénesis y la mineralización in vitro y que no tuvo efectos sobre la proliferación celular y la apoptosis en las células osteoblásticas en cultivos a corto plazo.
Conclusión
La SMP30 desempeña un papel fundamental en el mantenimiento de la homeostasis celular y la función de la respuesta celular en relación a la masa ósea. Mientras que la sobreexpresión de SMP30 induce osteoporosis e hiperlipidemia en ratones TG desde temprana edad, lo que indica un papel fisiopatológico de la SMP30.
Por lo tanto, se propone que tras conocer el uso y la expresión de la SMP30 en el modelo animal sería de especial interés, el conocimiento de esta proteína en la especie humana en relación con la masa ósea. Asimismo, el desarrollo de un fármaco para modular la acción de la SMP30 puede ser útil para explorar el papel celular de la SMP30 a nivel molecular. Esto puede tener un papel como herramienta terapéutica para enfermedades en las que está implicada la SMP30. Se espera que más estudios determinen los aspectos clínicos de la SMP30.