INTRODUCCIÓN
Los pacientes con fibrilación auricular (FA) tratados con una intervención coronaria percutánea (ICP) e implante de stent son un subgrupo en el que el tratamiento antitrombótico es especialmente complejo. En este desafiante escenario, la terapia anticoagulante es el tratamiento de elección para la prevención de accidentes cerebrovasculares y la terapia antiagregante plaquetaria doble (TAPD) lo es para prevenir la trombosis del stent y futuros eventos coronarios. No obstante, combinar ambos fármacos aumenta el riesgo hemorrágico1.
Un problema que solo puede ir a más pues la prevalencia de la FA y la enfermedad coronaria van aumentando con la edad y cada vez hay más poblaciones de pacientes ancianos2.
La incidencia de la enfermedad coronaria en pacientes con fibrilación auricular no valvular (FANV) es del 30%. De hecho, casi el 20% de los pacientes son revascularizados, sobre todo mediante ICP3. Además, entre el 6 y el 8% de los pacientes ingresados por síndrome coronario agudo (SCA) presentan FA4. Los mayores índices de mortalidad de estos pacientes (2 y 3 veces más altos a los 5 años) también podrían deberse, entre otros factores, a tener que combinar fármacos anticoagulantes y antiagregantes plaquetarios (FAP) y al alto índice de eventos hemorrágicos asociados5. De hecho, el efecto que provocan las hemorragias en la mortalidad por cualquier causa tras el alta y a los 2 años se ha asociado a índices crudos de mortalidad por cualquier causa más altos (13,0 frente al 3,2%; p < 0,0001; hazard ratio [HR] = 5,03; p < 0,0001), con un mayor tamaño de efecto que el del infarto de miocardio tras el alta (HR = 1,92; p < 0,009)6.
El cierre de la orejuela izquierda (COI) ha demostrado ser capaz de reducir las hemorragias comparado con los anticoagulantes orales (ACO) en pacientes de alto riesgo hemorrágico7-9. Esta estrategia también permitiría a los pacientes seguir con la TAPD posiblemente minimizando los eventos isquémicos con menos episodios hemorrágicos que el tratamiento combinado anticoagulante/antiagregante plaquetario.
Nuestro objetivo fue determinar si el COI podría ser viable que beneficiara a estos pacientes. En este sentido, nos propusimos estudiar cómo influye el COI + FAP frente a ACO (incluidos los de acción directa [ACOD]) + FAP en los resultados a largo plazo de estos pacientes en la prevención de la mortalidad y los eventos isquémicos y hemorrágicos (figura 1).
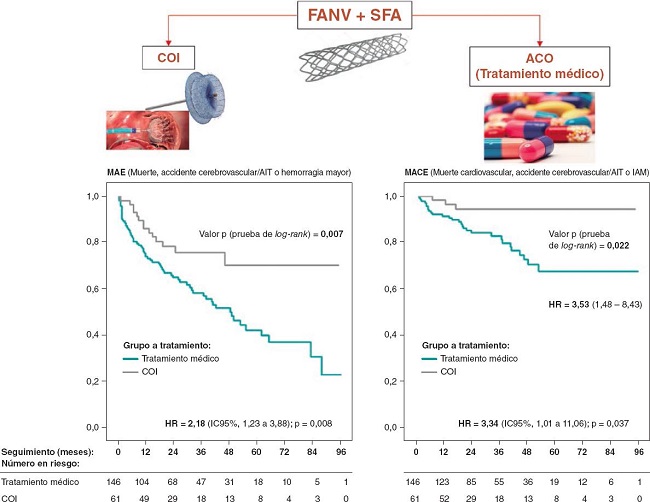
Figura 1. Figura central. ACO: anticoagulantes orales; AIT: accidente isquémico transitorio; COI: cierre de la orejuela izquierda; FANV: fibrilación auricular no valvular; HR: hazard ratio; IAM: infarto agudo de miocardio; IC: intervalo de confianza; MACE: eventos cardiovasculares adversos mayores; MAE: eventos adversos mayores; SFA: stent farmacoactivo.
MÉTODOS
Este fue un estudio multicéntrico y observacional de 2 cohortes históricas de pacientes. En 2021, se pidió a 11 centros españoles que participaran en un registro de pacientes tratados del COI con una indicación para interrumpir la administración de ACO ante la presencia de riesgo hemorrágico alto cuando esta indicación coexistía con la del TAPD tras implante de stent. La fase de inscripción se prolongó hasta marzo de 2021. Se realizó una comparativa entre pacientes tratados del COI y una serie consecutiva de pacientes con indicación para anticoagulación, tratados con implante de stent sin COI entre marzo de 2014 y marzo de 2021, un período que coincidió, en parte, con el período de inclusión de pacientes con COI. Los datos de la intervención se obtuvieron tanto de los registros hospitalarios como de las salas de hemodinámica de los centros participantes.
El uso del tratamiento antitrombótico y la indicación para el COI se dejaron a criterio del cardiólogo tratante. En todos los pacientes, el implante del dispositivo de cierre se indicó para la prevención primaria de eventos trombóticos y hemorrágicos. Los criterios de exclusión fueron a) contraindicación formal para terapia anticoagulante; b) paciente con cierre percutáneo previo de la orejuela izquierda fuera del marco temporal de la ICP especificado en el estudio; c) COI indicado por sangrado significativo o evento tromboembólico después de iniciar el tratamiento antitrombótico tras ICP; d) negativa a ser incluido en el estudio o a firmar el consentimiento informado; e) imposibilidad de obtener el seguimiento clínico. Es importante aclarar que, al tratarse de un estudio de la vida real, se incluyó a pacientes con hemorragias previas cuyos cardiólogos, en aquel momento, no consideraron oportuno proceder con el COI, razón por la cual, cuando se realizó la ICP, pudieron ser valorados para el COI. No obstante, los pacientes tratados del COI antes o después de la ICP por cuadros hemorrágicos no fueron considerados aptos para el estudio.
Los pacientes del grupo a tratamiento médico fueron todos incluidos consecutivamente en el centro de coordinación para garantizar la calidad de los datos porque eran el grupo más grande y podían plantear un mayor desafío a efectos de seguimiento. La presencia de historias clínicas digitalizadas a nivel regional en el centro de coordinación y el rigor del seguimiento garantizaron una recogida de datos de alta calidad para estos pacientes.
Intervención coronaria percutánea y cierre de la orejuela izquierda
La indicación del COI la estableció el médico tratante tras valorar la anatomía coronaria. El COI se realizó durante el período peri-ICP (antes, en el mismo momento o en un plazo de 6 meses tras la ICP). Tanto la técnica de implantación como el tipo de dispositivo y el tratamiento antitrombótico posterior al implante quedaron a criterio del operador. Como indicación IIb, la inclusión de estos pacientes fue limitada y, por regla general, siguió una estrategia de evitar suspender el tratamiento antiagregante antiplaquetario y/o el temor a sangrado con la combinación antitrombótica. Fueron consecutivos, pero podían pasar varios meses entre uno y otro debido a estas circunstancias.
Seguimiento y definiciones de los resultados clínicos
Todos los pacientes fueron seguidos clínicamente tras la ICP, incluso en el grupo en el que, luego, se realizó el COI. Durante el seguimiento, se recopilaron prospectivamente los siguientes eventos: muerte, hemorragia, accidente cerebrovascular o accidente isquémico transitorio e infarto agudo de miocardio (IAM). Los objetivos compuestos se definieron como eventos adversos mayores (definidos como el objetivo principal) e incluyeron la muerte, las hemorragias mayores o los accidentes cerebrovasculares/accidentes isquémicos transitorios. Los eventos cardiovasculares adversos mayores, por su parte, incluyeron la muerte cardiovascular, los accidentes cerebrovasculares/accidentes isquémicos transitorios y los IAM. Las hemorragias se clasificaron según los criterios del Bleeding Academic Rsearch Consortium (BARC)10. Solo se registraron las hemorragias BARC ≥ 2 que se clasificaron como importantes y las BARC ≥ 3 que se clasificaron como mayores (hemorragias mortales y/o sintomáticas en un área u órgano crítico [intracraneal, intrarraquídeo, intraocular, retroperitoneal, intra-articular, pericárdico o intramuscular con síndrome compartimental] y/o causantes de caídas de los niveles de hemoglobina ≥ 2 g/l [1,24 mmol/l] o que requiriesen transfusiones ≥ 2 unidades de sangre total o glóbulos rojos).
No hubo pérdidas en el grupo del COI y solo se perdieron 5 pacientes del grupo a tratamiento médico (3,4%) (sin eventos conocidos) antes de la fecha de finalización del estudio.
Métodos estadísticos
Las variables continuas se expresaron como media ± desviación estándar o mediana (percentiles 25-75) según la distribución de los datos. Las variables categóricas se compararon utilizando la prueba X2 o la prueba exacta de Fisher y las numéricas se analizaron empleando la prueba t de Student o la prueba U de Mann-Whitney. La tasa de incidencia ajustada observada en relación a la densidad de eventos (número de eventos durante el seguimiento dividido por la suma de personas-tiempo de la población en riesgo) se expresó por cada 100 pacientes-años. La supervivencia libre de eventos se analizó empleando los métodos de Kaplan-Meier y Cox. Todos los datos se analizaron utilizando el paquete de software estadístico SPSS V.22.0.
Cuestiones de índole ética
El protocolo del estudio DESAFIO (Implante de SFA en pacientes con fibrilación auricular seguido de dispositivo oclusor para el COI) fue aprobado por el comité ético de cada uno de los hospitales participantes. Por su parte, todos los pacientes dieron su consentimiento informado, por escrito, para participar en este estudio. Todas las intervenciones se realizaron con arreglo a los preceptos establecidos en la Declaración de Helsinki. El centro al que pertenecían los autores aprobó el análisis de los datos. Al tratarse de un estudio observacional no se consideró necesario el registro.
RESULTADOS
En líneas generales, 146 pacientes recibieron tratamiento antitrombótico convencional con ACO (75 con el antagonista de la vitamina K [AVK] acenocumarol y 71 con ACOD) y 61 fueron tratados del COI. La mediana de seguimiento tras la ICP fue de 35 meses (figura 2).

Figura 2. Diagrama de flujo del estudio. AAS: ácido acetilsalicílico; ACO: anticoagulantes orales; ACOD: anticoagulantes orales de acción directa; AIT: accidente isquémico transitorio; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; FANV: fibrilación auricular no valvular; MACE: eventos cardiovasculares adversos mayores; MAE: eventos adversos mayores; p: pacientes.
Las características de los 2 grupos se muestran en la tabla 1 y se clasifican según su posible impacto en los eventos isquémico-trombóticos o hemorrágicos.
Tabla 1. Características basales.
| TM (N = 146) | Acenocoumarol (N = 75) | ACOD (N = 71) | COI (N = 61) | pa | pb | |
|---|---|---|---|---|---|---|
|
| ||||||
| Edad | 75,7 ± 8,8 | 75,1 ± 8,8 | 76,4 ± 8,8 | 75,8 ± 8,9 | 0,947 | 0,664 |
|
| ||||||
| Edad ≥ 75 años | 88 (60,3) | 41 (54,7) | 47 (66,2) | 36 (59,0) | 0,866 | 0,359 |
|
| ||||||
| Edad, 65-74 años | 36 (24,7) | 23 (30,7) | 13 (18,3) | 17 (27,9) | 0,629 | 0,206 |
|
| ||||||
| Sexo femenino | 41 (28,1) | 22 (29,3) | 19 (26,8) | 14 (23,0) | 0,446 | 0,703 |
|
| ||||||
| Características trombóticas | ||||||
|
| ||||||
| FA paroxística | 79 (54,1) | 38 (50,7) | 41 (57,7) | 27 (44,3) | 0,196 | 0,301 |
|
| ||||||
| FA permanente | 66 (45,5) | 37 (49,3) | 30 (42,9) | 34 (55,7) | 0,180 | 0,249 |
|
| ||||||
| Insuficiencia cardiaca crónica | 28 (19,2) | 15 (20,0) | 13 (18,3) | 18 (29,5) | 0,103 | 0,257 |
|
| ||||||
| Hipertensión arterial | 121 (82,9) | 65 (86,7) | 56 (78,9) | 55 (90,2) | 0,180 | 0,171 |
|
| ||||||
| DM | 71 (48,6) | 33 (44,0) | 38 (53,5) | 24 (39,3) | 0,222 | 0,243 |
|
| ||||||
| Antecedentes de accidente cerebrovascular/AIT/TE | 27 (18,5) | 11 (14,7) | 16 (22,5) | 15 (24,6) | 0,320 | 0,303 |
|
| ||||||
| Antecedentes de accidente cerebrovascular/AIT | 24 (16,4) | 9 (12,0) | 15 (21,1) | 15 (24,6) | 0,172 | 0,145 |
|
| ||||||
| EC previa | 63 (43,2) | 36 (48,0) | 27 (38,0) | 46 (75,4) | < 0,001 | < 0,001 |
|
| ||||||
| IAM previo | 25 (17,1) | 12 (16,0) | 13 (18,3) | 24 (39,3) | 0,001 | 0,003 |
|
| ||||||
| ICP previa | 45 (30,8) | 27 (36,0) | 18 (25,4) | 42 (68,9) | < 0,001 | < 0,001 |
|
| ||||||
| EPA previo | 14 (9,6) | 5 (6,7) | 9 (12,7) | 14 (23,0) | 0,010 | 0,021 |
|
| ||||||
| EPA/AMI/revascularización previos | 59 (40,4) | 32 (42,7) | 27 (38,0) | 48 (78,7) | < 0,001 | < 0,001 |
|
| ||||||
| CHADS2 | 2,48 ± 1,31 | 2,35 ± 1,24 | 2,62 ± 1,39 | 2,67 ± 1,34 | 0,340 | 0,292 |
|
| ||||||
| CHADS-VASc | 4,07 ± 1,70 | 3,92±1,68 | 4,11 ± 1,75 | 4,56 ± 1,53 | 0,033 | 0,082 |
|
| ||||||
| Características hemorrágicas | ||||||
|
| ||||||
| PA > 160 mmHg | 14 (9,6) | 8 (10,7) | 6 (8,5) | 10 (16,4) | 0,163 | 0,347 |
|
| ||||||
| Insuficiencia hepática o renal | 38 (26,0) | 23 (30,7) | 15 (21,1) | 22 (36,1) | 0,147 | 0,156 |
|
| ||||||
| Diálisis | 4 (2,7%) | 4 (5,3) | 0 | 7 (11,5) | 0,017 | 0,014 |
|
| ||||||
| Accidente cerebrovascular/AIT previos | 24 (16,4) | 9 (12,0) | 15 (21,1) | 15 (24,6) | 0,172 | 0,145 |
|
| ||||||
| Hemorragias previas | 13 (8,9) | 9 (12,0) | 4 (5,6) | 30 (49,2) | < 0,001 | < 0,001 |
|
| ||||||
| Riesgo hemorrágico alto | 29 (19,9) | 19 (25,3) | 10 (14,1) | 37 (60,7) | < 0,001 | < 0,001 |
|
| ||||||
| INR lábil | 10 (6,8) | 8 (10,7) | 2 (2,8) | 6 (9,8) | 0,463 | 0,158 |
|
| ||||||
| Edad > 65 | 124 (84,9) | 64 (85,3) | 60 (84,5) | 53 (86,9) | 0,716 | 0,927 |
|
| ||||||
| Fármacos anti-inflamatorios | 9 (6,2) | 5 (6,7) | 4 (5,6) | 11 (18,0) | 0,008 | 0,030 |
|
| ||||||
| Abuso de alcohol/drogas | 5 (3,4) | 2 (2,7) | 3 (4,2) | 2 (3,3) | 0,999 | 0,872 |
|
| ||||||
| HAS-BLED | 1,63 ± 1,09 | 1,72 ± 1,24 | 1,54 ± 0,91 | 2,49 ± 1,18 | < 0,001 | < 0,001 |
Los datos de los grupos entre paréntesis expresan porcentajes. ACOD: anticoagulantes orales de acción directa; AIT: accidente isquémico transitorio; COI: cierre de la orejuela izquierda; DM: diabetes mellitus; EC: enfermedad coronaria; EPA: edema pulmonar agudo; FA: fibrilación auricular; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; INR: cociente internacional normalizado; PA: presión arterial; revasc: revascularización; TE: tromboembolismo; TM: tratamiento médico.
aCOI frente a TM.
bCOI frente a acenocoumarol frente a ACOD.
No se observaron diferencias significativas en variables tales como la edad (media: 75,5 años), la hipertensión arterial, la diabetes, el sexo, la FA permanente o paroxística o la historia clínica de accidentes cerebrovasculares o tromboembolismos entre los 2 grupos.
No obstante, sí se observaron más características desfavorables en el grupo COI y diferencias significativas en los antecedentes de enfermedad coronaria (43,2% frente al 75,4%; p < 0,001), CHA2DS2-VASc (4,07 ± 1,70 frente a 4,56 ± 1,53; p < 0,033), hemorragias importantes (BARC ≥ 2) (8,9 frente al 49,2%; p < 0,001), riesgo hemorrágico alto (definido como hemorragias previas o HAS-BLED ≥ 3) (19,9 frente al 62,3%; p < 0,001) y puntuación obtenida en la escala HAS-BLED (1,63 ± 1,09 frente a 2,49 ± 1.18; p < 0,001) entre los grupos ACO y COI, respectivamente.
La tabla 2 muestra las características asociadas a la ICP de los 2 grupos y la tabla 3 los diferentes tipos de hemorragias y su clasificación. Tal y como se muestra en la tabla 3, el 41% de los pacientes del grupo COI presentaban hemorragias GI frente al 6,8% de los pacientes del grupo a tratamiento médico.
Tabla 2. Intervención coronaria percutánea: indicaciones y tipo.
| TM (N = 146) | Acenocoumarol (N = 75) | ACOD (N = 71) | COI (N = 61) | pa | pb | |
|---|---|---|---|---|---|---|
|
| ||||||
| Indicación para ICP | ||||||
|
| ||||||
| Angina estable | 15 (10,3) | 6 (8,0) | 9 (12,7) | 12 (19,7) | 0,067 | 0,132 |
|
| ||||||
| SCASEST | 94 (64,4) | 55 (73,3) | 39 (54,9) | 43 (70,5) | 0,397 | 0,044 |
|
| ||||||
| SCACEST | 37 (25,3) | 14 (18,7) | 23 (32,4) | 6 (9,8) | 0,012 | 0,005 |
|
| ||||||
| Número de vasos enfermos | 1,76 ± 0,77 | 1,71 ± 0,71 | 1,82 ± 0,83 | 2,02 ± 1,06 | 0,091 | 0,116 |
|
| ||||||
| Número de vasos tratados | 1,32 ± 0,52 | 1,36 ± 0,56 | 1,27 ± 0,48 | 1,30 ± 0,53 | 0,782 | 0,575 |
|
| ||||||
| Número de lesiones tratadas | 1,50 ± 0,78 | 1,45 ± 0,72 | 1,55 ± 0,83 | 1,48 ± 0,77 | 0,835 | 0,736 |
|
| ||||||
| Número de stents | 1,71 ± 0,96 | 1,64 ± 0,78 | 1,75 ± 1,10 | 1,69 ± 1,04 | 0,984 | 0,827 |
|
| ||||||
| ICP sobre TCI | 11 (7,5) | 7 (9,3) | 4 (5,6) | 6 (9,8) | 0,582 | 0,617 |
|
| ||||||
| ICP sobre DA proximal | 37 (25,3) | 15 (20,0) | 23 (31,0) | 19 (31,1) | 0,391 | 0,227 |
|
| ||||||
| ICP sobre bifurcación | 3 (2,1) | 2 (2,7) | 1 (1,4) | 2 (3,3) | 0,601 | 0,772 |
|
| ||||||
| ICP por reestenosis/trombosis del stent | 3 (2,1) | 1 (1,3) | 2 (2,8) | 1 (1,6) | 1 | 0,793 |
|
| ||||||
| ICP por stents solapados | 20 (13,7) | 2 (2,7) | 18 (25,4) | 8 (13,1) | 0,911 | < 0,001 |
|
| ||||||
| ICP por IAM recurrente | 2 (1,4) | 1 (1,3) | 1 (1,4) | 6 (9,8) | 0,009 | 0,016 |
Los datos de los grupos entre paréntesis expresan porcentajes. ACOD: anticoagulantes orales de acción directa; COI: cierre de la orejuela izquierda; DA: descendente anterior; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SFA: stent farmacoactivo; TCI: tronco común izquierdo; TM: tratamiento médico.
aCOI frente a TM.
bCOI frente a acenocoumarol frente a ACOD.
Tabla 3. Historia clínica de hemorragias previas a la intervención coronaria percutánea en cada grupo.
| TM (N = 146) | Acenocoumarol (N = 75) | ACOD (N = 71) | COI (N = 61) | pa | pb | |
|---|---|---|---|---|---|---|
|
| ||||||
| Características | ||||||
| Necesidad de transfusión | 5 (3,4) | 4 (5,3) | 1 (1,4) | 13 (21,3) | < 0,001 | < 0,001 |
|
| ||||||
| Necesidad de hospitalización | 6 (4,1) | 5 (6,7) | 1 (1,4) | 23 (37,7) | < 0,001 | < 0,001 |
|
| ||||||
| Caída de los niveles de Hb en 3-5 g/dl | 4 (2,7) | 3 (4,0) | 1 (1,4) | 11 (18,0) | < 0,001 | < 0,001 |
|
| ||||||
| Caída de los niveles de Hb > 5 g/dl | 0 | 0 | 0 | 5 (8,2) | 0,002 | 0,002 |
|
| ||||||
| Puntuación BARC | ||||||
|
| ||||||
| Tipo 2 | 9 (6,2) | 4 (5,3) | 3 (4,2) | 8 (13,1) | 0,097 | < 0,001 |
|
| ||||||
| Tipo 3a | 5 (3,4) | 5 (6,7) | 1 (1,4) | 10 (16,4) | 0,002 | < 0,001 |
|
| ||||||
| Tipo 3b | 0 | 0 | 0 | 6 (9,8) | 0,002 | < 0,001 |
|
| ||||||
| Tipo 3c | 0 | 0 | 0 | 6 (9,8) | 0,001 | 0,004 |
|
| ||||||
| Tipo de hemorragia | ||||||
|
| ||||||
| Intracraneal | 0 | 0 | 0 | 6 (9,8) | 0,001 | 0,001 |
|
| ||||||
| GI | 10 (6,8) | 8 (10,7) | 2 (2,8) | 25 (41,0) | < 0,001 | < 0,001 |
|
| ||||||
| Otro tipo | 3 (2,1) | 1 (1,3) | 2 (2,8) | 2 (3,3) | 0,267 | 0,463 |
Los datos de los grupos entre paréntesis expresan porcentajes. ACOD: anticoagulantes orales de acción directa; BARC: Bleeding Academic Research Consortium; COI: cierre de la orejuela izquierda; GI: gastrointestinal; Hb: hemoglobina; ICP: intervención coronaria percutánea; SFA: stent farmacoactivo; TM: tratamiento médico.
aCOI frente a TM.
bCOI frente a acenocoumarol frente a ACOD.
En el grupo que recibió intervención, la relación temporal entre el COI y la ICP fue: en 4 pacientes (6,6%), el COI se realizó, de media, 35 días antes que la ICP; en 4 (6,6%), en la misma intervención, mientras que en 53 pacientes (86,9%), 75 días después de la ICP. Se emplearon dispositivos Amplatzer Amulet (Abbott, Estados Unidos), WATCHMAN (Boston Scientific, Estados Unidos) y LAmbre (Lifetech Scientific, China) en 50 (82%), 9 (14,8%) y 2 (3,2%) pacientes, respectivamente.
En cuanto al régimen antitrombótico que se administró entre la ICP y el COI, 30 pacientes recibieron tratamiento antiagregante plaquetario triple y 23, TAPD. Tras el COI, la mayoría siguió a TAPD (tabla 4).
Tabla 4. Tratamiento antiagregante plaquetario tras intervención coronaria percutánea o cierre de la orejuela izquierda.
| Acenocoumarol (N = 75) | ACOD (N = 71) | COI (N = 61) | p | |
|---|---|---|---|---|
|
| ||||
| AAS | 70 (93,3) | 41 (57,7) | 56 (91,8) | < 0,001 |
|
| ||||
| AAS > 1 mes | 39 (57,1) | 15 (29,7) | 31 (50,8) | < 0,001 |
|
| ||||
| Clopidogrel | 75 (100) | 67 (94,4) | 57 (93,4) | 0,091 |
|
| ||||
| Clopidogrel ≥ 6 meses | 41 (57,7) | 61 (92,4) | 28 (57,1) | < 0,001 |
|
| ||||
| Ticagrelor | 0 | 4 (5,6) | 1 (1,6) | 0,077 |
|
| ||||
| ACOD | 0 | 71 (100) | 3 (4,9) | - |
|
| ||||
| Curso de 1 mes a tratamiento antiagregante plaquetario triple | 39 (57,1) | 15 (29,7) | 0 | < 0,001 |
|
| ||||
| Curso de 6 meses a tratamiento antiagregante plaquetario triple | 3 (4) | 5 (7) | 0 | < 0,001 |
|
| ||||
| TD > 6 meses | 54 (72) | 65 (91,5) | 1 (1,6) | < 0,001 |
Los datos de los grupos entre paréntesis expresan porcentajes. AAS: ácido acetilsalicílico; ACOD: anticoagulantes orales de acción directa; COI: cierre de la orejuela izquierda; TD: terapia doble (anticoagulación + antiagregante plaquetario).
Resultados clínicos
Los índices de eventos adversos mayores y eventos cardiovasculares adversos mayores fueron mucho mayores en el grupo COI: 19,75 frente al 9,06% (HR = 2,18; p = 0,008) y 6,37 frente al 1,91% (HR = 3,34; p = 0,037) (tabla 5, figura 3A), respectivamente. La mediana de seguimiento fue de 29,6 y 23,3 meses para los grupos a tratamiento médico y COI, respectivamente (tabla 6).
Tabla 5. Eventos adversos mayores y eventos cardiovasculares adversos mayores durante el seguimiento.
| TM (N = 146; 449 p-a) | Acenocoumarol (N = 75; 277 p-a) | ACOD (N = 71; 175 p-a) | COI (N = 61; 158 p-a) | HR (IC95%) | pa | pb | |
|---|---|---|---|---|---|---|---|
|
| |||||||
| Mortalidad total | 49 (10,84) | 35 (12,68) | 14 (7,99) | 11 (6,95) | 1,56 (0,81-3,01) | 0,184 | 0,081 |
|
| |||||||
| Mortalidad cardiovascular | 4 (0,89) | 2 (0,72) | 2 (1,14) | 1 (0,63) | 1,41 (0,17-14,05) | 0,691 | 0,850 |
|
| |||||||
| Accidente cerebrovascular/AIT | 19 (4,59) | 11 (4,31) | 8 (5,05) | 2 (1,27) | 3,59 (0,84-15,54) | 0,084 | 0,150 |
|
| |||||||
| IAM | 4 (0,91) | 4 (1,52) | 0 | 1 (0,63) | 1,44 (0,19-15,40) | 0,628 | 0,167 |
|
| |||||||
| ICP | 7 (1,68) | 5 (2,08) | 2 (1,14) | 1 (0,63) | 2,67 (0,29-20,09) | 0,415 | 0,314 |
|
| |||||||
| Hemorragia BARC ≥ 2 | 42 (11,56) | 28 (13,14) | 14 (9,33) | 7 (4,57) | 2,53 (1,22-6,05) | 0,014 | 0,002 |
|
| |||||||
| Hemorragia BARC ≥ 3 | 31 (7,99) | 22 (9,48) | 9 (5,77) | 6 (3,88) | 2,06 (0,93-5,36) | 0,072 | 0,011 |
|
| |||||||
| Compuesto de mortalidad/accidente cerebrovascular - AIT/Hemorragia BARC ≥ 2 | 76 (23,52) | 47 (24,54) | 29 (21,79) | 15 (9,80) | 2,40 (1,38-4,17) | 0,002 | 0,001 |
|
| |||||||
| Compuesto de mortalidad/accidente cerebrovascular - AIT/Hemorragia BARC ≥ 3 (MAE) | 68 (19,75) | 43 (20,43) | 25 (18,02) | 14 (9,06) | 2,18 (1,23-3,88) | 0,008 | 0,004 |
|
| |||||||
| Compuesto de mortalidad cardiovascular/accidente cerebrovascular/AIT/IAM (MACE) | 25 (6,37) | 15 (6,16) | 10 (6,32) | 3 (1,91) | 3,34 (1,01-11,06) | 0,037 | 0,069 |
Los datos de los grupos entre paréntesis expresan porcentajes. Los valores absolutos y los porcentajes se expresan por cada 100 pacientes-años. a: años; ACOD: anticoagulantes orales de acción directa; AIT: accidente isquémico transitorio; BARC: Bleeding Academic Research Consortium; COI: cierre de la orejuela izquierda; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; MACE: eventos cardiovasculares adversos mayores; MAE: eventos adversos mayores; p: pacientes.
aTM frente al COI.
bCOI frente a acenocoumarol frente a ACOD.
Tabla 6. Tasas de eventos a los 12 y 36 meses.
| TM (146 p) | COI (61 p) | |
|---|---|---|
|
| ||
| MAE a los 12 m | 37 (30,5) | 8 (14,13) |
|
| ||
| MAE a los 36 m | 54 (20,5) | 13 (10,8) |
|
| ||
| MAE total | 68 (19,75) | 14 (9,06) |
|
| ||
| MACE a los 12 m | 11 (8,28) | 2 (3,41) |
|
| ||
| MACE a los 36 m | 18 (5,92) | 3 (2,43) |
|
| ||
| MACE total | 25 (6,37) | 3 (1,91) |
Las tasas de eventos expresan el número absoluto de eventos (por cada 100 pacientes-años). Los datos de los grupos entre paréntesis expresan porcentajes. m: meses; MACE: eventos cardiovasculares adversos mayores; MAE: eventos adversos mayores; p: pacientes.
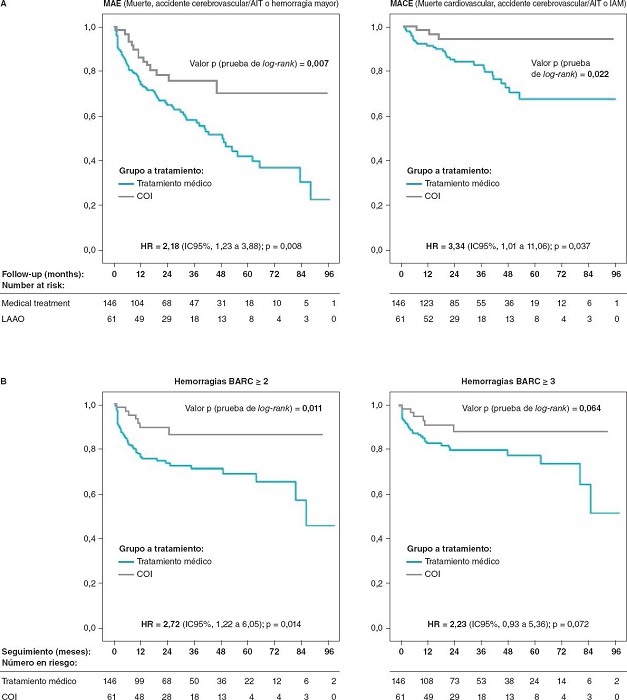
Figura 3. Curvas de Kaplan-Meier para la supervivencia libre de eventos adversos mayores y eventos cardiovasculares adversos mayores (A) y libre de eventos hemorrágicos (B) durante el seguimiento. AIT: accidente isquémico transitorio; BARC: Bleeding Academic Research Consorntium; COI: cierre de la orejuela izquierda; HR: hazard ratio; IAM: infarto agudo de miocardio; IC: intervalo de confianza; MACE: eventos cardiovasculares adversos mayores; MAE: eventos adversos mayores.
Los índices de muerte, accidente cerebrovascular/accidente cerebrovascular agudo y hemorragia importante, expresados por cada 100 pacientes-años, fueron mayores en el grupo de pacientes tratados con ACO que con COI. Como el índice de accidentes cerebrovasculares fue mayor de lo esperado en el grupo ACO, se investigaron las posibles razones de esta observación. Así, de los 19 pacientes con accidentes cerebrovasculares, al menos, 13 tenían una predisposición patológica que podría haber aumentado el riesgo: a) suspensión del tratamiento por cirugía: 3 casos; b) suspensión del tratamiento por hemorragias: 2 casos; y c) infradosificación: 9 casos (4 de los cuales estaban en el grupo de AVK con un cociente internacional normalizado < 2).
La figura 3B muestra diferencias hemorrágicas significativas entre el grupo COI y el ACO y la tabla 5 los diferentes eventos hemorrágicos por grupo; se observó una tendencia favorable en el grupo COI incluso frente a los ACOD en lo referente a las hemorragias relevantes.
En el análisis multivariado (regresión de Cox), solo la puntuación obtenida en la escala HAS-BLED (HR = 1,30; IC95%, 1,04-1,62; p = 0,019) y la asignación al tratamiento médico (HR = 3,42; IC95%, 1,57-7,42; p = 0,002) fueron predictores independientes de eventos adversos mayores. Por otro lado, tanto la puntuación obtenida en la escala CHA2DS2-VASc (HR = 1,24; IC95%, 1,01-1,53; p = 0,043) como la asignación al tratamiento médico (HR = 3,71; IC95%, 1,11-12,37; p = 0,033) fueron predictores independientes de eventos cardiovasculares adversos mayores.
En la población COI se informaron las siguientes complicaciones asociadas a la intervención: 1 paciente con una fístula arteriovenosa que no precisó cirugía vascular, 2 pacientes con derrame pericárdico, 1 paciente que requirió pericardiocentesis y otro con broncoespasmo tras la extubación que se resolvió, sin complicaciones, con tratamiento médico.
DISCUSIÓN
Nuestro principal hallazgo fue que, en pacientes con FANV tratados con stents coronarios, COI + FAP mejoró los resultados a largo plazo frente a ACO (ACOD incluidos) + FAP. Estos hallazgos son significativos teniendo en cuenta las características desfavorables del grupo COI. El beneficio del COI se mantuvo sobre los 2 subgrupos ya en tratamiento con acenocumarol como con ACOD. En lo referente a la seguridad, hubo significativamente menos hemorragias (BARC 2 y 3) con el COI que con el acenocumarol. No hubo diferencias hemorrágicas significativas entre el grupo COI y el ACOD, aunque sí menos eventos en el grupo COI, sobre todo, BARC ≥ 2.
Durante los últimos años, 4 estudios sobre ACOD y varios metanálisis han venido a confirmar que el TAPD (ACOD + P2Y12, generalmente clopidogrel) se asocia con menos hemorragias que el tratamiento antiagregante plaquetario triple (warfarina + clopidogrel + ácido acetilsalicílico). También que este tratamiento rara vez se asocia a peores resultados en eventos isquémico-trombóticos11-16. No cabe duda de que estos resultados son importantes y han dado forma a las nuevas recomendaciones publicadas por sociedades científicas sobre el manejo de estos pacientes17.
No obstante, los índices hemorrágicos siguen siendo muy altos en esta población. Además, estudios publicados aseguran que la suma de AVK + ácido acetilsalicílico ya ha demostrado ser menos eficaz que el TAPD1.
Los estudios PIONEER11 y REDUAL14 confirmaron un índice medio anual de hemorragias tras un seguimiento de 12 meses con TAPD consistente en ACOD + clopidogrel del 16,9 y 20,2%, respectivamente. Se debe mencionar que los datos del estudio AUGUSTUS sobre el apixaban son, solo, de 6 meses, lo cual explicaría, al menos en parte, el menor índice hemorrágico descrito11,12,14,15.
Estudios anteriores comparadores de TAPD con ácido acetilsalicícilo y clopidogrel en pacientes sin FA arrojaron índices hemorrágicos más bajos que la combinación de AVK + ácido acetilsalicílico18.
El seguimiento clínico de la mayoría de los estudios de ACOD ha sido corto (de los 6 meses del AUGUSTUS15 hasta los 14 meses del REDUAL14). Nuestro estudio informó de un seguimiento de 35 meses. Aunque se sabe que los episodios hemorrágicos son más habituales durante el primer año en ambos grupos, se observó que, más allá del primer año, las curvas se separaban favoreciendo al grupo COI (figura 3B). Esto ya se había observado en grandes registros sobre el COI19. Como estos tratamientos son de por vida, el riesgo de sangrado recurrente y la posibilidad de intervenciones quirúrgicas, en un futuro, en pacientes > 70-75 años en los que se debe suspender el uso de ACO obliga a valorar otras alternativas terapéuticas. Se sabe que el índice de eventos tromboembólicos, accidentes cerebrovasculares principalmente, es significativo los primeros días después de interrumpir los ACO20.
Asimismo, la aparición de SCA recurrentes en pacientes que ya han sufrido eventos coronarios no es algo infrecuente. El 12% de los 9.615 pacientes de registro de Melbourne tuvieron que ser hospitalizados 1 año después de sufrir un SCA21. En algunos de estos pacientes hay que volver a realizar una nueva ICP, lo cual nos vuelve al debate de si administrar, o no, tratamiento combinado.
Cabe destacar que los criterios de exclusión especificados en estos estudios limitan la extrapolación de los resultados a la población general de pacientes hospitalizados. Se calcula que los resultados de estos estudios podrían extrapolarse a menos de dos tercios de los pacientes en la práctica clínica habitual22.
En la mayoría de los estudios realizados sobre ACOD en pacientes con FA tratados de ICP, no se registra el historial de hemorragias previas salvo, indirectamente, en pacientes con hemorragias GI previas y, en cualquier caso, estos pacientes están ampliamente infrarepresentados. En este sentido, el 1,3% tenía antecedentes hemorrágicos GI en el subgrupo ACOD + clopidogrel del estudio PIONEER frente al 5% del grupo warfarina + clopidogrel del estudio WOEST14,23. En nuestro estudio, el 10,7%, 2,8% y 41% de los pacientes de los grupos de ACO, ACOD y COI, respectivamente, tenían antecedentes hemorrágicos GI. Como era de esperar, al no ser un estudio aleatorizado, los cardiólogos fueron más propensos a solicitar el COI en pacientes con antecedentes hemorrágicos.
Aunque estos 4 estudios informan sobre las puntuaciones obtenidas en la escala HAS-BLED, el valor predictivo de este parámetro, aunque útil, es mucho menor que los antecedentes hemorrágicos, sobre todo en pacientes con antecedentes hemorrágicos y edades > 75 años, tal y como se observa en los grandes estudios realizados sobre el COI24,25.
Por último, los eventos isquémicos mostraron una significación favorable al grupo TAPD frente al grupo a tratamiento antitrombótico (1,6 frente al 6,2%; p = 0,01 y 0,5 frente al 2,7%: p = 0,01), respectivamente1.
Limitaciones
El número de pacientes fue pequeño y nuestro estudio no aleatorizado. Por eso nuestros resultados solo deben considerarse generadores de hipótesis en este estudio piloto. A pesar de ser un estudio observacional sin control de los sesgos de confusión en su diseño, la mayoría de las variables basales se distribuyeron equitativamente entre los diferentes grupos siendo los riesgos hemorrágicos y trombóticos aún más desfavorables en el grupo COI. No obstante, no se puede descartar un sesgo de selección en los pacientes del grupo COI.
El índice de accidentes cerebrovasculares del grupo a tratamiento médico fue mayor de lo esperado en los estudios más importantes realizados a este respecto. Esto fue, probablemente, el resultado de las comorbilidades asociadas que aumentan la probabilidad de nuevas hospitalizaciones por intervenciones invasivas que, a su vez, requieren cambiar el tratamiento anticoagulante a modo de terapia puente hasta la realización de estas intervenciones. A la larga, esto aumenta el índice de accidentes cerebrovasculares en esta población frente a aquellos tratados del COI. Esto, sin embargo, es un reflejo del mundo real. Se deben realizar más estudios que nos ayuden a determinar cuál es la mejor estrategia terapéutica en estos complicados pacientes.
CONCLUSIONES
En pacientes con FANV tratados con stents coronarios, la estrategia COI + FAP ofrece mejores resultados a largo plazo en lo que respecta a los eventos adversos mayores y eventos cardiovasculares adversos mayores que el tratamiento con ACO (ACOD incluidos) + FAP a pesar de las características más desfavorables descritas en el grupo COI.
El beneficio favorable del grupo COI se mantuvo tanto en los grupos AVK como ACOD. Hubo muchos menos eventos hemorrágicos (BARC 2 y 3) tras el COI que en el grupo AVK, no así entre los grupos COI y ACOD (aunque sí menos eventos en el grupo COI, sobre todo, BARC ≥ 2).
¿QUÉ SE SABE DEL TEMA?
- Hay cada vez más evidencias de que el COI se erige como alternativa terapéutica al uso de ACO en pacientes con FANV y antecedentes hemorrágicos significativos o alto riesgo hemorrágico.
- El COI tiene una eficacia similar a los ACO en la prevención de la aparición de tromboembolismos y se asocia a un menor riesgo hemorrágico, sobre todo, 1 año después de la intervención.
¿QUÉ APORTA DE NUEVO?
- Los resultados del estudio sugieren que el COI es una alternativa favorable a los ACO en pacientes con FANV y cardiopatía isquémica que requieren stents coronarios y terapias basadas en FAP.
- Las observaciones resumidas en este estudio demuestran que, en el contexto del mundo real, la combinación COI + FAP reduce el índice de eventos adversos mayores y eventos cardiovasculares adversos mayores más de lo que lo hace el tratamiento con ACO + FAP.











 text in
text in 


