My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Asociación Española de Especialistas en Medicina del Trabajo
On-line version ISSN 3020-1160Print version ISSN 1132-6255
Rev Asoc Esp Espec Med Trab vol.25 n.2 Madrid Mar. 2016
ORIGINAL
Uso del QuantiFERON-TB Gold en la consulta de Medicina del Trabajo en un medio hospitalario. 8 años de experiencia
Utility of Quantiferon-TB gold in screening of healt care workers. 8 years of experience
Alejandro Fernández Montero(1), Alicia Alonso Álvarez(2), Ana Rodríguez Mourille(1), Manuel Rubio Vallejo(3) y José Ramón Yuste Ara(4)
(1) Medicina del Trabajo. Servicio de Prevención de Riesgos Laborales. Universidad de Navarra. Pamplona.
(2) Graduada en Medicina. Universidad de Navarra. Pamplona.
(3) Servicio de Microbiología Clínica. Clínica Universidad de Navarra. Pamplona.
(4) Área de Enfermedades Infecciosas. Medicina Interna. Clínica Universidad de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
Objetivo: Valorar la eficiencia del uso del QuantiFERON-TB Gold (QTF-GIT) en el diagnóstico de infección tuberculosa latente.
Material y métodos: En la consulta de Medicina del Trabajo de un medio hospitalario, se comparan los resultados del QTF-GIT en trabajadores con prueba de la tuberculina (PT) positiva entre los años 2007-2014. Además, se realiza un estudio de validación diagnóstica para la PT en los puntos de corte de 10 y 5mm.
Resultados: Se estudiaron 2.085 pacientes y se realizaron 2.679PT 182 (+), 2435 (-). Se realizaron 1.623 QTF-GIT; 132 (+), 1.486 (-). Tras una PT positiva el 61,4% QTF-GIT presentaron un resultado negativos (p<0,001).
La PT, con puntos de corte en 10 y 5mm, muestra una sensibilidad del 88% y 100% (p<0,001), una especificidad del 35% y 3% (p<0,001) respectivamente.
Conclusiones: La PT en la consulta de Medicina del Trabajo está justificada al tratarse de una prueba diagnóstica con alta sensibilidad, pero al generar un gran número de falsos positivos, precisa posteriormente de una prueba con una alta especificidad como el QTF-GIT para evitar la quimioprofilaxis innecesaria.
Palabras clave: Medicina del Trabajo; Infección Tuberculosa Latente; Prueba de Tuberculina; QuantiFERON- Gold In-tube®.
ABSTRACT
Objective: To evaluate the efficiency of QuantiFERON-TB Gold (QFT-GIT) to diagnose latent tuberculosis infection.
Methods: In an Occupational Medicine consultation, we analysed the results of QFT-GIT in hospital workers with positive tuberculin skin test (TST) between years 2007-2014. Also a validation study was performed for the TST in the cut offs considered as 10 and 5 mm.
Results: 2,085 patients were studied. We performed 2,679 TST 182 (+), 2,435 (-). 1,623 QTF-GIT were done; 132 (+), 1,486 (-). After a positive TST 61.4% QFT-GIT showed a negative result (p <0.001).
The TST, with 10 or 5 mm considered as cut-off, showed a sensitivity of 88% and 100% (p <0.001), and a specificity of 35% and 3% (p <0.001) respectively.
Conclusions: The use of TST in Occupational Medicine is justified as it is a diagnostic test with high sensitivity, but as it generates a large number of false positive, confirmation with a higher specificity test, such as the QFT-GIT is required to avoid unnecessary chemoprophylaxis.
Key words: Occupational Medicine; Latent Tuberculosis Infection; Tuberculin Skin Test; QuantiFERON- Gold In-tube®.
Introducción
La tuberculosis afecta en la actualidad a una tercera parte de la población mundial, según datos de la OMS. Aunque España es un país de baja incidencia, con 9,2 casos por 100.000 habitantes en 2013 (siendo Navarra, región en la que está situado el hospital objeto de este trabajo, una de las regiones con menor incidencia)(1), el screening de trabajadores sanitarios, un grupo de riesgo para infección tuberculosa latente (ITL)(2), constituye aún una medida importante para el control de esta enfermedad.
La ITL ha sido definida clásicamente como un estadio de la infección tuberculosa en la que existe una carga de Mycobacterium tuberculosis viable en el organismo, pero que permanece controlada por el sistema inmune y por tanto no se traduce en síntomas de enfermedad. Sin embargo, recientemente esta definición ha sido clasificada de simplista, y se prefiere ver la infección tuberculosa como un continuum que va desde la latencia (término que se prefiere sustituir por persistencia) hasta las manifestaciones clínicas. En este espectro están implicadas numerosas respuestas y complejas interacciones entre el patógeno y el sistema inmune del huésped, de cuyo equilibrio depende que la balanza se incline hacia uno u otro extremo(2,3).
La inmunología tiene una especial relevancia en el diagnóstico de la ITL, ya que las técnicas actualmente disponibles se basan en la detección de una respuesta de hipersensibilidad tipo IV por parte de los linfocitos T in vivo (prueba de la tuberculina) o in vitro (nuevas técnicas basadas en la liberación de interferón) tras su estimulación con derivados proteicos de Mycobacterium tuberculosis.
El método diagnóstico clásico de ITL ha sido la prueba de la tuberculina (PT) o intradermorreacción de Mantoux. Es una técnica in vivo basada en la reacción de hipersensibilidad tipo IV que se produce en individuos sensibilizados frente a Mycobacterium tuberculosis tras la inyección intradérmica con una aguja del calibre 27 en la cara volar del antebrazo de dos unidades (0,1mL) de un derivado proteico purificado de Mycobacterium tuberculosis (llamado PPD o tuberculina)(4), y por tanto refleja solamente el contacto previo con el patógeno, sin diferenciar infección de enfermedad. Esta técnica presenta conocidos inconvenientes como la necesidad de dos visitas médicas, la subjetividad de la medición, el efecto booster o la reactividad cruzada. Esta última se produce debido a que algunos componentes de la PPD son compartidos por otras especies de micobacterias no tuberculosas (MNT) y por la vacuna antituberculosa derivada de la cepa Bacille Calmette-Guérin (BCG), lo cual conduce a falsos positivos y disminuye su especificidad. También puede resultar falsamente negativa en personas con anergia inmunológica debido, por ejemplo, a tratamientos inmunosupresores, a VIH, o a la propia fase aguda de la enfermedad tuberculosa, lo cual disminuye su sensibilidad.
Desde hace pocos años, están disponibles las técnicas in vitro basadas en la liberación de interferón-gamma (IGRAs, Interferon-gamma release assays, por sus siglas en inglés) tras la estimulación de linfocitos con antígenos de Mycobacterium tuberculosis. Existen dos pruebas comercializadas:
El QuantiFERON-TB Gold In-Tube® (QTF-GIT) (Cellestis Limited, Canergie, Australia) que mide la producción de interferón gamma por los linfocitos T estimulados por un cóctel peptídico formado por antígenos específicos de Mycobacterium tuberculosis: ESAT-6 (early secreted antigenic target 6) y CFP-10 (culture filtrate protein 10) y el TB 7.7, codificados en la región RD1 del genoma de Mycobacterium tuberculosis y no de otras MNT, lo que confiere a la prueba una mayor especificidad y no se ve influido por la vacunación con BCG. El QTF-GIT es un test basado en enzyme-linked immunoabsorbent assay (ELISA), de sangre total, que mide el resultado en unidades internacionales (UI) de interferón-gamma por mililitro.
El T-SPOT.TB assay® (Oxford Inmunotec, Abingdon, United Kingdom) está basado en enzyme-linked inmunospot (ELISPOT), emplea células mononucleares de sangre periférica separadas, y mide el número de células productoras de IFN-gamma(3,5).
Sin embargo, ambos métodos constituyen aproximaciones indirectas e imperfectas al diagnóstico de la ITL, para la que no existe un gold standard(2,3), y sólo reflejan una sensibilización frente a Mycobacterium tuberculosis, sin poder diferenciar entre infección y enfermedad activa.
Desde la generalización de los IGRAs es escasa la bibliografía publicada respecto al empleo de estas técnicas para el screening de la ITL en trabajadores sanitarios, y es necesario un mayor nivel de evidencia y un mayor número de estudios al respecto(6). Algunos autores abogan por la adopción de programas basados en sólo IGRAs en países con baja incidencia de enfermedad tuberculosa (ET), dada su mayor especificidad, que permite evitar quimioprofilaxis innecesarias y potencialmente dañinas(7,8). En cambio, algunos centros que emplean QTF-GIT o T-SPOT seriados (y que han abandonado la PT) han advertido de las altas tasas de conversiones y reversiones que han encontrado desde la implementación de estas técnicas, y que son mayores que cuando se empleaba la PT(9). Especialmente escasos en la bibliografía son los estudios observacionales sobre el empleo de la combinación de ambas técnicas (PT e IGRAs).
Los programas de detención de ITL en trabajadores sanitarios, y el uso de diferentes estrategias diagnósticas, es, por tanto, un área que necesita aún de más investigación, y que al mismo tiempo es clave para proseguir con el control de una enfermedad tan prevalente a nivel global y con tanta morbimortalidad como es la tuberculosis.
Los objetivos de este estudio son:
1) Definir el procedimiento diagnóstico de la ITL en el personal sanitario de dicho hospital.
2) Determinar si el QTF-GIT ha modificado la actitud diagnóstica y terapéutica de la ITL.
3) Valorar la utilidad de la combinación de PT con puntos de corte de 5 y 10 mm y QTF-GIT.
Material y Métodos
Es un estudio de pruebas diagnósticas y de descripción de procedimientos, que se desarrolla de forma retrospectiva en un hospital de tercer nivel con más de 400 camas en Navarra (España), cuya incidencia de tuberculosis es de las comunidades más bajas del país, de 6 a 7,23 casos por 100.000 habitantes(1).
Obtención de los datos
Se solicitó al laboratorio de Microbiología los resultados de todas las pruebas de tuberculina y QTF-GIT solicitadas por el Departamento de Medicina del Trabajo desde el 1 de enero de 2007 hasta el 31 de diciembre de 2014.
A cada paciente se asignó un número aleatorio y la información referente al número de historia y al número de muestra fue eliminada, anonimizando las pruebas para garantizar la confidencialidad del paciente.
Así, se creó una base de datos nueva con 2085 pacientes, con 6 variables: número de paciente, prueba realizada (tuberculina y/o QTF-GIT), fecha de la/las prueba/s, resultado positivo/negativo (para la PT se consideró positivo una induración igual o mayor de 10mm) y en caso de la PT, además, milímetros de induración y categoría (se estratificaron en 3 categorías: de 0 a <5 mm, de 5 a <10 mm y ≥10mm).
Puesto que las pruebas fueron anonimizadas y no identificables, no se entregaron consentimientos informados.
Técnicas diagnósticas
Prueba de la tuberculina: La PT se realizó según la técnica de Mantoux con Tuberculina PPD Evans 2UT del derivado proteico purificado RT23 (Statens serum Institute, Copenhagen, Denmark). La lectura se realizó a las 72 horas.
QuantiFERON-TB Gold In-Tube (QTF-GIT) (Cellestis Limited, Canergie, Australia): Siguiendo las indicaciones de la casa comercial, la prueba se consideró positiva con un resultado ≥0,35 UI/mL. La prueba se realiza incubando 1 mL de sangre periférica anticoagulada con heparina en los tubos proporcionados por el fabricante que contienen los diferentes antígenos: suero salino como control negativo; fitohemaglutinina como control positivo (mitógeno), para medir la capacidad de linfoproliferación de los linfocitos; y los antígenos, ESAT-6 y CFP-10. La sangre se procesó antes de las 16 horas siguientes a su extracción. Después de un periodo de incubación de 16-24 h a una temperatura de 37o C, se determinó la concentración de interferón- en el plasma producido por los linfocitos T CD4 y CD8 mediante una técnica de ELISA(10).
Descripción del procedimiento de cribado de Infección Tuberculosa Latente.
El protocolo usado para diagnosticar la ITL desde la implantación del QTF-GIT fue el siguiente (Figura 1) a todo trabajador sanitario recientemente contratado se le indica la realización de un PT. Si esta prueba resulta negativa, se considera que no tiene ITL y se le sigue con una periodicidad variable en función de su nivel de riesgo según el puesto de trabajo. De los 2.085 trabajadores, el 42% se hizo una sola prueba, y el resto varias pruebas seriadas (30% dos pruebas, 15% tres pruebas, 8% cuatro pruebas, 3% cinco pruebas, 1% seis pruebas y <1% siete pruebas y ocho pruebas).
Si esta primera PT arroja un resultado mayor o igual a 10 milímetros de induración, se indica la realización de un QTF-GIT para confirmar el resultado en un plazo menor de 4 semanas. Si dicho QTF-GIT es negativo, se interpreta como falsamente positiva la PT previa, por tanto se considera que el sujeto no tiene ITL y se le sigue con QTF-GIT. En cambio, si este QTF-GIT fuera positivo, se indica una Radiografía de tórax y se pregunta por los síntomas para descartar una TB activa. Si la radiografía de tórax está alterada o el paciente presenta síntomas, se diagnostica de enfermedad tuberculosa activa y se deriva al Departamento de Enfermedades Infecciosas. Si la radiografía de tórax está alterada y el paciente no presenta síntomas, se diagnostica de ITL y se propone tratamiento profiláctico. En los dos últimos supuestos, se asume que la PT o el QTF-GIT siempre van a dar positivo y se deja de seguir al trabajador sanitario con cualquiera de ambas pruebas. Los porcentajes de pacientes que aceptan el tratamiento profiláctico, no se recoge en este estudio.
Este protocolo es el aplicado a la mayoría de trabajadores sanitarios (el 70,69% se realizó una PT como primera prueba de cribado), pero en algunos casos el protocolo puede sufrir variaciones en interés a las preferencias o riesgos individuales de los pacientes. Un 29,21% se realizó un QTF-GIT como primera prueba, lo cual puede deberse a diversos motivos como comodidad del propio paciente (por no poder acudir a la lectura de la PT 72 horas más tarde), o a la poca confianza en la PT por parte del paciente por estar vacunado de la BCG, o por referir un PT positiva previa en otro centro sanitario. De esta forma, un 43,39% de los casos diagnosticados de ITL lo fueron en base a un QTF-GIT positivo no precedido de PT.
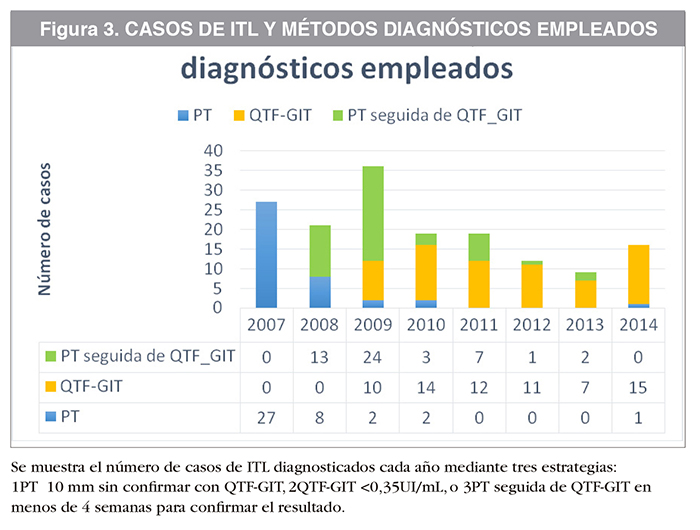
También hay casos de trabajadores sanitarios en los que, ante una PT positiva, no se realiza un QTF-GIT. Entre las razones para esta actitud podrían estar atribuir dicho resultado positivo a la vacunación BCG (y por tanto creer que se trata de un falso positivo), o por referir un contacto reciente con un paciente bacilífero (y por tanto creer que se trata de un verdadero positivo). Un 25,16% (40) de los casos de ITL fueron diagnosticadas con una PT positiva no seguida de QTF; no obstante, de estos 40 casos, 27 se produjeron en 2007, antes del inicio QTF-GIT; y 10 en los dos primeros años en los que el QTF-GIT estaba disponible (2008 y 2009). Solo 3 casos de ITL fueron diagnosticados en base a una PT aislada entre 2010 y 2014, cuando el protocolo estaba ya más implantado.
Finalmente, también hubo algunos casos de trabajadores sanitarios a los que se le realizó un QTF-GIT para confirmar una PT menor de 5 mm (5 personas) o una PT entre 5-10 mm (44 personas). No se ha podido profundizar en las razones para ello en todos los casos, pero probablemente, especialmente en el caso de las PT menores de 5 mm, fuera por un especial factor de riesgo en el paciente o en atención a su propia solicitud. En cuanto a las PT entre 5 y 10 mm, algunos autores han empleado el punto de corte de 5 mm para estimar la prevalencia de ITL(2). Es por ello que más adelante se evalúa la conveniencia de uno u otro punto de corte en nuestra muestra.
Análisis estadístico
Para analizar las tendencias ascendentes y descendentes en el uso de pruebas y en la prevalencia de ITL a lo largo de los años se realizó el test Chi cuadrado de tendencia, y el test de Chi cuadrado de Pearson para las diferencias entre proporciones. Para los estudios de validez diagnóstica se calcularon la sensibilidad, especificidad el valor predictivo negativo y el valor predictivo positivo de la PT con dos puntos de corte respecto al QTF-GIT en el subgrupo de pacientes que se sometieron a ambas pruebas. Dada la ausencia de gold standard para el diagnóstico de ITL, se decidió establecer el QTF-GIT como tal, debido a su elevada sensibilidad y especificidad(10).
Para todas las pruebas, un valor p<0,05 se consideró como límite de la significación estadística.
Los análisis estadísticos se han realizado con el programa informático STATA versión 12.
Resultados
Se obtuvieron los resultados de un total de 4.302 pruebas diagnósticas de ITL, de las cuales 2.679 fueron PT y 1.623 QTF-GIT, realizadas desde el 1 de enero de 2007 hasta el 31 de diciembre de 2014 (a lo largo de 8 años) a un total de 2.085 trabajadores sanitarios en el Departamento de Medicina del Trabajo de este Centro.
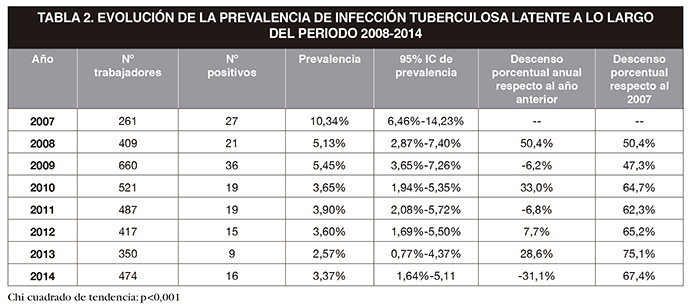
El QTF-GIT comenzó a emplearse en 2008. Se incluyó el año previo a la implantación del QTF-GIT (2007) para poder comparar los resultados en los años posteriores. Su implantación fue progresiva. Se diagnosticaron un total de 159 casos de ITL, lo que supone una prevalencia promedio anual de 4,75%, variando a lo largo de los años, del 10,34% en 2007 al 3,37% en 2014. De estos, un 25,16% fueron diagnosticados empleando la PT, 43,39% usando el QTF-GIT y 31,45% con la combinación de ambas pruebas.
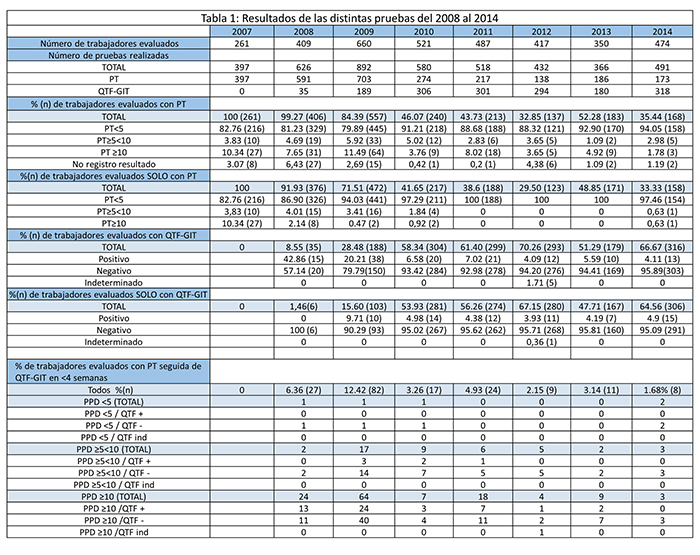
En la Tabla 1 se desglosan los resultados de las distintas pruebas cada año.
Determinar si el QuantiFERON-TB Gold In-Tube® ha modificado la actitud diagnóstica y terapéutica de la Infección Tuberculosa Latente
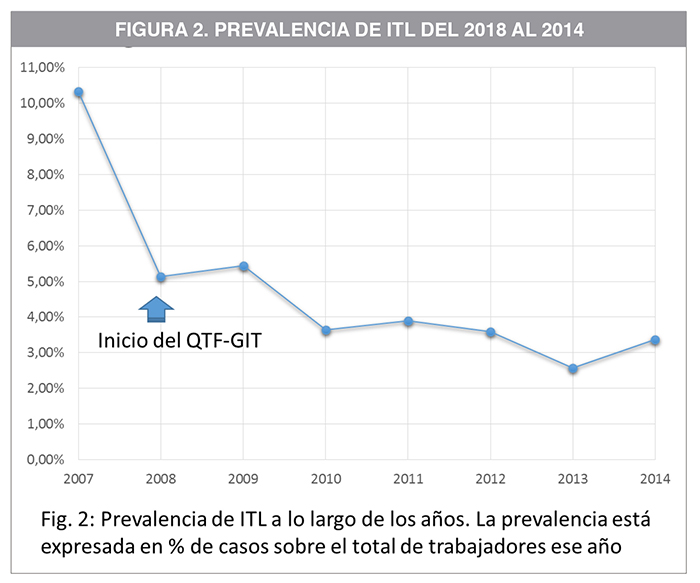
En la Figura 2 y en la Tabla 2 se expone la evolución de la prevalencia de ITL en la muestra en el periodo 2008-2014. Se aprecia una tendencia descendente con un valor p<0,001. La prevalencia fue de un 10,34% en 2007, antes de la implantación del QTF-GIT. Al año siguiente, cuando comenzó a usarse el nuevo test diagnóstico, la prevalencia descendió al 5,13%. La diferencia entre las proporciones fue significativa, p=0,011. La prevalencia a los largo de los años siguientes se mantuvo estable con pequeñas variaciones que no resultaron estadísticamente significativas. Este resultado se atribuye al descenso de falsos positivos debido a la implantación de una técnica más específica, como es el QTF-GIT; al disminuir el número de falsos positivos disminuye el número de diagnósticos efectivos. La Figura 3 ilustra el número de diagnósticos realizados con cada estrategia de screening.
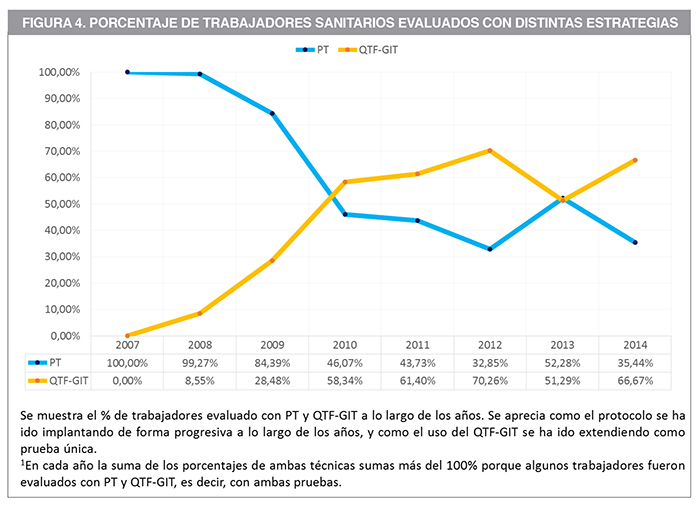
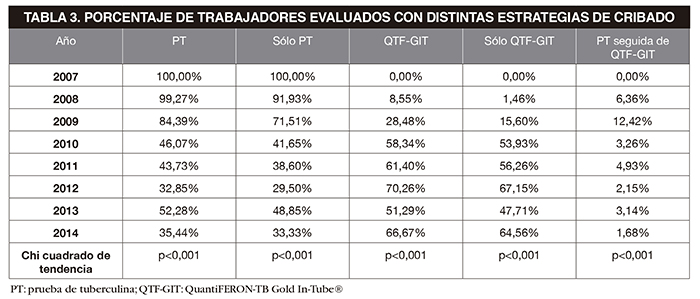
En la Figura 4 se detalla el porcentaje de trabajadores evaluados con las dos pruebas a lo largo de los años. Se aprecia cómo, desde la aparición del QTF-GIT en 2008, los trabajadores evaluados con PT han ido disminuyendo y en cambio los evaluados con QTF-GIT han ido aumentando. En la Tabla 3 se desglosa el porcentaje trabajadores evaluados con cada estrategia diagnóstica: con PT, sólo con PT (es decir, sin confirmación posterior con QTF-GIT), con QTF-GIT, sólo con QTF-GIT (sin una PT previa), y con la combinación de ambas pruebas. Las dos primeras muestran una tendencia descendente, y las tres últimas una tendencia ascendente. Todas estas tendencias fueron estadísticamente significativas.
Valoración de la utilidad de la combinación de Prueba de Tuberculina con puntos de corte de 5 y 10 mm y QuantiFERON-TB Gold In-Tube®
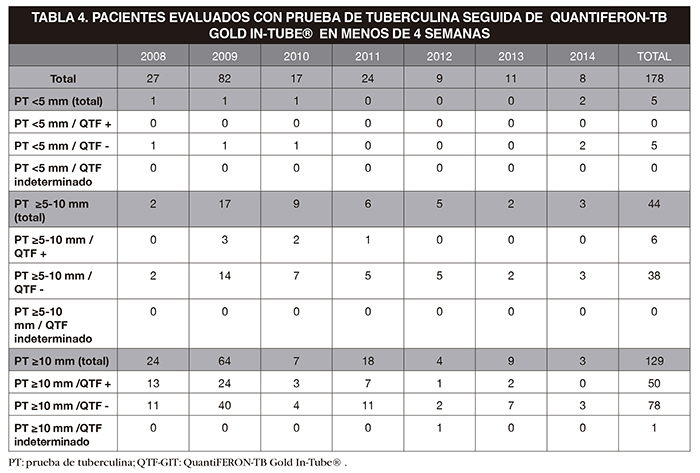
Para valorar la utilidad de la combinación de las dos pruebas con uno u otro punto de corte de la PT se evaluó a un subgrupo de pacientes que se había sometido a la PT seguida en menos de 4 semanas por un QTF-GIT (Tabla 4)
Se calculó la sensibilidad, especificidad y los valores predictivos de la PT respecto al QTF-GIT tomando como punto de corte una PT>10 mm. Se obtuvo un sensibilidad del 89,29% (IC95%, 80,29-98,28); una especificidad del 35,54% (IC95%, 26,60-44,48), un valor predictivo positivo del 39,06% (IC95%, 30,22-47,91), y un valor predictivo negativo del 87,76% (IC95%, 77,56-97,95)
Tomando como punto de corte de 5 mm se obtuvo una sensibilidad del 100% (IC 95%, 99,11-100%) una especificidad del 3% (IC 95%, 0,17-8,09%), un valor predictivo positivo del 33% (IC 95%, 25,26-39,85%) y un valor predictivo negativo del 100% (IC 95%, 90-100%). Esto indica que en nuestra muestra pasar de un punto de corte de 10 a 5 mm en la PT, si bien aumentaría discretamente la sensibilidad, sería a costa de una gran pérdida de especificidad, con número excesivo de falsos positivos.
Discusión
Sensibilidad, especificidad y valores predictivos de las pruebas. Prevalencia de Infección Tuberculosa Latente
El QTF-GIT ha demostrado ser más específico que la PT para el diagnóstico de la ITL, ya que elimina falsos positivos al no verse afectado por el contacto previo con MNT ni por la vacunación con la BCG(3,5,11). Esto permite reducir el número de tratamientos preventivos innecesarios, con sus posibles efectos secundarios, que ocasionalmente pueden ser graves.
Se ha descrito previamente que en poblaciones con baja incidencia de tuberculosis, la prevalencia de resultados positivos de QTF-GIT es menor que la prevalencia de PT positivas. En una revisión reciente, que incluye varios estudios, la prevalencia media de ITL en trabajadores sanitarios diagnosticada mediante PT fue de 29,5 (1,4-97,6), y mediante QFT-GIT de 14,1 (0,9-76,7)(2).No obstante, los intervalos de confianza son muy amplios. Un estudio español, por tanto en un entorno similar al nuestro, también encontró una menor prevalencia de ITL con QTF-GIT (5,97%) que con PT (8,96%), pero la diferencia no fue estadísticamente significativa(12), si bien la muestra era pequeña y posiblemente la potencia baja. Una revisión sistemática de 2012 incluyó estudios que habían medido la prevalencia de ITL en países de alta y baja incidencia de tuberculosis. Los autores también encontraron mayor prevalencia de ITL si se diagnosticaba con PT que haciéndolo con IGRAs, pero la diferencia sólo fue estadísticamente significativa en los países con incidencia baja de tuberculosis(13).
Por tanto, podemos afirmar que nuestros resultados concuerdan con la bibliografía encontrada, observando una prevalencia de ITL similar a la de estudios en contextos epidemiológicos parecidos, y que es menor si el diagnóstico se lleva a cabo con QTF-GIT que si se realiza con PT. Esto se atribuye a la mayor especificidad del primer método diagnóstico.
La principal limitación de todo estudio sobre ITL es que no existe un gold standard. Tanto la PT como el QTF-GIT son pruebas diagnósticas aceptables pero indirectas e imperfectas de la ITL(2,3). Los métodos empleados para estimar la sensibilidad varían entre los diferentes estudios, pero en general se lleva a cabo mediante la realización del QTF-GIT o la PT en pacientes con tuberculosis activa, y que por tanto están infectados. Menzies y cols(14). estimaron de esta forma, en un metaanálisis, una sensibilidad del 80% para el QTF-GIT, del 80% para la PT ≥5mm, y 73% para la PT ≥10mm. La guía americana del CDC (Center for Disease Control and Prevention) para el uso de los IGRAs actualizada en 2010(15) ofrece una estimación de la sensibilidad de todos los test diagnósticos combinando múltiples estudios. Según esta guía, la sensibilidad del QTF-GIT es del 83%, y la de la PT es de 89% (incluyendo estudios con puntos de corte de 5 y 10 mm). No obstante, los propios autores llaman a la interpretación cautelosa de estos datos, debido a la alta variabilidad entre los estudios incluidos respecto a los métodos elegidos para realizar sus cálculos, y a que no todos fueron realizados con pacientes con tuberculosis microbiológicamente confirmada.
En cuanto a la especificidad, suele estimarse realizando las pruebas en individuos de bajo riesgo, sin exposiciones conocidas, procedentes de poblaciones con baja incidencia de tuberculosis. Menzies y cols.(14) refirieron una especificidad del 97,7% para el QTF-GIT, basado en un metaanálisis de estudios con sujetos de bajo riesgo. La guía del CDC señala una especificidad del 99% para el QTF-GIT, comparada con la del 85% de la PT, ambas calculadas combinando los resultados de múltiples estudios(15). En ambas publicaciones se señala la principal limitación de cualquier estudio para el cálculo de la especificidad: que los sujetos realmente tengan ITL a pesar de su bajo riesgo.
En cuanto a los valores predictivos, estos dependen de la prevalencia, y siendo ésta muy baja en nuestro medio, es esperable que los valores predictivos negativos sean altos, y los positivos, bajos, como efectivamente señalan los cálculos realizados de la PT respecto al QTF-GIT. En este trabajo, al establecer el QTF-GIT como gold standard de ITL propiamente dicha, se pudieron calcular los valores predictivos para el diagnóstico de la ITL, pero la mayoría de los estudios calculan los valores predictivos de la PT y los IGRAs observando las tasas de progresión a enfermedad sintomática, y por tanto miden su capacidad para predecir el riesgo de infección tuberculosa activa. En este sentido, los valores predictivos positivos han sido clásicamente bajos, sugiriendo que menos de un 5% de los sujetos sanos sin factores de riesgo con un IGRA positivo progresa a enfermedad tuberculosa, incluso en países con incidencias altas(5).
Esto explica que los valores predictivos positivos calculados en este trabajo (aun siendo bajos debido a la baja prevalencia) sean más elevados que los descritos en la literatura, pues miden conceptos distintos: aquí se mide el VPP de la PT para el diagnóstico de ITL tomando como gold standard el QTF-GIT, mientras que en la literatura clásicamente se evalúa el VPP de las pruebas para progresión a enfermedad tuberculosa activa. En un metaanálisis de 2012(16) los autores encontraron unos valores predictivos positivos bajos para ambas pruebas, ligeramente superiores con los IGRAs, de 2,7% (95% IC, 2,3%-3,2%) comparado con el 1,5% (95% CI, 1,2%-1,7%) de la PT. Los valores predictivos negativos fueron muy altos y similares, también algo superiores con IGRA, de 99,7% (95% CI, 99,5%-99,8%) que con PT, de 99,4% (95% CI, 99,2%-99,5%). Otro metaanálisis(17) concluyó que la capacidad de cualquiera de las pruebas para predecir el riesgo de enfermedad activa es baja. Ambos estudios incluyeron poblaciones con incidencias bajas, intermedias y bajas, y reconocieron limitaciones como la falta de análisis de sesgo de publicación en el primero y la heterogeneidad de los estudios incluidos en el segundo. Ninguno de los dos se limitó a los estudios en trabajadores sanitarios.
En este trabajo se consideró la tuberculina diagnóstica de ITL con una induración mayor o igual a 10 mm, por considerarse a los trabajadores sanitarios un grupo de riesgo debido a su exposición laboral, pero no de tan alto riesgo como los grupos a los que se le suele aplicar el punto de corte de 5 mm, es decir, inmunodeprimidos, personas en contacto con pacientes bacilíferos o con cambios en la radiografía de tórax. No obstante, algunos trabajos sí han empleado el límite de 5 mm para trabajadores sanitarios(2), o distintos puntos de corte según el estado vacunal de los trabajadores(12). Es por ello que se planteó calcular la sensibilidad y especificidad de la PT, respecto al QTF-GIT, con un punto de corte de 5 mm. De esta forma, aumentó la sensibilidad, pasando del 89,29% al 100%, pero reduciendo drásticamente la especificidad, ya de por sí baja en nuestra muestra, pasando del 33 al 3%. Esto llevaría a un número excesivo de falsos positivos, conduciendo a unas quimioprofilaxis innecesarias que no son inocuas. Sin embargo, aunque con una sensibilidad de casi el 90%, algunos casos de ITL pudieran pasar desapercibidos, el riesgo de progresión a enfermedad tuberculosa es muy bajo en ausencia de factores de riesgo, como acabamos de detallar más arriba. Por tanto, recomendamos un punto de corte para la PT de 10 mm, pudiendo considerar puntos de corte menores sólo en trabajadores sanitarios con conocidos factores de riesgo, como inmunodepresión o contacto reciente con pacientes bacilíferos.
Limitaciones del screening con Prueba de Tuberculina
La PT tiene conocidos inconvenientes, que llevan a la posibilidad de falsos positivos, que afectan a la especificidad; y negativos, que afectan a la sensibilidad.
La PT se basa en una reacción in vivo mediada por los linfocitos T del organismo, y por tanto está sujeta al estado inmunológico del paciente. Esto explica que se puedan producir falsos negativos en situaciones en las que el organismo no puede reclutar un número suficiente de linfocitos T para la reacción (llamadas situaciones de anergia cutánea), lo cual sucede principalmente en inmunodeprimidos por diversas causas (fármacos o infección por VIH), ancianos y niños, y también con procesos infecciosos agudos concomitantes, como infecciones víricas o la propia enfermedad tuberculosa.
Tampoco se pueden descartar falsos negativos debidos a una mala técnica (inadecuada conservación de la tuberculina, inyección subcutánea) o a una mala lectura de la prueba, que siempre está condicionada por una cierta subjetividad del observador.
No obstante, el principal problema de la PT es la pérdida de especificidad debida a los falsos positivos. Se producen debido a que otras bacterias no tuberculosas, incluyendo la cepa de BCG empleada para la vacuna antituberculosa, comparten con Mycobacterium tuberculosis algunos de los antígenos contenidos en la tuberculina, dando lugar a reacciones cruzadas. La vacuna estuvo ampliamente extendida por el país hasta fechas relativamente recientes: oficialmente se eliminó de los calendarios vacunales de la mayoría de las comunidades autónomas en 1981, pero su discontinuación fue irregular y en varias regiones continuó administrándose. En la comunidad del País Vasco, región colindante a Navarra, donde se encuentra el hospital objeto de este estudio.
En este trabajo, no se recogió el lugar de procedencia de los sujetos ni el estado vacunal de los mismos, pero no es aventurado suponer que muchos de los casos en los que existe una discordancia entre una PT positiva y un QTF-GIT negativo sean debidos a reacciones cruzadas con la vacuna BCG, lo cual ha sido descrito previamente en la literatura, en contextos epidemiológicos similares al nuestro(12,18,20).
Limitaciones del QuantiFERON-TB Gold In-Tube®
El QTF-GIT ha mejorado la precisión del diagnóstico de la ITL(11) al aumentar la especificidad y disminuir por tanto los falsos positivos, al no presentar reactividad cruzada con la vacuna BCG ni con otras MNT (excepto M. marinum, M. kansaii, M. szulgai y M. flavescens), por ser los antígenos empleados específicos de Mycobacterium tuberculosis. Esto ha permitido evitar quimioprofilaxis innecesarias y potencialmente dañinas.
Sin embargo, a pesar del entusiasmo inicial que estas ventajas despertaron, varios autores que abandonaron la PT y adoptaron los IGRAs como único método de cribado de ITL, y que lo emplearon de forma seriada en el personal sanitario, han advertido de unas tasas inusualmente altas de conversiones y reversiones(9,20-23). Estas tasas son estadísticamente mayores que las observadas por estos mismos autores cuando los programas de screening se realizaban con PT, y mayores de lo esperado para el contexto epidemiológico, ya que se trata de países con una baja incidencia de tuberculosis. Así, la ventaja de reducir los falsos positivos con un único cribado con QTF-GIT, y por tanto reducir el número de profilaxis, podría diluirse al emplear este método de forma seriada, ya que las altas tasas de conversiones podrían, paradójicamente, tener el efecto contrario, aumentando el número de tratamientos innecesarios(3,13).
La PT podría ejercer un efecto en un QTF-GIT llevado a continuación, aumentando la tasa de positivos (efecto booster). Este fenómeno ha sido descrito recientemente y requiere de más investigación. Aparentemente, tiene lugar a partir unos tres días de la realización de la PT, y declina pasados unos meses. Posiblemente se deba al reclutamiento de linfocitos T dirigidos contra los antígenos RD1 del M.tuberculosis, contenidos tanto en la tuberculina como en los IGRAs. Es por ello que, en caso de necesidad de confirmar una PT con un IGRA, se recomienda hacerlo los primeros días tras la realización de la primera prueba (por ejemplo, en el momento de la lectura).
En nuestra muestra, sólo hubo 10 pacientes que de tener un QTF-GIT negativo pasaron a un resultado positivo en determinaciones siguientes, lo que supone aproximadamente un 1% de los pacientes avaluados con QTF-GIT y un 14% de los diagnósticos de ITL basados en esta prueba (10 de 69). No obstante, este dato es difícil de valorar, ya que no todos los pacientes fueron evaluados el mismo número de veces, ni siguiendo un mismo algoritmo diagnóstico. Respecto a las reversiones, no se pudieron cuantificar en esta muestra, ya que a los pacientes diagnosticados de ITL se les dejaba de evaluar con PT o con QTF-GIT, entendiendo que siempre van a ser positivas a partir de entonces. Por otra parte, el efecto booster que la PT pueda ejercer en el QTF-GIT no es un problema menor, para evitarlo en el futuro, podría estandarizase la práctica de realizar el QTF-GIT confirmatorio el mismo día de la lectura de la PT, es decir, 72 horas después.
Recomendaciones de cribado de la Infección Tuberculosa Latente en trabajadores sanitarios
Las recomendaciones para el screening de trabajadores sanitarios no son muy consistentes entre las distintas guías clínicas. Algunas sugieren emplear la PT o los IGRAs de forma indistinta, otras llaman a una mayor precaución con las nuevas técnicas o las desaconsejan, y otras aconsejan un cribado en dos pasos o en función de los riesgos individuales del paciente. Esto no es más que un reflejo de la necesidad de investigación en este campo.
La guía americana del CDC, actualizada en 2010, no establece una preferencia clara para el uso de un u otra prueba, pudiendo optar por una u otra de forma indiferente, tanto para el screening de trabajadores sanitarios como para la vigilancia de contactos de pacientes bacilíferos. A pesar de las ventajas de los IGRAs en este contexto, como una mayor comodidad sin necesidad de varias visitas médicas, advierten del riesgo de mayores tasas de conversiones de lo esperado en test seriados con esta técnica, sin que dichas conversiones representen un mayor riesgo real de enfermedad tuberculosa.
La guía canadiense de 2013, en cambio, es firme al recomendar la PT para el screening de trabajadores sanitarios, y desaconseja explícitamente los IGRAs para este fin, o en cualquier otra situación que requiera de pruebas seriadas, como en reclusos, basándose en el alto riesgo de conversiones y reversiones(24).
La guía europea del European Centre for Disease Prevention and Control (ECDC), de 2011, en cambio, señala que la evidencia científica respecto al cribado en trabajadores sanitarios es insuficiente, por lo que no establece una recomendación firme, pero apunta que una estrategia en dos pasos, con PT seguida de IGRA si resultara positiva, podría aumentar la especificidad, sobre todo en personas vacunadas.
La guía del Reino Unido elaborada por el National Institute for Health and Clinical Excelence (NICE) en 2011 ofrece recomendaciones distintas para los trabajadores sanitarios en función de su riesgo individual: para aquellos sin antecedentes de inmunosupresión o vacunación con BCG, y que no provengan de países con elevada incidencia, aconseja una PT y un IGRA para confirmarla si resulta positiva; para aquellos procedentes de áreas endémicas o vacunados, aconseja directamente IGRA; y para aquellos que están inmunodeprimidos, ambos test, para aumentar la sensibilidad(25).
En cuanto a los sujetos objeto del cribado en programas de prevención de riesgos laborales, algunos autores han planteado revisar la necesidad de someter a screening a todos los trabajadores, o sólo a los de mayor riesgo en función de su ocupación, en países con baja incidencia de tuberculosis(9,21,23). No obstante, en la mayoría de las instituciones se sigue incluyendo a todos los empleados en los programas de detección de ITL.
En cuanto a los estudios de coste-efectividad, la mayoría de los estudios coinciden en afirmar que la mayoría de los costes derivados de la PT son indirectos (necesidad de dos visitas médicas, pruebas confirmatorias como radiografías, etc.) y los de los IGRAs directos, debidos al precio más elevado de la prueba(11,26-28).
En el hospital objeto de este estudio se ha empleado un protocolo más parecido al sugerido por la guía europea, empleando en la mayor parte de los casos un algoritmo en dos pasos, con PT y QTF-GIT para confirmarla si resulta positiva. Este esquema ha sido previamente recomendado en nuestro país(29).
La principal limitación de este trabajo es carecer de los datos clínicos de los sujetos evaluados, y por tanto no poder llevar a cabo análisis ajustados por edad, sexo ni riesgos individuales u otros factores de confusión, que pueden estar presentes. No obstante, en la bibliografía no se ha reportado asociación entre los resultados de la PT o los IGRAs y el sexo; algunos estudios sí sugieren en cambio mayor prevalencia de ITL en trabajadores de más edad y más años de experiencia laboral, pero esto probablemente se deba a su vez a su mayor riesgo acumulado de exposición a Mycobacterium tuberculosis. La carencia de datos clínicos en este estudio supone una gran limitación especialmente cuanto al desconocimiento del estado vacunal, puesto de trabajo, condiciones de inmunosupresión y contacto directo con pacientes bacilíferos, que pueden asociarse a mayor o menor riesgo de ITL y de resultados positivos o negativos con las distintas pruebas.
El hecho de que no exista un gold standard para ITL supone una limitación importante para este y otros estudios relacionados con el tema. En este trabajo, se trató de suplir esta carencia usando el propio QTF-GIT como tal, dada su buena sensibilidad y especificidad, lo que nos permitió calcular la conveniencia de dos puntos de corte para la PT (5 o 10 mm). Respecto al cálculo de la sensibilidad y especificidad de la PT en estos dos límites, debe señalarse que la sensibilidad estará posiblemente sobreestimada y la especificidad, subestimada. Esto se debe a que los trabajadores que, con una PT negativa, se realizaron posteriormente un QTF-GIT, son escasos porque lo hicieron fuera del protocolo habitual. Esto lleva a que la fila inferior de la columna 2x2 necesaria para calcular sensibilidades y especificidades (las casillas de falsos negativos y de verdaderos negativos) contenga un número artificialmente bajo de sujetos. Esto nos lleva a interpretar los datos de sensibilidad y especificidad de forma cautelosa, y a establecer como más fiables los datos de valores predictivos positivos.
Los puntos fuertes de este estudio incluyen, sobretodo, el tamaño muestral y el periodo de seguimiento largo en un contexto real, de práctica clínica diaria, que permiten aportar una sólida experiencia a la mejora de la evidencia científica en este campo.
Concluímos que la introducción del QTF-GIT ha supuesto una mejora en el diagnóstico de la ITL en trabajadores sanitarios. Su mayor especificad, debido sobre todo a la ausencia de reacciones cruzadas con MNT y con la vacuna BCG, ha permitido disminuir los falsos positivos de la PT, como prueba el descenso de la prevalencia de ITL desde que ésta se diagnostica con el nuevo método.
La ITL puede derivar en complicaciones potencialmente graves, y los trabajadores sanitarios constituyen un grupo de alto riesgo, con una prevalencia que en este estudio y en la bibliografía precedente no resulta despreciable. Por tanto, es lógico emplear una prueba altamente sensible, como es la PT, para el screening. Sin embargo, la baja incidencia en nuestro medio lleva a un valor predictivo positivo bajo y a una elevada proporción de falsos positivos, que se someterían a una quimioprofilaxis no exenta de riesgos. El QTF-GIT es una prueba más específica que permite disminuir estos tratamientos innecesarios sin repercutir en la sensibilidad. Es por ello que recomendamos un diagnóstico basado en la combinación de pruebas en dos pasos, con la PT como cribado basal, empleando el QTF-GIT sólo para confirmar los positivos.
El punto de corte de esta PT debe establecerse en 10 mm. Hacerlo en 5 mm supondría una cierta ganancia en sensibilidad, pero a costa de una excesiva pérdida de especificidad, ya de por sí baja.
Se requiere una mayor investigación para mejorar el nivel de evidencia en este campo y elaborar guías clínicas y recomendaciones uniformes, que actualmente son dispares y cautelosas en sus planteamientos.
Bibliografía
1. Enfermedades de declaración obligatoria. Informes anuales. Available at: http:// www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-enfermedades/enfermedades-declaracion-obligatoria-informes-anuales.shtml. [ Links ]
2. Getahun H, Matteelli A, Chaisson RE, Raviglione M. Latent Mycobacterium tuberculosis infection. N Engl J Med 2015;372:2127-2135. [ Links ]
3. Pai M, Denkinger CM, Kik SV, Rangaka MX, Zwerling A, Oxlade O, et al. Gamma interferon release assays for detection of Mycobacterium tuberculosis infection. Clin Microbiol Rev 2014;27:3-20. [ Links ]
4. Cascante JA, Pascal I, Eguía VM, Hueto J. Diagnóstico de la infección tuberculosa. Anales del Sistema Sanitario de Navarra 2007;30:49-65. [ Links ]
5. Pai M, Menzies D. Interferon-gamma release assays for diagnosis of latent tuberculosis infection. 2015; Available at: http://www.uptodate.com/contents/interferon-gamma-release-assays-for-diagnosis-of-latent-tuberculosis-infection?source=search_result&search=interferon-gamma+release+assays+for+the+diagnosis+of+latent+tuberculosis+infection&selectedTitle=1~124. [ Links ]
6. European Center for Disease Prevention and Control. Use of interferon-gamma release assays in support of TB diagnosis. Stockholm, 2011. 2011; Available at: http://ecdc.europa.eu/en/publications/Publications/1103_GUI_IGRA.pdf. [ Links ]
7. Giri P, Basu S, Sargeant T, Rimmer A, Pirzada O, Adisesh A. Pre-placement screening for tuberculosis in healthcare workers. Occup Med (Lond) 2014;64:524-529. [ Links ]
8. Gran G, Assmus J, Dyrhol-Riise AM. Screening for latent tuberculosis in Norwegian health care workers: high frequency of discordant tuberculin skin test positive and interferon-gamma release assay negative results. BMC Public Health 2013;13:353-2458-13-353. [ Links ]
9. Joshi M, Monson TP, Joshi A, Woods GL. IFN-gamma release assay conversions and reversions. Challenges with serial testing in U.S. health care workers. Ann Am Thorac Soc 2014;11:296-302. [ Links ]
10. QuantiFERON-TB-Gold In-Tube. Prospecto en la página web de QuantiFEROn (QUIAGEN). 2015; Available at: http://www.quantiferon.com/irm/content/PI/QFT/PLUS/2PK-Elisa/ES.pdf. [ Links ]
11. Dominguez J, Latorre I. Up-to-date applicability of interferon-gamma release assays for the diagnosis of tuberculosis. Enferm Infecc Microbiol Clin 2015;33:15-19. [ Links ]
12. Alvarez-Leon EE, Espinosa-Vega E, Santana-Rodriguez E, Molina-Cabrillana JM, Perez-Arellano JL, Caminero JA, et al. Screening for tuberculosis infection in Spanish healthcare workers: Comparison of the QuantiFERON-TB gold in-tube test with the tuberculin skin test. Infect Control Hosp Epidemiol 2009;30:876-883. [ Links ]
13. Zwerling A, van den Hof S, Scholten J, Cobelens F, Menzies D, Pai M. Interferon-gamma release assays for tuberculosis screening of healthcare workers: a systematic review. Thorax 2012;67:62-70. [ Links ]
14. Menzies D, Pai M, Comstock G. Meta-analysis: new tests for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research. Ann Intern Med 2007;146:340-354. [ Links ]
15. Mazurek GH, Jereb J, Vernon A, LoBue P, Goldberg S, Castro K, et al. Updated guidelines for using Interferon Gamma Release Assays to detect Mycobacterium tuberculosis infection - United States, 2010. MMWR Recomm Rep 2010;59:1-25. [ Links ]
16. Diel R, Loddenkemper R, Nienhaus A. Predictive value of interferon-gamma release assays and tuberculin skin testing for progression from latent TB infection to disease state: a meta-analysis. Chest 2012;142:63-75. [ Links ]
17. Rangaka MX, Wilkinson KA, Glynn JR, Ling D, Menzies D, Mwansa-Kambafwile J, et al. Predictive value of interferon-gamma release assays for incident active tuberculosis: a systematic review and meta-analysis. Lancet Infect Dis 2012;12:45-55. [ Links ]
18. Torres Costa J, Silva R, Ringshausen FC, Nienhaus A. Screening for tuberculosis and prediction of disease in Portuguese healthcare workers. J Occup Med Toxicol 2011;6:19-6673-6-19. [ Links ]
19. Tenica I, Santillán M, Neyra A, Marzola M, Sánchez E, Peña A. Screening de Tuberculosis mediante la técnica IGRA en los residentes incorporados en mayo de 2014 en un hospital de tercer nivel de la Comunidad de Madrid. Revista de la Asociación Española de Especialistas en Medicina del Trabajo 2014; 23: 432-437. [ Links ]
20. Dorman SE, Belknap R, Graviss EA, Reves R, Schluger N, Weinfurter P, et al. Interferon-gamma release assays and tuberculin skin testing for diagnosis of latent tuberculosis infection in healthcare workers in the United States. Am J Respir Crit Care Med 2014;189:77-87. [ Links ]
21. Fong KS, Tomford JW, Teixeira L, Fraser TG, van Duin D, Yen-Lieberman B, et al. Challenges of interferon-gamma release assay conversions in serial testing of health-care workers in a TB control program. Chest 2012;142:55-62. [ Links ]
22. Slater ML, Welland G, Pai M, Parsonnet J, Banaei N. Challenges with QuantiFERON-TB Gold assay for large-scale, routine screening of U.S. healthcare workers. Am J Respir Crit Care Med 2013:15;188:1005-1010. [ Links ]
23. Pai M, Elwood K. Interferon-gamma release assays for screening of health care workers in low tuberculosis incidence settings: dynamic patterns and interpretational challenges. Can Respir J 2012;19:81-83. [ Links ]
24. Pai M, Kunimoto D, Jamieson F, Menzies D. Diagnosis of latent tuberculosis infection. Canadian TB Standards, 7th Edition. Canadian respiratory journal : journal of the Canadian Thoracic Society 2013;20:23A-34A. [ Links ]
25. Abubakar I, Griffiths C, Ormerod P, Guideline Development Group. Diagnosis of active and latent tuberculosis: summary of NICE guidance. BMJ 2012;17;345:e6828. [ Links ]
26. Abdalhamid B, Hinrichs SH, Garrett JL, O'Neill JM, Hansen-Cain KM, Armbrust AA, et al. Utilization of the QuantiFERON-TB Gold test in a two-step process with the tuberculin skin test to evaluate health care workers for latent tuberculosis. J Clin Microbiol 2010;48:2955-2956. [ Links ]
27. Linertova R, Alvarez-Leon EE, Garcia-Perez L, Serrano-Aguilar P. Costs of QuantiFERON-TB Gold versus tuberculin skin test in Spanish healthcare workers. J Hosp Infect 2010;75:52-55. [ Links ]
28. MT del Campo, H Fouad, MM Solís-Bravo, MA Sánchez-Uriz, I Mahíllo-Fernández, J Esteban. Cost-Effectiveness of Different Screening Strategies (Single or Dual) for the Diagnosis of Tuberculosis Infection in Healthcare Workers. Infection Control and Hospital Epidemiology 2012; 33: 1226-1234. [ Links ]
29. Guia per a la prevenció i control de la tuberculosi en personal sanitari. Generalitat de Catalunya, Institut Català de Salut, Área de prevenció de riscos laborals; 2012; Available at: http://canalsalut.gencat.cat/web/.content/home_canal_salut/professionals/temes_de_salut/tuberculosi/documents/arxius/guia_preve_tuber_personal_sanitari.pdf. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Alejandro Fernández Montero
Área de Medicina del Trabajo.
Clínica Universidad de Navarra.
Correo electrónico: afmontero@unav.es
Fecha de recepción: 19 de abril de 2016
Fecha de aceptación: 13 de junio de 2016