INTRODUCCIÓN
El estreñimiento es un síntoma frecuente, descrito en diferentes enfermedades crónicas (ya sea cáncer, insuficiencia cardiaca, enfermedad pulmonar obstructiva crónica, insuficiencia renal o enfermedades degenerativas neurológicas), estimándose su prevalencia entorno al 50 % 1,2, de los cuales un 20 % de los pacientes presentarán un estreñimiento severo en algún momento de la evolución de la enfermedad 3. De hecho la descripción de su prevalencia se ve afectada ampliamente por los factores considerados en su evaluación y definición 4. Aun en la ausencia de una definición de estreñimiento globalmente aceptada, los criterios propuestos por la Rome Fundation han ido ganando aceptación; así pues, los criterios ROMA III de estreñimiento combinan criterios objetivos (como la frecuencia de las deposiciones y la consistencia de las heces) junto con criterios subjetivos (como el esfuerzo defectorio, la percepción de evacuación incompleta y la sensación de obstrucción anorectal) 5.
El estreñimiento es un síntoma multicausal, en que causas farmacológicas, metabólicas o de otra índole contribuyen a su aparición; ello se ha evidenciado en especial en pacientes con cáncer 6. El papel del tratamiento opioide se ha reconocido como uno de los factores más importantes en la etiología del estreñimiento en pacientes oncológicos, considerándose relacionados en el 84,5 % de los casos y con una intensidad entre moderada-intensa en el 63 % 7. El reconocimiento de la relevancia del papel de los opioides ha hecho que en los nuevos criterios ROMA IV se reconozca como entidad específica el estreñimiento inducido por opioides (EIO) 8,9, cuyos criterios diagnósticos se muestran en el Tabla 1.
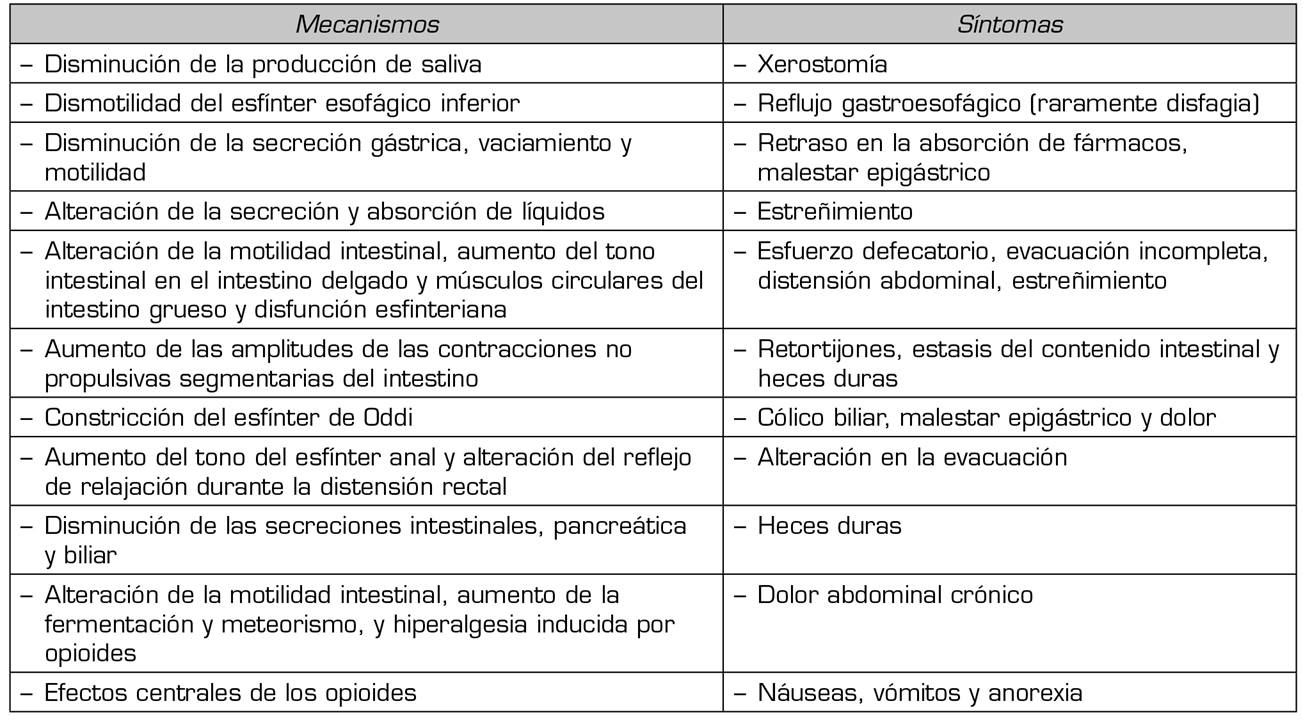
El estreñimiento es el síntoma quizás más evidente de todo un conjunto de alteraciones producidas por los opioides sobre el aparato digestivo, conocido como disfunción intestinal por opioides, caracterizada por el enlentecimiento en el tránsito gastrointestinal (GI), disminución en la secreción de líquidos intestinales e incremento del tono esfinteriano 10,11,12(Tabla 2). El tratamiento habitual del EIO está basado en el uso de laxantes, siendo habitual y más efectivo la combinación de laxantes, frecuentemente osmóticos y estimulantes 13,14, pero su acción es meramente sintomática y no incide en otros síntomas y problemas resultantes de la acción de los opioides sobre el tracto GI.
Desde hace algunos años se dispone de fármacos denominados antagonistas periféricos de los receptores opiodes Mu (Peripheral Acting Mu Opioid Receptor Antagonists), o PAMORA, que permiten la antagonización de los efectos periféricos de los opioides sin interferir en su efecto analgésico. El presente trabajo pretende revisar la información disponible sobre el uso de los PAMORA y su papel en el tratamiento del EIO.
ANTAGONISTAS PERIFÉRICOS DE LOS RECEPTORES MU OPIODES O PAMORAS
En la actualidad se hallan comercializados tres PAMORA: metilnaltrexona, alvimopan y naloxegol. La combinación comercializada de oxicodona-naloxona basa su mecanismo de acción y eficacia en la baja biodisponibilidad de la naloxona por vía oral 15, lo cual permite una antagonización periférica de los receptores opioides Mu, sin afectar la analgesia central mientras no se superen los 40 mg de naloxona al día. Se ha comunicado la administración de dosis superiores y posible afectación de la analgesia 16; por tanto, la combinación oxicodona-naloxona no se ha de considerar PAMORA, si no un antagonista de los receptores opioides con absorción sistémica limitada 17.
Respecto a la combinación buprenorfina-naloxona utilizada en el tratamiento de deshabituación de la adicción opioide 18, existen comunicaciones respecto a su beneficio en el alivio del dolor en pacientes con dolor y adicción 19,20, y un potencial beneficio en el EIO 21.
Metilnaltrexona
El bromuro de metilnatrexona (MTNX) es una amina cuaternaria que se forma de la N-metilación de la naltrexona; la carga positiva del grupo amonio incrementa su polaridad y reduce su liposolubilidad, disminuyendo su paso a través de la barrera hematoencefálica, y actúa como antagonista periférico de los receptores Mu, reduciendo el tiempo de tránsito oral-cecal sin revertir la analgesia 22.
Farmacocinética
La metilnaltrexona por vía subcutánea se absorbe rápidamente, observándose su concentración máxima (Cmáx) a los 30 minutos, siendo su biodisponibilidad subcutánea del 82 %. Tras la administración tanto a dosis única como repetida de 0,3 mg/kg/i.v., tiene una vida media de eliminación de ≈2,5 horas 23. Solo un 10 % se metaboliza por glucuronidación en el hígado y no hay interferencia con el sistema del citocromo P450 24. El 50 % se elimina inalterada por vía renal y un 40 % por las heces 24. En pacientes con un aclaramiento de creatinina ≤ 30 ml/min/1,73 m2, se recomienda una reducción de la dosis de un 50 %. No se recomienda su uso en insuficiencia renal terminal/diálisis ni en insuficiencia hepática severa. La edad no parece tener un efecto significativo en la farmacocinética de MTNX 25. Zacnya y cols. 26, en un estudio aleatorizado, cruzado doble ciego y placebo controlado en 29 voluntarios sanos, observaron que MTNX a dosis de 0,45 mg/kg (aproximadamente el doble de la dosis terapéutica habitual) administrados por vía subcutánea presentaban miosis, lo que sugiere cierto grado de acción central.
Estudios clínicos
Portenoy y cols. 27, en un estudio fase II en que se compararon dosis de MNTX de 1, 5, 12,5 y 20 mg subcutánea a días alternos, en pacientes con cáncer o SIDA avanzado, se mostró benefició en la laxación para dosis ≥ 5 mg sin que se viese comprometida la analgesia. Así pues, para una población de peso medio de 64 kg, la dosis de MTNX se situaría entre 0,08 y 0,20 mg/kg. Mori y cols. 28, en un estudio fase II de un solo brazo y no controlado, evaluaron 12 pacientes con cáncer y supervivencia esperada > 3 meses; el 83,3 % de los pacientes tuvieron una deposición espontánea dentro de las primeras 48 h tras la administración de MTNX, con mejoría adicional de la consistencia de las heces. En otro estudio fase II, placebo controlado, en pacientes con EIO agudo tras cirugía ortopédica en tratamiento con opioides, se observó que el 38,9 % de los pacientes en el brazo de MTNX tenían una deposición espontánea dentro de las 4 h tras administración, frente al 6,7 % del grupo placebo (p = 0,046) 29.
Thomas y cols. 30realizaron un estudio fase III multicéntrico, randomizado, doble ciego y placebo controlado. Fueron aleatorizados 133 pacientes: MTNX 0,15 mg/kg a días alternos vs. placebo. Los dos co-objetivos principales fueron la deposición dentro de las primeras 4 horas tras la primera administración de MTNX y la deposición dentro de las primeras horas tras la segunda o dosis sucesivas de MTNX. Para ambos objetivos el grupo de MTNX se mostró más eficaz que placebo. El 48 vs. 15 % (p < 0,0001) de los pacientes presentaron una deposición dentro de las primeras 4 h tras la primera administración de MTNX y placebo, respectivamente. Para las siguientes dosis, en el grupo de MTNX, el 52 % de los pacientes presentaron deposiciones dentro de las primeras 4 h, mientras que con placebo fue el 8 % (p < 0,0001). En el grupo de MTNX mejoró también la consistencia de las heces y el esfuerzo defecatorio. Similares resultados se obtuvieron en un estudio fase III 31aleatorizado, doble ciego y placebo controlado que incluyó 460 pacientes con dolor no oncológico. Los pacientes fueron aleatorizados en tres ramas: placebo, MTNX 12 mg/s.c./24 h y MTNX 12 mg/s.c./48 h; el porcentaje de pacientes con deposiciones dentro de las 4 h posteriores a la primera dosis fueron: 9,9 %, 33,3 % y 35,1 %, (p < 0,001), respectivamente. Asimismo, mejoró la consistencia de las heces y el esfuerzo defecatorio en los brazos de MNTX. Otro estudio fase III, placebo controlado 32, evaluó 154 pacientes con enfermedad avanzada, a los que se administró una sola dosis subcutánea de MTNX (0,15 mg/kg o 0,3 mg/kg) o placebo; el 62 % y el 58 % de los pacientes tuvieron una deposición espontánea dentro de las primeras 4 h respectivamente, mientras que en el grupo placebo fue un 14 % (p < 0,0001, para cada dosis vs. placebo). El 50 % de los respondedores a MTNX defecaron en los primeros 30 minutos tras su administración. El uso de MTNX también ha sido evaluado en dos estudios fase III 33mulicéntricos, doble ciego, placebo controlados, que incluyeron 1048 pacientes, en la recuperación del íleo posquirúrgico tras resección intestinal, sin que se pudiese observar diferencias entre el grupo de MTNX y placebo en un acortamiento en el tiempo entre la cirugía y la primera deposición, ni reducción de la estancia hospitalaria. En ninguno de los estudios anteriores se observaron modificaciones en la analgesia y los efectos secundarios fueron leves, siendo los más frecuentes: dolor abdominal, diarrea y náuseas, y vómitos. Un reciente metanálisis 34que analiza 6 ensayos clínicos aleatorizados MTNX vs. placebo y que incluyen 1239 pacientes, de los cuales el 48,3 % recibieron MTNX, muestra un significativo (p < 0,0001) incremento de las deposiciones espontáneas respecto placebo, tanto para dosis de 15 mg/kg como 30 mg/kg por vía subcutánea y a días alternos, así como su seguridad y no afectación de la analgesia. La eficacia y seguridad de MTNX se evaluó en un estudio 35abierto de 10 semanas en el que se administraron a días alternos 8 o 12 mg de MTNX para un peso de entre 38 y < 62 kg y ≥ 62 kg, respectivamente. Se incluyeron 149 pacientes con una dosis media equivalente de morfina oral de 157 mg/d; el 38,3 % con MTNX 8 mg y el 61,7 % tratados con MTNX 12 mg, observándose un promedio de deposiciones semanales de 2,2 y 3,1, respectivamente. Los principales efectos secundarios observados fueron similares a los observados en otros estudios: dolor abdominal (26,8 %), diarrea (16,1 %) y náuseas (14,1 %).
Alvimopan
Alvimopan (ALVP) (trans-3,4-dimetil.4-(3-hidroxifenil) piperidina) es un antagonista competitivo del receptor opioide Mu, sin actividad significativa sobre los receptores opioides delta y kappa, y baja afinidad para receptores no opioides (adenérgicos, dopaminérgicos, serotoninérgicos y peptidérgicos) disociándose lentamente de la mayoría de los ligandos; adicionalmente su afinidad con los receptores opioides Mu es mayor que la MTNX y naloxona 36. Su paso a través de la barrera hematoencefálica se ve limitado debido a su gran tamaño molecular (peso molecular 424,53 g/mol), forma y elevada polaridad 37. Actualmente está aprobado en el tratamiento del íleo postoperatorio después de una resección parcial del intestino grueso o del intestino delgado con anastomosis primaria, en aquellos pacientes con analgesia postoperatoria con opioides 38.
Farmacocinética
ALVP tiene una biodisponibilidad del ~6 % (38); en pacientes no quirúrgicos el alimento disminuye un 54 % la biodisponibilidad, mientras que en pacientes quirúrgicos esta se reduce un 80 % (39). Alcanza su concentración máxima (Cmáx) tras 2 horas de la administración de una dosis vía oral. Con su administración 2 veces al día durante 5 días se alcanza una media de Cmáx de 10,98 ng/ml. Su unión a proteínas (70-80 %) plasmáticas es independiente de su concentración 38. ALVP es metabolizado por la flora intestinal y su metabolito activo (ADL 08-0011) se absorbe sistémicamente sin que se haya podido demostrar relevancia clínica respecto a la acción de ALVP y sin aporte clínicamente significativo al efecto del fármaco 38. La eliminación de ALVP es principalmente por la vía biliar (~65 %) y secundariamente tiene un 35 % de excreción renal. La vida media de eliminación de ALVP es de 10 a 17 horas, mientras que la del metabolito intestinal es de 10 a 18 horas. La farmacocinética de ALVP no varía con el peso, el género, índice de masa corporal, enfermedad inflamatoria intestinal, colitis ulcerosa, función renal, antibioterapia, antiácidos o inhibidores de la P-Glicoproteína (amiodarona, diltiazem, ciclosporina, itraconazol, quinina, quinidina, espironolactona o verapamilo) 39; por otra parte, la farmacocinética de su metabolito ADL 08-0011 sí se ve afectada por el uso de antibióticos orales, raza, enfermedad intestinal inflamatoria, antiácidos, aunque con escasa relevancia clínica 39.
Estudios clínicos
En un estudio fase II aleatorizado, doble ciego, cruzado y placebo controlado en 14 voluntarios sanos en que se administró morfina (0,05 mg/kg/EV), ALVP (4 mg) y placebo; el tránsito GI se prolongó por la morfina de 69 a 103 minutos, lo cual fue prevenido por ALVP (p = 0,005) 37. En el mismo estudio 37, pero con diseño paralelo, se evaluó el efecto de ALVP sobre la analgesia (morfina 0,15 mg/kg/i.v.) en 45 pacientes sometidos a exodoncia del tercer molar, observándose que la analgesia y la contracción pupilar no se afectaban con ALVP (p < 0,002). En otro estudio fase II con 79 pacientes sometidos a colectomía parcial, histerectomía o resección intestinal, se valoró la eficacia de ALVP en acelerar la recuperación GI; se objetivó en el brazo de ALVP una reducción del tiempo para la primera flatulencia 70 vs. 49 h (p = 0,01) y primera deposición 91 vs. 68 h (p = 0,03). Asimismo, se redujo el tiempo medio para el alta de 91 h a 68 h (p = 0,03) 40.
Íleo post-operatorio
Wolf y cols. 41en un estudio fase III multicéntrico, aleatorizado, doble ciego y placebo controlado, analizó por intención de tratar (ITT) 469 pacientes sometidos a resección intestinal o histerectomía total que se aleatorizaron para ALVP 6 mg, 12 mg o placebo administrados hasta dos horas antes de la cirugía y postintervención cada 12 h hasta el alta, y como máximo 7 días. El tiempo medio de recuperación GI se aceleró 15 h para ALVP 6 mg (p < 0,05) y 22 h para ALVP 12 mg (p < 0,001) respecto a placebo, y se redujo el tiempo medio de alta hospitalaria frente placebo (146 h) para la dosis de ALVP 6 mg (133 h) y 12 mg (126 h) (p = 0,003). Los efectos secundarios más frecuentes fueron náuseas (54,5 %), vómitos (19,9 %) e hipotensión (13,6 %). Similares resultados se obtuvieron en un estudio fase III, que evaluó 451 pacientes, con la excepción que la recuperación de la función GI no fue significativa para ALVP 12 mg (p = 0,059) 42, mientras que otro estudio de igual diseño que enroló 615 pacientes mostró eficacia para ALVP 12 mg, pero no para ALVP 6 mg 43y el estudio de Büchler y cols. 44(911 pacientes) no mostró eficacia para ninguna de ambas dosis. En un análisis de tres estudios fase III 41,42,43mostró una reducción de complicaciones relacionadas con el íleo postoperatorio (uso de SNG, fugas de la anastomosis, náuseas y vómitos, y distensión abdominal) en el brazo de ALVP 12 mg respecto a placebo 45. Herzog y cols. 46, en un estudio fase III, de igual diseño que los anteriores, en 519 pacientes en que se practicó histerectomía total mostraron beneficio de ALVP 12 mg frente placebo en la recuperación GI.
Estreñimiento inducido por opioides
Webster y cols. 47investigaron la eficacia y seguridad de ALVP en 522 pacientes con dolor no oncológico y EIO en un estudio fase IIb doble ciego de 6 semanas de duración postaleatorización en cuatro ramas ALVP 0,5 mg/12 h, 1 mg/24 h, 1 mg/12 h y placebo. Los criterios de inclusión fueron: < 3 deposiciones espontáneas semanales y al menos uno de los siguientes síntomas en ≥ 25 % de las deposiciones: sensación de evacuación incompleta, esfuerzo defecatorio o heces duras o caprinas. El objetivo primario fue el cambio en el número de deposiciones espontáneas semanales durante las tres primeras semanas de las seis. Las tres dosificaciones de ALVP incrementaron de forma significativa la media de deposiciones espontáneas respecto a placebo (p ≤ 0,01). La media de pacientes con ≥ 3 deposiciones espontáneas semanales para las 6 semanas de seguimiento fueron para placebo (14 %), 0,5 mg/12 h (38,8 %), 1 mg/24 h (39,5 %), 1 mg/12 h (42,1 %). Los efectos adversos más frecuentemente observados fueron dolor abdominal (17-28 %), diarrea (7-14 %) y náuseas (7-10 %). Tres pacientes presentaron problemas cardiacos en el brazo ALVP 1 mg/24 h, que aunque no se relacionaron con ALVP, condujo a la FDA a limitar ALVP a uso hospitalario y para periodos cortos (15 dosis) y se contraindica en pacientes con más de una semana de tratamiento opioide 48. Similares resultados de eficacia se obtuvieron en otro estudio fase III que evaluó la respuesta en 518 pacientes aleatorizados en tres brazos: ALVP 0,5 mg/24 h, ALVP 0,5 mg/12 h o placebo durante 12 semanas, aunque el programa de desarrollo de ALVP para EIO ya había sido suspendido. Irving y cols. 49en un estudio fase III placebo controlado en 485 pacientes con dolor no oncológico e EIO se aleatorizaron a recibir ALVP 0,5 mg/24 h, 0,5 mg/12 h o placebo durante 12 semanas. El objetivo principal era la proporción de pacientes respondedores (≥ 3 deposiciones semanales espontáneas y un incremento promedio ≥ 1 de deposiciones semanales espontáneas respecto al inicio del estudio). La proporción de pacientes respondedores no fue significativa respecto placebo para ninguna de las dosis ensayadas (ALVP 0,5 mg/24 h; p = 0,259 y ALVP 0,5 mg/12 h; p = 0,214). Los efectos adversos más frecuentes fueron los observados en estudios previos.
Naloxegol
Naloxegol (NLXG) es un conjugado polienglicol (PEGilado) del naloxol, el cual es, asimismo, un derivado de la naloxona. NLXG posee una estructura basada en un anillo morfinano, que comparte con la metilnaltrexona, pero diferente del alvimopan 38, con un peso molecular de 637,7 g/mol. La PEGicación disminuye el primer paso hepático de NLXG y limita la penetración en el sistema nervioso central mediante la reducción de la permeabilidad pasiva de la barrera hematoencefálica. Actualmente está aprobado por la European Medicines Agency (EMEA) y la US Food and Drug Administration (FDA) en el tratamiento del estreñimiento inducido por opioides 11.
Farmacodinámica
NLXG es un antagonista neutro de los receptores opioides, es decir, carece de actividad intrínseca y, por lo tanto, no da ninguna respuesta en ausencia del agonista, en este caso un opioide. Respecto a naloxona se ha mostrado 33 veces menos potente en la antagonización de la morfina en el tracto GI y es 49 veces menos potente en antagonizar la analgesia producida por la morfina 11. Asimismo, NLXG ha mostrado una recaptación cerebral 15 veces inferior que naloxona 11. Respecto a metilnaltrexona, como antagonista opioide ha mostrado 3 veces mayor afinidad por los receptores opioides Mu humanos y 9,4 veces en los receptores opioides Delta humanos; para los receptores Kappa murinos no se hallaron diferencias significativas 11.
Farmacocinética
En voluntarios sanos NLXG 25 mg 50se absorbe rápidamente por vía oral (~ 15') alcanzando una Cmáx plasmática de 51 ng/ml en una mediana de tiempo de 1,74 horas (rango 0,25-3,02), con un segundo pico ~ 4 horas, atribuible a recirculación enterohepática. Su biodisponibilidad es ~ 62 %, incrementándose cerca de un 45 % cuando se administra junto a alimentos, lo cual hace recomendable su administración en ayunas 51. Por otra parte, cuando los comprimidos son triturados y disueltos para su administración por vía oral o por SNG, la biodisponibilidad de NLXG no se ve afectada 52. Su unión a proteínas plasmáticas es de un 4,2 %. La vida media de eliminación es de 7,88 horas. Se metaboliza rápidamente a través del citocromo P450 (CYP3A4/5) vía demetilación, oxidación, deaquilación y acortamiento de la cadena de polietilenglicol; ello se ha mostrado relevante, ya que fármacos que inhiben el CYP3A4/5 incrementan sustancialmente los niveles plasmáticos de NLXG 53, y aquellos que inducen la acción enzimática, como la rifampicina, los disminuyen marcadamente 53. La administración concomitante de un inhibidor débil CYP3A4 y potente de la P-glicoproteína, como la quinidina, no ha mostrado un incremento significativo en atravesar la barrera hematoencefálica por parte de NLXG 54,55. La administración de morfina y NLXG conjuntamente no alteraron las propiedades farmacocinéticas de ambos fármacos 54,55. Se han determinado seis metabolitos siendo el carboxi-metil-PEG4-Naloxol el más abundante (9,5 %). La eliminación es esencialmente fecal, eliminándose inalterado un 16 % en heces y un 5,9 % por orina 50.
La administración de NLXG 25 mg en pacientes con insuficiencia renal moderada (GFR 30-59 ml/min/1,73 m2)y severa (GFR < 30 ml/min/1,73 m2)tiene un escaso impacto en la farmacocinética del fármaco, pero a tenor de que la insuficiencia renal puede conllevar una disminución del metabolismo hepático e intestinal y un incremento de la excreción biliar con incremento de la biodisponibilidad de NLXG, se recomienda reducir su dosis un 50 % 56. Respecto a los pacientes con afectación hepática leve (Child-Pugh A) o moderada (Child-Pugh B), la farmacocinética de NLXG no se afecta significativa, por lo que no se requiere ajuste de la dosis 57.
Respecto a la edad, aunque no parece tener un efecto significativo en la farmacocinética de NLXG, se dispone de información de que en pacientes ancianos (edad mediana 72 años) la exposición a NLXG en fase de equilibrio se incrementó un 54 %, por lo es recomendable precaución en la administración repetida 58. La farmacocinética de NLXG no se ve afectada por el sexo, la raza, el peso corporal o el índice de masa corporal 58.
Estudios clínicos
En un estudio fase IIb 59multicéntrico, aleatorizado, doble ciego, placebo controlado y de escalada de dosis (NLXG 5 mg, 25 mg y 50 mg), incluyó 207 pacientes adultos tratados con opioide, tanto para dolor oncológico como no oncológico, y con una dosis estable de equivalente de morfina oral diaria entre 30 a 1000 mg en las dos semanas previas al screening, que presentasen síntomas de estreñimiento inducido por opioides (< 3 deposiciones espontáneas semanales y al menos uno de los siguientes síntomas: heces duras, esfuerzo defecatorio, sensación de evacuación incompleta, sensación de obstrucción anorectal) y que aceptasen abandonar el tratamiento laxante durante el ensayo. Los pacientes fueron estratificados respecto la dosis equivalente de morfina oral diaria: baja (30-100 mg) y alta (> 100-1000 mg). El objetivo principal de eficacia fue la media en el cambio de deposiciones espontáneas semanales entre la basal (antes de la inclusión) y las dos semanas de tratamiento. Los pacientes permanecieron en la fase de aleatorización 4 semanas. En el caso de que no hubiese deposiciones en 72 h, se permitía usar bisacodilo de rescate. Tanto los pacientes con dosis de 25 mg (p = 0,002) y 50 mg (p = 0,0001) obtuvieron un cambio significativo en el objetivo principal, comparados con placebo. Asimismo, durante las 4 semanas de aleatorización, la mediana de cambio respecto al basal se mantuvo significativa para 25 y 50 mg, p = 0,0022 y p < 0,0001, respectivamente. Los resultados fueron igual de consistentes para ambos estratos de dosis de opioide. La mediana de tiempo para la primera deposición espontánea fue de 6,6 h para 25 mg y 2,9 h para 50 mg. En cuanto a la seguridad, hay que destacar que la incidencia de efectos adversos en los pacientes con NLXG 50 mg fue superior que placebo, mientras que en el grupo de 25 mg la incidencia de efectos adversos fue similar a placebo. Los efectos secundarios más frecuentes fueron dolor abdominal, diarrea y náuseas. Durante el estudio no se observaron variaciones significativas respecto a los requerimientos analgésicos, tampoco se observaron síntomas de deprivación opioide. Para la dosis de NLXG de 5 mg no se observó beneficio ni efectos adversos diferentes a placebo. En definitiva, teniendo en cuenta la eficacia y seguridad la administración de NLXG 25 mg una vez al día se consideró la dosificación y posología adecuada para futuros estudios fase III.
Chey y cols. 60publicaron dos estudios fase III paralelos, multicéntricos, aleatorizados, doble ciego y controlado por placebo para establecer la eficacia y seguridad de NLXG. Se incluyeron 1352 pacientes adultos ambulatorios (18 a 84 años) en tratamiento con opioides por dolor no oncológico con una dosis estable de equivalente de morfina oral diaria entre 30 a 1000 mg y que presentaran síntomas de estreñimiento inducido por opioides (< 3 deposiciones espontáneas semanales o al menos uno de los siguientes síntomas en el 25 % de las deposiciones en las 4 semanas previas al screening: heces duras, esfuerzo defecatorio, sensación de evacuación incompleta, sensación de obstrucción anorectal). Los pacientes se aleatorizaron 1:1:1 en tres brazos: NLXG 12,5 mg/d, 25 mg/d, y placebo, 1 dosis diaria durante 12 semanas por ITT. Durante el estudio no se permitió el uso de laxantes, permitiéndose bisacodilo 10-15 mg y, si fuese preciso, un enema cuando no hubo deposiciones ≥ 72 h. El objetivo principal fue la tasa de respuesta durante las 12 semanas de tratamiento; entendiendo como respuesta la existencia de ≥ 3 deposiciones espontáneas a la semana y un incremento ≥ 1 deposición respecto a las deposiciones en el momento de la inclusión, en ≥ 9 de las semanas de las 12 del estudio y ≥ 3 semanas de las últimas 4 semanas del periodo de tratamiento.
Respecto a los pacientes, más del 50 % estaban en tratamiento con opioides por dolor lumbar, con una media de tratamiento superior a 3 años. El 71 % de los pacientes tomaban laxantes en las 2 semanas previas a su inclusión; alrededor de un 67 % utilizaba un tipo de laxante, y sobre un 30 % dos tipos de laxantes, habitualmente ablandadores y estimulantes.
Respecto placebo, en uno de los estudios el objetivo se alcanzó tanto para las dosis de nalexegol 12,5 mg (p = 0,02) y 25 mg (p = 0,001), con tasas de respuestas estadísticamente significativas del 11,5 % y 15 %, respectivamente; mientras que en el otro estudio el objetivo solo se alcanzó con la dosis de 25 mg (p = 0,02) con una tasa de respuesta del 10,3 % (95 % CI: 1,7 a 18,9). Adicionalmente, se observó una mejoría considerable en el esfuerzo defecatorio, consistencia de las heces y la frecuencia de las deposiciones, especialmente con NLXG 25 mg respecto placebo. Asimismo, la proporción de pacientes que requirieron durante el estudio laxantes de rescate fue 72 %, 63,4 % y 54,7 % para placebo, NLXG 12,5 mg y 25 mg, respectivamente. La mediana de tiempo en aparecer la primera deposición espontánea fue de 5,9 h y 12 h en los grupos de 25 mg. En cuanto a la seguridad, los pacientes estuvieron tomando NLXG ~ 90 % de los días de estudio. Los efectos secundarios fueron leves y ocurrieron con mayor frecuencia en los grupos de 25 mg; especialmente dolor abdominal (12,6-19 %), diarrea (9,1-9,3 %), náuseas 7,5-8,6 %), flatulencia (5,6-6 %) y vómitos (2,8-6 %). En ambos estudios, el 10,3 % presentaron efectos adversos que condujeron a la discontinuación del fármaco. La dosis media de opioide se mantuvo estable a lo largo del periodo de estudio solo 5 pacientes presentaron algún síntoma de deprivación opioide.
NLXG se intentó estudiar en pacientes oncológicos 61con EIO pero el reclutamiento tras 10 meses fue del 4 % de la población planificada (14 de 336). Los investigadores adujeron diferentes causas para el bajo reclutamiento como la priorización de otras investigaciones y que el protocolo era demasiado restrictivo o inconsistente con el manejo habitual de los pacientes con cáncer, como la estabilidad de la dosis de opioides durante 4 semanas.
La seguridad y tolerancia de NLXG a largo plazo se estudió en un estudio fase III paralelo, multicéntrico, abierto, aleatorizado de 52 semanas de duración 62. Se aleatorizaron un total de 844 pacientes, 84 de los anteriores estudios fase III, y 760 como nuevos pacientes. Los criterios de inclusión y exclusión fueron los mismos que los descritos previamente para los estudios fase III. Los pacientes se aleatorizaron 2:1 (NLXG 25 mg/día: tratamiento habitual con laxantes). Las características demográficas de ambos grupos fueron similares, así como las causas de dolor, siendo el 87,4 % de origen musculoesquelético, especialmente el dolor de espalda (52,9 %). Respecto al tipo de opioide y proporción de pacientes que los utilizaban en ambos grupos tampoco había diferencias sustanciales, siendo los analgésicos más usados: hidrocodona + paracetamol (32,3 %), morfina (27,9 %), oxicodona (25 %), oxicodona + paracetamol (18,9 %) y tramadol (13,6 %). Las dosis medias de morfina oral equivalente diaria fueron de 151,5 mg y 136,7 mg, para los grupos de NLXG y laxantes, respectivamente. El tiempo previo de tratamiento medio con opioides fue ~ 4 años en ambos grupos. Adicionalmente, el 98,3 % tomaban otros medicamentos: benzodiacepinas (41,4 %), antidepresivos (31,1 %) y estatinas (30,5 %), entre los más frecuentes. Los pacientes estuvieron tomando NLXG el 73,6 % de los días de estudio y el tratamiento con laxantes el 81,3 %. El 73 % de los pacientes con laxantes no los modificaron durante el estudio. La mayoría de los efectos adversos fueron leves o moderados, aunque más frecuentes en el grupo de NLXG frente al grupo de laxantes: dolor abdominal (17,8 % vs. 3,3 %), diarrea (12,9 % vs. 5,9%) y náuseas (9,4 % vs. 4,1 %), lo cual se interpretó como esperable a tenor del mecanismo de acción de NLXG. Respecto a otros efectos adversos de especial interés como accidentes cardiovasculares (2 pacientes), hipotensión (10), hiptensión (33), GIes (6), perforación intestinal (0), deprivación opioide (3), todos repartidos de forma similar en ambos brazos del estudio y ninguno atribuible a los fármacos utilizados. Tanto las puntuaciones para el dolor como las dosis de opiodes se mantuvieron estables a lo largo del estudio. Finalmente, completaron el estudio en el brazo de NLXG 327 pacientes y 189 en el de tratamiento con laxantes; descontinuando el tratamiento 207 (36,7 %) y 81 (28,8 %), respectivamente. Los resultados muestran que NLXG a 25 mg/día es seguro y bien tolerado sin interferir la analgesia por opioides.
DISCUSIÓN
Los PAMORA anteriormente descritos han mostrado eficacia en el tratamiento del EIO frente placebo y en distintas poblaciones de pacientes, y en el caso de NLXG frente a laxantes 62. MTNX se estudió y aprobó para pacientes con dolor oncológico u otras enfermedades en fases avanzadas 30,31,32,33,34, mientras que ALVP 41,42,43,44,45,46y NLXG 60,62lo han sido para pacientes no oncológicos, aunque en la ficha técnica de NLXG es aceptado su uso en pacientes oncológicos. Recientemente ha sido aprobado por la AEMPS la naldemedina como nuevo y prometedor PAMORA en la indicación de EIO (63), aunque no se haya comercializado todavía en España. Con relación a la eficacia de los distintos PAMORA, cada uno ha mostrado ser significativamente más efectivo frente placebo, pero no se disponen de estudios que los comparen entre sí. Una comparación indirecta tampoco es posible, ya que los parámetros de respuesta para los tres fármacos son diferentes: para MTNX la deposición espontánea está dentro de las primeras 4 h tras administración, mientras que para NLXG es la existencia de ≥ 3 deposiciones espontáneas a la semana, lo cual se adapta más a los criterios de EIO de ROMA IV 9,64. En el caso de ALVP el objetivo primario es la recuperación de la función GI tras cirugía, y los estudios para su desarrollo como tratamiento de EIO por vía oral, con iguales criterios de respuesta a los de los estudios de NLXG, fueron suspendidos por el riesgo cardiaco 48. En cuanto a los efectos secundarios, el perfil de seguridad es similar para los síntomas más prevalentes: dolor abdominal, diarreas, náuseas/vómitos, no tanto para el riesgo cardiaco con ALVP, ya comentado. Adicionalmente, deben tenerse en cuenta las potenciales interacciones de NLXG con los fármacos que comparten la vía del CP450 53, así como el uso de NLXG 56y MTNX 24,25en la insuficiencia renal (Tabla 3).
Tabla III. Aspectos relacionados con el uso de metilnaltrexona, alvimopan y naloxegol

EIO: estreñimiento inducido por opioides. FG: filtrado glomerular.
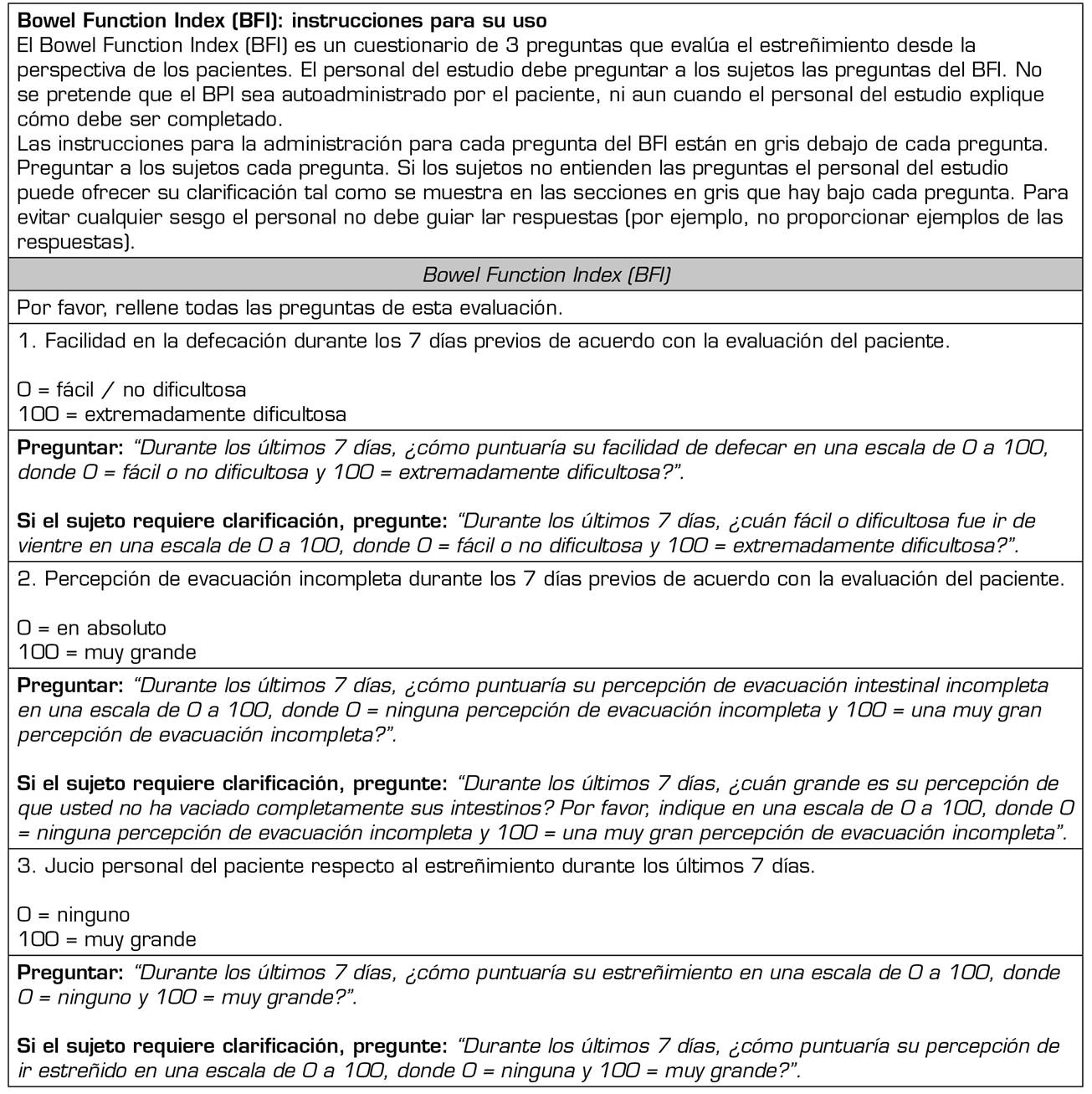
Solo una proporción de pacientes con EIO no respondieron a la administración de PAMORA en los diferentes estudios y precisaron laxantes de rescate; lo anterior sugiere que los mecanismos fisiopatológicos del estreñimiento, aun en presencia de opioides, son más complejos y que otras causas (como los fármacos con acción anticolinérgica 13o disfunción intestinal relacionada con el uso de quimioterápicos 65))deben ser tenidas en cuenta. Por lo tanto, aunque los PAMORA constituyen un abordaje etiopatogénico del EIO, ello no obvia el uso de laxantes y pone en cuestión si laxantes y PAMORA deben usarse de forma concomitante, o si bien los PAMORA se deben usar como rescate en pacientes que no responden a los laxantes 66. El uso de laxantes se ha propuesto como primera línea en el estreñimiento en pacientes con enfermedades avanzadas 6, limitando el uso de PAMORA en los casos refractarios; por otra parte se ha recomendado el uso de PAMORA en aquellos pacientes con un Bowel Functional Index (BFI) ≥ 30 67. El BFI ha sido validado para el diagnóstico del EIO 68,69(Tabla 4).
A parte del EIO, se ha hipotetizado sobre el uso de PAMORA en el prurito secundario al uso de opioides 70, o en el caso de colestasis 71; en este sentido se ha comunicado alivio del prurito en colestasis en pacientes con cáncer avanzado con MTNX 72, pero no en el prurito asociado a la administración de opioides espinales 73,74. Este puede parecer un aspecto marginal por su frecuencia, pero merece ser estudiado, especialmente el prurito asociado a colestasis en pacientes con cáncer avanzado.
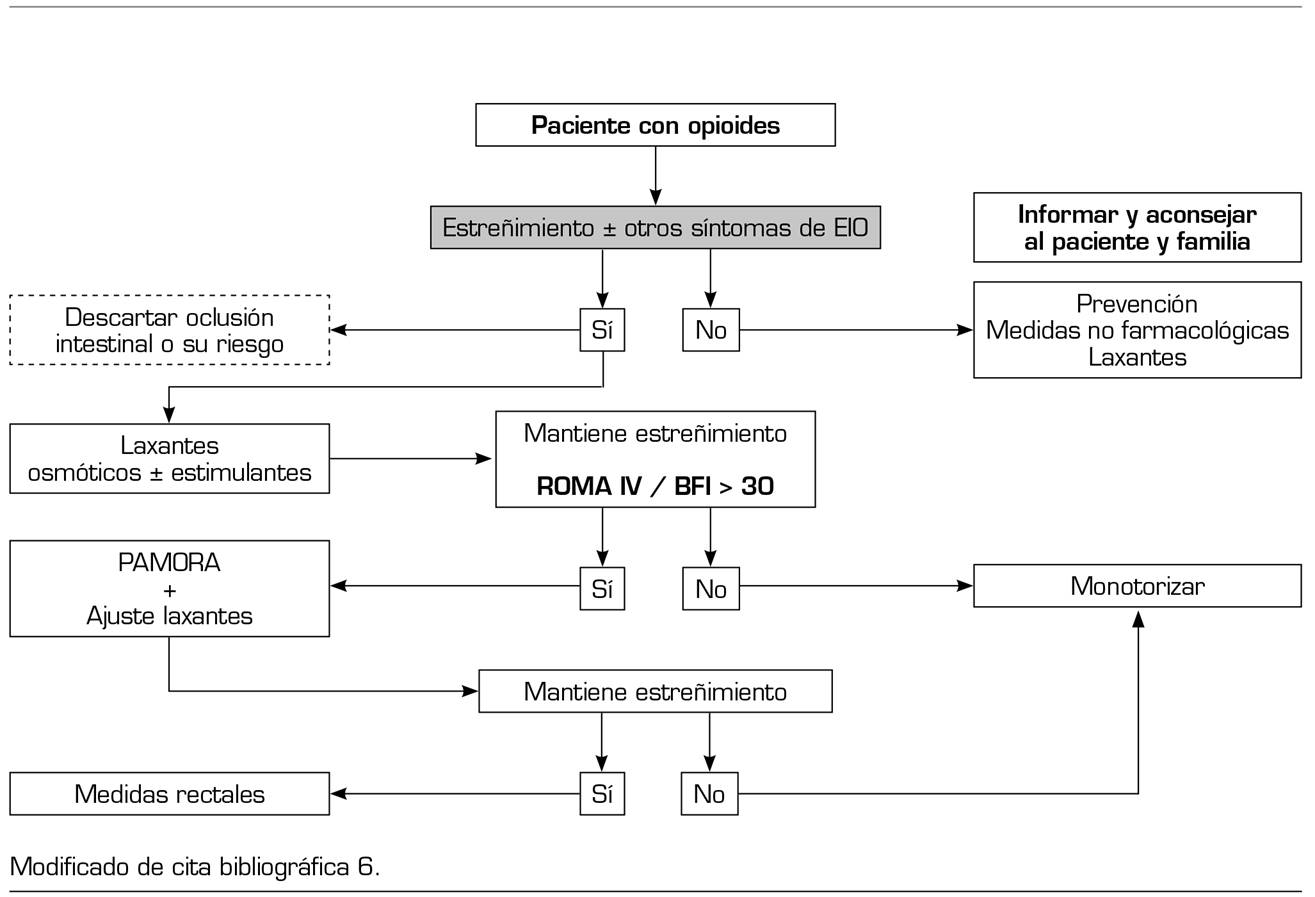
A tenor de la información disponible, parece adecuado considerar que una aproximación al paciente en tratamiento opioide (Figura 1) deba continuar considerándose el tratamiento laxante como primera opción, teniendo en cuenta que la combinación de laxantes osmóticos y estimulantes suele ser más efectiva que el laxante único 75. Si a pesar del tratamiento laxante el paciente cumple los criterios de EIO ROMA IV y el BMI es > 30, el uso de PAMORA debería ser el siguiente paso lógico. En cualquier caso, la comprobación de un limitado efecto de los laxantes no debería demorar la indicación de una PAMORA, aunque posiblemente sea más realista y acorde con la clínica iniciar PAMORA y laxantes de forma concomitante reduciendo las dosis de estos últimos y ajustando las dosis de laxantes según la respuesta del paciente. Todo ello siempre debería sustentarse en una adecuada información de unas expectativas realistas, tanto al propio paciente como a la familia.
Todos los PAMORA descritos anteriormente han sido aprobados por la European Medicines Agency (EMEA) y la US Food and Drug Administration (FDA) en el tratamiento del EIO; en el caso particular de ALVP solo para acelerar el tiempo de recuperación GI después de resección intestinal con anastomosis primaria. En España la MTNX se comercializó desde julio 2009 a septiembre 2012, y ALVP no se haya disponible. En la actualidad en España solo se halla disponible NLXG en comprimidos de 12,5 y 25 mg.
CONCLUSIONES
Parece perentorio un mejor diagnóstico del EIO en el contexto clínico, en que sin duda el uso de instrumentos validados como el BFI y criterios como ROMA IV pueden ser de gran ayuda. Todos los PAMORA disponibles han mostrado eficacia en el EIO, pero queda abierto cuál ha de ser su lugar en el esquema terapéutico del tratamiento del EIO, su uso ante EIO refractario a laxantes o su uso concomitante. Adicionalmente, el potencial beneficio de los PAMORA en el prurito refractario por colestasis merita ser evaluado. Todo ello son aspectos claves a abordar en futuros estudios.











 texto en
texto en