INTRODUCCIÓN
La infección de prótesis aórtica (IPA) tras cirugía abierta de la aorta abdominal es una complicación infrecuente pero grave (1,2) con una mortalidad perioperatoria global descrita entre 4 y 40 % (2-9). Su incidencia ha sido reportada entre 0,7 % y 3 % (3,11,12) con manifestaciones hasta 10 años después de la cirugía original (2). Son escasas las series reportadas en la literatura y no existen series comparativas prospectivas, por lo que las revisiones y guías generan recomendaciones con bajo nivel de evidencia (2,9-12).
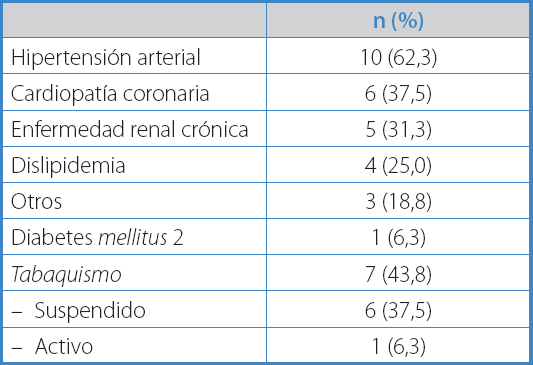
Además de los factores de riesgo comunes a otras infecciones, como diabetes mellitus e inmunosupresión, los factores de riesgo propios para desarrollar IPA son principalmente cirugía gastrointestinal concomitante, cirugía de emergencia y anastomosis distal a nivel inguinal, entre otros (3).
El tratamiento quirúrgico no está exento de complicaciones y mortalidad (3,7,8); la historia natural de esta condición no tratada es hacia la muerte (2,13). Tradicionalmente, el tratamiento estándar de las infecciones protésicas ha sido la revascularización extraanatómica de las extremidades inferiores a través de sitios alejados de la infección, asociada al retiro del material protésico infectado en un segundo campo y/o tiempo quirúrgico. Actualmente existen alternativas para reparación in situ aparentemente seguras utilizando material autólogo, biológico o protésico con antibióticos o antisépticos, con diversas ventajas y desventajas. Estas son consideradas como una opción preferente en centros relevantes actualmente (3,7-15). Los estudios de tratamiento in situ tienden a reportar una mortalidad menor (4-33 %) que en los estudios de resección y revascularización extraanatómica (23-40 %), aunque estas series son más antiguas que las primeras (2-14).
A nivel nacional, la experiencia publicada se limita a un caso clínico (15,16).
En el presente estudio buscamos reportar nuestra experiencia con tratamiento mediante revascularización extraanatómica y resección de la prótesis infectada.
MATERIAL Y MÉTODOS
Estudio retrospectivo analítico que incluye a todos los pacientes con IPA resueltos mediante revascularización extraanatómica y exéresis de la prótesis tratados entre enero del año 1977 y abril del año 2020.
En todos los pacientes se efectuó una derivación extraanatómica para revascularizar las extremidades inferiores.
La resección del material protésico infectado se efectuó en un mismo acto quirúrgico en pacientes que debutaron con hemorragia digestiva masiva o sepsis grave con compromiso hemodinámico, en casos extremos antecediendo a la revascularización. Siempre ambos procedimientos se realizaron en campos quirúrgicos aparte.
Aquellos que presentaron estabilidad hemodinámica al ingreso fueron solamente revascularizados en un primer tiempo, con retiro de la prótesis y eventual reparación duodenal diferida a un segundo tiempo.
Se excluyeron pacientes con otros tratamientos: manejo médico exclusivo, resección de prótesis sin derivación extraanatómica, reparaciones in situ o manejo endovascular.
Se consideraron variables demográficas y comorbilidades, indicación, condición de urgencia y tipo de reconstrucción aórtica original, cuadro clínico al momento del diagnóstico de la infección, agente microbiano aislado, tiempo transcurrido desde la cirugía original, localización de la infección y los métodos diagnósticos utilizados.
Se evaluó como resultado primario la mortalidad perioperatoria (ocurrida dentro de los primeros 30 días del posoperatorio o intrahospitalaria). Resultados secundarios fueron amputación mayor, reoperaciones, otras complicaciones posoperatorias, permeabilidad de la reconstrucción y sobrevida a largo plazo.
Para la recolección de datos se realizó una revisión de registros clínicos, seguimiento mediante contacto directo con el paciente o su médico tratante y obtención de certificados de defunción de la Oficina del Registro Civil de Chile (www.registrocivil.cl).
El análisis estadístico se realizó con el programa 16 (StataCorp, College Station, TX) mediante estadística descriptiva. Las variables cuantitativas continuas se expresan en promedio con desviación estándar. Para asociaciones dicotómicas se utilizó chi2. La sobrevida se representa con curva de sobrevida de Kaplan-Meier. Se consideró valor de p significativo menor o igual a 0,05.
RESULTADOS
Se identificaron 16 casos en el periodo estudiado, todos masculinos, cuya edad promedio fue de 69,2 años (rango: 55-82).
Catorce pacientes (87,5 %) fueron originalmente intervenidos por aneurisma aórtico abdominal (AAA), 4 de ellos por ruptura (28,6 %). Los 2 pacientes restantes (12,5 %) fueron operados por enfermedad oclusiva aortoiliaca. Las comorbilidades se expresan en la tabla I.
La cirugía inicial fue realizada en nuestra institución en 9 pacientes. De estos, 1 paciente (6,3 %) fue intervenido por enfermedad oclusiva del eje aortoiliaco, 5 (31,3 %) por AAA electivo y 3 (18,8 %) por AAA roto.
Durante el periodo de estudio se realizaron 1168 cirugías convencionales por aneurisma aórtico, lo que representaría una incidencia de al menos 0,8 %, sin poder descartarse que algún paciente haya sido tratado por esta complicación en otra institución. La incidencia en AAA electivo fue de 0,5 % (5/1040) y en AAA roto fue 2,4 % (3/128). Esta diferencia es estadísticamente significativa (p < 0,05).
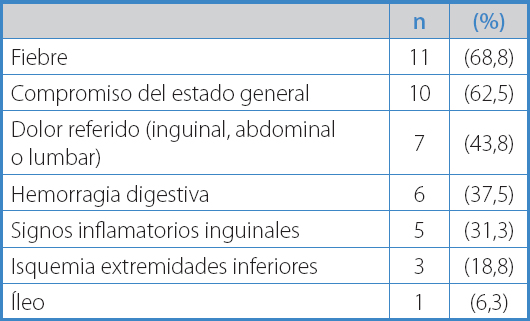
Las manifestaciones clínicas se exponen en la tabla II. Los síntomas más frecuentes fueron fiebre y malestar general. Al momento del diagnóstico 12 pacientes (75 %) presentaron algún tipo de compromiso entérico: 6 pacientes (37,5 %) presentaron fístulas aortoentéricas completas que se manifestaron con hemorragia digestiva secundaria, mientras que otros 6 pacientes (37,5 %) presentaron erosiones enteroprotésicas (Fig. 1). En todos estos pacientes el compromiso fue duodenal, mayoritariamente en tercera porción (91,6 %).
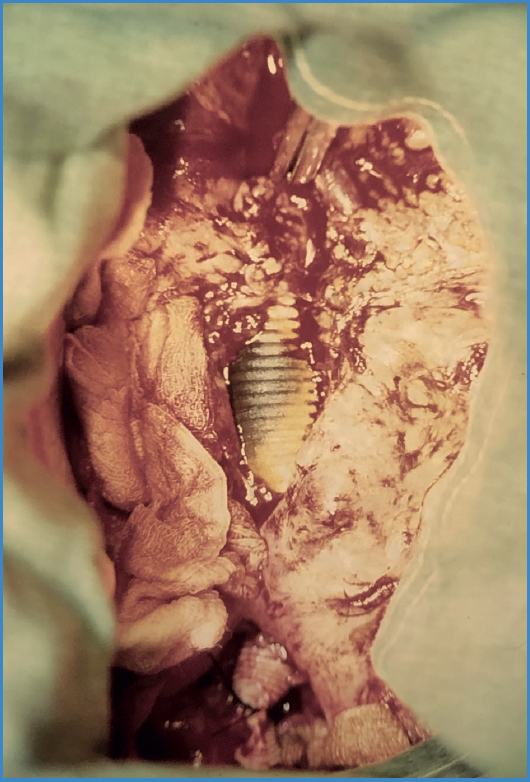
Figura 1. Foto intraoperatoria de una erosión enteroprotésica extensa, que originó la infección. Se aprecia la prótesis expuesta con tinte bilioso.
La mediana desde la cirugía aórtica hasta la infección fue de 14,5 meses (1-84); 4 pacientes presentaron infección antes de 3 meses. Se analizó la aparición precoz de infección (menor a 12 meses) en relación a la naturaleza del procedimiento original, sin presentarse diferencias significativas.
La reconstrucción original fue una prótesis aortoaórtica en 5 casos (31,3 %), prótesis bifurcada aortobiiliaca en 5 casos (31,3 %) y en 6 pacientes (37,5 %) al menos una de las anastomosis distales se localizaba en la ingle. Trece pacientes tenían infección retroperitoneal, mientras que en 3 la infección estaba confinada a la ingle. En 7 pacientes se logró aislar el agente microbiológico patógeno (Tabla III).
Tabla III. Resumen de los casos
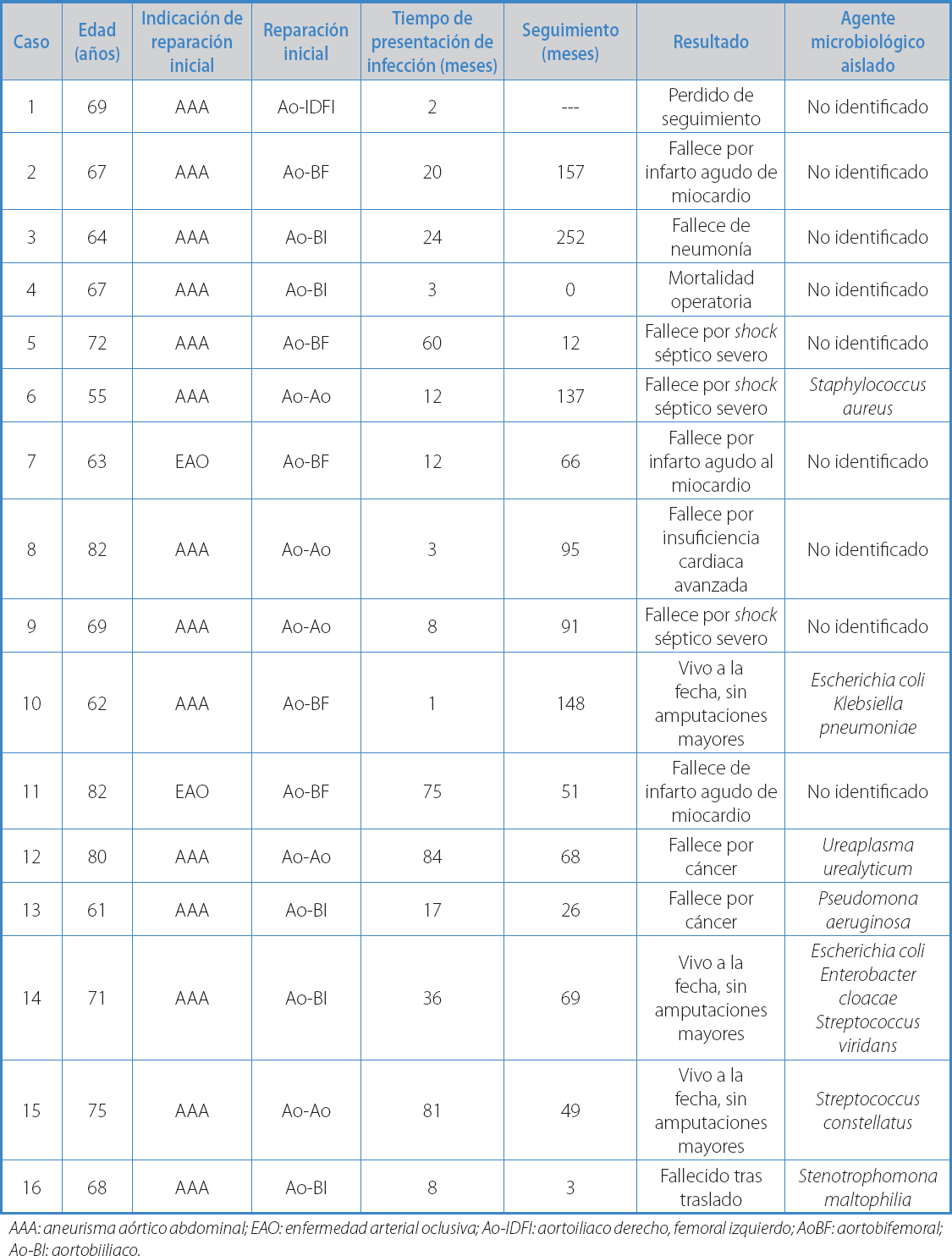
AAA: aneurisma aórtico abdominal; EAO: enfermedad arterial oclusiva; Ao-IDFI: aortoiliaco derecho, femoral izquierdo; AoBF: aortobifemoral; Ao-BI: aortobiiliaco.
El examen imagenológico utilizado con mayor frecuencia fue la tomografía computarizada con fase angiográfica (angioTC) (Fig. 2), obtenida en 14 pacientes, siendo suficiente para el diagnóstico en 11; en 2 pacientes el estudio se complementó con tomografía computarizada por emisión de positrones (PET-CT) (Fig. 2). En 1 paciente el estudio imagenológico no fue categórico y se intervino en base a una alta sospecha clínica. En 2 pacientes no se realizó tomografía: en un paciente tratado simultáneamente de revascularización miocárdica convencional y reparación de un AAA de gran tamaño, se realizó diagnóstico ecográfico en el contexto de un cuadro febril a los 3 meses, y se encontró una gran colección retroperitoneal, mientras que en otro paciente el diagnóstico fue mediante una endoscopía digestiva alta, en el contexto de una hemorragia digestiva alta masiva que mostró una lesión sangrante en la pared posterior de la tercera porción duodenal.
En 6 pacientes se realizó bypass extraanatómico y exéresis de prótesis en un mismo acto quirúrgico, de los cuales en 3 casos la resección se realizó antes de la revascularización por inestabilidad hemodinámica.
En 10 pacientes se realizó un primer tiempo quirúrgico consistente en la construcción del bypass extraanatómico para retirar la prótesis en forma diferida en un segundo tiempo quirúrgico separado del original por una mediana de 3 días (rango: 1-4); uno de estos pacientes presentó trombosis de la reconstrucción extraanatómica en el intervalo entre ambas cirugías. En 2 de los pacientes con resección diferida se desplegó en el primer procedimiento un dispositivo Amplatzer vascular plug II (Abbott, Abbott Park, IL, USA) en su segmento aórtico infrarrenal, para evitar flujo competitivo con la reconstrucción extraanatómica y eventual trombosis. Ninguno de estos 2 pacientes presentó oclusión de su puente axilobifemoral en el intervalo entre cirugías.
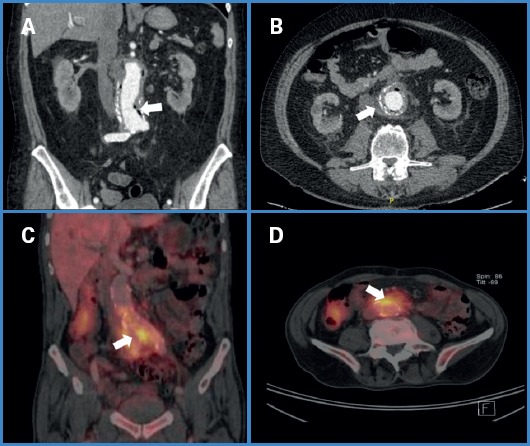
Figura 2. Imágenes diagnósticas en IPA. A. Burbujas de gas periprotésico. B. Colección y gas periprotésico. Además se aprecian cambios inflamatorios retroperitoneales. C y D. Realce periprotésico de actividad metabólica en PET-CT, sugerente de infección.
En 13 pacientes la revascularización fue axilobifemoral (Fig. 3); en 1 paciente se realizó derivación axilopoplítea bilateral, en otro una derivación axilopoplítea izquierda y en 1 paciente un puente axilofemoral unilateral. Tres pacientes fueron sometidos a resección parcial de una rama iliaca por vía retroperitoneal e inguinal, resultando el examen microbiológico del nivel de sección proximal negativo, y se continuó con revascularización axilobifemoral, mientras que en 13 pacientes se realizó resección completa de la prótesis abdominal y ligadura del muñón aórtico; uno de estos casos requirió adicionalmente de la confección de un puente hepatorrenal derecho con vena safena para permitir un margen adecuado para el cierre del muñón aórtico.
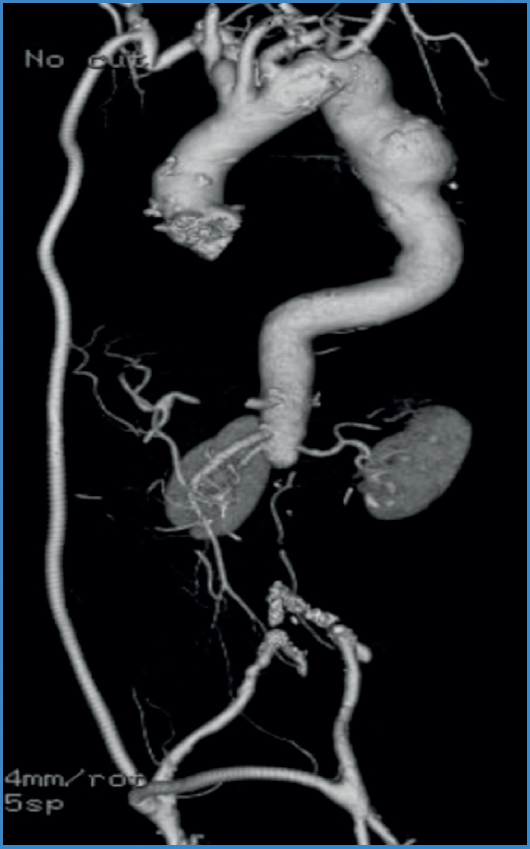
Figura 3. Reconstrucción tomográfica de uno de nuestros pacientes en el seguimiento a largo plazo. Se aprecia bypass axilobifemoral permeable, con flujo retrógrado hacia ambas arterias iliacas.
Uno de los pacientes presentaba signos de isquemia irreversible extensa en su extremidad inferior derecha al momento del diagnóstico. Se realizó revascularización para conseguir nivel de amputación supracondíleo, la cual se efectúa en forma diferida 7 días después.
Seis pacientes (37,5 %) presentaron complicaciones mayores, 3 de los cuales (18,8 %) debieron ser reintervenidos: un caso de hemorragia digestiva masiva por una arteria duodenal sangrante requirió reintervención a las 24 horas; un caso de necrosis de la herida operatoria que fue necesario revisar a los 7 días; la trombosis del bypass axilobifemoral ya mencionada, diagnosticada al momento del retiro de la prótesis infectada 48 horas después de su construcción y tratada mediante trombectomía, permaneciendo permeable posteriormente; 2 pacientes presentaron distrés respiratorio del adulto requiriendo ventilación mecánica prolongada, uno de los cuales fue traqueostomizado, y 1 paciente portador de insuficiencia renal etapa 3 (creatinina 1,8 mg/dL) presentó insuficiencia renal que requirió hemodiálisis permanente.
La mortalidad hospitalaria de la serie fue de 2/16 casos (12,5 %): 1 paciente falleció a las 16 horas de operado, ingresó por sepsis grave de 3 meses de evolución secundario a un gran absceso retroperitoneal. El segundo paciente debutó con una fístula aortoentérica con hemorragia digestiva masiva, y falleció por fallo multiorgánico a los 3 meses posoperado.
Se realizó seguimiento por un promedio de 81,6 meses (rango 0-252), 9 pacientes (56,3 %) completaron seguimiento por más de 5 años. Un paciente es perdido del seguimiento tras el primer control. La sobrevida actuarial fue de 80,6 % (ES 9,85) a un año, 66,8 % (ES 12,8) a 5 años y 34,3 % (ES 13,9) a 10 años. Las causas de mortalidad alejada se detallan en la tabla III. Ningún paciente ha presentado ruptura conocida del muñón aórtico. Tres pacientes fallecieron por causas sépticas no especificadas, a los 12, 91 y 137 meses pos-alta respectivamente.
En el seguimiento alejado la permeabilidad primaria y secundaria a 1 año fue de 93,3 % y 100 % (ES 0,07), mientras que a 5 años fueron 77,8 % y 100 % (ES 0,12), respectivamente. Además del paciente con la oclusión entre procedimientos, 1 paciente presentó isquemia aguda a los 15 meses por trombosis de una revascularización axilopoplítea construida originalmente por infección inguinal activa. Se realizó trombectomía y se convierte a revascularización axilobifemoral que se encuentra permeable a 13 años. No hubo pérdida de extremidades.
DISCUSIÓN
La IPA es una entidad poco frecuente y, sin tratamiento específico, es letal.
Desde el punto de vista patogénico, la matriz extracelular que rodea al material protésico (biofilm), cubre a los microorganismos y los hace poco accesibles a los antibióticos, lo cual provoca una resistencia hasta 600 veces mayor (12). Esto explica el fracaso terapéutico con antibioticoterapia exclusiva.
La sospecha clínica debe estar siempre presente en pacientes con cirugía convencional de aorta que consultan por hemorragia digestiva masiva o cursan con un cuadro febril sostenido sin causa evidente. Ante esto, el angioTAC es la imagen de elección para establecer el diagnóstico (Fig. 2). Los hallazgos tomográficos sugerentes de IPA son cambios inflamatorios periprotésicos, gas periaórtico, colecciones retroperitoneales o comunicaciones enteroprotésicas (18). En caso de duda diagnóstica, la PET-TC puede ser de utilidad, donde se evidencia un realce en la actividad metabólica en la zona (Fig. 2). Este examen tiene una sensibilidad cercana al 100 %, y una especificidad de 70-95 % (18).
En una revisión de la literatura reciente (3) se describe una mortalidad global a 30 días de 13,5 % para todos los tratamientos, similar a lo expuesto en nuestra serie. Sin embargo, al evaluar por tipo de reparación, la mortalidad a 30 días aumenta a 26,7 % en el grupo de reparación extraanatómica, más elevada que la reportada en esta serie. Sin embargo, las series que incluyen revascularización extraanatómica estudiadas en dicha revisión son en promedio 14 años más antiguas, lo que limita las conclusiones que se pueden obtener.
El manejo clásico, con bypass extraanatómico y resección del material protésico infectado, continúa siendo el estándar en nuestro centro por los buenos resultados obtenidos (Fig. 3). El riesgo de oclusión de la revascularización extraanatómica por competencia de flujo entre la reconstrucción extraanatómica y la aorta nativa en el tiempo de espera para la resección de la prótesis aórtica es una preocupación válida. Una estrategia exitosa utilizada en nuestro centro recientemente después de haber tenido esa complicación, ha sido ocluir el flujo aórtico infrarrenal de forma endovascular mediante un oclusor. Además, es razonable plantear que al excluir el flujo hacia distal, disminuye el riesgo de descarga séptica en la cirugía de exéresis de prótesis. Esta experiencia es muy acotada como para hacer recomendaciones y no tenemos información acerca de su descripción previa en la literatura, sin embargo parece razonable y prudente su uso.
Si bien no hemos tenido reingresos por reinfección alejada, en nuestro seguimiento hay 3 pacientes que fallecieron de causas sépticas no especificadas en otros centros. Dos de estos pacientes tenían infecciones retroperitoneales, factor de riesgo para presentar reinfección tardía (2) .
El reemplazo in situ de la prótesis infectada, sea por aloinjertos, vena femoral (Neoaortoiliac System, NAIS), prótesis embebidas en rifampicina o prótesis cubiertas con plata, puede considerarse eventualmente como una primera opción de tratamiento (1,9,12,17,18). Sin embargo, en nuestra experiencia el manejo con exéresis de la prótesis infectada y derivación extraanatómica ofrece resultados equivalentes en mortalidad y permeabilidad a corto, mediano y largo plazo.
CONCLUSIONES
La infección de prótesis aórtica convencional es una complicación grave, cuya sospecha oportuna es fundamental. Es indispensable considerar esta posibilidad diagnóstica ante un cuadro febril o hemorragia digestiva alta en todo paciente con antecedente de cirugía aórtica abdominal. El apoyo imagenológico es fundamental para confirmar el diagnóstico.
A pesar que estudios recientes sugieren mejores resultados con resección del material protésico infectado y revascularización in situ, consideramos que las derivaciones extraanatómicas son una alternativa segura y duradera para tratar esta complicación.