My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos Españoles de Urología (Ed. impresa)
Print version ISSN 0004-0614
Arch. Esp. Urol. vol.62 n.3 Apr. 2009
Presentación clínica del carcinoma de células renales en el trasplante renal
Clinical presentation of renal cell carcinoma in renal transplant
Raquel González-López, Gonzalo Bueno-Serrano, Javier Mayor-De Castro, José Julián Vázquez-Escuderos, Víctor Díez-Nicolás, Roberto Marcén Letosa, Julio Pascual Santos y Francisco Javier Burgos Revilla.
Servicio de Urología y Servicio de Nefrología. Universidad de Alcalá de Henares. Hospital Ramón y Cajal. Madrid. España.
Dirección para correspondencia
RESUMEN
Objetivo: Analizar la presentación clínica y la actitud terapéutica ante la afectación del injerto por un Carcinoma de células renales (CCR).
Métodos: Análisis de los casos descritos en nuestro Centro y revisión de la literatura actual.
Resultados: El CCR presenta una incidencia superior en los pacientes trasplantados, afectando en menos del 10% al injerto. La ausencia de inervación hace que habitualmente sea un hallazgo casual durante el seguimiento, aunque su presentación puede llegar a ser como un abdomen agudo en caso de rotura del injerto.
El tratamiento convencional es la trasplantectomía, realizándose en los últimos años la nefrectomía parcial con buenos resultados. La modificación de la inmunosupresión es una medida habitual tras el tratamiento.
Conclusiones: La incidencia de CCR post-TR en nuestra serie es del 0,7%, originándose el 22% de los mismos en el injerto. La presentación clínica del CCR primitivo del injerto es variable. La nefrectomía parcial es técnicamente posible y oncológicamente segura en el tratamiento del CCR del injerto renal.
Palabras clave: Carcinoma de células renales. Trasplante renal. Inmunosupresión. Presentación clínica. Trasplantectomía. Nefrectomía parcial.
SUMMARY
Objectives: To analyze the clinical presentation and therapeutic response of renal cell carcinoma (RCC) of the renal graft.
Methods: Analysis of the cases described in our centre and review of current literature.
Results: RCC has a higher incidence in transplant patients, affecting the graft in less than 10% of the cases. Detection is usually a casual event during follow-up due to the absence of innervation, although its presentation may be as an acute abdomen in case of breakage of the graft. Conventional treatment consists of transplant nephrectomy, but partial nephrectomy has been performed in recent years with good results. The modification of immunosuppression is a routine measure after treatment.
Conclusions: The incidence of RCC after renal transplants in our series is 0.7%, of which 22% are originated in the graft. The clinical presentation of the primitive RCC of the graft is variable. Partial nephrectomy is technically feasible and oncologically safe in the treatment of RCC of the renal graft.
Key words: Renal cell carcinoma. Kidney transplantation. Immunosuppression. Clinical presentation. Transplantectomy. Partial nephrectomy.
Introducción
La aparición de un Carcinoma de Células Renales (CCR) en el injerto renal es extremadamente rara. La incidencia de CCR en pacientes trasplantados es superior a la que se produce en la población general (4,8% frente a 2,3%). De estos tumores, menos del 10% afectan al injerto y su presentación clínica puede ser extremadamente variada, siendo lo habitual el hallazgo incidental durante el seguimiento. La inmunosupresión (IS) es uno de los factores más importantes asociados a la aparición de tumores en estos pacientes. De hecho, la modificación de la misma es la tendencia actual tras el diagnóstico y tratamiento.
Objetivo
Analizar la presentación clínica y la actitud terapéutica ante la afectación del injerto por un CCR, teniendo en cuenta el grado de afectación, la presentación y el pronóstico de cada paciente. Analizar la situación actual del CCR en el trasplante renal.
Material y métodos
Un total de 1250 trasplantes renales (TR) se llevaron a cabo desde 1978 hasta 2008. Tan sólo 9 receptores han desarrollado un CCR, localizándose 7 de ellos en el riñón nativo y 2 en el injerto. Uno de los CCR del riñón nativo presentó afectación metastásica sincrónica y múltiple del injerto. Se analizó la presentación clínica, la actitud terapéutica y la evolución de los 3 pacientes con afectación del injerto por CCR. Tras revisión de la bibliografía actual, se comentan los aspectos más importantes del CCR en relación con el TR en la actualidad.
Resultados
Caso 1
Varón de 67 años con antecedentes personales de hipertensión arterial, dislipemia, miocardiopatía hipertrófica obstructiva y síndrome de apnea obstructiva del sueño. Insuficiencia renal crónica por nefroangioesclerosis, siendo trasplantado en el año 1998 en fosa ilíaca derecha, sin incidencias. El paciente presenta un injerto normofuncionante (creatinina sérica: 2,4 mg/dL basal) y sigue tratamiento con Prednisona y Ciclosporina A (CsA). En el año 2006, se detecta lesión en labio inferior que es extirpada, con el resultado anatomopatológico de carcinoma epidermoide microinfiltrante. Se realiza modificación de la inmunosupresión, sustituyéndose la CsA por Tacrolimus.
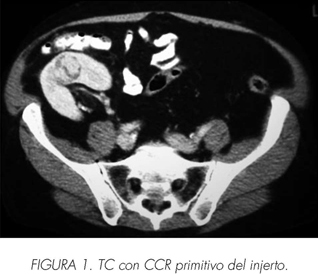
En mayo de 2007 se detecta en ecografía de rutina una masa sólida en cortical anterior, en zona media superior, de aproximadamente 3 cm de diámetro mayor. El paciente se encuentra asintomático y con función del injerto conservada. Se realiza TC de confirmación, donde se aprecia lesión focal y sólida en zona media superior de la cara anterior del injerto (Figura 1). Tras punción-aspiración que confirma la lesión como carcinoma de células renales, se decide realización de cirugía conservadora de nefronas ante la buena funcionalidad del injerto y las características favorables de la lesión. Bajo isquemia fría y con control ecográfico intraoperatorio, se realiza nefrectomía parcial con abordaje intracapsular, enviándose lecho tumoral para análisis patológico intraoperatorio que confirma la negatividad de los márgenes quirúrgicos. El resultado definitivo del análisis confirmó un carcinoma de células renales estadio pT1 G1, extirpado en su totalidad (Figura 2).
La evolución del paciente es satisfactoria, presentando una discreta elevación de la creatinina hasta 4,2 mg/dl con recuperación de ésta a los valores basales al quinto día de postoperatorio. Actualmente, tras un seguimiento de 14 meses, el paciente se encuentra asintomático y no existen datos de recidiva tumoral ni metástasis a distancia. La función del injerto se encuentra estable con cifras de creatinina de 2,3 mg/dl. Se mantuvo la inmunosupresión previa con Prednisona y se añadió Sirolimus.
Caso 2 (1)
Varón de 51 años trasplantado en 1986 por glomerulonefritis mesangiocapilar tipo II, con disfunción crónica del injerto por recidiva de su enfermedad renal sobre el mismo, que obliga a reanudar la hemodiálisis en 1996. Se había realizado un descenso de su inmunosupresión con CsA y la adición de Azathioprina, sin resultados. Presenta 15 días después de iniciar la hemodiálisis un cuadro de dolor agudo sobre el injerto con inestabilidad hemodinámica progresiva y refractaria al tratamiento médico.
En la ecografía urgente se detecta hematoma subcapsular e intraparenquimatoso en el injerto, que se confirma mediante TC (Figura 3), realizándose trasplantectomía pocas horas después. Durante la intervención se aprecia lesión sólida en polo superior del injerto, de unos 4 cm de diámetro, con evidentes signos de ruptura espontánea y sangrado (Figura 4). También se advierten otras múltiples lesiones sólidas y quísticas de pequeño tamaño en la superficie del injerto. El análisis anatomopatológico reveló un CCR multicéntrico, en el seno de una enfermedad quística renal adquirida del injerto. El paciente reanudó la hemodiálisis y se encuentra libre de enfermedad y asintomático tras 12 años de seguimiento.
Caso 3 (2)
Varón de 62 años de edad, trasplantado en 1989 por nefropatía IgA y en tratamiento inmunosupresor con CsA y Prednisona. Seis años después del trasplante presenta cuadro de dolor lumbar derecho monosintomático, detectándose en ecografía riñón derecho nativo con múltiples quistes (había desarrollado EQRA 2 años después del inicio de la hemodiálisis) y masa renal sólida de 7 cm en polo inferior. En la TC se confirmó la lesión y se detectaron múltiples lesiones sólidas en el injerto renal, además de otras lesiones metastásicas en hígado, implantes subcutáneos y adenopatías retroperitoneales (Figura 5). La punción aspiración con aguja fina confirmó la presencia de CCR en todas las lesiones. Se inició tratamiento conservador con analgesia y reducción de la inmunosupresión, falleciendo el paciente tres semanas después del diagnóstico.
Discusión
El carcinoma de células renales (CCR) es el tumor maligno más frecuente del riñón. Su incidencia en los pacientes trasplantados es discretamente superior a la de la población general (4,8% frente a 2,3%) (3), sin que se haya establecido por el momento la causa de este incremento, aunque se cree que pueda estar en relación con la inmunosupresión que reciben los pacientes trasplantados. La mayor parte de estos tumores se localizan en los riñones nativos, encontrándose menos del 10% de ellos afectando al injerto (4). En nuestra experiencia, la incidencia de CCR es del 0,66%, estando afectado el injerto en el 22%. El intervalo medio de aparición postrasplante en la literatura está en 3,5 años (5), aunque se han descrito casos en injerto hasta 26 años después del trasplante (6). Se estima que el crecimiento de estos tumores está entre 0,5 y 1cm al año (7), igual que en los tumores que aparecen en los riñones nativos y en los pacientes no trasplantados. Habitualmente presentan una agresividad menor en los pacientes trasplantados, independientemente de su localización (8), excepto los CCR de estirpe papilar, en los que se ha descrito un aumento en su agresividad en dichos pacientes. Los tumores de estirpe papilar, además, son más frecuentes en la población trasplantada que en la población general, y se suelen asociar a la enfermedad quística renal adquirida de los riñones nativos (7,9).
La ausencia de inervación del injerto hace que la mayoría de los pacientes estén asintomáticos al diagnóstico, que suele ser incidental en la mayoría de los casos, realizándose durante el seguimiento periódico al que son sometidos los pacientes trasplantados. El seguimiento habitual, además de un estudio analítico de la función renal, suele comprender una prueba de imagen, generalmente una ecografía anual (9-12). Esta técnica permite realizar el diagnóstico inicial, confirmándose las imágenes posteriormente mediante TC, que permite el estadiaje simultáneo. Algunos autores se inclinan por la realización de RMN en lugar de TC, ya que proporciona una mejor visualización de los tejidos y de la extensión locorregional sin efecto nefrotóxico del contraste, prefiriéndola también en el seguimiento (10, 13-17). La disponibilidad de la misma y su menor sensibilidad a la hora de detectar masas inferiores a 3 cm (60%) (10) hace más habitual la realización de la TC.
Algunos autores abogan por la realización de punción-aspiración con aguja fina (PAAF) para confirmar la naturaleza de la lesión (6, 16-19) como en el primer caso de la presente serie, mientras que otros no la llevan a cabo al considerarla peligrosa para el injerto, por los riesgos de sangrado y teórica siembra tumoral, circunstancias que no se han producido nunca en nuestro centro. El elevado número de falsos negativos que se producen también les hace considerarla una técnica poco rentable en estos casos (4,10), optando por la confirmación anatomo-patológica de la pieza. En nuestra opinión, esto produce el sobretratamiento de lesiones benignas que podrían ser diagnosticadas mediante PAAF. El análisis del ADN de la pieza quirúrgica puede indicarnos el origen del tumor (10,20-21), ya que aunque lo habitual es que se trate de un tumor primario del injerto, también se puede tratar de una metástasis de un CCR situado en el riñón nativo. También es posible determinar el origen mediante análisis con hibridación in situ fluorescente del material de biopsia (22).
El aumento de la incidencia de tumores en los pacientes trasplantados se ha relacionado con la terapia inmunosupresora que reciben estos pacientes, entre otros factores. Se ha demostrado el desarrollo de tumores tras el inicio de la inmunosupresión postrasplante, con una incidencia elevada de tumores cutáneos (28-40%) y linfomas (11-27%) (5,7,23). Kunikata et al. (12) realizan un estudio en la población japonesa analizando la incidencia de tumores en pacientes trasplantados y en diálisis, detectando la existencia de una incidencia aumentada de carcinoma gástrico y CCR (tumores más frecuentes en este grupo étnico). También encuentran asociación entre la administración de CsA y el desarrollo de CCR en riñones nativos en varones trasplantados.
Algunos autores han descrito un aumento en la agresividad de los tumores y una mayor posibilidad de diseminación en los pacientes trasplantados debido a la inmunosupresión (10), por lo que muchos optan por la modificación de las pautas inmunosupresoras. El ajuste de la inmunosupresión se realiza según la gravedad de los tumores, siendo habitual su modificación en los carcinomas cutáneos (7).
Se recomienda la suspensión de la CsA y habitualmente su sustitución por Sirolimus, que ha demostrado ser un potente inhibidor del crecimiento tumoral y actuar como un agente protector frente a la progresión del CCR (21,24). No debemos olvidar que el CCR es un tumor que se caracteriza por ser un inductor de la respuesta inmune (21), por lo que la acción de los agentes inmunosupresores sobre él es indudable. Aunque habitualmente el trasplante es una contraindicación para la administración de inmunoterapia, existen casos descritos de su aplicación sobre infección por VHC en pacientes trasplantados renales con buenos resultados y sin aparición de rechazo (7,25). La investigación en este campo aún debe progresar.
A pesar de esto, otros autores defienden el mantenimiento de los esquemas de inmunosupresión sin modificaciones, ya que así se disminuyen las posibilidades de rechazo y se evitan las complicaciones derivadas del uso de determinados inmunosupresores como el Sirolimus (11,21,26). Otros autores mantienen el tratamiento al no haber demostrado asociación entre inmunosupresión y tumores. Así, en un estudio realizado sobre 373 pacientes trasplantados, Moudoni et al. (7) no encuentran asociación de la aparición de carcinoma de novo en riñones nativos con la edad del receptor, el tiempo de permanencia en hemodiálisis, el tiempo post-TR o la pauta inmunosupresora. De hecho, estos autores no modifican la inmunosupresión de los mismos.
En este momento no existe consenso sobre la actitud a tomar, aunque la tendencia actual es a la modificación del tratamiento inmunosupresor, con suspensión o minimización del anticalcineurínico e inclusión de un inhibidor de la mTOR (Sirolimus o Everolimus) en la pauta inmunosupresora. Los 3 pacientes incluidos en esta serie se encontraban bajo tratamiento con CsA, suspendiéndose ésta en los dos últimos y sustituyéndose por Sirolimus en el primero.
Conclusiones
La incidencia de CCR post-TR en nuestra serie es del 0,7%, originándose el 22% de los mismos en el injerto. Ocasionalmente éste puede estar afectado por metástasis de un CCR primitivo del riñón nativo. La presentación clínica del CCR primitivo del injerto es variable: desde incidental en un paciente asintomático hasta un abdomen agudo por rotura del injerto. La nefrectomía parcial es técnicamente posible y oncológicamente segura en el tratamiento del CCR del injerto renal.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
1. Fernández-Juárez G, Pascual J, Burgos FJ, Mampaso F, Cano T, Liaño F, et al. Late rupture of the renal graft: not always graft rejection. Nephron Dial Transplant. 1998; 13: 496-498. [ Links ]
2. Gómez García I, FJ Burgos Revilla, E Sanz Mayayo, S Conde Someso, C Quicios Dorado, J Pascual, et al. Metástasis en injerto renal de adeno-carcinoma renal primario. Actas Urol Esp. 2004; 28(6):458-461. [ Links ]
**3. Penn I. Occurrence of cancers in immunosuppressed organ transplant recipients. Clin Transplant 1998; 147-158. [ Links ]
4. Penn I. Primary kidney tumors before and after transplantation. Transplantation 1995; 59: 480-485. [ Links ]
**5. Penn I. Cancers in renal transplant recipients. Adv Ren Replace Ther. 2000; 7: 147-156. [ Links ]
**6. Charboneau JW, O'Loughlin MT, Milliner DS, Engen DE. Sonographically guided percutaneous radio frequency ablation of a renal cell carcinoma in a transplanted kidney. J Ultrasound Med. 2002; 21: 1299-1302. [ Links ]
*7. Moudoni SM, Lakmichi A, Tligui M, Rafii A, Tchala K, Haab F, et al. Renal cell carcinoma of native kidney in renal transplant recipients. BJU Int. 2006; 98: 298-302. [ Links ]
8. Ghasemian SR, Guleria AS, Light JA, Sasaki TM. Multicentric renal cell carcinoma in a transplanted kidney. Transplantation. 1997; 64(8): 1205-1206. [ Links ]
**9. Burgos FJ, Marcén Letosa R, Pascual Santos J, Gómez García I, Sanz Mayayo E, Gómez Dosantos V, et al. Carcinoma renal y trasplante renal. Urol Integr Invest 2005; 10(1): 46-54. [ Links ]
10. Moudouni SM, Tligui M, Doublet JD, Haab F, Gattegno B, Thibault P. Nephron-sparing surgery for de novo renal cell carcinoma in allograft kidneys. Transplantation. 2005; 80(6): 865-867. [ Links ]
*11. Ribal MJ, Rodríguez F, Musquera M, Segarra J, Guirado L, Villavicencio H, et al. Nephron-sparing surgery for renal tumor: a choice of treatment in an allograft kidney. Transplant Proc. 2006;38:1359-1362. [ Links ]
*12. Kunikata S, Imanishi M, Akiyama T, Kurita T. Comparative study of renal carcinomas in renal transplant, dialysis, and general (nongrafted and nonuremic) patients. Transplant Proceed. 2000; 32: 1986-1987. [ Links ]
13. Leonardou P, Semelka RC, Mastropasqua M, Kanematsu M, Woosley JT. Renal cell carcinoma in a transplanted kidney: MR imaging findings. Magn Reson Imaging. 2003; 21(6): 691-693. [ Links ]
**14. Goeman L, Joniau S, Oyen R, Van Poppel H. Percutaneous ultrasound-guided radiofrequency ablation of recurrent renal cell carcinoma in renal allograft after partial nephrectomy. J Urol. 2006; 67(1): 199.e17-199.e19. [ Links ]
15. Schostak M, Heicappell R, Sauter T, Goessl C, Krause H, Hoyer J, et al. Renal cell carcinoma in a kidney transplant: allogenic genome in the tumor justifies organ-preserving surgery. Transplant Proc. 2002; 34: 2231-2232. [ Links ]
*16. Aron M, Hegarty NJ, Remer E, O'Malley C, Goldfarb D, Kaouk JH. Percutaneous radiofrequency ablation of tumor in transplanted kidney. Urology. 2007 Apr; 69(4):778.e5-778.e7. [ Links ]
**17. Shingleton WB and Sewell PE. Percutaneous cryoablation of renal cell carcinoma in a transplanted kidney. BJU International. 2002; 90: 137-138. [ Links ]
18. Thomalla JV. Renal cell carcinoma in a renal allograft: successful treatment with 5 year follow-up. Clin Med Res. 2004; 2(3): 151-153. [ Links ]
19. Baughman SM, Sexton WJ, Glanton CW, Dalrymple NC, Bishoff JT. Computerized tomography guided radio frequency ablation of a renal cell carcinoma within a renal allograft. J Urol 2004; 172: 1262-1263. [ Links ]
20. Park KI, Inoue H, Kim CJ, Tomoyoshi T. Nephron sparing surgery for de novo renal cell carcinoma in an allograft kidney: a case report. Int J Urol. 1997; 4(6): 611-614. [ Links ]
*21. Barama A, St-Louis G, Nicolet V, Hadjeres R, Daloze P. Renal cell carcinoma in kidney allografts: a case series from single center. Am J Transplant. 2005; 5: 3015-3018. [ Links ]
22. McHayleh W, Morcos JP, Wu T, Shapiro R, Yousem S, Appleman L, Friedland DM. Renal cell carcinoma from a transplanted allograft: two case reports and a review of the literature. Clin Genitourin Cancer. 2008 Mar; 6(1):53-55. [ Links ]
*23. Ishikawa N, Tanabe K, Tokumoto T, Shimmura H, Yagisawa T, Goya N, et al. Clinical study of malignancies after renal transplantation and impact of routine screening for early detection: a singlecenter experience. Transplant Proc. 2000; 32(7): 1907-1910. [ Links ]
24. Huang S, Houghton PJ, et al. Inhibitors of mammalian target of rapamycin as novel antitumour agents. Curr Opinion in Invest Drugs. 2002; 3(2):295-304. [ Links ]
25. Tang S, Cheng IK, Leung VK, Kuok UI, Tang AW, Wing Ho Y, et al. Successful treatment of hepatitis C after kidney transplantation with combined interferon alpha-2b and ribavirin. J Hepatol. 2003; 39: 875-878. [ Links ]
26. Lledo-Garcia E, Duran-Merino R, Moralejo-Garate M, Monzo JI, Hernandez-Fernandez C. Sub-capsular nephron-sparing surgical approach for small renal graft tumor: a case report. Trans Proc. 2006; 39: 303-304. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Raquel González López
Pza Ondarreta, 4 8oC
28923 Alcorcón. Madrid. (España).
rakelgon@hotmail.com
Trabajo recibido: 7 de octubre 2008
Comentario editorial
La incidencia de patología oncológica en los pacientes trasplantados renales es claramente superior a la de la población general, con un mejor pronóstico y una menor mortalidad. El carcinoma de células renales en estos pacientes es 2 a 3 veces más frecuente, pero el que aparezca en el injerto renal es raro, de ahí el interés del trabajo que nos ocupa.
En cuanto a los puntos controvertidos no podemos estar más de acuerdo con los autores (1). La PAAF guiada por ecografía o TAC puede ofrecer una información muy valiosa con escasos riesgos y evitar cirugías innecesarias. Aunque anteriormente el tratamiento de estos pacientes era la trasplantectomía, los autores recomiendan la cirugía conservadora, en pacientes seleccionados, siguiendo los mismos principios que para el carcinoma renal convencional. La bibliografía consultada es extensa y bien seleccionada.
Jesús Blázquez Izquierdo
Servicio de Urología
Hospital Clínico San Carlos
Madrid
Bibliografía
1. Hernández Sánchez J E, Gómez Vegas A, Blázquez Izquierdo J, et al. Cirugía conservadora de cáncer renal en injerto funcionante: A propósito de un caso. Arch. Esp. Urol., 2007; 60(3):295-297.











 text in
text in