My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actas Urológicas Españolas
Print version ISSN 0210-4806
Actas Urol Esp vol.35 n.4 Apr. 2011
Pérdida de masa ósea en pacientes con cáncer de próstata sometidos a deprivación androgénica
Loss of bone mass in patients with prostate cancer subjected to androgenic deprivation
J. Morote y J. Planas
Servicio de Urología, Hospital Vall d'Hebron, Universidad Autónoma de Barcelona, Barcelona, España
Amgen SA ha colaborado en la financiación de esta publicación. Las conclusiones, interpretaciones y opiniones expresadas en ella corresponden exclusivamente a sus autores, no asumiendo Amgen responsabilidad alguna sobre las mismas.
Dirección para correspondencia
RESUMEN
Contexto: El tratamiento basado en deprivación androgénica es uno de los tratamientos estándar que reciben muchos pacientes con cáncer de próstata. Además, su utilización está aumentando debido a una clara expansión de las indicaciones de esta terapia hacia los pacientes con cáncer localizado.
Resumen de evidencia: A pesar de que clásicamente se considera que es bien tolerada, la deprivación androgénica tiene efectos adversos. Entre estos cabe destacar la pérdida de masa mineral ósea, que puede conducir a osteoporosis y elevación del riesgo de fractura ósea. Algunas fracturas pueden tener graves consecuencias, como sucede con la fractura de cadera. Para realizar el diagnóstico de esta situación, existen procedimientos útiles como la densitometría ósea. Y una vez diagnosticada, la disminución de la masa mineral ósea puede ser manejada con recomendaciones dietéticas, cambios generales en el estilo de vida, o con fármacos como los bisfosfonatos o el recientemente aprobado denosumab.
Conclusiones: Los urólogos, siguiendo las recomendaciones vigentes, deben llevar a cabo una cuidadosa vigilancia de la salud ósea de los pacientes con cáncer de próstata sometidos a deprivación androgénica, para poder obtener un diagnóstico precoz e instaurar las medidas generales y/o terapéuticas apropiadas, en caso necesario.
Palabras clave: Cáncer de próstata; Deprivación androgénica; Densitometría ósea; Osteoporosis; Bisfosfonatos; Denosumab.
ABSTRACT
Context: Treatment based on androgenic deprivation is one of the standard treatments that many prostate cancer patients receive. Moreover, its use is increasing due to a clear expansion of the indications of this therapy in patients with localized cancer.
Summary of evidence: In spite of being classically considered that it is well tolerated, androgenic deprivation has adverse effects. Of these, it is worth mentioning the loss of mineral bone mass, which can lead to osteoporosis and increase the risk of bone fracture. Some fractures may have serious consequences, as occurs with hip fractures. To make a diagnosis in this situation, there are useful procedures such as bone densitometry. Once diagnosed, the decrease in mineral bone mass can be managed with dietary recommendations, general changes in lifestyle, or with drugs such as denosumab.
Conclusions: Following applicable recommendations, urologists must carefully monitor the bone health of patients with prostate cancer subjected to androgenic deprivation, in order to obtain an early diagnosis and to apply the appropriate general and/or therapeutic measures, if necessary.
Key words: Prostate cance; Androgenic deprivation; Bone densitometry; Osteoporosis; Bisphosphonates; Denosumab.
Introducción
El cáncer de próstata es uno de los tumores malignos más frecuentes tanto en incidencia como en prevalencia. Los datos epidemiológicos referidos a los Estados Unidos estiman para el año 2010 una incidencia de 155 casos nuevos/100.000 habitantes y año1. Por lo que se refiere a España, las cifras absolutas para el año 2008 estimaban 25.000 casos nuevos y 6.000 muertes que representan una incidencia de 57 casos nuevos y 10 muertes por 100.000 habitantes y año, respectivamente2. Es probable que las diferencias regionales en incidencia sean debidas a diferentes medidas de diferentes registros poblacionales o a diferentes protocolos en el manejo del cribado con el antígeno prostático específico (PSA). En cualquier caso, estas cifras justifican claramente la afirmación de que el cáncer de próstata es un problema mayor de Salud Pública.
Históricamente, el hueso ha sido objeto de un gran interés por parte de los urólogos, debido a que las células malignas del cáncer de próstata tienen un especial osteotropismo. Es por ello que el hueso constituye la localización metastásica más frecuente de este tumor. Este osteotropismo se debe a factores anatómicos, como el plexo paravertebral de Batson que conecta la próstata con el esqueleto axial, a factores biológicos, como la proteína relacionada con la hormona paratiroidea (PTHRP) y el Transforming Growth Factor-β (TGF-β). Estos factores establecen un bucle de retroalimentación entre las células del cáncer de próstata y el microambiente óseo, que favorece el establecimiento y el crecimiento de localizaciones metastásicas3. Una vez que han aparecido metástasis, el cáncer de próstata se considera incurable y el tratamiento de elección de primera línea es la terapia de deprivación androgénica (TDA), reservándose la quimioterapia antineoplásica para la segunda línea de tratamiento.
El efecto favorable de la TDA en pacientes con cáncer de próstata es conocido desde hace más de 50 años, considerándose, en general, un tratamiento bien tolerado. Sin embargo, no está exento de efectos adversos que pueden llegar a ser molestos para el paciente o graves, predominando los de naturaleza hormonal (ginecomastia, impotencia, sofocos), metabólica (resistencia a la insulina, hiperglucemia, hipercolesterolemia, hipertrigliceridemia), posiblemente un aumento del riesgo cardiovascular y la pérdida de masa ósea. El primer estudio que relacionó deprivación androgénica con osteoporosis se publicó en 1997. Daniell analizó el efecto de la orquiectomía terapéutica en 235 pacientes con cáncer de próstata4 y mostró que este procedimiento se asociaba a una subsecuente elevación en el riesgo de padecer osteoporosis y fracturas osteoporóticas. De forma casi simultánea, se publicó otro estudio que observó resultados similares en pacientes tratados con análogos de la hormona liberadora de hormona luteinizante (LHRH)5.
La TDA ha mostrado aportar beneficio clínico en términos de aumento de la supervivencia, en pacientes afectos de cáncer de próstata no metastásico, en 2 ámbitos concretos: cuando se administra asociada a radioterapia en pacientes con cáncer de próstata localizado con alto riesgo de recidiva y cuando se usa como tratamiento adyuvante a la prostatectomía radical en pacientes con afectación ganglionar demostrada en el espécimen de linfadenectomía pélvica. Así, las indicaciones de la TDA se han expandido y ya se usa, como tratamiento neoadyuvante o adyuvante, en algunos pacientes con tumores no metastásicos al diagnóstico. Así, en los últimos años, se ha podido apreciar que el número de pacientes que son tratados con TDA va en progresivo aumento, especialmente en pacientes que antes se trataban exclusivamente con radioterapia6. Además, en la actualidad, muchos de estos pacientes tienen intervalos libres de enfermedad largos e incluso posibilidad de curarse definitivamente. Por otra parte, un estudio de base poblacional mostró que la generalización de la práctica de la determinación del PSA en pacientes ancianos, tuvo como consecuencia un incremento en la prescripción de TDA7, en vez de una disminución que, de hecho, era la hipótesis de partida. Así, actualmente se está observando la emergencia de complicaciones a largo plazo de la TDA que antes eran poco conocidas porque sólo se apreciaban en los pacientes metastáticos supervivientes a largo plazo. La pérdida de masa mineral ósea es la más importante de estas complicaciones.
Durante toda la vida adulta el hueso está sometido a un continuo proceso de remodelación, basado en creación y resorción ósea coordinadas, que está mediado por la actuación de los osteoblastos y los osteoclastos, respectivamente. La función de los osteoclastos está regulada por diversos factores como el receptor activador del ligando del factor nuclear-κB (RANK) y la osteoprotegerina (OPG)8. La unión de RANK con su ligando (RANKL) deriva en la activación de una vía de transducción de señal que actúa como mediadora de la formación y supervivencia de los osteoclastos, estimulando su función, mientras que la OPG se une a RANKL bloqueándolo e inhibiendo la resorción ósea mediada por los osteoclastos (Figura 1). Así, la densidad mineral ósea es el resultado final de una compleja sucesión de equilibrios a nivel celular (osteoblasto-osteoclasto) y molecular (RANKL-OPG).
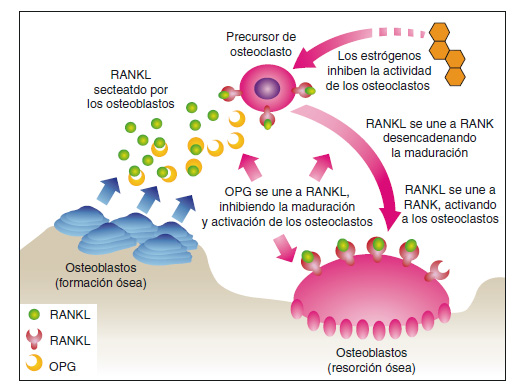
Figura 1. Control de la actividad de los osteoclastos mediante la interacción
entre el receptor activador del ligando del factor nuclear-κB (RANK) y la
osteoprotegerina (OPG).
La fisiología del proceso de remodelación ósea, mediado por múltiples citoquinas y hormonas, explica por qué los pacientes en curso de TDA pueden padecer disminución de masa mineral ósea. Los estrógenos inhiben la resorción ósea, mientras que los andrógenos promueven la formación ósea. La alteración del equilibrio entre estos mecanismos por estatus menopáusico, por tratamiento con inhibidores de la aromatasa en pacientes con cáncer de mama o con TDA en pacientes con cáncer de próstata conduce a una elevación del riesgo de pérdida de masa ósea.
El principal objetivo del presente trabajo de revisión es aportar información y revisar los conocimientos científicos actualmente disponibles, de forma ordenada desde el punto de vista metodológico, al respecto de la importancia de la pérdida de masa ósea durante el curso de la TDA, de su incidencia, de su prevalencia y de los factores de riesgo conocidos. También se revisan de forma sistemática el estado del arte del diagnóstico, así como las maniobras farmacológicas y no farmacológicas disponibles para el manejo de esta situación en pacientes con cáncer de próstata tratados con TDA.
Impacto clínico de la pérdida de masa ósea
La ocurrencia de una fractura ósea representa para los pacientes oncológicos una situación de estrés que puede condicionar dolor, requerimiento de intervención quirúrgica o de radioterapia, encamamiento y, en general, una disminución clara de la calidad de vida de inicio brusco. No todas las fracturas tienen el mismo impacto, ya que éste depende de la localización. Mientras que fracturas en el esqueleto distal tienen un impacto relativo y un bajo riesgo de mortalidad asociado, las fracturas vertebrales, si son múltiples, pueden dar lugar a cifosis severa e insuficiencia respiratoria restrictiva. Otras veces, el evento puede ser catastrófico para el paciente y para sus cuidadores como sucede, en ocasiones, con la fractura de cadera que está asociada a un significativo riesgo de mortalidad en pacientes varones de más de 60 años, con o sin cáncer de próstata, según ha reportado un estudio basado en casi 4.000 pacientes9. Tanto éste como otro estudio mostraron además que la mortalidad en hombres fue significativamente superior a la observada en mujeres9,10. Por otra parte, la ocurrencia de una fractura ósea de cualquier localización en pacientes afectos de cáncer de próstata en curso de TDA está asociada a una disminución de la supervivencia global estadísticamente significativa11. Así, la prevención de fracturas óseas en estos pacientes es importante porque tiene un impacto en la supervivencia global.
El riesgo de nuevas fracturas osteoporóticas en pacientes en curso de TDA se incrementa con la duración del tratamiento. Este fenómeno ya fue subrayado por Daniell en su estudio publicado en 1997, donde se apreció que la incidencia acumulada de fractura llegaba a ser de casi el 50% a los 9 años de la orquiectomía4. Otros estudios clínicos12 y tres grandes estudios de base poblacional más recientes han confirmado claramente el incremento de riesgo de fractura osteoporótica en los pacientes en curso de TDA13-15 y su relación con el número de dosis de análogos recibidos durante los primeros doce meses de tratamiento14,15.
Cuantificación de la pérdida de masa ósea y riesgo de fractura
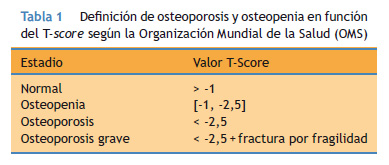
La osteoporosis es un trastorno metabólico óseo caracterizado por pérdida de masa ósea y deterioro de la micro arquitectura del tejido óseo. La absorciometría de doble energía de rayos X (DXA) es el método de elección para la cuantificación de la pérdida de masa ósea y ya fue recomendada en 1994 por la Food and Drug Administration (FDA) de los Estados Unidos, como el mejor método para realizar esta determinación. Los resultados de una medición de masa ósea en un paciente se ofrecen en forma de dos scores, el T-score que cuantifica la pérdida de masa ósea en relación con la estimada como normal para un adulto joven, en forma de desviaciones estándar, y el Z-score que compara el resultado obtenido con el estimado como normal para una persona de la misma edad, sexo y raza. El Z-score se utiliza en la práctica como una cuantificación del riesgo relativo de fractura. Según los resultados del T-score, la Organización Mundial de la Salud (OMS)16 realizó una agrupación cualitativa en 4 grupos (Tabla 1).
Es importante tener en cuenta que en el caso de pacientes con cáncer de próstata y metástasis óseas, la localización donde se realiza la medición de masa ósea con DXA debe estar libre de afectación metastásica. La Sociedad Internacional de Densitometría Clínica ha recomendado que se mida la masa ósea en cuello femoral y vértebras lumbares, así como, sólo en casos seleccionados, en radio distal. Sin embargo, esta última fue la localización más sensible para diagnosticar osteoporosis en un reciente estudio realizado por nuestro grupo en pacientes con cáncer de próstata17. En este estudio, hemos diagnosticado de osteoporosis a un 30% de los pacientes según el resultado de la medición en el radio distal, mientras que la medición en vértebras lumbares o cuello femoral la diagnosticaba a un 20% y 23% de los pacientes, respectivamente. Además, los pacientes con cáncer de próstata son, en general, de edad avanzada y pueden tener osteofitosis vertebral, calcificaciones aórticas o problemas degenerativos en huesos pélvicos. Por todos estos motivos nosotros recomendamos que para estimar la densidad mineral ósea en pacientes con cáncer de próstata se realicen las mediciones en el radio distal, además de las recomendadas por la OMS en columna lumbar y cuello femoral.
Recientemente la OMS ha generado un nuevo instrumento para la evaluación del riesgo de fractura. Se trata de la herramienta FRAX que ofrece el riesgo de fractura osteoporótica de un paciente en base a una serie de características clínico-epidemiológicas (edad, sexo, índice de masa corporal, tabaquismo y otras). La herramienta FRAX se ha aplicado para estimar el riesgo de fractura en pacientes con cáncer de próstata tratados con TDA en una cohorte de 363 pacientes. Los resultados muestran que, sin utilizar los datos de la DXA, la edad es un factor predictivo fundamental que discrimina entre pacientes con alto y bajo riesgo de fractura (con punto de corte en los 70 años) y que la incorporación de la DXA modifica a la baja la estimación del riesgo de fractura18.
Características de la pérdida de masa ósea durante la TDA
La edad, en los hombres, está relacionada con un descenso en los niveles de testosterona y estradiol que resulta en un descenso anual de la masa ósea de alrededor del 1%. En nuestra experiencia12, antes de iniciar el tratamiento con TDA, alrededor del 15% y del 30% de los hombres tenían osteopenia y osteoporosis, respectivamente. En otro estudio19 se mostró que el porcentaje de pacientes con osteoporosis, antes de iniciar la TDA, era del 42%. Así, un porcentaje significativo de los pacientes con cáncer de próstata candidatos a iniciar TDA tienen un hueso con una baja densidad mineral preexistente. Una vez iniciada la TDA, el riesgo de fractura de cadera va aumentando de forma progresiva, ya desde el primer año, hasta llegar a un riesgo relativo de 4, en los pacientes que han recibido TDA durante más de cinco años12. La adición de bicalutamida a la castración, para realizar la estrategia de bloqueo androgénico máximo o total, no modifica la incidencia de osteoporosis12. La pérdida de masa ósea en pacientes afectos de cáncer de próstata en curso de TDA es superior a la observada en la menopausia natural y en los tratamientos con inhibidores de la aromatasa en mujeres postmenopáusicas con cáncer de mama20
Como ya hemos comentado, la pérdida de masa ósea durante el curso de la TDA se inicia desde el primer año21. Nuestro grupo mostró que la pérdida es más intensa durante el primer año de tratamiento, aunque posteriormente se mantiene con un ritmo menor22. En observaciones hechas más allá del segundo año, a largo plazo23, se apreciaba una disminución progresiva de masa ósea durante toda la duración del tratamiento, hasta el punto de que tras 10 años de tratamiento la tasa de osteoporosis era del 80% y no había pacientes que tuvieran una densidad ósea mineral dentro del rango normal (Figura 2).
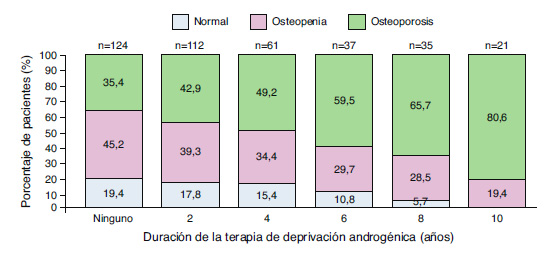
Figura 2. Disminución progresiva de masa ósea durante el tratamiento con
deprivación androgénica en pacientes con cáncer de próstata.
Prevención y tratamiento de la pérdida de masa ósea
Frente a este robusto cuerpo de evidencia que pone de manifiesto una relación directa entre la TDA y la disminución de la densidad mineral ósea, con un incremento en el riesgo de fracturas osteoporóticas, existen una serie de posibilidades de actuación que comentaremos a continuación. Para la prevención de la disminución de la densidad mineral ósea, la existencia de una serie de factores evitables debe ser remarcada a los pacientes en curso de TDA. Se les debe recomendar abstención del consumo de tabaco, moderación en el consumo de alcohol y cafeína, ingesta de más de 1.500mg diarios de calcio y 800 UI de vitamina D, por la dieta o con suplementos. Por lo que respecta a la ingesta diaria de calcio en estos pacientes, un estudio mostró que el 93% tenía una ingesta diaria inferior a 1.000mg, es decir, inferior a la recomendada por la OMS para la población general (1.200mg/día), y que una baja ingesta diaria de calcio es un factor de riesgo independiente para el desarrollo de osteoporosis en estos pacientes24. La ingesta de suplementos de calcio y vitamina D no tiene un efecto preventivo independiente sobre la aparición de la osteoporosis pero su déficit es un importante factor de riesgo para padecerla. Finalmente, se debe recomendar la práctica de ejercicio físico, uno de los estímulos formadores de hueso más importantes, de forma regular y mantenida pero no forzada, a los pacientes en curso de TDA.
La posibilidad de que exista alguna estrategia de administración de TDA que sea mejor que otra en términos de preservación de masa ósea ha sido evaluada en diversos estudios. Una de las estrategias estudiadas es retrasar el inicio de la hormonoterapia. Esta estrategia no modifica la supervivencia en los pacientes metastásicos cuando se difiere el inicio de la TDA al momento de inicio de los síntomas del paciente, ni tampoco lo hace en algunos pacientes seleccionados con recidiva bioquímica tras prostatectomía. Otra estrategia de tratamiento hormonal pensada para reducir sus efectos adversos es la terapia hormonal intermitente. Un pequeño estudio que incluyó 19 pacientes con cáncer de próstata no metastásico mostró que un periodo de interrupción seguida de un descanso y posterior reintroducción de la TDA guiada por la monitorización de las cifras de PSA tenía un efecto favorable sobre la masa ósea de los pacientes, en comparación con los resultados obtenidos en los pacientes que siguieron un tratamiento continuo25. La administración de bicalutamida en monoterapia a dosis de 150mg/día ha evidenciado, en un pequeño ensayo aleatorizado, que los pacientes experimentaban un pequeño aumento en la densidad mineral ósea26, por lo que puede ser considerada una opción en el manejo de estos pacientes. Sin embargo, la eficacia y seguridad tanto de la estrategia de TDA intermitente como de la monoterapia con bicalutamida deben ser confirmadas en futuros estudios con un tamaño muestral más amplio, por lo que, actualmente, el tratamiento hormonal estándar en el cáncer de próstata sigue siendo la castración continuada que, en algunos casos, puede iniciarse de forma diferida.
Los bisfosfonatos (alendronato y zoledronato) y el anticuerpo anti-RANKL denosumab son los fármacos que han evidenciado eficacia, en ensayos aleatorizados frente a placebo, en términos de preservación de la masa ósea en pacientes en curso de TDA (Tabla 2). Los bisfosfonatos son fármacos inhibidores de la actividad osteoclástica al igual que denosumab, un anticuerpo monoclonal de origen completamente humano que se une específicamente al RANKL, un mediador de la actividad osteoclástica, inhibiendo su formación, supervivencia y activación. Entre los estudios realizados con bisfosfonatos, destacamos tres ensayos clínicos, dos con zoledronato27,28 y uno con alendronato29 aleatorizados y comparativos con placebo. El mayor de estos estudios incluyó 112 pacientes28. La variable principal de estos estudios era la variación en la densidad mineral ósea al cabo de un año de TDA. Los tres ensayos mostraron que en el grupo de tratamiento activo se observaba un aumento de la densidad mineral ósea, mientras que en el grupo placebo se apreciaba una disminución de la misma. Sin embargo, ninguno de estos estudios ha podido demostrar que modifiquen el riesgo de fracturas osteoporóticas. Por otra parte, la elección del fármaco, la vía de administración (oral o intravenosa), así como la duración óptima del tratamiento, son aspectos aún no aclarados por lo que respecta a la terapia con bisfosfonatos para pacientes en curso de TDA. En 2009 se publicaron los resultados de un estudio aleatorizado doble-ciego que comparó denosumab con placebo, en pacientes con cáncer de próstata no metastásico30. Este estudio aleatorizó 1.468 pacientes a recibir denosumab 60mg cada seis meses por vía subcutánea o placebo. La variable principal de este estudio fue el porcentaje de variación de densidad mineral ósea en columna lumbar, pero incluyó, a diferencia de los estudios con bisfosfonatos, la tasa de nuevas fracturas vertebrales observadas, como variable secundaria. Los resultados de este estudio mostraron que, en comparación con placebo, además de un incremento de la masa mineral ósea apreciable de forma precoz, ya desde el final del primer mes de tratamiento, denosumab presentaba una tasa significativamente menor de nuevas fracturas vertebrales a 12, 24 y 36 meses. Concretamente a 36 meses, en términos absolutos 1,5% para denosumab frente a 3,9% para placebo y en términos relativos una reducción del riesgo en un 62%, p<0,006. Denosumab y placebo mostraron la misma incidencia de efectos adversos. Cabe señalar que no se apreciaron casos de osteonecrosis de mandíbula o de retraso en la curación de fracturas vertebrales. El hecho de que la tasa de fracturas, y no sólo la disminución de la masa mineral ósea, fuera una variable de este último estudio ha hecho que las autoridades sanitarias hayan aprobado el denosumab para la prevención de la pérdida de masa mineral ósea en pacientes en curso de TDA, mientras que la utilización de bisfosfonatos en este ámbito sigue siendo, en la actualidad, una indicación en forma de uso compasivo.
Recomendaciones de diagnóstico y prevención
La National Osteoporosis Foundation (NOF)31 ha editado recientemente una serie de recomendaciones para pacientes con osteoporosis en general (Tabla 3). En resumen, la NOF recomienda realizar cribado de osteoporosis a todos los pacientes que tengan algún factor de riesgo. Hay que destacar que en este grupo se incluyen todos los hombres de más de 70 años. Por lo que respecta al tratamiento, recomienda una ingesta adecuada, por dieta o con suplementos, de calcio y vitamina D. Finalmente recomienda medidas terapéuticas para la osteoporosis en pacientes de más de 50 años con resultados de DXA y/o FRAX sugerentes de que la pérdida de masa ósea pueda representar un problema clínicamente significativo en el futuro. Del mismo modo, las últimas guías clínicas de la Sociedad Europea de Urología del año 2010 también incluyen la recomendación de realizar estudio de la densidad mineral ósea con DXA en los pacientes tratados con TDA32.
Nos parece recomendable realizar una evaluación del estado de la densidad mineral ósea y el riesgo de fractura con DXA previa al inicio de la TDA, otra a los 6 meses, otra al año y, posteriormente, realizar una monitorización periódica de la misma. El intervalo de repetición la DXA durante la TDA no está definitivamente establecido en la literatura, pero una buena opción es la realización de la misma con periodicidad anual, a partir del primer año en general, y acortarlo de forma individual según las necesidades del paciente, en el caso de que se aprecie una disminución significativa en la densidad mineral ósea.
Conclusiones
La osteoporosis es un problema clínico muy frecuente y puede generar morbimortalidad significativa en los pacientes que la padecen. La TDA, el tratamiento de elección en muchos pacientes afectos de cáncer de próstata, está relacionada con una pérdida progresiva de masa ósea que puede conducir a osteoporosis. Así, los urólogos, siguiendo las recomendaciones de las guías clínicas de la European Association of Urology, debemos llevar a cabo una cuidadosa vigilancia de la salud ósea de nuestros pacientes en curso de TDA, para poder obtener un diagnóstico precoz e instaurar las medidas generales y/o terapéuticas apropiadas, en caso necesario.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses
Agradecimientos
Los autores agradecen a Vicente Valentí y Marta Mas (Trial Form Support) su colaboración en la redacción de este manuscrito.
Bibliografía
1. Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010; 60:277-300. [ Links ]
2. http://globocan.iarc.fr/ [Acceso: 19 de septiembre de 2010]. [ Links ]
3. Yoneda T, Hiraga T. Crosstalk between cancer cells and bone microenvironment in bone metastasis. Biochem Biophys Res Commun. 2005; 328:679-87. [ Links ]
4. Daniell HW. Osteoporosis after orchiectomy for prostate cancer. J Urol. 1997; 157:439-44. [ Links ]
5. Townsend MF, Sanders WH, Northway RO, Graham SD. Bone fractures associated with luteinizing hormone-releasing hormone agonists used in the treatment of prostate carcinoma. Cancer. 1997; 79:545-50. [ Links ]
6. Shahinian VB, Kuo YF, Freeman JL, Orihuela E, Goodwin JS. Increasing use of gonadotropin-releasing hormone agonists for the treatment of localized prostate carcinoma. Cancer. 2005; 103:1615-24. [ Links ]
7. Barry MJ, Delorenzo MA, Walker-Corkery ES, Lucas FL, Wennberg DC. The rising prevalence of androgen deprivation among older American men since the advent of prostate-specific antigen testing: a population-based cohort study. BJU Int. 2006; 98:973-8. [ Links ]
8. Kong YY, Yoshida H, Sarosi I, Tan HL, Timms E, Capparelli C, et al. OPGL is a key regulator of osteoclastogenesis, lymphocyte development and lymph-node organogenesis. Nature. 1999; 397:315-23. [ Links ]
9. Jiang HX, Majumdar SR, Dick DA, Moreau M, Raso J, Otto DD, et al. Development and initial validation of a risk score for predicting in-hospital and 1-year mortality in patients with hip fractures. J Bone Miner Res. 2005; 20:494-500. [ Links ]
10. Roche JJ, Wenn RT, Sahota O, Moran CG. Effect of comorbidities and postoperative complications on mortality after hip fracture in elderly people: prospective observational cohort study. BMJ. 2005; 331:1374-9. [ Links ]
11. Oefelein MG, Ricchiuti V, Conrad W, Resnick MI. Skeletal fractures negatively correlate with overall survival in men with prostate cancer. J Urol. 2002; 168:1005-7. [ Links ]
12. Morote J, Martínez E, Trilla E, Esquena S, Abascal JM, Encabo G, et al. Osteoporosis during continuous androgen deprivation: influence of the modality and length of treatment. Eur Urol. 2003; 44:661-5. [ Links ]
13. Smith MR, Lee WC, Brandman J, Wang Q, Botteman M, Pashos CL. Gonadotropin-releasing hormone agonists and fracture risk: a claims-based cohort study of men with nonmetastatic prostate cancer. J Clin Oncol. 2005; 23:7897-903. [ Links ]
14. Shahinian VB, Kuo YF, Freeman JL, Goodwin JS. Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med. 2005; 352:154-64. [ Links ]
15. Dickman PW, Adolfsson J, Aström K, Steineck G. Hip fractures in men with prostate cancer treated with orchiectomy. J Urol. 2004; 172(6 Pt 1):2208-12. [ Links ]
16. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organ Tech Rep Ser. 1994; 843:1-129. [ Links ]
17. Morote J, Planas J, Raventós C, Placer J, Encabo G. Axial versus peripheral DXA scan to asses osteoporosis in prostate cancer patients. J Urol. 2010; 183(4)Suppl335.[AUA, Annual Meeting Proceedings: Abstract 858]. [ Links ]
18. Saylor PJ, Kaufman DS, Michaelson MD, Lee RJ, Smith MR. Application of a fracture risk algorithm to men treated with androgen deprivation therapy for prostate cancer. J Urol. 2010; 183:2200-5. [ Links ]
19. Hussain SA, Weston R, Stephenson RN, George E, Parr NJ. Immediate dual energy X-ray absorptiometry reveals a high incidence of osteoporosis in patients with advanced prostate cancer before hormonal manipulation. BJU Int. 2003; 92:690-4. [ Links ]
20. Higano CS. Androgen-deprivation-therapy-induced fractures in men with nonmetastatic prostate cancer: what do we really know?. Nat Clin Pract Urol. 2008; 5:24-34. [ Links ]
21. Greenspan SL, Coates P, Sereika SM, Nelson JB, Trump DL, Resnick NM. Bone loss after initiation of androgen deprivation therapy in patients with prostate cancer. J Clin Endocrinol Metab. 2005; 90:6410-7. [ Links ]
22. Morote J, Orsola A, Abascal JM, Planas J, Trilla E, Raventos CX, et al. Bone mineral density changes in patients with prostate cancer during the first 2 years of androgen suppression. J Urol. 2006; 175:1679-83. [ Links ]
23. Morote J, Morin JP, Orsola A, Abascal JM, Salvador C, Trilla E, et al. Prevalence of osteoporosis during long-term androgen deprivation therapy in patients with prostate cancer. Urology. 2007; 69:500-4. [ Links ]
24. Planas J, Morote J, Orsola A, Salvador C, Trilla E, Cecchini L, et al. The relationship between daily calcium intake and bone mineral density in men with prostate cancer. BJU Int. 2007; 99:812-5. [ Links ]
25. Higano C, Shields A, Wood N, Brown J, Tangen C. Bone mineral density in patients with prostate cancer without bone metastases treated with intermittent androgen suppression. Urology. 2004; 64:1182-6. [ Links ]
26. Smith MR, Goode M, Zietman AL, McGovern FJ, Lee H, Finkelstein JS. Bicalutamide monotherapy versus leuprolide monotherapy for prostate cancer: effects on bone mineral density and body composition. J Clin Oncol. 2004; 22:2546-53. [ Links ]
27. Smith MR, Eastham J, Gleason DM, Shasha D, Tchekmedyian S, Zinner N. Randomized controlled trial of zoledronic acid to prevent bone loss in men receiving androgen deprivation therapy for nonmetastatic prostate cancer. J Urol. 2003; 169:2008-12. [ Links ]
28. Michaelson MD, Kaufman DS, Lee H, McGovern FJ, Kantoff PW, Fallon MA, et al. Randomized controlled trial of annual zoledronic acid to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate cancer. J Clin Oncol. 2007; 25:1038-42. [ Links ]
29. Greenspan SL, Nelson JB, Trump DL, Resnick NM. Effect of once-weekly oral alendronate on bone loss in men receiving androgen deprivation therapy for prostate cancer: a randomized trial. Ann Intern Med. 2007; 146:416-24. [ Links ]
30. Smith MR, Egerdie B, Hernández Toriz N, Feldman R, Tammela TL, Saad F, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009; 361:745-55. [ Links ]
31. National Osteoporosis Foundation. Clinician's Guide to Prevention and Treatment of Osteoporosis. Washington, DC: National Osteoporosis Foundation; 2010. [ Links ]
32. Heidenreich A, Bolla M, Joniau S, Mason MD, Matveev V, Mottet N, et al. 2010. Guidelines on prostate cancer. Disponible en: http://www.uroweb.org/guidelines/online-guidelines/ [Acceso 19 de septiembre de 2010]. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: jmorote@vhebron.net
(J. Morote)
Recibido 19 Noviembre 2010
Aceptado 1 Enero 2011