My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicina Intensiva
Print version ISSN 0210-5691
Med. Intensiva vol.33 n.2 Mar. 2009
PUESTA AL DÍA: NEUROINTENSIVISMO
Papel de la craniectomía descompresiva en el enfermo neurocrítico
Role of decompressive craniectomy in brain injury patient
S. Lubilloa, J. Blancob, P. Lópeza, I. Molinaa, J. Domínguezc, L. Carreirad y J.J. Manzanob
a Unidad de Medicina Intensiva. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife. España.
b Unidad de Medicina Intensiva. Hospital Universitario Dr. Negrín. Las Palmas de Gran Canaria. España.
c Servicio de Neurocirugía. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife. España.
d Servicio de Neurocirugía. Hospital Universitario Dr. Negrín. Las Palmas de Gran Canaria. España.
Dirección para correspondencia
RESUMEN
Las medidas terapéuticas de segundo nivel para el control de la hipertensión intracraneal (HIC) que propone el European Brain Injury Consortium y la American Association of Neurological Surgeons son los barbitúricos, la hipotermia moderada o la craniectomía descompresiva (CD). Pero ni los barbitúricos ni la hipotermia han mejorado el resultado de los pacientes. Por tanto, la CD quizá sea una opción terapéutica razonable a aplicar en la HIC sin lesiones ocupantes de espacio.
Nuestro objetivo es revisar y analizar la utilidad clínica de la CD en el paciente neurocrítico e intentar contestar a las preguntas que nos planteamos los intensivistas al respecto.
¿La CD puede mejorar el resultado de los pacientes? Actualmente no hay ningún trabajo prospectivo, controlado y aleatorizado y la mayoría de los artículos son de nivel III. No obstante, sus resultados son alentadores.
¿En qué momento realizaremos la CD? Precozmente, evitando HIC más de 12 h.
¿Qué efecto tiene la CD en la presión intracraneal (PIC) y la oxigenación cerebral? En la mayoría de los pacientes se consigue una PIC < 25 mmHg, pero no ocurre lo mismo con la oxigenación cerebral (PtiO2). El sensor debe colocarse en área cerebral sana del hemisferio más dañado.
¿Qué técnica neuroquirúrgica se aconseja en estos casos? Craniectomía fronto-subtemporo-parieto-occipital con apertura de la duramadre y duroplastia.
Y finalmente, ¿cuáles son las contraindicaciones de la CD? Puntuación en la escala de coma de Glasgow de 3 tras reanimación con pupilas midriáticas y arreactivas, edad > 65 años, HIC > 12 h y diferencia arterio-yugular de oxígeno [Dif(a-vj)O2] < 3,2 vol% o PtiO2 < 10 mmHg mantenidas ambas desde el ingreso.
Palabras clave: Presión intracraneal. Craniectomía descompresiva. Traumatismo craneal. Oxigenación cerebral.
ABSTRACT
Second level therapeutic maneuvres for controlling intracranial hypertension (ICH) proposed by the European Brain Injury Consortium and the American Association of Neurological Surgeons include barbiturates, moderate hypothermia and decompressive craniectomy (DC). However, neither barbiturates nor hypothermia have been demonstrated to improve its outcome. DC could be a therapeutic option in the management of ICH without intracerebral masses. Therefore, our goal has been to review and analyze the clinical usefulness of DC in patients with brain injury in an attempt to deal with some concerns of the critical care physicians.
Can DC improve patient outcome? Currently, there are no randomized and controlled clinical trials supporting or rejecting the practice of DC in adults. Most published reports provide level II of evidence. However, most of those studies have shown that the outcome is better in patients with DC.
When should DC be performed? It should be performed early to prevent ICH from occurring more than 12 hours.
What are the effects of DC on intracranial pressure and brain oxygenation? In most patients, ICP can be maintained below 25 mmHg after a DC.
However, to improve brain oxygenation (PtiO2), the probe must be placed in the healthy area of the most severely damaged cerebral hemisphere.
What is the suggested surgical procedure? Frontal-subtemporal-parietal-occipital craniectomies, including enlargement of the dura by duroplasty.
And finally, what are the current contraindications of DC? Glasgow Coma Scale score 3 points post-resuscitation states with dilated and arreactive pupils, age > 65 years old, ICH > 12 hours, persistent (a-yv)DO2< 3.2% or PtiO2 < 10 mmHg maintained from the moment of admission.
Key words: Intracranial pressure. Decompressive craniectomy. Brain injuries. Brain oxygenation.
Introducción
La isquemia y la hipoxia del tejido cerebral son las afecciones que comúnmente acompañan a los traumatismos craneoencefálicos (TCE), hemorragias intracerebrales espontáneas y tumores que producen un efecto masa, vasospasmo secundario a hemorragia subaracnoidea (HSA) o de cualquier otra etiología, accidentes cerebrovasculares y enfermedad neurológica infecciosa. En este sentido, la afección más estudiada ha sido el TCE donde se han detectado cambios isquémicos en más del 90% de los pacientes fallecidos1.
Los mecanismos que intervienen en la isquemia cerebral son múltiples, complejos y no siempre entendidos. Sin embargo, independientemente de la etiología y de los diferentes mecanismos de producción de daño cerebral, todo confluye en unas manifestaciones comunes, como la hipertensión intracraneal (HIC), las alteraciones del flujo sanguíneo cerebral y la hipoxia tisular.
La HIC sin hematomas que ocupen espacio es todavía la causa más frecuente de muerte e invalidez después de una afección grave cerebral, particularmente en el enfermo traumático2,3. Aproximadamente, un 10-15% de los pacientes con TCE grave presentan HIC resistente a las máximas medidas terapéuticas médicas2,4-7. En esta situación, el médico especialista en medicina intensiva se enfrenta al dilema de qué medidas terapéuticas de segundo nivel puede utilizar, si altas dosis de barbitúricos, hipotermia moderada o craniectomía descompresiva (CD), como propone el European Brain Injury Consortium8 (EBIC) y la American Association of Neurological Surgeons (AANS)9.
A pesar de las recomendaciones de la Brain Trauma Foundation10 sobre el uso de los barbitúricos, la revisión sistemática de la Cochrane actualizada11 no halló pruebas de que los barbitúricos, aunque pueden disminuir la presión intracraneal (PIC), mejoraran el pronóstico en el TCE grave.
Aunque la hipotermia moderada profiláctica se desestimó tras el trabajo de Clifton et al12, hay datos no concluyentes de que pudiera utilizarse como medida de segundo nivel del control de la HIC13,14.
Por lo tanto, la CD quizá sea una opción terapéutica razonable como medida de segundo nivel que tanto el intensivista como el neurocirujano pueden decidir para el tratamiento de la HIC resistente en los pacientes neurocríticos cuando no presentan lesiones ocupantes de espacio.
La CD no es una técnica nueva ya que Kocher en 1901 fue el primero en proponerla en los casos con signos clínicos de PIC elevada; estos datos fueron ratificados posteriormente por Cushing en 1905. Con el paso del tiempo, la indicación se ha vuelto muy controvertida, con estudios a favor y en contra y, sobre todo, con resultados dispares, hasta que a comienzos de los años ochenta se obtuvieron buenos resultados que son concordantes con los de la literatura más refractaria.
El objetivo de este trabajo es revisar y analizar la utilidad clínica de la CD en el paciente neurocrítico, fundamentalmente en el neurotraumático, basados en la literatura y en nuestra propia experiencia, para intentar contestar a las preguntas que nos planteamos los intensivistas ante un paciente con HIC refractaria.
1. ¿La craniectomía descompresiva puede mejorar el resultado de los pacientes?
2. ¿En qué momento y a qué pacientes realizaremos la CD?
3. ¿Qué efecto tiene la CD en la PIC y la oxigenación cerebral?
4. ¿Qué técnica neuroquirúrgica se aconseja en estos casos?
5. ¿Cuáles son las indicaciones y contraindicaciones actuales de la CD terapéutica en el paciente neurocrítico?
¿La craniectomía descompresiva puede mejorar el resultado de los pacientes?
A pesar de que se han publicado más de 240 artículos que tratan el tópico de la CD en los últimos 10 años (100 en los últimos dos años), actualmente no hay ningún artículo prospectivo, controlado y aleatorizado al respecto (nivel de evidencia I).
La primera pregunta que nos viene a la mente es si realmente realizamos CD en nuestros pacientes con procesos intracraneales ocupantes de espacio de origen traumático. Esta pregunta dio lugar a la preparación de un estudio multicéntrico por parte del EBIC sobre manejo quirúrgico de las lesiones intradurales en pacientes con TCE moderado y severo durante un periodo de tres meses15. En ese estudio participaron 67 centros de 24 países europeos, entre los cuales estuvo nuestro hospital. Se incluyó a 729 pacientes, de los que 502 fueron intervenidos, y llama la atención el elevado número de CD. El 33% fueron primarias, es decir, realizadas a criterio del neurocirujano en el acto quirúrgico y el 30%, terapéuticas o secundarias, realizadas posteriormente para el control de la HIC sin tener que evacuar lesiones ocupantes de espacio.
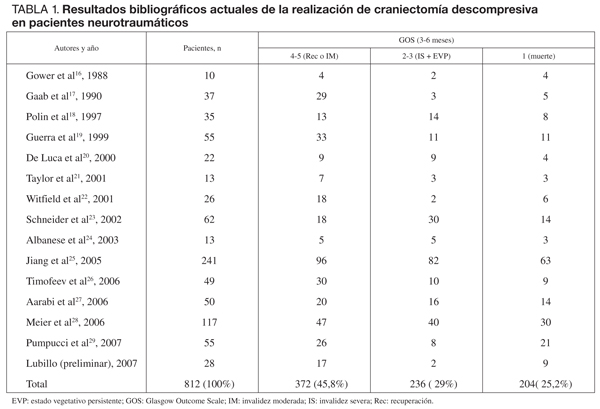
La tabla 1 muestra los resultados de los trabajos más relevantes en CD16-29. El total de pacientes fue 812; a los 3 meses, 372 (45,8%) pacientes presentaban un Glasgow Outcome Scale (GOS) de 4-5 puntos, y 236 (29%) pacientes, GOS de 2-3; la mortalidad en la unidad de medicina intensiva (UMI) fue de 204 (25,1%) pacientes. Como vemos, estos resultados son alentadores en comparación con datos publicados de diferentes autores2-4,30-32, en los que no se realizó CD como medida de segundo nivel para el control de la HIC y donde la mortalidad osciló entre el 42 y el 100%.
Solamente hay en la literatura un estudio, publicado por Taylor et al21 en 2001, controlado y aleatorizado que examina el efecto de la CD en una población pediátrica (12 meses-18 años) sobre la muerte y la discapacidad, después de un TCE grave con PIC alta resistente al tratamiento farmacológico máximo. Aunque el número de pacientes es bajo (27 en total), con 13 pacientes sometidos a CD, la recogida de datos fue muy prolongada ya que se realizó durante 7 años, y la incapacidad de ocultamiento de los brazos del estudio, al ser una intervención quirúrgica; la calidad de este estudio fue alta. El riesgo de muerte de los participantes tratados con CD fue menor que el de los tratados con soporte farmacológico máximo (odds ratio [OR] = 0,54; intervalo de confianza [IC] del 95%, 0,17-1,72). El riesgo de resultado desfavorable (muerte, estado vegetativo o discapacidad grave) en los participantes tratados con CD fue también menor en el grupo de CD que en el control (OR = 0,54; IC del 95%, 0,29-1,01). En la mayoría de los pacientes que recibieron CD también se controló la PIC. Aunque idealmente estos resultados deben repetirse en un ensayo clínico más grande, es muy improbable que cualquier comité ético apruebe un segundo ensayo en la población pediátrica sobre la base de razones científicas solamente.
Hay pocos trabajos prospectivos, aunque no aleatorizados, en los últimos años. Así, Gaab et al17 publicaron en 1990 un estudio prospectivo sobre pacientes con TCE grave con HIC que no respondían a tratamiento médico. Los criterios de inclusión para realizar CD fueron muy estrictos y sólo incluyeron a pacientes menores de 40 años y que al menos presentaran alguna respuesta motora al estímulo doloroso. De los 37 pacientes incluidos, 8 (21,6%) presentaron un resultado desfavorable (GOS 1-3) a los 6 meses tras el traumatismo y 29 (78,4%), un resultado favorable (GOS 4-5).
Guerra et al19 publicaron en 1999 un interesante trabajo prospectivo realizado en un solo centro donde incluyeron a 57 pacientes muy bien seleccionados con TCE grave, con una edad < 30 años y sin signos de daño irreversible de tronco cerebral. Todos los pacientes presentaron signos de edema cerebral difuso uni o bilateral en la tomografía computarizada (TC) craneal de admisión o luego de evacuación quirúrgica de un proceso expansivo intracraneal. En 17 pacientes la CD se realizó sin control de la PIC ya que se hizo en el momento de evacuar la lesión intracraneal y fue a criterio del neurocirujano (CD primaria). El resto de los pacientes presentaron edema cerebral difuso con HIC. En esta serie de pacientes la supervivencia con buena calidad de vida fue del 58% (33 pacientes) y la morbimortalidad fue del 39%.
De Luca et al20 presentan su experiencia en 22 pacientes que al ingreso presentaban una lesión expansiva intracraneal con criterios de evacuación, tras la cual medían la PIC y si ésta era elevada, decidían inmediatamente realizar la CD. De los 22 pacientes incluidos, 9 (48%) evolucionaron favorablemente, 4 (18%) lo hicieron con discapacidad grave, 5 (23%) en estado vegetativo y 4 (18%) fallecieron.
En este contexto, nuestro grupo publicó en esta revista, en el año 200433, los datos preliminares de un estudio prospectivo realizado en dos hospitales universitarios de las Islas Canarias, donde los criterios de inclusión fueron: TCE grave (escala de coma de Glasgow [ECG] < 9 tras reanimación o dentro de las primeras 24 h del ingreso) y edad > 18 años. Todos presentaban, a su ingreso, una lesión expansiva que fue evacuada y se pudo cerrar la duramadre y colocar el hueso. A todos se monitorizó la PIC y la oxigenación cerebral mediante PtiO2 o SjO2. En caso de que los pacientes presentaran hipertensión intracraneal que no respondía a las maniobras de primer nivel, incluidas hiperventilación y presión de perfusión cerebral (PPC) optimizada, se realizó CD sin tener que evacuar ninguna lesión expansiva. Ninguno recibió barbitúricos ni hipotermia antes de la CD. Este grupo de pacientes se comparó con un grupo histórico control de nuestra UMI cuando no se realizaba CD y que recibieron barbitúricos a altas dosis y/o se colocó un drenaje intraventricular para drenar LCR abierto siempre que fuera posible. Con objeto de asegurarnos la homogeneidad en la gravedad de los grupos a comparar (CD y grupo histórico) analizamos si había diferencias en las siguientes variables que incidan en la morbimortalidad de los pacientes con TCE, como motor-ECG, número de pacientes con arreactividad pupilar unilateral o bilateral, hipotensión arterial prehospitalaria y lesión intracraneal concomitante (contusiones puntiformes y hemorragias intraventricular o subaracnoidea) en ambos grupos. Los resultados demostraron que no había diferencias significativas en cuanto a gravedad en ambos grupos. Hasta el momento hemos introducido en el estudio 28 pacientes y la morbimortalidad (GOS 1-3 a los 6 meses) del grupo de la CD fue del 39,3% (11/28) y en el grupo histórico, del 76,6% (23/30) (OR = 5,07; IC del 95%, 1,63-15,83; p = 0,0041) (fig. 1).
Por último, aunque no es un estudio prospectivo, Timofeev et al26 publicaron la realización de la CD dentro del protocolo preestablecido y analizaron los resultados de 49 pacientes con TCE que presentaban HIC refractaria al tratamiento médico, sin lesiones intracraneales evacuables. El 61% (30 pacientes) evolucionó favorablemente o presentaba una mínima invalidez, el 20,4% (10 pacientes) sobrevivió con discapacidad grave y el 18,4% (9 pacientes) falleció en el hospital. Ese equipo propone que en la actualidad hay justificación, basada en los datos publicados, para realizar un estudio multicéntrico y aleatorizado. El estudio está dirigido por el Dr. Hutchinson del Departamento de Neurocirugía del Addenbrooke's Hospital34; RESCUE (Randomized Evaluation of Surgery with Craniectomy for Uncontrollable Elevation of Intracranial Pressure) ha comenzado en enero de 2005 e incluye en la actualidad alrededor de 100 pacientes (comunicación personal).
Como hemos descrito al inicio de esta cuestión hay una gran cantidad de artículos retrospectivos que publican resultados tras CD con diferentes criterios de inclusión, técnica aplicada y momento de la realización de la CD, pero analizaremos, por ser muy peculiar, el artículo recientemente publicado por Aarabi et al27, del University of Maryland Shock Trauma Center, que recibe una cantidad muy importante de pacientes con traumatismo craneal. Ese estudio retrospectivo analizó a un subgrupo de los 967 pacientes ingresados consecutivamente con un TCE grave (ECG < 9) de 2000 a 2004, a quienes se realizó CD. Todos ellos eran pacientes con edema cerebral masivo en los que no se pudo controlar la PIC por debajo de 20 mmHg o presentaban desviación de la línea media. Se incluyó a 50 pacientes y 20 (40%) de ellos presentaban una evolución favorable a los 3 meses del traumatismo, 14 (28%) pacientes fallecieron y los 16 restantes permanecían en estado vegetativo o gravemente discapacitados.
Como hemos podido ver en esta revisión, en la última década los neurocirujanos y los intensivistas han mostrado un interés renovado en la CD para el control de la HIC resistente a las medidas terapéuticas de primer nivel.
Aunque los datos revisados son muy esperanzadores, la revisión sistemática de la Cochrane, realizada por Sahuquillo et al35, sobre el uso de la CD en la HIC refractaria al tratamiento en la lesión cerebral traumática, concluye que no hay resultados disponibles que confirmen o refuten la efectividad de la CD en el TCE.
Si no hay consenso en los resultados en el uso de la CD en el paciente traumático, que es donde se tiene más experiencia y hay más trabajos publicados, en las otras etiologías, como el infarto cerebral de la arteria cerebral media (ACM) o la HSA secundaria a rotura de un aneurisma que presenten HIC refractaria, los resultados son menos concluyentes.
Aproximadamente, el 10% de los infartos cerebrales de la ACM se convierten en malignos por edema masivo cerebral y los pacientes tienen una mortalidad alta, del 78%, debido a la herniación del lóbulo temporal sobre el tronco cerebral36-38. La necesidad de buscar tratamientos alternativos a los pacientes con ictus cerebral y la detección precoz de los signos de malignidad son de gran importancia, pues es una enfermedad muy frecuente y, además, en un elevado porcentaje los pacientes que sobreviven lo hacen con gran discapacidad.
En una revisión sistemática, publicada en Stroke en 200439, se analizaron, de forma retrospectiva y sin grupo control, los resultados de 138 pacientes tratados con CD por infarto masivo de la ACM. La mediana de edad fue 50 (11-76) años y el tiempo medio de la realización de la cirugía fue 59 (8-456) h. La mortalidad general fue del 24% y ésta fue significativamente más elevada en los pacientes mayores de 50 años (el 34 frente al 14%). El 42% de los pacientes sobrevivieron con independencia funcional o moderada discapacidad. A pesar de ello, estos resultados fueron mejores si los comparamos con las mortalidades históricas del 78% cuando no se realizaba la CD44. A pesar de ello, como hemos descrito, la CD puede mejorar la mortalidad, pero hay que tener en cuenta el porcentaje d e supervivientes con discapacidad moderada o severa.
La clave del tratamiento del infarto cerebral de la ACM radica en la detección precoz de los que progresarán hacia un infarto masivo. Éstos serían los pacientes que realmente se beneficiarían de un tratamiento precoz con CD para evitar la herniación y la hipoxia cerebral.
Estudios caso-control han detectado predictores clínicos basados en variables independientes en la aparición de infarto maligno de la ACM40,41 (tabla 2).
También hay evidencia de que los pacientes que en la TC craneal del ingreso presentan un área de isquemia mayor del 50% del territorio correspondiente a la ACM suelen ser más propensos a presentar signos de herniación40-43 o con desviación de la línea media a nivel del septum pellucidum mayor de 5 mm o con infartos cerebrales en otros territorios vasculares44 tienen más posibilidades de herniación cerebral. Obviamente, la aparición de infarto cerebral es una fase tardía del proceso y, por lo tanto, necesitamos otros métodos diagnósticos que detecten la afectación del riesgo vascular cerebral, sin que ésta sea irreversible mediante otras técnicas de imagen, como PET44, Xenon CT45, SPECT46 y resonancia magnética por difusión47. Desafortunadamente, estas técnicas solamente están disponibles en algunos hospitales y, por lo tanto, no se pueden aplicar a todos los pacientes.
Teniendo en cuenta estas limitaciones, se han desarrollado marcadores bioquímicos precoces de la afección vascular cerebral, entre las que destacamos la proteína S100B48 y la fibronectina celular plasmática49. La utilización terapéutica de la CD en pacientes con HSA secundaria a aneurisma cerebral y asociada a una gran hemorragia cerebral ha sido analizada en estudios recientes50-52, con resultados variables en cuanto a calidad de vida, si bien, hay una mejora en la mortalidad a corto plazo.
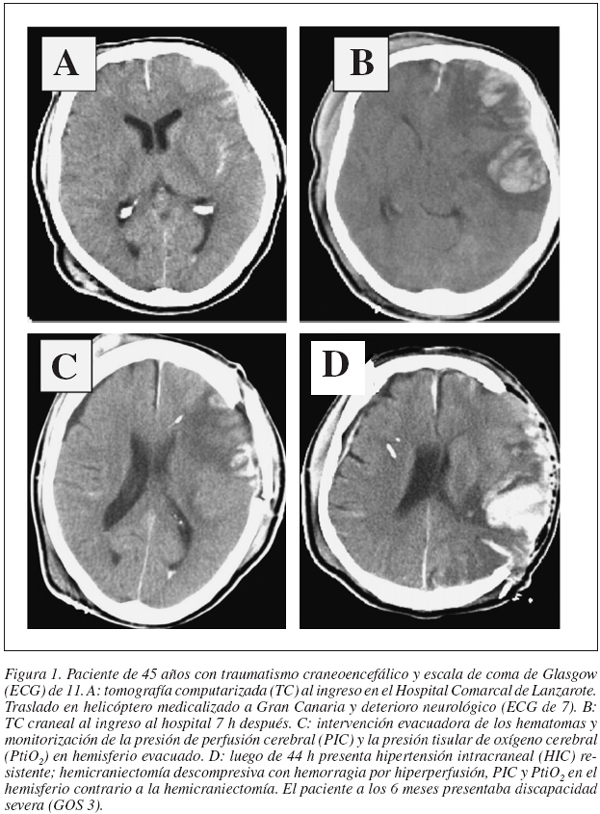
También se ha publicado algún artículo53 acerca de la indicación de la CD en el seno de pacientes con alto grado de HSA e HIC resistente en ausencia de hemorragia cerebral. Los resultados, aunque el número de casos es muy reducido (n = 16), son alentadores, no sólo en cuanto a la mortalidad, sino también en cuanto a la morbilidad de estos pacientes, fundamentalmente cuando la CD se hace precozmente. En la figura 2 podemos ver un caso de una paciente con HSA secundaria a un aneurisma que presentó un infarto masivo de la ACM en el postoperatorio inmediato con HIC e hipoxia cerebral (PtiO2 < 15 mmHg) a quien se realizó una CD precoz y su resultado fue favorable.
¿En qué momento y a qué pacientes realizaremos la CD?
En la mayoría de los trabajos la indicación de la CD se realizaba cuando había signos de herniación cerebral secundaria a un aumento de la PIC o bien cuando estos signos aparecían en la TC inmediatamente después del traumatismo (daño primario). Pero realmente hay una gran variabilidad en el momento que decidimos realizar la CD terapéutica; así, por ejemplo, el tiempo entre el ingreso y la descompresión en el estudio de Witfield et al22 fue de 6 h a 11 días; el de Guerra et al19, entre 12 h y 18 días; Aarabi et al27, entre 24 h y 11 días, al igual que nuestra experiencia sobre 28 pacientes tras lesión expansiva evacuada desde el ingreso hasta la CD, entre 4 h y 6 días (mediana de 45 h). Esto significa que las lesiones en la TC y la HIC son procesos dinámicos y pueden aparecer precoz o tardíamente tras un TCE.
¿Cuándo planteamos la cd dentro de un protocolo de tratamiento dirigido al control de la hic sin necesidad de evacuar una lesión expansiva ocupante de espacio? No hay un criterio uniforme acerca del umbral de PIC a partir del cual se considera patológica ni tampoco la duración del evento y además no hay un acuerdo en el momento en que hemos agotado todas las medidas médicas agresivas.
Por ejemplo, en el trabajo de Taylor et al21, consideraron HIC sólo durante el primer día del ingreso (PIC: 20-24 mmHg durante 20 min, 25-29 mmHg durante 10 min o > 30 mmHg durante un minuto) o con evidencia de herniación (dilatación pupilar unilateral o bradicardia). Csokay et al54, con PIC > 30 mmHg; Whitfield et al22 realizaron la CD con una media de 28 mmHg y Guerra et al26 incluyeron a pacientes con PIC > 30 e incluso algunos con > 50 mmHg antes de proceder a la CD. En nuestra serie la mediana de PIC máxima antes de la CD fue 38 (27-56), tomando como valor de HIC 25 mmHg al igual que el protocolo del estudio RESCUE34.
En nuestra opinión, la CD terapéutica debe reservarse a casos muy seleccionados, en que se debe considerar: a) aumentos progresivos y mantenidos de la PIC por encima de 25 mmHg al menos durante 30-60 min y tras descartar todas las causas extracraneales de HIC, y b) si tenemos una PIC > 25 mmHg y la causa es intracraneal, ¿qué medidas terapéuticas deben fracasar antes de considerar la CD? No hay acuerdo en la literatura, excepto cuando agotamos las medidas de primer nivel y pasamos a las de segundo nivel (tabla 3).
Nosotros pensamos, dada la poca evidencia por el momento de la eficacia de la administración de barbitúricos y de la hipotermia, realizar la CD como primera medida de segundo nivel tras fracasar las medidas de primer nivel bajo una monitorización multimodal (PIC, presión de perfusión cerebral [PPC], presión tisular de oxígeno [PtiO2], saturación yugular de oxígeno [SjO2], índice biespectral [BIS]...) en unidades específicas para el tratamiento de pacientes neurocríticos.
Hay consenso general en que los pacientes más jóvenes con TCE se beneficiarían más de la CD, pero no hay datos que confirmen un límite edad. Pompucci et al29 han publicado recientemente un trabajo prospectivo en 55 pacientes, donde demostraron que no había diferencias en cuanto al resultado, tomando como variable independiente la edad menor de 40 y entre 40 y 65 años, por lo que pensamos que debe revisarse el límite de edad.
También parece haber un acuerdo en que los pacientes con signos de afectación del tronco cerebral irreversible, como ECG 3, con pupilas arreactivas bilaterales no son candidatos a recibir CD en caso de HIC refractaria. Aunque parece ser que la ECG 3-4 y la arreactividad pupilar son variables independientes de mal pronóstico29,55,56, en algunos casos no se obtienen los mismos resultados, si bien el número de pacientes es escaso19,20,27,28. Por tanto, aunque la mayoría de los autores describen peores resultados en los pacientes con ECG 4-5 o mECG ≤ 3, el bajo número de pacientes incluidos en los estudios en un solo centro y la gran variabilidad de indicaciones y el momento de la intervención hacen pensar que este aspecto debiera ser revisado de forma individual. No obstante, pensamos que la CD es una intervención quirúrgica no exenta de problemas y que su uso generalizado en todos los pacientes con HIC resistente pudiera aumentar el número de discapacitados graves.
Otro aspecto, además de la edad y la ECG, es la situación de salud previa del paciente y la existencia de lesiones extracraneales traumáticas graves. En este último aspecto, el grupo de Berlín28 hace un análisis de los pacientes a los que se realizó CD y compararon los TCE aislados (mortalidad del 34% y GOS 4-5 en el 34%) en comparación con los pacientes politraumatizados (mortalidad del 3% y GOS 4-5 en el 10%).
¿Qué efecto tiene la CD en la PIC y la oxigenación cerebral?
En la mayoría de los trabajos analizados en esta revisión, los autores monitorizan la PIC tras CD en el área de la descompresión. En esa área el cerebro se expande y desvía la curva de presión-volumen hacia la derecha, lo que explicaría el descenso de la PIC. Sin embargo, esta expansión del cerebro podría dar lugar a un aumento del flujo sanguíneo cerebral regional que aumentaría el edema y la necrosis en esa zona. Este efecto fue estudiado por Yamakami et al57 mediante SPECT y observaron que a los pocos minutos se producía un aumento de la perfusión en el área cerebral descomprimida que llegaba a su grado máximo a la semana, y que, luego, en aproximadamente un mes, se normalizaba y esto coincidía con la mejora del paciente. Los autores añaden que la hiperperfusión ocurría, sobre todo, cuando la CD se realizaba demasiado tarde. Por todo ello, durante la fase aguda del TCE, algunas revisiones acerca del manejo de la HIC58 proponen que, en estos pacientes, se descienda el umbral en que se debería tratar la PIC a 15 mmHg. Nosotros pensamos que sería importante conocer los valores de PIC antes y después de la hemicraniectomía con el catéter colocado en el lado contralateral a la descompresión.
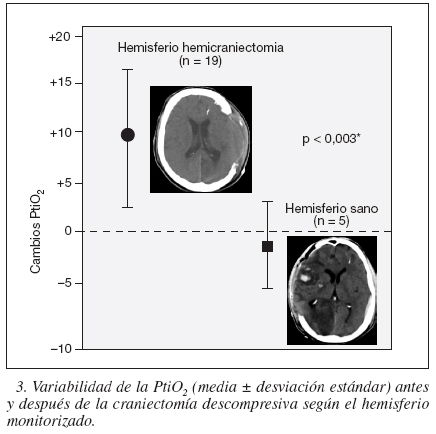
La medición de la oxigenación cerebral local mediante un catéter polarográfico tipo Clark implantado en el cerebro (PtiO2) es una monitorización habitual en muchas unidades de neurocríticos según las últimas guías publicadas por la Brain Trauma Foundation10. Artículos recientes describen la mejora de la oxigenación cerebral (PtiO2) tras la descompresión craneal28,59-61. Desde 1999 en nuestro hospital monitorizamos, de forma sistemática, la PtiO2 conjuntamente con la PIC en todos los pacientes con TCE grave. Hemos analizado la monitorización en más de 200 pacientes y siempre intentamos colocar el catéter en área aparentemente sana del hemisferio más dañado. En nuestro estudio prospectivo de CD, donde hasta el momento hemos incluido a 28 pacientes, en 21 de ellos se monitorizó la PtiO2 antes y después de la CD. De ellos, en 19 se midió la PtiO2 con el catéter colocado en área aparentemente sana en la TC del hemisferio más dañado (lado de la hemicraniectomía), en dos se monitorizó el lado opuesto de la hemicraniectomía y en los tres restantes se hizo bilateralmente. Tras la descompresión, se produjo un aumento significativo de la PtiO2 (9,7 ± 7,06 mmHg) con el catéter colocado en área aparentemente sana en la TC craneal del hemisferio de la hemicraniectomía, en comparación con la medición en el lado contralateral a la CD, que incluso descendió una media de 1,4 ± 3,8 mmHg (p < 0,001) (fig. 3). Los tres pacientes con valores iniciales de PtiO2 en el intervalo de isquemia cerebral y que la PtiO2, medida en el lado de la craniectomía, no aumentó a la normalidad tras la CD, fallecieron en muerte cerebral.
Basados en estos hallazgos, podemos afirmar que la monitorización de la PtiO2, medida en un área sana del hemisferio más dañado, puede ser de utilidad no sólo para la indicación del momento de la CD, sino también para evaluar su efectividad y posteriormente ayudar al manejo del paciente.
¿Qué técnica neuroquirúrgica se aconseja en estos casos?
La craniectomía fronto-subtemporo-parieto-occipital con apertura de la duramadre y su alargamiento con duroplastia es la técnica de descompresión más utilizada en la mayoría de las investigaciones recientes y descritas en esta revisión. Desde el punto de vista fisiopatológico, esta técnica es la única que previene la protuberancia del cerebro, que se hernia con los bordes del cerebro, y evita la distorsión de las venas puente del cerebro que pueden producir infartos venosos que dan lugar al aumento del edema cerebral62.
La CD no está exenta de complicaciones, y así, en el estudio de Aarabi et al27, el 50% de los pacientes presentaron higromas subgaleales y subdurales que se resolvieron espontáneamente y no necesitaron intervención quirúrgica posterior. En 6 (12%) pacientes apareció un infarto cerebral y, de ellos, tres evolucionaron desfavorablemente. Ocho pacientes presentaron hemorragia cerebral y/o edema en el periodo postoperatorio inmediato, pero ninguno precisó reintervención.
¿Cuáles son las indicaciones y contraindicaciones de la craniectomía descompresiva terapéutica en el paciente neurocrítico?
La CD debe incorporarse al arsenal terapéutico de segundo nivel en pacientes con HIC refractaria a medidas de primer nivel de acuerdo con las guías desarrolladas por el EBIC y la AANS.
La descompresión ha de hacerse precozmente (antes de las 6 h de PIC > 25 mmHg), ya que el retraso en su realización puede favorecer la aparición de hiperperfusión focal y hemorragias intracraneales. La necrosis cerebral focal puede evitarse con CD amplia y duroplastia.
La CD primaria o profiláctica es cuestionable, pero puede dar buenos resultados cuando los signos intraoperatorios de herniación cerebral son evidentes, en opinión del neurocirujano. Hay que tener en cuenta que en los países en desarrollo o en los centros donde no hay posibilidad de neuromonitorización multimodal, la CD puede ser el tratamiento de elección para prevenir la herniación cerebral.
Parece ser que los pacientes jóvenes evolucionan mejor tras la CD, pero no hay evidencia en la literatura que indique un límite de edad. A pesar de ello, hay una tendencia a limitar la edad a 65 años.
Las contraindicaciones de la CD en el paciente neurocrítico se pueden resumir en:
- Pacientes con ECG 3 tras resucitación, con pupilas midriáticas y arreactivas.
- Edad > 65 años.
- Traumatismo devastador en que el paciente no sobrevivirá más de 24 h.
- Enfermedad sistémica irreversible a corto plazo.
- HIC incontrolable durante más de 12 h a pesar de todas las medidas médicas agresivas.
- Dif(a-v)O2 < 3,2 vol% medida en el lado de la hemicraniectomía o PtiO2 < 10 mmHg en área aparentemente sana, mantenida desde el ingreso del paciente que, en ambos casos, indicarían infarto cerebral.
Por último, hay que tener en cuenta que la indicación del CD debe ser individualizada para cada paciente, valorando su estado de salud previo, tipo de lesión y enfermedad, y experiencia del equipo de tratamiento, y la decisión debe ser siempre consensuada entre, al menos, un médico intensivista y un neurocirujano.
Estamos seguros que los resultados de los estudios aleatorizados y controlados actualmente en marcha nos darán algo más de luz para decidir la realización de la CD en el paciente neurocrítico.
Bibliografía
1. Graham DI, Ford I, Adams JH, Doyle D, Teasdale GM, Lawrence AE, et al. Ischaemic brain damage is still common in fatal non missile head injury. J Neurol Neurosurg Psychiatry. 1989;52:346-50. [ Links ]
2. Marmarou A, Anderson RL, Ward JD, Choi SC, Young HF, Eisenberg HM, et al. Impact of ICP instability and hypotension on outcome in patients with severe head trauma. J Neurosurg (Suppl). 1991;75:S59-66. [ Links ]
3. Clifton Gl, Miller ER, Choi SC, Levin SH. Fluid thresholds and outcome from severe head injury. Crit Care Med. 2002;30:739-45. [ Links ]
4. Juul N, Morris GF, Marshall SB, Marshall LF. Intracranial hypertension and cerebral perfusion pressure: influence on neurological deterioration and outcome in severe head injury. The Executive Committee of the International Selfotel Trial. J Neurosurg. 2000;92:1-6. [ Links ]
5. Marshall LF. Head injury: recent past, present, and future. Neurosurgery. 2000;47:546-61. [ Links ]
6. Miller JD, Piper IR, Dearden NM. Management of intracranial hypertension in head injury: matching treatment with cause. Acta Neurochir Suppl. 1993;57:152-9. [ Links ]
7. Lubillo S, Manzano JJ, Villar J, Quintana J, Manzano JL. Aspectos pronósticos y terapéuticos en el trauma craneal y torácico. Med Intensiva. 1983;7:33-42. [ Links ]
8. Maas AI, Dearden M, Teasdale GM, Braakman R, Cohadon F, Iannotti F, et al. Guidelines for management of severe head injury in adults. European Brain Injury Consortium. Acta Neurochir (Wien). 1997;139:286-94. [ Links ]
9. Guidelines for management of severe head injury. Brain Trauma Foundation. J Neurotrauma. 2000;17:451-627. [ Links ]
10. Bratton SL, Chestnut RM, Ghajar J, McConnell Hammond FF, Harris OA, et al; Brain Trauma Foundation; American Association of Neurological Surgeons; Congress of Neurological Surgeons; Joint Section on Neurotrauma and Critical Care, AANS/ CNS. Guidelines for the management of severe traumatic brain injury. XI. Anesthetics, analgesics, and sedatives. J Neurotrauma. 2007;24 Suppl 1:S71-6. [ Links ]
11. Roberts I. Barbiturates for traumatic brain injury. Cochrane Database Syst Rev. 2000; 2: CD000033. [ Links ]
12. Clifton Gl, Miller ER, Choi SR, Levin HS, McCauley S, Smith KR, et al. Lack of effect of induction of hypothermia after acute brain injury. N Engl J Med. 2001;344:556-63. [ Links ]
13. Polderman KH, Tjong T Jr, Peerdeman SM, Vandertop WP, Girbes AR. Effects of therapeutic hypothermia on intracranial pressure and outcome in patients with severe head injury. Intensive Care Med. 2002;28:1653-73. [ Links ]
14. McIntyre LA, Fergusson DA, Herbert PC, Moher D, Hutchison JS. Prolonged therapeutic hypothermia after traumatic brain injury in adults. A systematic review. JAMA. 2003;289:2992-9. [ Links ]
15. Compagnone C, Murray GD, Teasdale G, Maas AI, Esposito D, Princi P, et al. The management of the patients with intradural post-traumatic mass lesions: a multicenter survey of current approaches to surgical management in 729 patients coordinated by the European Brain Injury Consortium. Neurosurgery. 2005;57:1183-92. [ Links ]
16. Gower DJ, Lee KS, McWhorter JM. Role of subtemporal decompression in severe closed head injury. Neurosurgery. 1988;23:417-22. [ Links ]
17. Gaab MR, Rittierodt M, Lorenz M, Heissler HE. Traumatic brain swelling and operative decompression: a prospective investigation. Acta Neurochir Suppl. 1990;51:326-8. [ Links ]
18. Polin RS, Shaffrey ME, Bogaev CA, Tisdale N, Germanson T, Bocchicchio B, et al. Decompressive bifrontal craniectomy in the treatment of severe refractory posttraumatic cerebral edema. Neurosurgery. 1997;41:84-94. [ Links ]
19. Guerra WK, Gaab MR, Dietz H, Mueller JU, Piek J, Fritsch MJ. Surgical decompression for traumatic brain swelling: indications and results. J Neurosurg. 1999;51:187-96. [ Links ]
20. De Luca GP, Volpin L, Fornezza U, Cervellini P, Zanusso M, Casentini L, et al. The role of decompressive craniectomy in the treatment of uncontrollable post-traumatic intracranial hypertension. Acta Neurochir Suppl. 2000;76:401-4. [ Links ]
21. Taylor A, Butt W, Rosenfeld J, Shann F, Ditchfield M, Lewis E, et al. A randomized trial of very early decompressive craniectomyin children with traumatic brain injury and sustained intracranial hypertension. Childs Nerv Syst. 2001;17:154-62. [ Links ]
22. Whitfield PC, Patel H, Hutchinson PJ, Czosnyka M, Parry D, Menon D, et al. Bifrontal decompressive craniectomy in the management of posttraumatic intracranial hypertension. Br J Neurosurg. 2001;15:500-7. [ Links ]
23. Schneider GH, Bardt T, Lanksch WR, Unterberg A. Decompressive craniectomy following traumatic brain injury: ICP, CPP and neurological outcome. Acta Neurochir Suppl. 2002;81:77-9. [ Links ]
24. Albanese J, Leone M, Alliez JR, Kaya JM, Antonini F, Alliez B, et al. Decompressive craniectomy for severe traumatic brain injury: evaluation of the effects at one year. Crit Care Med. 2003;31:2535-8. [ Links ]
25. Jiang JY, Gao GY, Li WP, Yu MK, Zhu C. Early indicators of prognosis in 846 cases of severe traumatic brain injury. J Neurotrauma. 2002;19:869-74. [ Links ]
26. Timofeev I, Kirkpatrick PJ, Corteen E, Hiler M, Czosnyka M, Menon DK, et al. Decompressive craniectomy in traumatic brain injury: outcome following protocol-driven therapy. Acta Neurochir Suppl. 2006;96:11-6. [ Links ]
27. Aarabi B, Hesdorffer DC, Ahn ES, Aresco C, Scalea TM, Eisenberg HM. Outcome following decompressive craniectomy for malignant brain swelling due to severe head injury. J Neurosurg. 2006;104:469-79. [ Links ]
28. Meier U, Lemcke J, Reyer T, Grawe A. Decompressive craniectomy for severe head injury patients with major extracranial injuries. Acta Neurochir Suppl. 2006;96:373-6. [ Links ]
29. Pompucci A, De Bonis P, Pettorini B, Petrella G, Di Chirico A, Anile C. Decompresive craniectomy for traumatic brain injury: patient age and outcome. J Neurotrauma. 2007;24:1182-8. [ Links ]
30. Miller JD, Becker DP, Ward JD, Sullivan HG, Adams WE, Rosner MJ. Significance of intracranial hypertension in severe head injury. J Neurosurg. 1977;47:503-16. [ Links ]
31. Marshall LF, Smith RW, Shapiro HM. The outcome with aggressive treatment in severe head injuries. Part I: the significance of intracranial pressure monitoring. J Neurosurg. 1979;50:20-5. [ Links ]
32. Saul TG, Ducker TB. Effect of intracranial pressure monitoring and aggressive treatment on mortality in severe head injury. J Neurosurg. 1982;56:498-503. [ Links ]
33. Lubillo S, González B, Peña V, Morera J, Barrientes F. Craniectomía descompresiva en las lesiones expansivas intracraneales de origen traumático [resumen]. Med Intensiva. 2004;28 Supl 1:24. [ Links ]
34. Hutchinson PJ, Corteen E, Czosnyka M, Mendelow AD, Menon DK, Mitchell P, et al. Decompressive craniectomy in traumatic brain injury: the randomized multicenter RESCUE study. Acta Neurochir Suppl. 2006;96:17-20. [ Links ]
35. Sahuquillo J, Arikan F. Decompressive craniectomy for the treatment of refractory high intracraneal pressure in traumatic brain injury. Cochrane Datebase Syst Rev. 2006; 25,CD003983. [ Links ]
36. Moulin DE, Lo R, Chiang J, Barnett HJ. Prognosis in middle cerebral artery occlusion. Stroke. 1985;16:282-7. [ Links ]
37. Silver FL, Norris JW, Lewis AJ, Hachinski VC. Early mortality following stroke: a prospective review. Stroke. 1984; 15:492-8. [ Links ]
38. Hacke W, Schwab S, Horn M, Spranger M, De Georgia M, Von Kummer R. Malignant middle cerebral artery territory infarction: clinical course and prognostic signs. Arch Neurol. 1996;53:309-16. [ Links ]
39. Gupta R, Connolly ES, Mayer S, Elkind MS. Hemicraniectomy for massive middle cerebral artery territory infarction: a systematic review. Stroke. 2004;35:539-47. [ Links ]
40. Krieger DW, Demchuk AM, Kasner SE, Jauss M, Hantson L. Early clinical and radiological predictors of fatal brain swelling in ischemic stroke. Stroke. 1999;30:287-92. [ Links ]
41. Kasner SE, Demchuk AM, Berrouschot J, Schmutzhard E, Harms L, Verro P, et al. Predictor of fatal brain edema in massive hemispheric ischemic stroke. Stroke. 2001;32:2117-24. [ Links ]
42. Von Kummer R, Meyding-Lamade U, Forsting M, Rosin L, Rieke K, Hacke W, et al. Sensitivity and prognostic value of early computed tomography in middle cerebral artery trunk occlusion. Am J Neuroradiol. 1994;15:9-16. [ Links ]
43. Barber PA, Demchuk AM, Zhang J, Kasner SE, Hill MD, Berrouschot J, et al. Computed tomographyc parameters predicting fatal outcome in large middle cerebral artery infraction. Cerebrovasc Dis. 2003;16:230-40. [ Links ]
44. Dohmen C, Bosche B, Graf R, Staub F, Kracht L, Sobesky J, et al. Prognosis of malignant course in MCA infarction by PET and microdialysis. Stroke. 2003;32:2152-7. [ Links ]
45. Firlik AD, Yonas H, Kaufmann AM, Wechsler LR, Jungreis CA, Fukui MB, et al. Relationship between cerebral blood flow and the development of swelling and life-threatening herniation in acute ischemic stroke. J Neurosurg. 1998;89:243-9. [ Links ]
46. Berrouschot J, Barthel H, Von Kummer R, Knapp WH, Hesse S, Schneider D. 99m Technetium-ethyl-cysteinate-dimer single-photon emission CT can predict fatal ischemic brain edema. Stroke. 1998;29:2556-62. [ Links ]
47. Oppenheim C, Samson Y, Manay R, Lalam T, Vandamme X, Crozier S, et al. Prediction of malignant middle cerebral artery infarction by diffusion-weighted imageing. Stroke. 2000;31:2175-80. [ Links ]
48. Foerch C, Otto B, Singer OC, Neumann-Haefelin T, Yan B, Berkefeld J, et al. Serum S100B Predicts a malignant course of infarction in patients with acute middle cerebral artery occlusion. Stroke. 2004;35:2160-6. [ Links ]
49. Serena J, Blanco M, Castellanos M, Silva Y, Vivancos J, Moro MA, et al. The prediction of malignant cerebral infarction by molecular barrier disruption markers. Stroke. 2005;36:1921-7. [ Links ]
50. Mitka M. Hemicraniectomy improves outcomes for patients with ruptured brain aneurysms. JAMA. 2001;286:2084-8. [ Links ]
51. Smith ER, Carter BS, Ogilvy CS. Proposed use of prophylactic decompressive craniotomy in poor grade aneurismal subarchnoid hemorrhage patients presenting with associated large sylvian hematomas. Neurosurgery. 2002;51:117-24. [ Links ]
52. D'Ambrosio AL, Sughrue ME, Yogarson JG, Mocco JD, Kreiter KT, Mayer SA, et al. Decompressive hemicraniectomy for poor-grade aneurysmal subarachnoid hemorrhage patients with associated intracerebral hemorrhage: clinical outcome and quality of life assessment. Neurosurgery. 2005;56:12-9. [ Links ]
53. Schirmer CM, Hoit DA, Malek AD. Decompressive hemicraniectomy for the treatment of intractable intracranial hypertension after aneurysmal subarachnoid hemorrhage. Stroke. 2007;38:987-92. [ Links ]
54. Csokay A, Egyud L, Nagy L, Pataky G. Vascular tunnel creation to improve the efficacy of decompressive craniotomy in post-traumatic cerebral edema and ischemic stroke. Surg Neurol. 2002;57:126-9. [ Links ]
55. Ucar T, Akyuz M, Kazan S, Tuncer Rl. Role of decompressive surgery in the management of severe head injuries. Prognostic factors and patient selection. J Neurotrauma. 2005;22: 1311-8. [ Links ]
56. Munch E, Horn P, Shurer L, Piepgras A, Paul T, Schmiedek P. Management of severe traumatic brain injury by decompressive craniectomy. Neurosurgery. 2000;47:315-23. [ Links ]
57. Yamakami I, Yamaura A. Effects of decompressive craniectomy on regional cerebral blood flow in severe head injuries patients. Neurol Med Chir (Tokio). 1993;33:13-8. [ Links ]
58. Sahuquillo J, Biestro A, Mena MP, Amorós S, Lung M, Poca MA, et al. [First tier measures in the treatment of intracranial hypertension in the patient with severe craniocerebral trauma. Proposal and justification of a protocol]. Neurocirugía (Astur). 2002;13:78-100. [ Links ]
59. Jaeger M, Soehle M, Meixensberger J. Improvement of brain tissue oxygen and intracranial pressure during an surgical decompression for diffuse brain edema and space occupying infarction. Acta Neurochir Suppl. 2005;95:117-8. [ Links ]
60. Stiefel MF, Heuer GG, Smith MJ, Bloom S, Maloney-Wilensky E, Gracias VH, et al. Cerebral oxygenation following decompressive hemicraniectomy for the treatment of refractory intracranial hypertension. J Neurosurg. 2004;101:241-7. [ Links ]
61. Boret H, Fesselet J, Meaudre E, Gaillard PE, Cantais E. Cerebral microdialysis and PtiO2 for neuro-monitoring before decompresive craniectomy. Acta Anaesthesiol Scand. 2006;50: 252-4. [ Links ]
62. Piek J. Decompressive surgery in the threatment of traumatic brain injury. Curr Opin Crit Care. 2002;8:134-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. S. Lubillo Montenegro.
Jefe de Servicio de Medicina Intensiva. Hospital Universitario Nuestra Señora de Candelaria.
Carretera del Rosario, 145. 38100 Santa Cruz de Tenerife. España.
Correo electrónico: Slubmon@gobiernodecanarias.org
Aceptado: 17-11-2008.