My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos de la Sociedad Española de Oftalmología
Print version ISSN 0365-6691
Arch Soc Esp Oftalmol vol.87 n.4 Apr. 2012
Análisis bacteriológicos en el tratamiento de las conjuntivitis. Comparación de la resistencia a antibióticos entre 1982 y 2008
Bacteriological analysis in the management of conjunctivitis. Comparison of antibiotic resistance between 1982 and 2008
B. Carreras
Departamento de Cirugía y sus especialidades, Universidad de Granada, Granada, España
Dirección para correspondencia
RESUMEN
Objetivo: Mostrar la necesidad de análisis bacteriológicos para un tratamiento racional de las infecciones de la superficie ocular, incluyendo las conjuntivitis.
Métodos: Los resultados de 1.970 análisis bacteriológicos consecutivos, obtenidos desde 2001 a 2008, en pacientes con hiperemia conjuntival y secreción fueron contados y comparados con un estudio similar realizado en 1982 en la misma área geográfica.
Resultados: Se obtuvo crecimiento bacteriano en 1.044 casos (53%). Las bacterias más frecuentes fueron Staphylococci spp. (56,6%), seguidos de Streptococci spp. (21,4%), Haemophili spp. (12,1%) y otras bacterias gram-negativas (9,9%). Ningún antibiótico fue eficaz frente a todas las bacterias aisladas. La frecuencia de bacterias resistentes a la neomicina, tobramicina, eritromicina y gentamicina estaba significativamente aumentada con respecto al estudio de 1982.
Conclusiones: Los análisis bacteriológicos de las muestras obtenidas de la conjuntiva son necesarios para asegurar la elección de un antibiótico efectivo frente a las bacterias de la superficie ocular cuando fracasa el tratamiento inicial.
Palabras clave: Conjuntivitis. Bacterias. Antibióticos. Resistencia a los antibióticos.
ABSTRACT
Objective: To demonstrate the need for bacteriological analysis for the rational treatment of infections of the corneal surface, including conjunctivitis.
Methods: The results of 1,970 consecutive bacteriological analysis obtained from 2001 to 2008 in patients with ocular hyperemia and discharge were analysed and compared with a similar study done in 1982 in the same geographical area.
Results: Bacterial growth was obtained in 1,044 cases (53%). The most frequent bacteria were Staphylococci spp. (56.6%), followed by Streptococci spp. (21.4%), Haemophili spp. (12.1%), and other gram-negative bacteria (9.9%). No antibiotic was effective against all the bacteria isolated. The frequency of resistant bacteria against neomycin, tobramycin, erythromycin and gentamicin was significantly increased with respect to the study of 1982.
Conclusions: Bacteriological analysis of conjunctival specimens are necessary to ensure the choice of an effective antibiotic against bacteria of the ocular surface when the initial treatment fails.
Key words: Conjunctivitis. Bacteria. Antibiotics. Antibiotic resistance.
Introducción
El tratamiento de las conjuntivitis y la profilaxis de las infecciones en intervenciones de cirugía ocular o en lesiones traumáticas del segmento anterior se inicia habitualmente mediante la elección de un antibiótico que se supone de amplio espectro. Esta elección está basada en estudios previos que han mostrado la eficacia del antibiótico frente a una variedad de agentes infecciosos. Si no se realizan análisis bacteriológicos la elección tiende a recaer insistentemente en el mismo antibiótico inicial, pues tampoco se dispone de una base racional para elegir otro. El presente estudio pretende mostrar que esa actitud conduce a la pérdida de eficacia de los agentes antibacterianos por el incremento de bacterias resistentes a los antibióticos, y que es necesario realizar análisis bacteriológicos con antibiogramas para poder elegir el agente antibacteriano más eficaz cuando fracasa el tratamiento inicial.
Sujetos, material y métodos
Se analizan los resultados de 1.970 análisis bacteriológicos consecutivos realizados a los pacientes de la consulta privada (Dr. B. Carreras) desde el año 2001 hasta el año 2008.
La indicación de la toma de muestra se hizo en aquellos casos que presentaban hiperemia conjuntival y secreción y se sospechaba o se quería descartar la participación de una infección bacteriana en el cuadro clínico. Los pacientes que estaban poniéndose algún tipo de tratamiento previo por vía tópica lo interrumpieron completamente al menos 48h antes de la toma de muestra. Antes de esta no se hizo ningún tipo de lavado, ni se pusieron gotas, ni se tocó la conjuntiva con ningún otro material.
La toma de muestra se obtuvo del fondo de saco y conjuntiva tarsal inferiores con dispositivos comerciales fabricados expresamente para ese fin (Culturette®, Venturi Transystem®), que constan de un vástago de madera o plástico con una torunda estéril en una punta, un tapón en la otra punta y un tubo con un medio de enriquecimiento y transporte. Todos los elementos estaban en condiciones estériles, sellados y solamente fueron abiertos justo en el momento de la toma. Los vástagos con la torunda fueron asidos por el extremo del tapón, de forma que la torunda solamente tocase la conjuntiva tarsal antes de ser introducida en el medio de transporte y sin que el vástago tocase con nada salvo la parte superior del medio de transporte al introducirlo en el tubo.
Las muestras tomadas, junto con una hoja de petición en la que se pedía expresamente la inclusión en el antibiograma de una relación de antibióticos disponibles en forma de colirios o pomadas oftálmicas, fueron enviadas a diversos laboratorios privados de análisis clínicos, pero la mayoría de los resultados proceden del mismo laboratorio.
Habitualmente se utilizaron los siguientes medios de cultivo: M. Cled y McConkey, agar cetrimida, agar sangre, agar sabouraud gentamicina cloramfenicol, actidiona con rojo fenol y se incubaron a 37oC. Se diseñó una base de datos (OpenOffice.org Base v3.3.0) para introducir los resultados de los informes de los análisis bacteriológicos con los siguientes campos: número de identificación (asignado automáticamente), nombre (texto), sexo (1=varón, 2=mujer), año de nacimiento (número), mes del informe (número del 01 al 12), año del informe (número), cultivo (0=no crecimiento de bacterias, 1=crecimiento de bacterias), bacilos gram-negativos de cualquier tipo, cocos gram-positivos de cualquier tipo, estafilococo de cualquier tipo (Staphylococci spp.), Staphylococcus aureus, Staphylococci spp. coagulasa negativos (Staphylococcus epidermidis, etc.), Streptococci spp., Neisseria, Escherichia coli, Klebsiella, Enterobacter, Pseudomonas, Hemophili, Proteus, Serratia, (todos ellos con los valores iguales a los del campo cultivo, es decir, 0=no crecimiento de bacterias, 1=crecimiento de bacterias), ácido fusídico, ciprofloxacino, cloramfenicol, eritromicina, gentamicina, neomicina, norfloxacino, ofloxacino, rifampicina, tetraciclina, tobramicina, trimetoprim-sulfametoxazol, vancomicina, clindamicina, cefotaxima, cefazolina (todos ellos con los valores 0=no probado, 1=resistente, 2=intermedio, 3=sensible). Mediante las consultas correspondientes se obtuvieron las tablas de resultados. Los porcentajes de resistencias fueron comparados entre los distintos grupos de bacterias y también con el estudio realizado en 1982 por Al-Hiraki, Carreras y Cantalejo1. Se realizaron pruebas estadísticas de contingencia (prueba de Chi cuadrado y prueba de Fisher) para valorar su significación (GraphPad Prism v5.04).
Resultados
De los 1.970 informes de análisis bacteriológicos, 1.386 corresponden a mujeres y 584 a varones. Las edades estaban comprendidas entre pocos meses (0 años) y 102 años, con la media de edad en 54,4 años, desviación típica 22,2 años, y error típico 0,5 años.
Los cultivos fueron positivos en 1.044 casos (53%): 728 mujeres (69,73% de los cultivos positivos, 52,5% de las mujeres) y 316 varones (30,27% de los cultivos positivos, 54% de los varones). La edad media en los cultivos positivos era 57,8 años, desviación típica 21,5 años y error típico 0,7 años.
Las bacterias más frecuentemente aisladas en los exudados de la superficie ocular fueron Staphylococci spp. (56,6%), seguidos de Streptococci spp. (21,4%), Hemophili (12,1%) y otras bacterias gram-negativas (9,9%). Staphylococci spp. coagulasa negativos (Staphylococcus epidermidis, etc.) constituían el 41,2% de todas las bacterias aisladas y Staphylococcus aureus el 13,2%.
El antibiótico disponible en forma de colirios o pomadas frente al que apareció mayor porcentaje de bacterias resistentes, si consideramos el conjunto de todas las bacterias aisladas (Fig. 1), fue la neomicina, con un 76,7% de bacterias resistentes, seguido del ácido fusídico, con 55,2%; tobramicina, con 48,7%; eritromicina, con 46,2%; trimetoprim-sulfametoxazol, con 29,4%; ofloxacino, con 27,6%; tetraciclina, con 27,3%; gentamicina, con 22%; cloramfenicol, con 17,8%; norfloxacino, con 17,7%; ciprofloxacino con 13, 6% y rifampicina con 5,3% de bacterias resistentes.
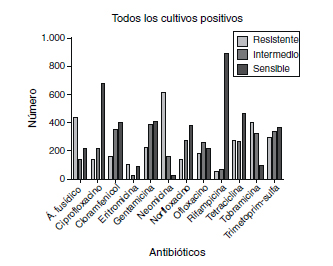
Fig. 1. Resultados de la sensibilidad a los antibióticos
del total de los cultivos positivos.
Si excluimos Staphylococci spp., el ácido fusídico pasa a ocupar el primer lugar en el porcentaje de bacterias resistentes, con un 87,6% del total, seguido de la neomicina, con 76,1%; tobramicina, con 43,1%; eritromicina, con 35,3%; tetraciclina, con 31,9%; trimetoprim-sulfametoxazol, con 29,4%; ofloxacino, con 28,2%; gentamicina, con 18,1%; cloramfenicol, con 17,8%; norfloxacino, con 15,4%; ciprofloxacino, con 12,3% y rifampicina, con 10,1%.
Si solamente consideramos Staphylococci spp. (Fig. 2), el antibiótico con mayor porcentaje de resistencias vuelve a ser la neomicina, con 77,4%, seguido de la tobramicina, con 54,9%; eritromicina con 46,9%,; trimetoprim-sulfametoxazol, con 29,3%; ofloxacino, con 27%; gentamicina, con 25%; tetraciclina, con 23,9%; norfloxacino, con 20,2%; ácido fusídico, con 18,9%; cloramfenicol, con 17,8%; ciprofloxacino, con 14,7% y rifampicina, con 1,7% de estafilococos resistentes. Frente a Staphylococcus aureus la frecuencia de resistencias de la neomicina llega al 91,76%; tobramicina al 67%; ofloxacino al 46,3%; norfloxacino al 39,5%; eritromicina al 36,5%; trimetoprim-sulfametoxazol al 31,85%; gentamicina al 29,9%; ciprofloxacino al 25,5%; cloramfenicol al 24,8%; ácido fusídico al 21,2%; tetraciclina al 19% y rifampicina al 5%. Frente a Staphylococci spp. coagulasa negativos, la neomicina sigue teniendo la frecuencia más alta de resistencias (74,56%) seguida de eritromicina (51,7%); tobramicina (51%); trimetoprim-sulfametoxazol (28,8%), tetraciclina (25,9%), gentamicina (24,2%), ofloxacino(20,5%), ácido fusídico (18,3%), cloramfenicol (15,76%), norfloxacino (14,8%), ciprofloxacino (11,7%), y rifampicina (1,7%).
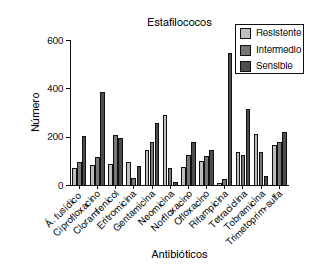
Fig. 2. Resultados de la sensibilidad a
los antibióticos de Staphylococci spp.
Frente a Streptococci spp. (Fig. 3) el antibiótico con mayor porcentaje de resistencias es el ácido fusídico (83,2%), seguido de neomicina (72,6%), tobramicina (51,2%), eritromicina (41,7%), ofloxacino (29,7%), trimetoprim-sulfametoxazol (27,6%), gentamicina (19,7%), cloramfenicol (18%), norfloxacino (17,5%), ciprofloxacino (16,1%) y rifampicina (1,4%).
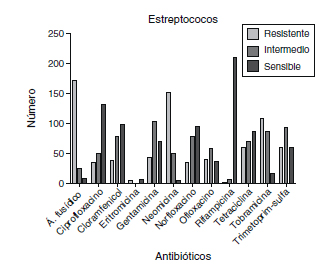
Fig. 3. Resultados de la sensibilidad a
los antibióticos de Streptococci spp.
Frente a las bacterias y bacilos gram-negativos (Fig. 4), el ácido fusídico (93,1%) vuelve a ocupar el primer puesto en la frecuencia de resistencias, seguido de neomicina (80%), tetraciclina (36,1%), tobramicina (32,1%), trimetoprim-sulfametoxazol (27,3%), ofloxacino (25,9%), rifampicina (18,6%), cloramfenicol (18,2%), gentamicina (15,3%), norfloxacino (12%) y ciprofloxacino (6,9%).
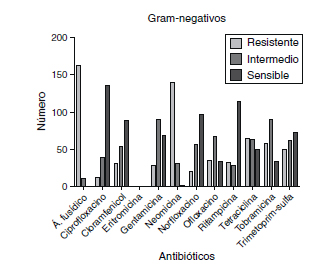
Fig. 4. Resultados de la sensibilidad a
los antibióticos de los bacilos gram-negativos.
Si comparamos los antibióticos disponibles en forma de colirio y pomadas comunes al estudio actual y al estudio realizado también en Granada en 19821 realizados en la misma zona geográfica (Fig. 5), vemos que la frecuencia de resistencias en el conjunto de todas las bacterias aisladas frente a la mayoría de los antibióticos disponibles en forma de colirios y pomadas en ambos estudios (neomicina, tobramicina, eritromicina, gentamicina) ha aumentado con diferencias estadísticamente significativas (p<0,0001 en todos los casos), pero frente al cloramfenicol y las tetraciclinas ha disminuido con diferencias estadísticamente significativas (p<0,0001 en ambos casos) y prácticamente no han cambiado para el trimetoprim-sulfametoxazol (diferencia estadísticamente no significativa). Si consideramos solamente Staphylococci spp., hay un aumento estadísticamente significativo de las resistencias al trimetoprim-sulfametoxazol (p=0,0119), además de a la neomicina (p<0,0001), la tobramicina (p<0,0001), la eritromicina (p<0,0001) y la gentamicina (p<0,0001), y una disminución estadísticamente significativa al cloramfenicol (p<0,0001) y a las tetraciclinas (p<0,0001). Si consideramos solamente las bacterias gram-negativas, se sigue observando el aumento de las resistencias frente a la neomicina (p<0,0001), la tobramicina (p=0.0158) y la gentamicina (p=0,0299); la disminución de resistencias frente al cloramfenicol y las tetraciclinas no es estadísticamente significativa, pero se observa una disminución estadísticamente significativa (p=0,023) de las resistencias frente al trimetoprim-sulfametoxazol.
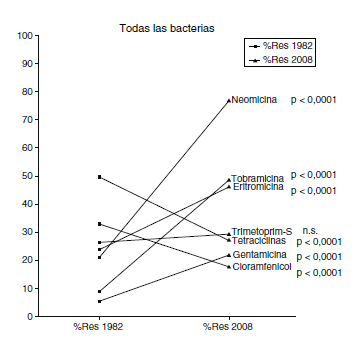
Fig. 5. Comparación del porcentaje de la sensibilidad de
los antibióticos frente a todas las bacterias entre 1982 y 2008.
Discusión
La actividad de los antibióticos frente a las bacterias aisladas en nuestro estudio es un ejemplo de lo que puede estar ocurriendo en la población general. De hecho, otros estudios en la literatura2-13 muestran un incremento de las resistencias de las bacterias a los antibióticos aunque los porcentajes de las distintas bacterias y las resistencias a los antibióticos varían de unos estudios a otros. Esto apoya la tesis general de este trabajo sobre la necesidad de realizar análisis bacteriológicos continuados para conocer la sensibilidad a los antibióticos de las bacterias de nuestro entorno.
La razón de exponer los resultados de la sensibilidad de las bacterias a los antibióticos en diferentes grupos es mostrar hasta qué punto las resistencias se deben a las características del espectro antimicrobiano del antibiótico (como puede ser el caso del ácido fusídico) o se debe a un aumento general de las resistencias.
Es evidente en los datos del estudio que no existe ningún antibacteriano entre los disponibles en colirios y pomadas que cubra el 100% de las bacterias. Además vemos que hay una gran frecuencia de resistencias a antibióticos de amplia difusión en el mercado. Llama la atención el alto porcentaje de resistencias frente a la tobramicina, teniendo en cuenta que parece ser el antibiótico inicial de elección para muchos médicos, oftalmólogos y no oftalmólogos.
La comparación con el estudio realizado también en Granada en 19821 muestra un comportamiento desigual en la evolución de las resistencias a los antibióticos. En aquellos tiempos (antes de 1982) los colirios y pomadas de cloramfenicol y tetraciclinas eran los que se usaban como antibacterianos de primera elección en la mayoría de los casos, cuando no se hacían cultivos y antibiogramas. La aparición de otros antibióticos en el mercado puede haber beneficiado la actividad antibacteriana del cloramfenicol y de las tetraciclinas, pero se ha reducido en gran medida la eficacia antibacteriana de la tobramicina, la eritromicina y, sobre todo, de la neomicina. Aun dentro del mismo grupo y mostrando también un incremento de las resistencias el comportamiento de la gentamicina no ha sido tan desfavorable como el de la tobramicina y el de la neomicina. El hecho de que con frecuencia los antibóticos se administren asociados a conservantes y corticosteroides puede haber ocultado a los clínicos en muchos casos la pérdida de su eficacia. En la medida de que los resultados de este estudio puedan ser aplicados al conjunto de la población, la indicación como fármaco de elección de la tobramicina o de la neomicina ante la sospecha de una infección ocular ha dejado de tener fundamentación racional.
Como consecuencia de este estudio podría decidirse que lo que hay que hacer es cambiar el antibiótico de elección inicial y usar una fluorquinolona para el tratamiento de las conjuntivitis infecciosas en vez de realizar análisis bacteriológicos. Pero esa actitud a largo plazo conducirá a la pérdida de eficacia de la fluorquinolona o del antibiótico elegido. Recientemente, Fintelman et al.14 han mostrado en cultivos de Staphylococcus aureus que el uso de fluorquinolonas por vía tópica en un plazo de tres meses antes de la prueba se asociaba a una mayor frecuencia de Staphylococcus aureus resistentes a estos antibióticos.
Aunque la realización de un análisis bacteriológico en la primera visita de un paciente con conjuntivitis parece el modo más adecuado de tratar una conjuntivitis infecciosa15, tal proceder es imposible en muchos casos por problemas de disponibilidad, es probablemente demasiado costoso en términos generales, y también, si se dispone de experiencia, innecesario en muchos casos. Pero en cuanto no se observe una mejoría significativa del cuadro clínico después de 4 o 5 días de tratamiento, debe reconsiderarse el diagnóstico inicial, suspender los tratamientos tópicos al menos 48h y tomar muestras de la superficie ocular para análisis bacteriológico. Además de mejorar nuestra eficacia terapéutica, la realización de análisis bacteriológicos permite orientar mejor la elección de los antibióticos usados en primera instancia y hacer rotaciones en su elección que dificulten el incremento de las bacterias resistentes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Al-Hiraki H, Carreras B, Sánchez-Cantalejo E. Eficacia de los antimicrobianos frente a la flora bacteriana conjuntival patológica. Arch Soc Esp Oftalmol. 1982; 42:585-93. [ Links ]
2. Shittu AO, Okon K, Adesida S, Oyedara O, Witte W, Strommenger B, et al. Antibiotic resistance and molecular epidemiology of Staphylococcus aureus in Nigeria. BMC Microbiol. 2011; 11:92-9. [ Links ]
3. Karpecki P, Paterno MR, Comstock TL. Limitations of current antibiotics for the treatment of bacterial conjunctivitis. Optom Vis Sci. 2010; 87:908-19. [ Links ]
4. NeBeta T. Multiresistente Keime in der Augenheilkunde. Ophthalmologe. 2010; 107:318-22. [ Links ]
5. Fernández-Rubio E, Urcelay JL, Cuesta-Rodríguez T. The antibiotic resistance pattern of conjunctival bacteria: a key for designing a cataract surgery prophylaxis. Eye. 2009; 23:1321-8. [ Links ]
6. Bertino JS. Impact of antibiotic resistance in the management of ocular infections: The role of current and future antibiotics. Clin Ophthalmol. 2009; 3:507-21. [ Links ]
7. Ubani UA. Bacteriology of external ocular infections in Aba, South Eastern Nigeria. Clin Exp Optom. 2009; 92:482-9. [ Links ]
8. Asbell PA, Colby KA, Deng S, McDonnell P, Meisler DM, Raizman MB, et al. Ocular TRUST: nationwide antimicrobial susceptibility patterns in ocular isolates. Am J Ophthalmol. 2008; 145:951-8. [ Links ]
9. Azevedo Gayoso MF, Dourado Oliveira AD, Alves d´Azevedo P, Zorat Yu MC, Höfling-Lima AL, Francisco W. Suscetibilidade antimicrobiana in vitro dos Staphylococcus coagulase negativa oculares. Arq Bras Oftalmol. 2007; 70:924-8. [ Links ]
10. Chalita MR, Hofling-Lima AL, Paranhos A, Schor P, Belfort R. Shifting trends in in vitro antibiotic susceptibilities for common ocular isolates during a period of 15 years. Am J Ophthalmol. 2004; 137:43-51. [ Links ]
11. Monroe S, Polk R. Antimicrobial use and bacterial resistance. Curr Opin Microbiol. 2000; 3:496-501. [ Links ]
12. Amstrong RA. The microbiology of the eye. Ophthal Physiol Opt. 2000; 20:429-41. [ Links ]
13. Pichichero ME. Bacterial conjunctivitis in children: antibacterial treatment options in an era of increasing drug resistance. Clin Pediatr. 2011; 50:7-13. [ Links ]
14. Fintelmann RE, Hoskins EN, Lietman TM, Keenan JD, Gaynor BD, Cevallos V, et al. Topical fluoroquinolone use as a risk factor for in vitro fluoroquinolone resistance in ocular cultures. Arch Ophthalmol. 2011; 129:399-402. [ Links ]
15. Everts RJ, Barnett T, Lahood BR. The utility of routine conjunctival swabs in management of conjunctivitis. NZ Med J. 2011; 124:64-71. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: bcarrera@ugr.es
Recibido 15 Junio 2011
Aceptado 27 Noviembre 2011














