My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Oncología (Barcelona)
Print version ISSN 0378-4835
Oncología (Barc.) vol.28 n.7 Jul. 2005
NOTAS CLÍNICAS
Sarcomas de útero después de tratamiento con tamoxifeno por cáncer de mama
J. I. Bermejo AycartI; S. Iniesta PérezII; T. Redondo MartínII; I. Gallego VillaescusaIII; M. C. García AndradeIII
IServicio de Ginecología y Obstetricia. Complejo Hospitalario. Hospital General. Segovia
IIServicio de Obstetricia y Ginecología. Hospital Universitario Santa Cristina. Madrid
IIIServicio de Anatomía Patológica. Hospital Universitario Santa Cristina. Madrid
Dirección para correspondencia
RESUMEN
PROPÓSITO: Descripción de dos casos de sarcomas en mujeres que recibieron tamoxifeno después del tratamiento quirúrgico de cáncer de mama.
MATERIAL Y MÉTODOS: Se describen dos casos de dos mujeres de 74 y 53 años que recibieron tratamiento con 20 mg diarios de tamoxifeno después del tratamiento quirúrgico de un cáncer de mama. Cuatro y dos años después de iniciar el tratamiento, desarrollaron un tumor Mülleriano mixto maligno heterólogo (Estadio III) y un sarcoma del estroma endometrial (Estadio I).
DISCUSIÓN: Los carcinosarcomas y otros sarcomas uterinos son raros, y ocurren en menos del 4% de los tumores uterinos. En la mayoría de los estudios se refieren tasas altas de estos tumores en mujeres postmenopáusicas, con cáncer de mama, tratadas con tamoxifeno, en comparación a las no tratadas, especialmente aquellas expuestas a largos periodos de tratamiento.
Palabras clave: Sarcoma uterino. Tamoxifeno. Cáncer de mama.
SUMMARY
PURPOSE: Description of two cases of sarcoma in women who received tamoxifen after the surgical treatment of breast cancer.
MATERIAL AND METHODS: We report two cases of 74 and 53 years old women that received tamoxifen 20 mg daily after the surgical treatment of breast cancer. Four and two years after initiation of tamoxifen treatment, they developed an heterologous malignant mixed Müllerian tumor (stage III) and an endometrial stromal sarcoma (stage I), respectively.
DISCUSSION: Carcinosarcomas and other uterine sarcomas are rare, accounting for fewer than 4% of uterine tumors. Most studies reported on a higher rate of these sarcomas among postmenopausal women with breast cancer treated with tamoxifen when compared with non-treated patients, especially those exposed to a long term treatment.
Key words: Uterine sarcoma. Tamoxifen. Breast cancer.
Introducción
El tamoxifeno es el tratamiento antiestrogénico de elección en pacientes postmenopáusicas con cáncer de mama y receptores estrogénicos positivos. Uno de sus efectos adversos más destacable es su acción proliferativa sobre el endometrio, desde hiperplasias, pólipos, carcinomas y sarcomas; llegando a identificarse hasta en el 36% de los casos tratados1 pero tratándose en su mayoría de alteraciones benignas del útero. Es por ello por lo que los ensayos prospectivos en este tipo de pacientes no desaconsejan el uso del tamoxifeno como tratamiento coadyuvante2-4, aunque se investigan otras líneas carentes de estos efectos adversos como los inhibidores de la aromatasa. Queremos presentar aquí 2 casos de sarcomas uterinos, en dos pacientes postmenopáusicas tratadas con tamoxifeno por un cáncer de mama, como una patología aunque poco frecuente, ampliamente descrita en la bibliografía.
Casos clínicos
Caso 1
Paciente de 74 años en 1997, que consulta por tumoración en mama izquierda de 4 cm y una adenopatía palpable. Estudio radiológico compatible con carcinoma. Es tratada mediante mastectomía radical modificada tipo Madden previa biopsia intraoperatoria positiva para carcinoma. Informe anatomopatológico: Carcinoma ductal infiltrante mucinoso (coloide) de 3.2 cm de eje máximo y una adenopatía positiva de 22 ganglios axilares aislados. Recibe como tratamiento complementario tamoxifeno a dosis de 20 mg diarios. Se realizan controles de rastreo de tumor que resultan negativos. Así mismo se realizan ecografías ginecológicas anuales que son normales. En Mayo de 2001 consulta por metrorragia postmenopáusica. Se realiza una ecografía vaginal que resulta ser compatible con "pólipo endometrial" de 19*16 mm. Se realiza una Histeroscopia donde se aprecia una formación excrecente en la cara anterior de vagina que es biopsiada y a nivel intrauterino una formación polipoidea con vasos anómalos, altamente sospechosa que es igualmente biopsiada. El informe anatomopatológico de la zona en vagina se informa como carcinoma pobremente diferenciado y la formación polipoidea como atipia celular no filiada.
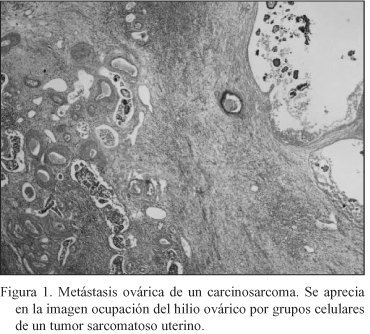
Se realiza una histerectomía total con doble anexectomía, manguito vaginal y linfadenectomía. Informe anatomopatológico: Lavado peritoneal positivo para células malignas. Tumor intracavitario de 6 cm, Tumor Mülleriano Mixto Maligno Heterólogo con extensa permeación vascular linfática. Metástasis múltiples en miometrio, trompa y ovarios (Fig. 1) y metástasis ganglionares. La formación de vagina es de un carcinoma pobremente diferenciado probablemente metástasis del tumor Mülleriano mixto descrito (Estadio III). Realiza tratamiento complementario con Taxol, que tolera mal, y radioterapia, falleciendo al año de este proceso.
Caso 2
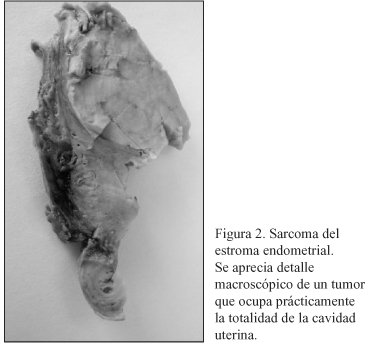
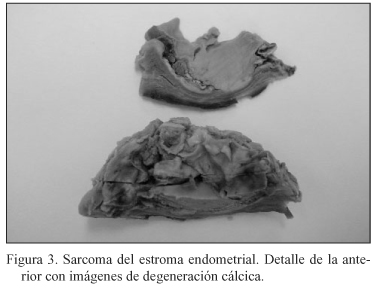
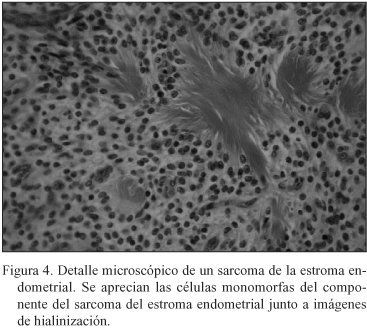
Paciente de 53 años en 1993 momento en el que se le realiza una biopsia diferida previa localización con arpón en mama izquierda por presentar unas microcalcificaciones sospechosas. Se informa como carcinoma ductal infiltrante G II con componente intraductal sólido. Se realiza mastectomía radical tipo Madden no objetivándose tumor residual y 21 ganglios linfáticos sin metástasis. No realiza tratamiento complementario. En 1996 tiene una recidiva local sobre la cicatriz realizándose una exéresis que es informada como recidiva local de carcinoma infiltrante de mama. Se indica tratamiento complementario con radioterapia y tamoxifeno 20 mg diarios. Dos años más tarde, en una revisión rutinaria, se le practica una ecografía vaginal en la que se describe un mioma de 7*8 cm no visto con anterioridad realizándose una histerectomía total con doble anexectomía. Informe anatomopatológico: "Sarcoma del estroma endometrial de bajo grado de malignidad e hiperplasia glandular quística de endometrio. Trompas y ovarios sin lesiones (Estadio I). (Figs. 2-4).
En Enero del 2002 la paciente presenta un cuadro de disnea con derrame pleural que resulta ser positivo para células tumorales, falleciendo a los seis meses por múltiples metástasis pulmonares.
Discusión
De nuestra población estudiada de 463 mujeres que realizaron tratamiento con 20 mg/diarios de tamoxifeno por cáncer de mama, 7 mujeres desarrollaron un cáncer de endometrio (1.55% de la población en estudio y 2.52 por mil mujeres año) siendo cinco de ellos adenocarcinomas de endometrio, un tumor Mülleriano mixto heterólogo y un sarcoma del estroma endometrial.
El tamoxifeno es un modulador selectivo del receptor estrogénico, utilizado como tratamiento hormonal estándar en la mujer con cáncer de mama y receptores de estrógenos positivo y como coadyuvante en algunos cánceres de mama metastásico, hasta que se concluyan los estudios con inhibidores de la aromatasa, sigue siendo de elección en mujeres postmenopáusicas con cáncer de mama y receptores de estrógeno positivo5. No obstante no se aconseja su uso durante más de cinco años por el riesgo de cáncer sobre el endometrio6.
La patología endometrial es más frecuente en mujeres con cáncer de mama tratadas con tamoxifeno que en las no tratadas7, existen múltiples publicaciones que demuestran un incremento del riesgo relativo del cáncer endometrial en mujeres con cáncer de mama tratadas con tamoxifeno versus las no tratadas7-11, Odds Ratio (OR) = 2.4, 95% Intervalo de Confianza (CI) = 1.8-3.0 e íntimamente relacionado con la duración del tratamiento; si comparamos tratadas más de 5 años con no tratadas el riesgo aumenta OR = 3.6 95% CI = 2.6-4.8.
Además el riesgo es mayor de desarrollar Tumores Müllerianos mesodérmicos mixtos OR = 13.5 95% CI 4.1-44.5 que adenocarcinomas OR = 2.1 95% CI 1.6-2.7 o carcinomas de células claras y serosopapilares OR = 3.1 95% CI = 0.8-17.912.
La mayoría de los carcinomas diagnosticados son endometrioides o adenocarcinomas como ocurre en nuestra serie9, 13.
En estudios recientes se ha puesto de manifiesto que los cánceres endometriales en postmenopáusicas con cáncer de mama y tratadas con tamoxifeno, fueron de diagnóstico en estadio más avanzado y de peor pronóstico que los tumores que desarrollaban las pacientes no tratadas con tamoxifeno7, 9, 11, 14, 15. Las dos pacientes descritas en nuestra casuística tuvieron una evolución muy desfavorable.
También se ha descrito una mayor incidencia de este tipo de sarcomas en las mujeres tratadas con tamoxifeno frente a las no tratadas (15.4% vs 2.9% p>0.02 de todas las pacientes con tumores uterinos)11, 14, 15.
No existen test de diagnóstico temprano ni recomendaciones para el diagnóstico de estas patologías en mujeres que toman tamoxifeno, siendo el sangrado vaginal el único elemento de alarma, como igualmente piensa el Colegio Americano de Obstetras y Ginecólogos.
Existen factores que incrementan el riesgo de desarrollar adenocarcinomas como son la obesidad o la terapia hormonal sustitutiva sólo con estrógenos en la menopausia y la radioterapia en el caso de los sarcomas, por ello podríamos replantearnos un tratamiento concreto con tamoxifeno ante estos factores de riesgo y sustituirlo por otros fármacos como son los inhibidores de la aromatasa.
Bibliografía
1. Cohen I. Endometrial pathologies associated with postmenopausal tamoxifen treatment. Ginecology Oncology 2004;94:256-266. [ Links ]
2. Bertelli G, Venturini M, Del Mastro L, et al. Tamoxifen and the endometrium: findings of pelvic ultrasound examination and endometrial biopsy in asymtomatic breast cancer patients. Breast Cancer Res Treat 1998;47:41-46. [ Links ]
3. Love CD, Muir BB, Scrimgeour JB, et al. Investigation of endometrial abnormalities in asymtomatic women treated with tamoxifen and an evaluation of the role of endometrial screening. J Clin Oncol 1999;17:2050-2054. [ Links ]
4. Seoud MA-F, Shamseddine A, Kahlil A, et al. Tamoxifen and endometrial pathologies: a prospective study. Gynecol Oncol 1999;75:15-19. [ Links ]
5. Tamoxifen for early breast cancer: an overview of the randomised trials. Early Breast Cancer Trialists' Collaborative Group. Lancet 1998;351:1451-1467. [ Links ]
6. Kloos I, Delaloge S, Pantier P, et al. Tamoxifen - related uterine carcinosarcomas occur under/after prolonged treatment: report of five cases and review of the literature. Int J Gynecol Cancer 2002;12:496-500. [ Links ]
7. Deligdisch L, Kalir N, Cohen CJ, et al. Endometrial histopathology in 700 patients treated with tamoxifen for breast cancer. Gynecol Oncol 2000;78:181-186. [ Links ]
8. Fornander T, Cedermak B, Mattson A, et al. Adjuvant tamoxifen in early breast cancer: occurrence of new primary cancers. Lancet 1989;I:117-120. [ Links ]
9. Mignotte H, Lasset C, Bonadona V, et al. Iatrogenic risks of endometrial carcinoma after treatment for breast cancer in a large French case - control study. Int J Cancer 1998; 76:325 - 330. [ Links ]
10. Early Breast Cancer Trialists' Collaborative Group. Systemic treatment of early breast cancer by hormonal, cytotoxic and immune therapy. Lancet 1992;339:1-15, 71-85. [ Links ]
11. Lasset C, Bonadona V, Mignotte H, Bremond A. Tamoxifen and risk of endometrial cancer. Lancet 2001;357:66-7. [ Links ]
12. Swerdlow AJ, Jones ME, British Tamoxifen Second Cancer Study Group. Tamoxifen treatment for breast cancer and risk of endometrial cancer: a case - control study. J Nat Cancer Inst 2005 Mar 2;97(5):375-84 [ Links ]
13. Barakat RR, Wong G, Curtis JP, et al. Tamoxifen use in breast cancer patients who subsequently developed corpus cancer is not associated with a higher incidence of adverse histologic features. Gynecol Oncol 1994;55:164-168. [ Links ]
14. Narod SA, Pal T, Graham T, et al. Tamoxifen and risk of endometrial cancer. Lancet 2001;357:65-66 [ Links ]
15. Bergman L, Beelen ML, Gallee MP, et al. Risk and prognosis of endometrial cancer after tamoxifen for breast cancer. Lancet 2000;356:881-887. [ Links ]
 Dirección para correspondencia
Dirección para correspondencia
Dr. J. I. Bermejo Aycart
Servicio de Ginecología y Obstetricia
Complejo Hospitalario
Hospital General de Segovia
Carretera de Ávila, s/n
E-40002 Segovia
Recibido: 27.05.05
Aceptado: 06.07.05














