My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.96 n.10 Madrid Oct. 2004
| TRABAJOS ORIGINALES |
El fracaso orgánico precoz como mejor factor predictivo de mortalidad en la
pancreatitis aguda
I. Poves Prim, J. Fabregat Prous, F. J. García Borobia, R. Jorba Martí, J. Figueras Felip y E. Jaurrieta Mas
Servicio de Cirugía General y del Aparato Digestivo. Hospital Prínceps d’Espanya. Citutat Sanitària i Universitària de Bellvitge.
L’Hospitalet del Llobregat. Barcelona
RESUMEN
Introducción: el APACHE II se ha utilizado como factor predictivo de gravedad en la pancratitis aguda (PA). La instauración de fracaso orgánico (FO) en la PA se correlaciona con una mayor mortalidad.
Objetivos: evaluar la utilidad del APACHE II como factor predictivo precoz de gravedad en la PA, su correlación con el FO y la relevancia del establecimiento precoz del FO en la PA.
Pacientes y métodos: desde enero de 1999 hasta noviembre de 2001 se estudiaron 447 pacientes ingresados consecutivamente por PA. Se utilizó el sistema APACHE II y los criterios de Atlanta para evaluar la gravedad.
Resultados: el 25% de los pacientes presentaron una pancreatitis aguda grave (PAG). El APACHE II a las 24 horas del ingreso mostró una sensibilidad, especificidad, valor predictivo positivo y negativo del 52, 77, 46 y 84%, respectivamente, como marcador de gravedad. La mortalidad global de la PAG fue del 20,5%. El 70% de los pacientes que presentaron FO lo hicieron en las primeras 24 horas del ingreso, falleciendo el 52% de ellos. La mortalidad fue significativamente mayor (p < 0,01) si el FO se estableció en ese periodo.
Conclusiones: el APACHE II por si solo no es un sistema fiable de detección precoz de gravedad en las primeras 24 horas del ingreso por lo que debe utilizarse junto con otros métodos. El FO suele establecerse en los primeros días del curso evolutivo de la PA. La precocidad del establecimiento del FO muestra una estrecha relación con la mortalidad en la PA.
Palabras clave: Pancreatitis aguda grave. Fracaso orgánico. APACHE II.
INTRODUCCIÓN
El sistema APACHE II (1) es un sistema de evaluación de gravedad para procesos agudos, relativamente sencillo de realizar, que ha mostrado utilidad en la valoración de severidad de la pancreatitis aguda (PA) (2). A diferencia de otros métodos, puede utilizarse desde el momento del ingreso y durante todo el curso evolutivo de la enfermedad. En la PA se ha demostrado una estrecha relación entre la evolución clínica y los registros de puntuación APACHE II (3,4).
La reunión internacional de expertos de Atlanta en 1992 promovió la generalización del uso del APACHE II en la evaluación de gravedad de la PA. En dicha reunión se consideró que la PA cumplía criterios de gravedad si se asociaba fracaso orgánico (FO) y/o complicaciones locales tales como necrosis pancreática, absceso o pseudoquistes (5). La pancreatitis aguda grave (PAG) se caracterizaría por presentar ocho o más puntos en el sistema APACHE II.
El objetivo del estudio es evaluar la utilidad real del sistema APACHE II como factor pronóstico precoz de gravedad en la PA correlacionando sus puntuaciones con el curso evolutivo de la enfermedad y la existencia de FO, así como evaluar la relación entre la mortalidad y establecimiento precoz de FO en los pacientes que presenten una PAG.
PACIENTES Y MÉTODOS
Desde enero de 1999 a noviembre de 2001, ingresaron consecutivamente en nuestro centro 447 pacientes con el diagnóstico de PA. El diagnóstico se realizó en base a la presentación de un cuadro clínico compatible junto a la elevación de los valores séricos de amilasa tres veces por encima de lo normal (normal < 2,16 ukat/l) y/o valores de amilasa en orina superiores a 20 ukat/l (normal < 18 ukat/l). Los pacientes con diagnóstico dudoso o cuyo diagnóstico final se modificó en base a otros hallazgos y aquellos con pancreatitis crónica se excluyeron del estudio.
La puntuación APACHE II se calculó al ingreso, a las 24 h, a las 48 h y diariamente hasta presentar mejoría clínica o fallecer. Los parámetros fisiológicos (temperatura, frecuencia cardiaca, tensión arterial y frecuencia respiratoria) se registraron cada 6 horas y la escala de coma de Glasgow una vez al día. La puntuación diaria APACHE II se calculó en base a los registros más anormales durante las 24 horas. Para estudiar el FO precoz, se incluyeron sólo los pacientes que acudieron a urgencias dentro de las primeras 48 horas desde el inicio de los síntomas.
Se realizó una tomografía computadorizada (TC) abdominal ante la sospecha de complicaciones locales, en caso de deterioro clínico, existencia de FO o cuando el diagnóstico de PA era dudoso. Se practicaron hemocultivos y punción aspiración con aguja fina guiada por TC (PAAF) ante la sospecha de infección pancreática (fiebre alta con leucocitosis, FO o deterioro clínico).
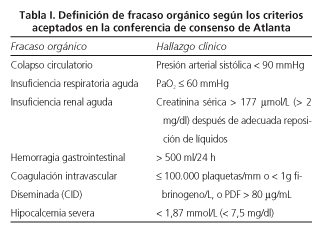
Se utilizó la clasificación de Atlanta, basada en hallazgos clínicos y radiológicos, para determinar la gravedad de la PA (5,6). La PA se consideró grave cuando se asoció FO (Tabla I) y/o complicaciones locales. Aquellos pacientes con hipoxemia inicial, hipotensión transitoria o insuficiencia real aguda en el momento del ingreso, atribuida a deshidratación previa y que respondieron rápida y eficazmente a la reposición hidroelectrolítica, no se consideraron como PAG si no se hallaron complicaciones locales en la TC.
Se indicó tratamiento quirúrgico en los pacientes que presentaron una pancreatitis infectada diagnosticada por PAAF y en aquellos que presentaron una PAG estéril con evolución catastrófica y disfunción orgánica severa a pesar del tratamiento médico intensivo de soporte.
Se utilizó el test estadístico de la t de Student para comparar las puntuaciones del APACHE II. Para el estudio de las variables cualitativas se utilizó test exacto de Fisher's. En ambos tests, se consideró que las diferencias eran significativas si la p < 0,05.
RESULTADOS
Etiología
Las causas etiológicas de PA durante el ingreso fueron: litiasis biliar y/o coledocal en 266 pacientes (59,5%), idiopática en 86 (19,3%), alcohol en 61 (13,6%) y otros factores reconocibles (colangiopancreatografía retrógrada endoscópica, fármacos, neoplasia, etc.) en 34 (7,6%).
Criterios de gravedad
Según la clasificación de Atlanta, el 75% de los casos (335 pacientes) fueron PA leves y el 25% graves (112 pacientes). El pico máximo de proteína C reactiva (PCR) en las primeras 48 horas del ingreso fue de 89 ± 88 y 277 ± 111 mg/l, respectivamente para la PA leve y grave. En los pacientes con PAG, 57 presentaron FO, 62 necrosis pancreática y 100 colecciones agudas múltiples.
Tratamiento quirúrgico
Se operaron 37 pacientes por PAG. Las indicaciones para tratamiento quirúrgico fueron: sepsis con hemocultivos y/o PAAF positiva en 27 pacientes (73%), pancreatitis estéril con FO persistente o deterioro clínico progresivo a pesar del tratamiento médico intensivo en 7 pacientes (18,9%), hemorragia intraabdominal masiva en 2 pacientes (5,4%) y 1 (2,7%) paciente por presentar una oclusión intestinal por bezoar duodenal que era la causa de la PAG.
Veinte pacientes se operaron en la primera semana del ingreso, ocho en la segunda, cuatro en la tercera y cinco a partir de la cuarta (Fig. 1). El 65% de los pacientes operados en la primera semana del ingreso presentaban una infección de la necrosis pancreática.
Puntuación APACHE II
En 8 pacientes no se pudo registrar la puntuación APACHE II en el ingreso y a las 24 horas. La puntuación APACHE II media al ingreso, en las primeras 24 horas y la puntuación pico máxima fue de 6,1 ± 3,8, 5,3 ± 3,7, 6,5 ± 4, y 8,6 ± 4,8, 9,1 ± 5.1, 12,2 ± 6,3, respectivamente para la PA leve y grave. Mientras que en la PA leve el pico máximo se alcanzó en las primeras 24 horas del ingreso (0,3 ± 0,1 días), en la PAG este se alcanzó pasadas las primeras 48 horas del mismo (4,1 ± 7,8 días). El pico máximo del APACHE II se presentó en el momento del ingreso en el 81% (270/331) y 34% (37/108) de los pacientes con una PA leve y grave, respectivamente. Si se tienen en cuenta las primeras 24 horas del ingreso, la puntuación pico se obtuvo en el 94% (311/331) y el 56% (60/108) de los pacientes con una PA leve y grave, respectivamente.
El 37% (126/335) de los pacientes con una PA leve tuvieron una puntuación pico ≥ 8. Ciento uno de esos pacientes tenían más de 65 años y otros siete enfermedades crónicas graves asociadas. En el 85% de los pacientes con una PA leve y APACHE II ≥ 8, se pudo atribuir esta elevada puntuación exclusivamente al valor específico que representa la edad y el estado previo de enfermedad crónica, no a la respuesta inflamatoria o gravedad de la PA.
En la tabla II se muestra la sensibilidad, especificidad, valor predictivo positivo y negativo del sistema APACHE II como factor predictivo de gravedad para un punto de corte ≥ 8 puntos y según el tiempo de evolución desde el ingreso.
La puntuación APACHE II al ingreso, a las 24 h y el pico máximo fueron de 10,4 ± 5,2, 11,3 ± 5,4 y 15,6 ± 6,5 para aquellos pacientes que presentaron una PAG con FO. En aquellos con PAG sin FO las puntuaciones registradas fueron de 6,7 ± 3,4, 6,6 ± 3,4 y 8,4 ± 3,2. Las diferencias en estas puntuaciones fueron estadísticamente significativas entre ambos grupos dependiendo de la presencia o no de FO (p < 0,01).
Evolución y seguimiento
No hubo ninguna muerte en el grupo de la PA leve y ninguno de estos pacientes tuvo que ser operado. La mortalidad global de la PAG fue del 20,5% (23/112). La mortalidad osciló entre un 40,3% (23/57) y un 0% (0/55) dependiendo de si, respectivamente, se estableció FO o no. Las causas de las muertes fueron: 13 por fracaso orgánico múltiple (FOM) sin respuesta al tratamiento médico intensivo ni al quirúrgico (9 PA estériles y 4 infectadas); 5 por insuficiencia respiratoria aguda intratable; 1 por hemorragia cerebral; 2 por sepsis intraabdominal persistente; 1 por hemorragia intraabdominal difusa y 1 por hemorragia digestiva alta masiva. Diez de los pacientes fallecidos eran ancianos (más de 75 años) con enfermedad crónica grave asociada (7 padecían de insuficiencia cardiaca y 3 de insuficiencia respiratoria crónica severa). Cuatro de los otros pacientes que fallecieron presentaban una obesidad mórbida y uno una insuficiencia renal crónica.
Diecinueve pacientes presentaron FO en el momento del ingreso, veintiuno en las siguientes 24 horas, nueve entre las 24 y 48 horas del ingreso y ocho después de las primeras 48 horas del ingreso. La mortalidad fue significativamente mayor en aquellos pacientes en los que el FO se estableció en las primeras 24 horas del ingreso (p < 0,01) (Tabla III).
Veintiseis de los 37 pacientes operados presentaron FO previo. La mortalidad en estos fue del 46% (12/26). Ninguno de los pacientes operados sin FO previo falleció.
DISCUSIÓN
La PA es una enfermedad compleja que puede afectar tanto al páncreas, como a órganos adyacentes y a distancia (6), demostrándose por alteraciones en la microvascularización tanto del páncreas, como del hígado, colon y pulmones (7) y cuyas complicaciones son difíciles de prevenir (8). Debido a la poca efectividad del tratamiento médico surge la necesidad de utilizar factores de predicción precoz de mala evolución (9,10). El soporte de órganos vitales es el único tratamiento que se ha demostrado efectivo. Ninguno de los factores pronósticos de gravedad habitualmente utilizados, APACHE II (2-4) y la TC abdominal (11,12), han demostrado tener influencia clara en mejorar el pronóstico final en la PAG.
Dado que la PA es una enfermedad sistémica, se han propuesto sistemas de puntuación basados en parámetros fisiológicos y bioquímicos para evaluar la gravedad del proceso, siendo el APACHE II uno de los más fiables (3,4). Su aplicación ya desde las primeras 24 horas del ingreso permite, además de equipararse en fiabilidad a otros como los criterios de Ranson o Glasgow (13), un mejor seguimiento durante todo el curso clínico del proceso. No obstante, sigue siendo impreciso por lo que se siguen comunicando otros nuevos (14). El sistema APACHE III, propuesto para mejorar la estratificación del riesgo en los pacientes hospitalizados graves (15), no ha demostrado beneficios respecto al APACHE II (16). La determinación en orina del péptido activador del tripsinógeno (TAP) ha mostrado una adecuada predicción de gravedad, como marcador único, pasadas 24 horas después del inicio de los síntomas (17). En el estudio multicéntrico de Neoptolemos y cols., la sensibilidad, especificidad, valor predictivo positivo y negativo del TAP urinario a las 24 horas fueron del 58, 73, 39 y 86%, respectivamente (18). Estos valores son similares a los obtenidos en nuestro estudio para el APACHE II al ingreso y a las 24 horas. Ninguno de los factores de predicción precoz de gravedad comunicados se ha mostrado como el ideal y todos ellos, incluido el APACHE II, como hemos demostrado, muestran carencias.
La mortalidad en la PA suele atribuirse a las complicaciones sistémicas (9,19). El FO representa la manifestación clínica de la respuesta sistémica inflamatoria causada por la liberación masiva de sustancias vasoactivas a la circulación sistémica (20,21). Las alteraciones en la microcirculación de los órganos afectados aparecen desde la instauración del proceso y pueden persistir más de 48 horas (6). Se ha demostrado que la mortalidad en los pacientes con necrosis pancreática es mayor si se asocia FO, variando entre un 20 y 40% dependiendo de las series (22-25). La aparición del FO se determinaría tanto por la existencia de infección bacteriana, como por la extensión de la necrosis pancreática estéril (26). Los trabajos clásicos de Beger parecían mostrar que la infección pancreática sucedía predominantemente en fases tardías de la enfermedad (27,28). En estos pacientes, el FO aparecería en fases tardías del ingreso. En cambio, cuando el FO se instaura en una pancreatitis estéril, suele hacerlo en las fases tempranas de la enfermedad (22,26).
Los hallazgos de nuestro estudio corroboran el hecho que la severidad del proceso inflamatorio que afecta a órganos lejanos en la PA se establece en las primeras horas del curso de la enfermedad. Como se ha demostrado en otros estudios (24), existe un subgrupo de pacientes que presentan una PAG en la que el FO se instaura de forma precoz, estando generalmente presente en el momento del ingreso, y que suele ser intratable y de pronóstico infausto. Veintiuno de los veintitrés pacientes de nuestra serie que fallecieron presentaron FO en las primeras 24 horas del ingreso. En base a nuestros resultados, la ausencia de FO en las primeras 24 horas del ingreso resultaría como un factor predictivo de supervivencia muy fiable. Según Buter y cols. (29), el deterioro de la disfunción orgánica durante la primera semana del ingreso sería determinante de supervivencia; pero más aún, en nuestra opinión, el momento del establecimiento del FO sería el factor más importante. Cuanto más tarde se establece el FO, mejor es el pronóstico. El tratamiento quirúrgico, efectivo para el manejo de las complicaciones locales que suceden en la necrosis infectada, deja de serlo para el control de las complicaciones sistémicas. Cuanto más tardíamente se precise realizar el desbridamiento quirúrgico, más efectivo será este. Desafortunadamente, en nuestra serie, la mayoría de los pacientes operados, tuvieron que ser sometidos a desbridamiento quirúrgico en la primera semana del ingreso (Tabla II).
Considerando una puntuación APACHE II ≥ 8 puntos como predictiva de gravedad en la PA (5), en nuestro grupo de pacientes este punto de corte mostró una mala sensibilidad, especificidad y valor predictivo positivo. Esta pobre sensibilidad probablemente se pueda atribuir al excesivo peso que tiene la edad avanzada y el estado crónico preexistente de salud en la puntuación final del APACHE II. Según nuestros resultados, consideramos que el punto de corte del APACHE II ≥ 8 no refleja la severidad del proceso en los pacientes sin FO. Ningún paciente sin FO y con una puntuación ≥ 8 falleció, en cambio, todos los pacientes que presentaron FO que murieron obtuvieron puntuaciones máximas pico ≥ 8. Estos resultados consolidan las conclusiones descritas por Lankisch y cols. (30), respecto a que la puntuación APACHE II en el momento del ingreso no sería determinante para el diagnóstico de necrosis pancreática. En nuestra opinión, el APACHE II no debe ser utilizado aisladamente, sino que debe apoyar la valoración clínica y la cuidadosa búsqueda de signos de FO.
El FO es el principal factor pronóstico para detectar evolución desfavorable y riesgo de muerte en la PA. Una puntuación corte del APACHE II ≥ 8 no es fiable para predecir la evolución en las primeras 48 horas del ingreso, siendo su principal utilidad en la PA la de servir como modelo de referencia para nuevos métodos predictivos y para comparación interinstitucional de distintas series. Los pacientes que presentan una PAG con instauración del FO en las primeras 24 horas del ingreso son aquellos que tendrán un peor pronóstico y evolución desfavorable. Un estricto seguimiento de los parámetros de FO, definidos en la conferencia de consenso de Atlanta, durante las primeras 24 horas del ingreso es el método más fiable y adecuado para predecir gravedad en la PA, siendo el riesgo de muerte superior al 50% en estos casos.
BIBLIOGRAFÍA
1. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13: 818-29. [ Links ]
2. Banks PA. Practice guidelines in acute pancreatitis. Am J Gastroenterol 1997; 92: 377-86. [ Links ]
3. Larvin M, McMahon MJ. APACHE II score for assessment and monitoring of acute pancreatitis. Lancet 1989; II: 201-4. [ Links ]
4. Wilson C, Heads A, Imrie CW. Prediction of outcome in acute pancreatitis: a comparative study of APACHE II, clinical assessment and multiple factor scoring systems. Br J Surg 1990; 77: 1260-4. [ Links ]
5. Bradley III E. A clinically based classification system for acute pancreatitis. Arch Surg 1993; 128: 586-90. [ Links ]
6. Banks PA. A new classfication system for acute pancreatitis. Am J Gastroenterol 1994; 89: 151-2. [ Links ]
7. Foitzik T, Eibl G, Hotz B, Hotz H, Kahrau S, Kasten C, et al. Persistent multiple organ microcirculatory disorders in severe acute pancreatitis: experimental findings and clinical implications. Dig Dis Sci 2002; 47: 130-8. [ Links ]
8. Mozo G, Del Olmo ML, Caro-Patón A, Reyes E, Manzano L, Belmonte A, et al. Lung changes and cytokine levels in a model of experimental acute pancreatitis. Rev Esp Enferm Dig 2002; 94: 53-66. [ Links ]
9. Beger HG, Rau B, Isenmann R. Prevention of severe change in acute pancreatitis: prediction and prevention. J Hepatobiliary Pancreat Surg 2001; 8: 140-7. [ Links ]
10. Banks PA. Acute pancreatitis: medical and surgical management. Am J Gastroentol 1994; 89: S78-85. [ Links ]
11. Wyncoll DL. The management of severe acute necrotizing pancreatitis: an evidence-based review of the literature. Intensive Care Med 1999; 25: 146-56. [ Links ]
12. Banks PA. Predictors of severity in acute pancreatitis. Pancreas 1991; 6 (Supl. 1): S7-S12. [ Links ]
13. Ribeiro MD, Paiva JA, Landeiro N, Duarte J. Patients with severe acute pancreatitis should be more often treated in an Intensive Care Department. Rev Esp Enferm Dig 2002; 94: 523-32. [ Links ]
14. Zhu AJ, Shi JS, Sun XJ. Risk factors influencing mortality of patients with severe acute pancreatitis within 24 hours after admission. Hepatobiliary Pancreat Dis Int 2003; 2: 453-7 [ Links ]
15. Balthazar EJ, Robinson DL, Megibow AJ, Ranson JHC. Acute pancreatitis: value of CT in establishing prognosis. Radiology 1990; 174: 331-6. [ Links ]
16. Basterra G, Álvarez M, Marcaide A, Delgado E, Díaz de Otazu R, García Campos F. Acute pancreatitis: evaluation of the prognostic criteria of the latest Baltasar tomographic classification. Rev Esp Enferm Dig 1999; 91: 433-8. [ Links ]
17. Johnson CD, Toh S. Prediction of severity in acute pancreatitis. In: Pancreatic disease, Towards the year. 2nd ed. Springer, 2000. [ Links ]
18. Yadav D, Agarwal N, Pitchumoni CS. A critical evaluation of laboratory tests in acute pancreatitis Am J Gastroenterol 2002; 97: 1309-18. [ Links ]
19. Knaus WA, Wagner DP, Draper EA, Zimmerman JE, Bergner M, Bastos PG, et al. The APACHE III prognostic system. Risk prediction of hospital mortality for critically ill hospitalized patients. Chest 1991; 100: 1619-36. [ Links ]
20. Chatzicostas C, Roussomoustakaki M, Vlachonikolis IG, Notas G, Mouzas I, Samonakis D, et al. Comparison of Ranson, APACHE II and APACHE III scoring systems in acute pancreatitis. Pancreas 2002; 25: 331-5. [ Links ]
21. Luengo L, Castellote M, Ros S, Feliu F, Vadillo J, Olona C. Clinical usefulness of the determination of the lipase/elastase ratio and of the polymorphonuclear elastase in the hospital admission of the patient with acute pancreatitis. Rev Esp Enferm Dig 1996; 88: 551-4. [ Links ]
22. Tenner S, Fernández-del Castillo C, Warshaw A, Steinberg W, Hermon-Taylor J, Valenzuela JE, et al. Urinary trysinogen activation peptide (TAP) predicts severity in patients with acute pancreatitis. Int J Pancreatol 1997; 21: 105-10. [ Links ]
23. Neoptolemos JP, Kemppainen EA, Mayer JM, Fitzpatrick JM, Raraty MG, Slavin J, et al. Early prediction of severity in acute pancreatitis by urinary trypsinogen activation peptide: a multicentre study. Lancet 2000; 355 (9219): 1955-60. [ Links ]
24. Bradley EL. Necrotizing pancreatitis. Br J Surg 1999; 86: 147-8. [ Links ]
25. Norman J. The role of cytokines in the pathogenesis of acute pancreatitis. Am J Surg 1998; 175: 76-83. [ Links ]
26. Karne S, Gorelick F. Etiopathogenesis of acute pancreatitis. Surg Clin North Am 1999; 79: 699-710. [ Links ]
27. Rau B, Pralle U, Uhl W, Schoenberg MH, Beger HG. Management of sterile necrosis in instances of severe acute pancreatitis. J Am Coll Surg 1995; 181: 279-88. [ Links ]
28. Poves I, Fabregat J, Biondo S, Jorba R, Borobia FG, Llado L, et al. Results of treatment in severe acute pancreatitis. Rev Esp Enferm Dig 2000; 92: 586-90. [ Links ]
29. Isenmann R, Rau B, Beger HG. Early severe acute pancreatitis: characteristics of a new subgroup. Pancreas 2001; 22: 274-8. [ Links ]
30. Soran A, Chelluri L, Lee KK, Tisherman SA. Outcome and quality of life of patients with acute pancreatitis requiring intensive care. J Surg Res 2000; 91: 89-94. [ Links ]
31. Isenmann R, Rau B, Beger HG. Bacterial infection and extent of necrosis are determinants of organ failure in patients with acute necrotizing pancreatitis. Br J Surg 1999; 86: 1020-4. [ Links ]
32. Beger HG, Bittner R, Block S, Büchler M. Bacterial contamination of pancreatic necrosis. A prospective clinical study. Gastroenterology 1986; 91: 433-8. [ Links ]
33. Beger HG, Rau B, Mayer J, Pralle U. Natural course of acute pancreatitis. World J Surg 1997; 21: 130-5. [ Links ]
34. Buter A, Imrie CW, Carter CR, Evans S, McKay CJ. Dynamic nature of early organ dysfunction determines outcome in acute pancreatitis. Br J Surg 2002; 89: 289-302. [ Links ]
35. Lankisch PG, Warnecke B, Bruns D, Werner HM, Grossmann F, Struckmann K, et al. The APACHE II score is unreliable to diagnose necrotizing pancreatitis on admission to hospital. Pancreas 2002; 24: 217-22. [ Links ]











 text in
text in